利用甲醇的产油酵母工程菌株构建方法及工程菌和应用与流程
本发明涉及在产油酵母中构建甲醇利用途径的方法及所得基因工程菌株的应用,属于生物技术和生物能源领域。
背景技术:
油脂是一类氧含量低、能量密度高、富含碳氢元素的天然可再生资源,是液体生物燃料、油脂化工品、食品和材料等生产的基础原料,广泛应用于日常生产、生活各个方面(Jin MJ et al.Trends Biotechnol,2015,33(1):43-54.)。传统动、植物油脂产量有限,难以满足日益增长的需求,亟待发展油脂生产新技术。为解决油脂来源问题,利用工业生物技术采用产油酵母如圆红冬孢酵母(R.toruloides)、斯达氏油脂酵母(L.starkeyi)、皮状丝孢酵母(T.cutaneum)、弯曲隐球酵母(C.curvatus)等,以碳水化合物或木质纤维素水解液、废甘油等为原料(Huang C et al.Biotechnol Adv,2013,31(2):129-39.),或者培养产油微藻固定和转化CO2生产油脂,已成为研究热点(Khoo HH et al.Bioresour.Technol.2013,143:298-307.)。然而,生物质原料复杂,预处理过程冗长、成本高,微藻培养密度低等瓶颈,阻碍了微生物油脂生产技术的产业化。
甲醇能量密度高、来源广、价格低廉、可以利用多种原料---特别是煤炭进行合成,能够保证稳定供给,作为微生物碳源用于生产碳链较长的化合物具有特殊优势,已受到生物技术领域研究的高度关注(McCann DM,et al.Angew Chem Int Ed Engl,2008,47(28):5179-5182.)。此外,利用煤炭或合成气生产甲醇用于生物转化还能够促进化石资源的清洁利用,具有较好的经济、环境和社会效益。
目前通过代谢工程或合成生物学策略改造微生物,以甲醇为碳源生产的化学品有氨基酸、1,5-戊二胺、聚氨等(Brautaset T et al.Appl Microbiol Biotechnol,2007,74:22-34;Schneider J and Wendisch VF.Appl Microbiol Biotechnol,2011,91:17-30;Schrader J et al.Trends Biotechnol,2009,27:107-115.)。但目前无甲醇为碳源生产油脂的报道。已知的甲醇转化途径共有4种:1.核糖单磷酸途径;2.二羟丙酮途径;3.丝氨酸途径和4.甲醇缩合循环途径(Bogorada IW et al.PNAS,2014,111(45):15928-15933.)。其中甲醇缩合循环途径避开了中心代谢途径,碳的理论得率达到100%,用作甲醇转化策略具有明显优势。
近年来产油酵母的系统生物学研究取得了长足进展,对脂质代谢网络的分子机制有比较深入的认识,为理性改造奠定了科学基础(Zhu ZW et al.Nat.Commun,2012,3:3112.)。通过代谢工程或合成生物学策略改造产油酵母生产油脂及油脂衍生物得以实现。
天然的甲醇利用菌不积累油脂,天然的油脂生产菌株不能利用甲醇为底物。经检索,目前未见有使用代谢工程改造的产油酵母利用甲醇为底物生产油脂的报道。
技术实现要素:
本发明目的是克服现有技术的不足,提供一种能利用甲醇生产油脂的产油酵母菌株的构建方法。
本发明的第二个目的是提供一种利用甲醇生产油脂的产油酵母菌株的用途。
本发明在产油酵母中构建甲醇利用途径,并利用所得基因工程菌株将甲醇转化为油脂,从而提供一条新的油脂生产路线。相对于从植物中提取油脂,或将碳水化合物及木质纤维素资源转化为油脂,以甲醇为碳源生产油脂,能有效降低成本,降低CO2排放,避免与民争粮、与粮争地的困境。
本发明菌株构建方法涉及过表达甲醇脱氢酶酶基因(MDH)、己糖磷酸合酶(HPS)和磷酸己糖异构酶基因(PHI)。
本发明的菌株构建方法涉及的甲醇利用关键酶MDH(共合成两个序列MDH和MDH3ACT),HPS和PHI的蛋白序列分别源自Bacillus methanolicus,Methylococcus capsulatus和M.flagellatus,针对产油酵母R.toruloides密码子偏好性由苏州鸿讯生物科技有限公司进行全基因合成。其中MDH与源基因序列相比GC含量由41%提高至59%;MDH3ACT(甲醇脱氢酶MDH3与激活蛋白ACT的融合基因)与源基因序列相比GC含量由40%提高至61%;HPS与源基因序列相比GC含量由65%降低至60%;PHI与源基因序列相比GC含量由52%提高至62具体序列见附录基因序列1至序列5。
本发明的菌株构建方法涉及的启动子Pgpd,终止子Thsp,均克隆自R.toruloides,序列见附录。P2A,F2A序列由苏州鸿讯生物科技有限公司进行全基因合成,序列见附录。
综上所述本发明提供:
一种利用甲醇的产油酵母工程菌株构建方法,利用基因工程技术在产油酵母中表达甲醇代谢相关的基因,得到可利用甲醇为碳源生长的基因工程菌株;
所述产油酵母为油脂酵母属Lipomyces、丝孢酵母属Trichosporon、隐 球酵母属Cryptococcus、冬孢酵母属Rhodosporidium、红酵母属Rhodotorula中的一种;
所述甲醇代谢相关的基因为:甲醇脱氢酶(MDH)编码基因MDH、己糖磷酸合酶(HPS)编码基因HPS和磷酸己糖异构酶(PHI)编码基因PHI。
所述的基因MDH、HPS和PHI,其DNA序列分别来源于Bacillus methanolicus,Methylococcus capsulatus和M.flagellatus,或按照产油酵母密码子偏好性进行优化,优化后序列分别如序列1、序列2和序列3所示。
将所述的基因MDH、HPS和PHI构建成表达盒,转化产油酵母,得到可利用甲醇为碳源生长的基因工程菌株。
将基因工程菌株在甲醇为碳源的培养液中进行发酵,得到含油菌体,经提取分离得到油脂。
所生产的油脂作为基础原料,用于生产生物柴油、航空燃料、表面活性剂、油漆、油墨、润滑剂或医药化妆品领域。
附图说明
图1为甲醇利用关键酶2A肽融合表达盒构建示意图。
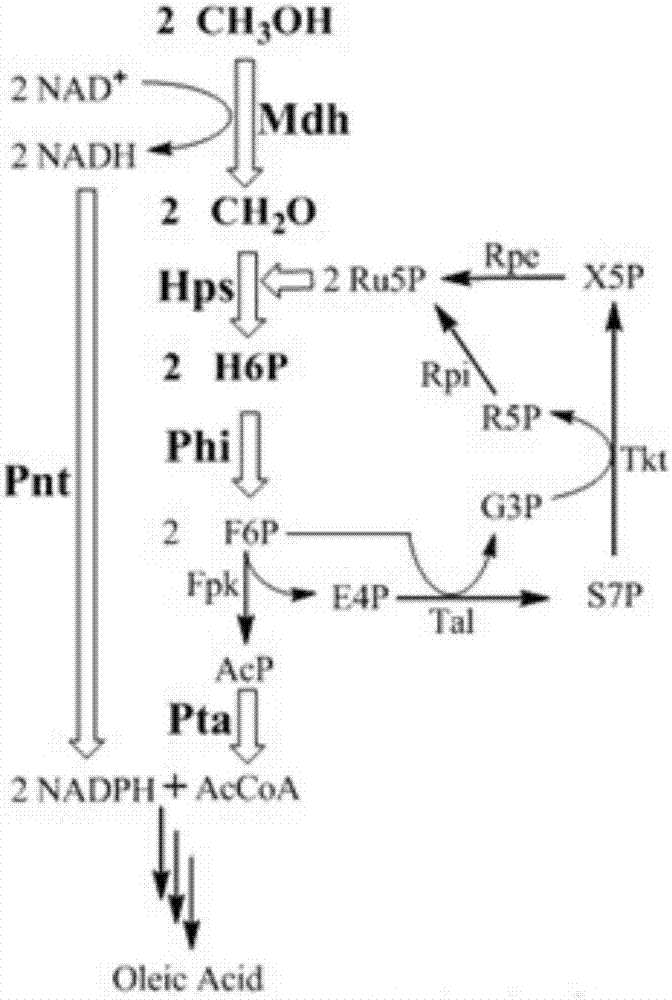
图2为甲醇为底物生产油脂的代谢途径示意图。
具体实施方式
通过如下实施例对本发明进行进一步详细描述,但不以任何方式限制本发明。
本发明实施例所用到的圆红冬孢酵母(R.toruloides)CGMCC 2.1389、Trichosporon cutaneum CGMCC 2.571、Lipomyces starkeyi CGMCC 2.1608购自中国普通微生物菌种保藏中心(CGMCC,保藏号为CGMCC 2.1389)。Cryptococcus curvatus ATCC 20509来源于美国典型微生物菌种保藏中心)。
实施例1
重组菌株M-R1利用甲醇生产油脂
产油酵母Rhodosporidium toruloides CGMCC 2.1389购自中国普通微生物菌种保藏管理中心。重组菌株M-R1是共过表达MDH、HPS和PHI的R.toruloides菌株,其构建过程如下。
步骤一根据GPD-p的核苷酸序列设计以下引物,用于构建组成型克隆载体pZPK(引物Pgpd-Xbal I-F的下划线部分为XbaI酶切位点,引物Pgpd-Eco V-R的下划线部分为EcoR V酶切位点)其中克隆GPD-p所用特异引物为:
Pgpd-Xbal I-F 5’-CTAGTCTAGATCCATGCTGCTGCGATCTGGGAGTG-3’
Pgpd-Eco V-R 5’-CCATGGGATATCTGTGACTGATCTGGTGTTGTTCTGA-3’
根据MDH、HPS和PHI的核苷酸序列分别设计以下引物,用于构建相应的组成型表达载体pZPK(引物名中带有EcoR V的下划线部分为EcoR V酶切 位点,引物名中带有Spe I的下划线部分为Spe I酶切位点):
克隆MDH所用特异引物为:
MDH-EcoR V-F 5’-CCATGGGATATCATGACCACCAACTTCTTCATC-3’
MDH-Spe I-R 5’-GGACTAGTCTACATGGCGTTCTTGATGATC-3’
克隆HPS所用特异引物为:
HPS-Eco V-F 5’-CCATGGGATATCATGGCTCGCCCTTTGATCC-3’
HPS-Spe I-R 5’-GGACTAGTCTAAGCCGAAGCGGCGAC-3’
克隆PHI所用特异引物为:
PHI-Eco V-F 5’-CCATGGGATATCATGAACAAGTACCAGGAGCTC-3’
PHI-Spe I-R 5’-GGACTAGTCTACTCGAGGTTAGCGTGGATAG-3’
步骤二表达双元表达载体pZPK-GPD-MDH、pZPK-GPD-HPS和pZPK-GPD-PHI的构建
采用Pgpd-Xbal I-F和Pgpd-EcoR V-R两个引物各20μM扩增GPD-p片段,经Xba I/EcoR V双酶切后连入同样酶切的pZPK(购自Biovector)。将经Xba I/EcoR V酶切鉴定可释放出约0.8kb插入片段的重组质粒送TaKaRa测序,测序正确的重组质粒命名为pZPK-GPD。采用MDH-EcoR V-F/MDH-Spe I-R、HPS-EcoR V-F/HPS-Spe I-R和PHI-EcoR V-F/PHI-Spe I-R三对引物分别克隆MDH、HPS和PHI三个基因片段,经SpeI/EcoR V双酶切后连入同样酶切的pZPK-GPD。GPD-p PCR
将经SpeI/EcoR V酶切鉴定可释放出相应插入片段的重组质粒送TaKaRa测序,测序正确的重组质粒分别命名为pZPK-GPD-MDH、pZPK-GPD-HPS和pZPK-GPD-PHI,这三个表达载体所带有的抗性基因分别为潮霉素、诺尔斯菌素和博来霉素。
其中GPD-p PCR克隆程序如下:首先,以R.toruloides基因组为模板,按照Prime STARMax 100uL,R.toruloides基因组40ng,20uM的Pgpd-Xbal I-F和Pgpd-Eco R V-R各2uL,加水至200uL,分别加入到PCR反应体系中,反应条件为:
MDH、HPS和PHI所采用的PCR克隆程序参数基本相同,不同之处在于MDH 72℃延伸时间为20s,HPS为10s,PHI同样为10s。
对测序正确的质粒采用电击转化的方式转化土壤农杆菌,所得转化菌株分别命名为AGL-GPD-MDH、AGL-GPD-HPS和AGL-GPD-PHI,然后利用土壤农杆菌介导转化的方式将甲醇利用功能基因转化入R.toruloides,在含有潮霉素、博莱霉素和诺尔斯菌素的YEPD平板上进行筛选。挑取转化子在甲醇中进行发酵培养,产油脂。相应的圆红冬孢酵母工程菌株命名为圆红冬孢酵母M-R1。
其中,土壤农杆菌感受态制备及介导转化圆红冬孢酵母步骤参考文献进行(Lin XP,et al.FEMS Yeast Res.2014,14(6),547-555.)。挑取转化子进行连续5代接种验证其稳定性,验证稳定的转化子经PCR验证正确后用于甲醇发酵产油脂。
重组圆红冬孢酵母菌株M-R1在甲醇中发酵产油脂的过程如下:
1.挑取酵母菌株单菌落接种于5mL YPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约1mL过夜培养物于50mL的2%(v/v)甲醇为碳源,1%YNB为营养元素的培养基中,使初始OD600nm=0.05,于30℃,200rpm培养,经4次补充甲醇至2%(v/v),并在甲醇耗尽时停止发酵;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)
4.最终生物量为36g/L,菌体油脂含量为55%(w/w,DCW),所得油脂量为20g/L。
实施例2
重组菌株M-R2利用甲醇生产油脂
产油酵母R.toruloides CGMCC 2.1389购自中国普通微生物菌种保藏管理中心。重组菌株M-R2是共过表达MDH3、HPS和PHI的R.toruloides菌株,其构建过程与实施例1基本相同。不同之处在于在M-R2构建过程中选择甲醇脱氢酶MDH3。
根据MDH3的核苷酸序列分别设计以下引物,用于构建相应的组成型表达载体pZPK-GDP-MDH3(引物名中带有EcoR V的下划线部分为EcoR V酶切位点,引物名中带有Spe I的下划线部分为Spe I酶切位点):
克隆MDH3所用特异引物为:
MDH3-EcoR V-F 5’-CCATGGGATATCATGAAGAACACCCAGTCGGC-3’
MDH3-Spe I-R 5’-GGACTAGTCTACTTGATGATCTGGATGAC-3’
克隆HPS所用特异引物为:HPS-EcoR V-F和HPS-Spe I-R(见实施例1)
克隆PHI所用特异引物为:PHI-EcoR V-F和PHI-Spe I-R(见实施例1)
步骤一表达双元表达载体pZPK-GPD-MDH3的构建
采用MDH3-EcoR V-F/MDH3-Spe I-R克隆MDH3基因片段,经SpeI/EcoR V双酶切后连入同样酶切的pZPK-GPD。将经SpeI/Eco V酶切鉴定可释放出相应插入片段的重组质粒送TaKaRa测序,测序正确的重组质粒命名为pZPK-GPD-MDH3,这该表达载体所带有的抗性基因分别为潮霉素。
其中MDH3PCR克隆程序如下:首先,以全基因合成MDH3为模板模板,按照Prime STARMax 100uL,模板40ng,20uM的MDH3-EcoR V-F/和MDH3-Spe I-R各2uL,加水至200uL,分别加入到PCR反应体系中,反应条件为:
其他基因序列的克隆同实施例1。对测序正确的质粒采用电击转化的方式转化土壤农杆菌,所得转化菌株分别命名为AGL-GPD-MDH3,然后利用AGL-GPD-MDH3与AGL-GPD-HPS和AGL-GPD-PHI方式将甲醇利用功能基因转化入R.toruloides,在含有潮霉素、博莱霉素和诺尔斯菌素的YEPD平板上进行筛选。挑取转化子在甲醇中进行发酵培养,产油脂。相应的圆红冬孢酵母工程菌株菌株命名为圆红冬孢酵母M-R2。
其中,土壤农杆菌感受态制备及介导转化圆红冬孢酵母步骤同实施例1
重组圆红冬孢酵母菌株M-R1在甲醇中发酵产油脂的过程如下:
1.挑取酵母菌株单菌落接种于5mL YPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约1mL过夜培养物于50mL的5%(v/v)甲醇为碳源,0.5%YNB为营养元素的培养基中,使初始OD600nm=0.05,于30℃,200rpm培养;甲醇耗尽时补充甲醇至浓度达到5%(v/v),经四次补料,在甲醇耗尽后结束发酵;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)
4.最终生物量为63g/L,菌体油脂含量为70%(w/w,DCW)所得油脂为44g/L。
实施例3
重组菌株M-R3利用甲醇生产油脂
产油酵母R.toruloides CGMCC 2.1389购自中国普通微生物菌种保藏管理中心。重组菌株M-R3是共过表达MDH3ACT、HPS和PHI的R.toruloides菌株,其构建过程与实施例1基本相同。不同之处在于在M-R2构建过程中表达的是带有激活蛋白的甲醇脱氢酶MDH3-ACT。
根据MDH3-ACT的核苷酸序列分别设计以下引物,用于构建相应的组成型表达载体pZPK-GDP-MDH3(引物名中带有EcoR V的下划线部分为EcoR V酶切位点,引物名中带有Spe I的下划线部分为Spe I酶切位点):
克隆MDH3所用特异引物为:MDH3-EcoR V-F和MDH3-ACT-Spe I-R,其中
MDH3-ACT-Spe I-R 5’-GGACTAGTCTACTTGTGCTTGAGCGCTTC-3’
克隆HPS所用特异引物为:HPS-EcoR V-F和HPS-Spe I-R(见实施例1);
克隆HPS所用特异引物为:PHI-EcoR V-F和PHI-Spe I-R(见实施例1)
步骤一双元表达载体pZPK-GPD-MDH3-ACT的构建
采用MDH3-EcoR V-F/MDH3-ACT-Spe I-R克隆MDH3基因片段,经SpeI/EcoR V双酶切后连入同样酶切的pZPK-GPD。其中MDH3ACT PCR克隆程序如下:首先,以全基因合成MDH3ACT为模板模板,按照Prime STARMax100uL,模板40ng,20uM的MDH3-EcoR V-F/和MDH3ACT-Spe I-R各2uL,加水至200uL,分别加入到PCR反应体系中,反应条件为:
其他基因序列的克隆同实施例1。将经SpeI/EcoR V酶切鉴定可释放出相应插入片段的重组质粒送TaKaRa测序,测序正确的重组质粒命名为pZPK-GPD-MDH3-ACT,这该表达载体所带有的抗性基因分别为潮霉素。对测序正确的质粒采用电击转化的方式转化土壤农杆菌,所得转化菌株分别命名为AGL-GPD-MDH3-ACT,然后利用AGL-GPD-MDH3-ACT与AGL-GPD-HPS和AGL-GPD-PHI方式将甲醇利用功能基因转化入R.toruloides,在含有潮霉素、博莱霉素和诺尔斯菌素的YEPD平板上进行筛选。挑取转化子在甲醇中进行发酵培养,产油脂。相应的圆红冬孢酵母菌株命名为M-R3。
其中,土壤农杆菌感受态制备及介导转化R.toruloides步骤同实施例1
重组圆红冬孢酵母菌株M-R3在甲醇中发酵产油脂的过程如下:
1.挑取酵母菌株单菌落接种于5mL YPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约1mL过夜培养物于100mL的2%(v/v)甲醇为碳源,1%YNB为营养元素的培养基中,使初始OD600nm=0.05,于30℃,200rpm培养24h;将培养物转接至工作体积为1L的1.5-L生物反应器中,初始甲醇浓度为3(v/v)%,硫酸铵10g/L,磷酸二氢钾1g/L,结晶硫酸镁1.5g/L,酵母浸粉2g/L,30℃,溶氧40%-60%,pH 6.0,进行发酵,期间以甲醇为碳源进行补料,每次补充结束时甲醇浓度为3(v/v)%,经过14次补料,在甲醇耗尽后结束发酵;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)
4.最终生物量为154g/L菌体油脂含量为65%(w/w,DCW)所得油脂量为100g/L。
所得油脂,参考文献制备得到脂肪酸甲酯(Li YH et al.Enzyme Microb.Technol.2007,41(3),312–317.)。分析发现其脂肪酸组成为:肉豆蔻酸2%,棕榈酸35%,棕榈油酸0.5%,硬脂酸11.5%,油酸45%,亚油酸3%,亚麻酸1%,该脂肪酸组成与大豆油转酯化产物的相似。因此,利用甲醇为底物生产的油脂,可作为生物柴油的原料。
实施例4
重组粘红酵母菌株M-R4利用甲醇生产油脂
出发菌株选择产油酵母Rhodotorula glutinis CGMCC 2.703购自中国普通微生物菌种保藏管理中心。重组粘红酵母菌株M-R4R4是共过表达2A序列连接的甲醇利用关键酶MDH、HPS和PHI生产油脂的R.toruloides菌株,其构建过程与菌株R1的构建过程基本相同,不同之处是MDH、HPS与PHI三个基因通过2A肽序列进行连接形成多顺反子在一个GPD启动子下同时表达并发挥功能,其中,P2A、F2A序列根据圆红冬孢酵母密码子偏好性进行优化。
根据MDH、P2A、HPS、F2A和PHI的核苷酸序列分别设计以下引物,用于构建相应的组成型表达载体pZPK-GDP-MHP(引物名中带有EcoR V的下划线部分为EcoR V酶切位点,引物名中带有Spe I的下划线部分为Spe I酶切位点):
构建融合表达载体所需要的引物为:MDH-EcoR V-F,PHI-Spe I-R,MDH-P2A-R,P2A-F,F2A-F,McHPS-F,McHPS-P2A-R,MfPHI-F,MfPHI-F2A-R,McHPS-F2A-R。其中,
MDH-P2A-R:AAGTTGGTAGCGCCCGAGCCCATGGCGTTCTTGATGATC
P2A-F:GGCTCGGGCGCTACCAACTTCTCGCTCCTCAAGCAGG
F2A-F:GGCTCGGGCGTCAAGCAGACCCTCAACTTCGACCTCC
McHPS-F:ATGGCTCGCCCTTTGATCCAGTTGGCTTTGGACACC
McHPS-P2A-R:ACTGGATCAAAGGGCGAGCCATAGGGCCAGGGTTCTCTTCG
MfPHI-F:ATGAACAAGTACCAGGAGCTCGTCGTCAACAAGCTC
MfPHI-F2A-R:GAGCTCCTGGTACTTGTTCATAGGGCCAGGGTTCGACTCGAC
McHPS-F2A-R:GTCTGCTTGACGCCCGAGCCAGCCGAAGCGGCGACGACCTG
首先,MDH、HPS、PHI、P2A和F2A序列的连接采用融合PCR的方法(Yu et al.,2004,Fungal genetics and biology.41:973-981),融合PCR法共分三轮PCR反应。第一轮是MDH、HPS和P2A的片段组合,所用引物及浓度:MDH-EcoR V-F(20μM),MDH-P2A-R(2μM),P2A-F(2μM),McHPS-F(2μM),McHPS-P2A-R(2μM),McHPS-F2A-R(20μM);所用模板及浓度MDH(40ng)、P2A(10ng)和HPS(40ng)分别加入到PCR反应体系中,不需加额外的引物和模板,体系中各片段即做引物又做模板,反应条件为:1.95℃5min;2.98℃10s;3.68℃3min;4.重复步骤2和步骤3,24个循环;5.72℃10min,获得片段MH;第二轮是HPS、F2A和的PHI片段组合,所用引物及浓度:McHPS-F(20μM),(2μM),F2A-F(2μM),MfPHI-F(2μM),McHPS-F2A-R(2μM),PHI-SpeI-R(20μM);所用模板及浓度HPS(40ng)、F2A(10ng)和PHI(40ng)分别加入到PCR反应体系中,不需加额外的引物和模板,体系中各片段即做引物又做模板,反应条件为:1.95℃5min;2.98℃10s;3.68℃2min;4.重复步骤2和步骤3,34个循环;5.72℃10min,获得融合片段HP;第三轮是以前轮PCR产物为模板,所需引物为MDH-EcoR V-F(20μM)和PHI-Spe I-R(20μM),片段MH和HP各40ng,反应条件为:1.98℃2min;2.98℃10s;3.60℃10℃s;4.72℃1min;5.重复步骤2和步骤3,35个循环;5.72℃10min,获得融合片段MHP。最后,将MHP进行EcoRV/Spe I双酶切,并与同样双酶切的的线性化质粒pZPK-GPD连接,测序正确后电击转入R.toruloides,相应的粘红酵母菌株菌株命名为M-R4。
其中,电击感受态制备及转化步骤如下:
1.挑取酵母菌株单菌落接种于5mL YEPD培养基中,30℃,200rpm培养过夜16h;
2.转接2mL过夜培养物于50mL的YEPD培养基中,于30℃,200rpm培养过夜16h,直到细胞密度达到1×108细胞/mL(OD600nm=0.8-1.0);
以下3-7步操作均在0-4℃下进行:
3.2000g离心10min收集菌体细胞;
4.20mL冰预冷的无菌水洗涤菌体细胞2次,2000g离心10min收集菌体细胞;
5.20mL冰预冷的1mol/L山梨醇洗涤菌体细胞2次,2000g离心10min收集菌体细胞;
6.0.4mL冰预冷的1mol/L山梨醇重悬菌体细胞,50μl每管分装;
7.将细胞与待转化DNA(200-600ng,总体积≤5ul)转移到冰预冷的0.2cm间隙的电转杯中,以1.5KV、25uF、200Ω做脉冲转化;
8.迅速加入1mL冰预冷的1mol/L山梨醇于电转杯中,枪头轻轻吹吸混匀,于30℃培养1-3h;
9.将酵母菌涂布在山梨醇选择培养基平板上(山梨醇180g/l,YNB 1.7g/l,NH4SO45g/l,葡萄糖20g/l,组氨酸20mg/l,琼脂粉13g/l),于30℃培养3-6天,直到转化子出现。
重组粘红酵母菌株M-R4在甲醇中发酵产油脂的过程如下:
1.挑取酵母菌株单菌落接种于50mL YPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约10mL过夜培养物于100mL的1%(v/v)甲醇为碳源,1%YNB为营养元素的培养基中,使初始OD600nm=0.05,于30℃,200rpm培养72h;然后按5%的接种量接种的工作体积为2L的3-L生物反应器,初始甲醇浓度为5(v/v)%,硫酸铵10g/L,磷酸二氢钾1g/L,结晶硫酸镁1.5g/L,酵母浸粉5g/L,30℃,溶氧45%-55%,pH 6.0,进行发酵,期间以甲醇为碳源进行补料,每次补充结束时甲醇浓度为5(v/v)%,经过10次补料,在甲醇耗尽后结束发酵;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)
4.最终生物量为167g/L,菌体油脂含量为60%(w/w,DCW)所得油脂为100g/L。
所得油脂,参考文献(Fu J et al.Chemsuschem,2011,4(4):481-6)方法,进行催化加氢处理,制备碳链长度在14-18的烃类混合物,作为航空燃料。
实施例5
重组弯曲隐球酵母菌株M-C1利用甲醇生产油脂
产油酵母Cryptococcus curvatus ATCC 20509来源于美国典型微生物菌种保藏中心。重组弯曲隐球酵母菌株M-C1是过表达MDH、HPS和PHI的菌株,即为重组质粒pZPK-MDH、pZPK-HPS和pZPK-PHI转入C.curvatus 得到的工程菌株。
其中pZPK-MDH、pZPK-HPS和pZPK-PHI表达载体的构建过程如实施例1所述;电击感受态制备及转化步骤如实施例4
重组弯曲隐球酵母菌株M-C1在甲醇中发酵产油脂的过程如下:
1.挑取酵母菌株单菌落接种于50mL YEPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约10mL过夜培养物于100mL的1%(v/v)甲醇为碳源,1%YNB为营养元素的培养基中,于30℃,200rpm培养72h;然后按20%的接种量接种的工作体积为10L的15-L生物反应器,初始甲醇浓度为5(v/v)%,硫酸铵10g/L,磷酸二氢钾1g/L,结晶硫酸镁1.5g/L,酵母浸粉5g/L,30℃,溶氧40%-55%,pH 6.0,进行发酵,期间以甲醇为碳源进行补料,每次补充结束时甲醇浓度为4(v/v)%,经过10次补料,在甲醇耗尽后结束发酵;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)
4.最终生物量为150g/L,菌体油脂含量为50%(w/w,DCW)所得油脂为75g/L。
所得油脂,参考文献(Voeste T et al.Journal of the American Oil Chemists Society,1984,61(2):350-352)制备得到脂肪醇。用于制备表面活性剂。
实施例6
重组丝孢酵母菌株M-T1利用甲醇生产油脂
产油酵母Trichosporon cutaneum CGMCC 2.571菌株来源于中国普通微生物菌种保藏管理中心。重组丝孢酵母菌株T1以T.cutaneum为出发菌株是过表达融合MDH、HPS和PHI酶的菌株,其表达载体构建过程如实施例4,土壤农杆菌感受态制备及介导转化T.cutaneum步骤如实施例1。相应的丝孢酵母菌株命名为M-T1。
重组丝孢酵母菌株M-T1在甲醇中发酵产油脂的过程如下:
1.挑取酵母菌株单菌落接种于5mL YPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约1mL过夜培养物于50mL的2%(v/v)甲醇为碳源,1%YNB为营养元素的培养基中,使初始OD600nm=0.05,于30℃,200rpm培养,经6次补充2%(v/v)甲醇,并在甲醇耗尽时停止发酵;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb. Technol.2007,41(3),312-317.)
4.最终生物量为44g/L,菌体油脂含量为45%(w/w,DCW)所得油脂为20g/L。
所得油脂,参照文献(H Aoshima et al.International Journal of Pharmaceutics,2005,293(1-2):25-34)方法,制备得到的润滑剂,可用作生产片剂药物的润滑剂。
实施例7重组油脂酵母菌株M-L1利用甲醇生产油脂
产油酵母Lipomyces starkeyi CGMCC 2.1608来源于中国普通微生物菌种保藏管理中心。在液体种子培养基中。重组油脂酵母菌株M-L1是以L.starkeyi为出发菌株,通过过表达融合蛋白MHP,其中MHP融合过程如下同实施例4。测序正确后电击转入L.starkeyi。相应的油脂酵母菌株命名为M-L1。
其中,电击感受态制备及转化步骤同实施例4。
重组油脂酵母菌株M-L1的摇瓶发酵及利用甲醇生产油脂过程如下:
1.挑取酵母菌株单菌落接种于50mL YEPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约10mL过夜培养物于100mL的2%(v/v)甲醇为碳源,1%酵母浸粉,1%蛋白胨为营养元素的培养基中,于30℃,200rpm培养48h;然后按20%的接种量接种的工作体积为2L的3-L生物反应器,初始甲醇浓度为4(v/v)%,硫酸铵10g/L,磷酸二氢钾1g/L,结晶硫酸镁1.5g/L,酵母浸粉5g/L,30℃,溶氧40%-55%,pH 6.0,进行发酵,期间以甲醇为碳源进行补料,每次补充结束时甲醇浓度为4(v/v)%,经过7次补料,并在甲醇耗尽后结束发酵;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)
4.最终生物量为111g/L,菌体油脂含量为45%(w/w,DCW)所得油脂为50g/L。
所得油脂,参照文献(H Aoshima et al.International Journal of Pharmaceutics,2005,293(1-2):25-34)方法,制备得到的润滑剂,可用作生产片剂药物的润滑剂。
序列1
SEQ ID No.1的信息
(a)序列特征
*长度:1149bp
*类型:核苷酸
*链型:单链
最初来源:甲醇芽孢杆菌
特征名称:甲醇脱氢酶
MDH(1149bp)
ATGACCACCAACTTCTTCATCCCTCCAGCTTCGGTCATCGGACGCGGAGCCGTCAAGGAGGTCGGAACCCGCCTCAAGCAGATCGGAGCTAAGAAGGCTCTCATCGTCACCGACGCTTTCCTCCACTCGACCGGACTCTCGGAGGAGGTCGCTAAGAACATCCGCGAGGCCGGAGTCGACGTCGCTATCTTCCCTAAGGCTCAGCCAGACCCAGCCGACACCCAGGTCCACGAGGGAGTCGACGTCTTCAAGCAGGAGAACTGCGACTCGCTCGTCTCGATCGGAGGAGGATCGTCGCACGACACCGCTAAGGCTATCGGACTCGTCGCCGCTAACGGAGGACGCATCAACGACTACCAGGGAGTCAACTCGGTCGAGAAGCCAGTCGTCCCAGTCGTCGCTATCACCACCACCGCCGGAACCGGATCGGAGACCACCTCGCTCGCCGTCATCACCGACTCGGCTCGCAAGGTCAAGATGCCAGTCATCGACGAGAAGATCACCCCTACCGTCGCTATCGTCGACCCAGAGCTCATGGTCAAGAAGCCAGCCGGACTCACCATCGCTACCGGAATGGACGCTCTCTCGCACGCTATCGAGGCTTACGTCGCTAAGGGAGCTACCCCAGTCACCGACGCTTTCGCTATCCAGGCTATGAAGCTCATCAACGAGTACCTCCCTAAGGCCGTCGCTAACGGAGAGGACATCGAGGCTCGCGAGAAGATGGCTTACGCTCAGTACATGGCCGGAGTCGCTTTCAACAACGGAGGACTCGGACTCGTCCACTCGATCTCGCACCAGGTCGGAGGAGTCTACAAGCTCCAGCACGGAATCTGCAACTCGGTCAACATGCCTCACGTCTGCGCTTTCAACCTCATCGCTAAGACCGAGCGCTTCGCTCACATCGCCGAGCTCCTCGGAGAGAACGTCGCCGGACTCTCGACGGCTGCTGCTGCTGAGCGCGCTATCGTCGCTCTCGAGCGCATCAACAAGTCGTTCGGAATCCCTTCGGGATACGCCGAGATGGGAGTCAAGGAGGAGGACATCGAGCTCCTCGCTAAGAACGCTTACGAGGACGTCTGCACCCAGTCGAACCCTCGCGTCCCTACCGTCCAGGACATCGCTCAGATCATCAAGAACGCCATGTAG
序列2
SEQ ID No.2的信息
(a)序列特征
*长度:648bp
*类型:核苷酸
*链型:单链
最初来源:荚膜甲基球菌
特征名称:己酮糖磷酸合酶
HPS(648bp)
ATGGCTCGCC C T TTGATCCAGT T GGC T T TGGACAC C T TGGACATCCCTCAGACCTTGAAGTTGGCTT CGT TGACCGCTCCTTACGTCGACATCTTCGAGATCGGCACCCC TTC GATCAAGCACAACGGCATC GC T T TGGTCAAGGAGT TCAAGAAGCGCTTCCCTAACAAGCTCCTCTTGGTCGACTTGAAGACGATGGACGCCGGCGAGTACGAGGCTACCCCTTTCTTCGCCGCGGGCGCTGACATCACCACCGTCTTGGGCGTCGCCGGCTTGGCTACCATCAAGGGCGTCATCAACGCCGCTAACAAGCACAACGCCGAGGTCCAGGTCGACTTGATCAACGTCCCAGACAAGGCCGCTTGCGCTCGCGAGTCGGCTAAGGCTGGCGCTCAGATCGTCGGCATCCACACGGGCTTGGACGCTCAGGCTGCTGGCCAGACCCCTTTCGCCGACTTGCAGGCTATCGCTAAGTTGGGCTTGCCAGTCCGCATCTCGGTCGCTGGCGGCATCAAGGCTTCGACCGCTCAGCAGGTCGTCAAGACCGGCGCTAACATCATCGTCGTCGGCGCTGCTATCTACGGCGCGGCTTCGCCAGCTGACGCCGCTCGCGAGATCTACGAGCAGGTCGTCGC CGCTTCGGC TTAG
序列3
SEQ ID No.3的信息
(a)序列特征
*长度:546bp
*类型:核苷酸
*链型:单链
最初来源:鞭毛甲基球菌
特征名称:磷酸己酮糖异构酶
PHI(546bp)
ATGAACAAGTACCAGGAGCTCGTCGTCAACAAGCTCACCAACGTCATCAACAACACCGCCGAGGGCTACGACGACAAGATCCTCTCGATGGTCGACGCGGCTGGCCGCACCTTCCTCGGCGGCGCCGGCCGCTCGCTCCTCGTCTCGCGCTTCTTCGCTATGCGCCTCGTCCACGCCGGCTACCAGGTCTCGATGGTCGGCGAGGTCGTCACCCCTTCGATCCAGGCCGGCGACCTCTTCATCGTCATCTCGGGCTCGGGCTCGACCGAGACCCTCATGCCTCTCGTCCGCAAGGCTAAGTCGCAGGGCGCTAAGGTCATCGTCATCTCGATGAAGGCTCAGTCGCCTATGGCCGAGCTCGCTGACCTCGTCGTCCCTATCGGCGGCAACGACGCTCACGCTTTCGACAAGACCCACGGCATGCCTATGGGCACCATCTTCGAGCTCTCGACCCTCTGGTTCCTCGAGGCTACCATCGCTAAGCTCATCGACCAGAAGGGCCTCACCGAGGAGGGCATGCGCGCTATCCACGCTAACCTCGAGTAG
序列4
SEQ ID No.4的信息
(a)序列特征
*长度:1149bp
*类型:核苷酸
*链型:单链
最初来源:甲醇芽孢杆菌
特征名称:甲醇脱氢酶
MDH3(1149bp)
ATGAAGAACACCCAGTCGGCTTTCTACATGCCTTCGGTCAACCTCTTCGGAGCCGGATCGGTCAACGAAGTCGGAACCCGCCTCGCCGGACTCGGAGTCAAGAAGGCTCTCCTCGTCACCGACGCCGGACTCCACTCGCTCGGACTCTCGGAAAAGATCGCCGGCATCATCCGCGAAGCCGGAGTCGAAGTCGCGATCTTCCCGAAGGCCGAACCGAACCCGACCGACAAGAACGTCGCCGAAGGCCTCGAAGCGTACAACGCCGAAAACTGCGACTCGATCGTCACCCTCGGCGGCGGATCGTCGCACGACGCCGGCAAGGCGATCGCGCTCGTCGCCGCCAACGGCGGCACCATCCACGACTACGAAGGCGTCGACGTCTCGAAGAAGCCGATGGTCCCGCTCATCGCGATCAACACCACCGCCGGAACCGGCTCGGAACTCACCAAGTTCACCATCATCACCGACACCGAACGCAAGGTCAAGATGGCGATCGTCGACAAGCACGTCACCCCGACCCTCTCGATCAACGACCCGGAACTCATGGTCGGCATGCCGCCGTCGCTCACCGCCGCGACCGGCCTCGACGCGCTCACCCACGCGATCGAAGCGTACGTCTCGACCGGCGCGACCCCTATCACCGACGCGCTCGCGATCCAGGCCATCAAGATCATCTCGAAGTACCTCCCGCGCGCCGTCGCGAACGGCAAGGACATCGAAGCGCGCGAACAGATGGCGTTCGCGCAGTCGCTCGCCGGAATGGCTTTCAACAACGCCGGCCTCGGCTACGTCCACGCGATCGCGCACCAGCTCGGCGGATTCTACAACTTCCCTCACGGCGTCTGCAACGCGATCCTCCTCCCGCACGTCTGCCGCTTCAACCTCATCTCGAAGGTCGAACGCTACGCCGAAATCGCCGCGTTCCTCGGCGAAAACGTCGACGGACTCTCGACCTACGAAGCGGCGGAAAAGGCGATCAAGGCTATCGAACGCATGGCGCGCGACCTCAACATCCCGAAGGGATTCAAGGAGCTCGGCGCGAAGGAAGAAGACATCGAGACCCTCGCGAAGAACGCGATGAACGACGCGTGCGCGCTCACCAACCCTCGCAAGCCGAAGCTCGAAGAGGTCATCCAGATCATCAAGTAG
序列5
SEQ ID No.5的信息
(a)序列特征
*长度:585bp
*类型:核苷酸
*链型:单链
最初来源:甲醇芽孢杆菌
特征名称:甲醇脱氢酶活化蛋白
ACT(585bp)
ATGAACGCGATGGGCGGCGGCGGCTCGATGGGCAAGCTCTTCGAGGAGAAGACCATCAAGACCGAACAGATCTTCTCGGGCCGCGTCGTCAAGCTCCAGGTCGACGACGTCGAACTCCCGAACGGACAGACCTCGAAGCGCGAAATCGTCCGCCACCCAGGAGCGGTCGCCGTCATCGCGATCACCAACGAGAACAAGATCGTCATGGTCGAACAGTACCGCAAGCCTCTCGAAAAGTCGATCGTCGAAATCCCAGCGGGAAAGCTCGAAAAGGGAGAAGACCCTCGCGTCACCGCGCTCCGCGAACTCGAAGAAGAAACCGGATACGAGTGCGAACAGATGGAGTGGCTCATCTCGTTCGCGACGTCGCCAGGATTCGCCGACGAAATCATCCACCTCTACGTCGCTAAGGGACTCTCGAAGAAGGAAAACGCCGCCGGACTCGACGAAGACGAGTTCGTCGACCTCATCGAACTCACCCTCGACGAAGCGCTCCAGTACATCAAGGAGAAGCGCATCTACGACTCGAAGACCGTCATCGCCGTCCAGTACCTCCAGCTCCAGGAAGCGCTCAAGCACAAGTAG
序列6
SEQ ID No.6的信息
(a)序列特征
*长度:881bp
*类型:核苷酸
*链型:单链
最初来源:圆红冬孢酵母
特征名称:甘油磷酸脱氢酶启动子
GPD启动子序列(881bp)
TCCATGCTGCTGCGATCTGGGAGTGCAAGCCCGCGGTCAGCAGCCATTGCCCGCCTACAATGTCTTCCCAAAGCCGCCCTTGCTCGCTCGCTGCGTGGAGTTCGACGTTCTCCTCGCTCCGCAAGCATTGGAATGAACCTTGCTCTCTAGTTCCCTCCTCCGTGACCTCGTTTCGTCCTTTAGACGGCACGATGGAAGGAAGAAATCTCTGCGGACAAGCAAATCTGCTGGCTCGCCTTGTAGGTCGCCTACCGGAGCAAGCCTTGTGCCGCCGGGATGCCAACGTCGTTTTTTGACGTTTGCAAGACGTAGAGGACGCTTCGGACGACGAAACAAGCTGTGAGGACATGGAAGTCGTGGGAGGAACGGCGCAGAGCGGCGCCGCGGGAGCATAAGGCAAGCGAGATAGTCCAGAAATCGCGGCGCCAAGTACAGTAATTTATTGGAGCAGGCACCAGAAGCGGGCAGCAGTATGCGCAGGCTTGGGGTCGACGAGAGACGACTCCCTCATACTCGGTTACCTCGAGCAATACAATCAATCGAAGCTGCGCGAATCTCGGCTTGTAAGGGTCGGAAAGGAACCTCGGAGATGGCCACGTCACATCACCAACTTATCGATCTCAGCCGACGTCGCAGAGAGGGCGAGCGAAGCGGTGAAGGAGGGAAACAATCCCTCGAGAGCATGATCCGTCTGAATCTGCAGCGCAGGAAGCCGTCACACGCCCGCCTCGAGCGCAGGTCGGGTCCAGCCGGGGGACGAAACGCGCGAGGGCTGATTTCGTGAGCGAAGGAAGCCGCATCGACAAGTTCGCGTCCCTTTGCCCTCTTTCCCATCACCCGCTCTCGCTCTACCCGCTCAGAACAACACCAGATCAGTCACA
序列7
SEQ ID No.7的信息
(a)序列特征
*长度:440bp
*类型:核苷酸
*链型:单链
最初来源:圆红冬孢酵母
特征名称:热休克蛋白70终止子
Thsp终止子序列(440bp)
ACGATTCCGCCCCGTCTCACCTCGCATCCGACCTGTGTAGCCACGCCTTTTCTCTTTCCGCCCCCGACACTAAAAGGAGTTCAGTCGTCCGCTTTTCCTCTCTTCCGTTCTCCACGCCTGCAGTACTGCATGCCTCAGCTGTGTAATTTCGATAGAGTACTCGCACGTATGCTCGCGCGGACTTGTCGAGAGAGCGGGCGAGAGGTCGAGAGGAGCTGACTTGAGTGAGCAGCGAGAGCGGAGCGGCTTGTTGCGGCACACAACGGTCCGGCTTACGGACAATCAGCGATGAAGCCGGAAGAGCGGCAGGAGTGGACGAAGACGTGCGAAGAGGAAAGGGGGCGAGGAAGAGAAGCGGAGGAGGAAACGCAGCGAAGCAGCACAACTTCCGCAGAGACGACGGTTCACATAGTCAAAGATGCAGTGCAGAGAAGTGCGCG
序列8
SEQ ID No.8的信息
(a)序列特征
*长度:66bp
*类型:核苷酸
*链型:单链
最初来源:猪捷申病毒
特征名称:2A肽
P2A序列(66bp)
GGCTCGGGCGCTACCAACTTCTCGCTCCTCAAGCAGGCTGGCGACGTCGAAGAGAACCCTGGCCCT
序列9
SEQ ID No.9的信息
(a)序列特征
*长度:66bp
*类型:核苷酸
*链型:单链
最初来源:手足口病毒
特征名称:2A肽
F2A序列(66bp)
GGCTCGGGCGTCAAGCAGACCCTCAACTTCGACCTCCTCAAGCTCGCTGGCGACGTCGAGTCGAACCCTGGCCCT
SEQUENCE LISTING
<110> 中国科学院大连化学物理研究所
<120> 利用甲醇的产油酵母工程菌株构建方法及工程菌和应用
<130>
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 35
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(35)
<400> 1
ctagtctaga tccatgctgc tgcgatctgg gagtg 35
<210> 2
<211> 37
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(37)
<400> 2
ccatgggata tctgtgactg atctggtgtt gttctga 37
<210> 3
<211> 33
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(33)
<400> 3
ccatgggata tcatgaccac caacttcttc atc 33
<210> 4
<211> 30
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(30)
<400> 4
ggactagtct acatggcgtt cttgatgatc 30
<210> 5
<211> 31
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(31)
<400> 5
ccatgggata tcatggctcg ccctttgatc c 31
<210> 6
<211> 26
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(26)
<400> 6
ggactagtct aagccgaagc ggcgac 26
<210> 7
<211> 33
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(33)
<400> 7
ccatgggata tcatgaacaa gtaccaggag ctc 33
<210> 8
<211> 31
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(31)
<400> 8
ggactagtct actcgaggtt agcgtggata g 31
- 还没有人留言评论。精彩留言会获得点赞!