一种促进产油酵母生产油脂的方法与流程
本发明涉及磷酸乙酰基转移酶PTA,具体地说是依据枯草芽孢杆菌PTA蛋白序列,根据圆红冬孢酵母密码子偏好性优化后全基因合成的磷酸乙酰基转移酶PTA的重组载体构建,以及在代谢工程研究中的应用。
背景技术:
油脂是一类氧含量低、能量密度高、富含碳氢元素的天然可再生资源,是液体生物燃料、油脂化工品、食品和材料等生产的基础原料,广泛应用于日常生产、生活各个方面[Jin MJ et al.Trends Biotechnol,2015,33:43-54.]。传统动、植物油脂产量有限,难以满足日益增长的需求,且存在着与人争粮,与农争地的问题,而微生物因其生长快、基本不依赖耕地、可连续生产、便于改造等特点,近年来显示出其突出的特点[赵宗保.中国生物工程杂志2005,25(2),8-11]。
自然界中部分微生物在极端情况(如氮源缺乏)能在胞内积累超过其细胞干重20%的油脂,其中以甘油三酯为主,这些微生物被称为产油微生物,主要包括细菌、酵母、霉菌、藻类等[Ratledge C,Wynn J P.Adv Appl Microbiol 2002,51,1-51]。油脂的合成需要大量的乙酰辅酶A和NADPH作为前体和还原力。通常乙酰辅酶A是微生物可降解的糖类物质经过细胞内的中心代谢途径和三羧酸生成,在这一过程中有1/3的碳原子以CO2的形式释放,使得糖类物质到油脂的理论得率(w/w)仅为0.30-0.33,碳原子经济性较差[Bogorad IW et al.PNAS 2014,111,15928-15933]。
磷酸乙酰基转移酶(phosphate acetyltransferase,PTA)可以催化乙酰磷酸到乙酰辅酶A的转化,为生物体内蛋白质、糖类、油脂的合成提供前体[Bock AK et al.J.Bacteriol 1999,1861-1867]。乙酰磷酸的来源中共有三种途径:1.乙酸经乙酸激酶活化;2.木酮糖磷酸经木酮糖磷酸激酶作用生成;3.己酮糖磷酸经己酮糖磷酸激酶催化生成,这些酶已经被证实存在于圆红冬孢酵母酵母基因组内[Zhu ZW et al.Nat common 2012,3,1112]。因而引入PTA有可能增加乙酰辅酶A合成效率。另外,利用PTA催化乙酰磷酸到乙酰辅酶A,可绕过细胞内中心代谢途径,减少CO2生成。因此,过表达PTA可将糖类物质到油脂的提高理论得率[Bogorad IW et al.Nature 2013,502,693-697]。
但是,至今为止未有人在产油酵母的中进行过PTA基因的过表达,也没有人使用这个基因进行过油脂的生产。
技术实现要素:
本发明的目的是提供一种增强乙酰辅酶A供应能力,提高底物到油脂质量得率的方法。具体来说,是在产油酵母中过表达磷酸乙酰基转移酶PTA,增加胞内乙酰辅酶A供应,提高微生物油脂的生效率及底物到油脂的得率。
本发明中磷酸乙酰基转移酶PTA的蛋白质序列源自枯草芽孢杆菌,委托苏州弘迅生物科技有限公司对磷酸乙酰基转移酶PTA基因按照R.toruloides密码子偏好性进行核酸序列设计并全基因合成,优化后的基因序列与源基因序列不同,GC含量由42%提高至62%的差异,具体序列见SEQ ID No.1。
本发明的菌株构建方法涉及的启动子Pgpd,终止子Thsp,均克隆自R.toruloides,序列见附录。
为实验上述目的,本发明采用的技术方案为:
首先,根据产油酵母密码子偏好性全基因从头合成PTA核酸序列。而后通过将其导入产油酵母中进行过表达,获得了大量油脂含量及得率提高的菌株。
本领域技术人员应该理解,将编码全基因合成和密码子优化的磷酸乙酰基转移酶PTA的核苷酸序列或包含PTA核苷酸序列的重组载体导入宿主细胞可以按照本领域的常规技术进行,例如,可以通过转化、转染(例如,农杆菌介导的转染)或电穿孔等常规技术进行。
为了便于对转基因细胞系或重组菌株进行鉴定及筛选,可对所用载体进行修饰,如引入可在细胞中表达的编码产生颜色变化的酶(如绿色荧光蛋白)或发光化合物的基因(如GUS基因、荧光素酶基因等)、具有抗性的抗生素标记基因(如卡那霉素标记基因、博莱霉素标记基因、潮霉素标记基因)或抗化学试剂标记基因(如抗除莠剂基因)、以及营养筛选标记基因(如LEU2、URA3、URA3、LYS2、LYS5、MET15)等。
本发明提供下述:
一种提高产油酵母油脂生产的方法,利用基因工程技术,在产油酵母中表达磷酸乙酰基转移酶,并在产油培养基中发酵,提高油脂得率。
所述产油酵母为油脂酵母属Lipomyces、丝孢酵母属Trichosporon、隐球酵母属Cryptococcus、冬孢酵母属Rhodosporidium、红酵母属Rhodotorula中的一种。
所述的磷酸乙酰基转移酶的编码基因PTA,为来源于枯草芽孢杆菌的序列或按照产油酵母密码子偏好性进行优化的序列,优化后序列如SEQ ID No.1所示。
将基因工程菌株在产油培养基中进行发酵,得到含油菌体,经提取分离得到油脂。
所述产油培养基的碳源为葡萄糖、木糖、阿拉伯糖、半乳糖、甘露糖、醋酸、甘油、蔗糖、果糖、淀粉或木质纤维素水解液中的一种或多种。
所述生产的油脂作为油脂化工原料,用于生物柴油、表面活性剂、油漆、油墨、润滑剂或医药化妆品领域。
附图说明
图1为从头合成PTA基因序列与源序列对比。
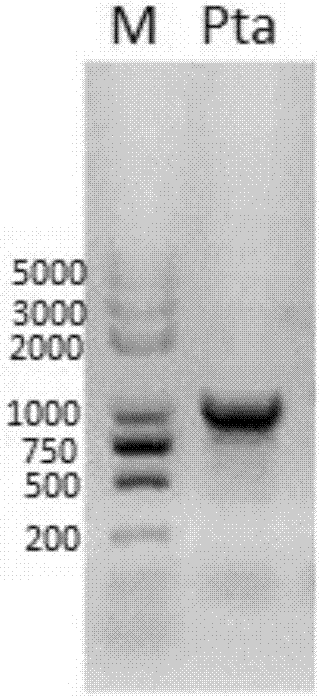
图2为扩增PTA结果,扩增条带约为1kb。M为分子量标准,泳道1为PTA扩增产物。
图3为PTA在圆红冬孢酵母中表达载体pZPK-GPD-PTA的构建。
图4为在圆红冬孢酵母中表达PTA后油脂发酵结果。每组数据均为三株重组菌株测定平均值。
具体实施方式
以下实施例将有助于本领域的普通技术人员进一步理解本发明,但不以任何形式限制本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为自常规生化试剂公司购买得到的。
本发明实施例所用到的圆红冬孢酵母(R.toruloides)CGMCC 2.1389、Trichosporon cutaneum CGMCC 2.571、Lipomyces starkeyi CGMCC 2.1608购自中国普通微生物菌种保藏中心(CGMCC,保藏号为CGMCC 2.1389)。Cryptococcus curvatus ATCC 20509来源于美国典型微生物菌种保藏中心)。
以下实施例中所涉及的培养基配方及用途如下:
(1)YEPD培养基(g/L):酵母粉10,蛋白胨10,葡萄糖20,pH 6.0,固体培养基则再加入琼脂粉15;用于菌种活化培养、种子液制备和菌种短期保藏。
(2)葡萄糖-限氮培养基(g/L):酵母粉0.75,(NH4)2SO4 0.1,KH2PO4 1.0,MgSO4·7H2O 1.5,pH 5.6,并补加1%(V/V)的痕量元素液体,用于菌株油脂积累和富含脂滴菌体的培养,初始葡萄糖浓度依实施例为准。
(3)醋酸-限氮培养基(g/L):NH4Cl 1.07,yeast extract 0.5,peptone 0.5,H3PO40.58,KCl 0.15,Na2SO41.2,CaCl2 0.22,MgCl2·6H2O 0.41,FeCl2·4H2O0.0004,微生物母液10mL/L,初始pH 7.0,初始醋酸浓度依实施例为准。
(4)痕量元素溶液配方(g/L):CaCl2·2H2O 4.0,FeSO4·7H2O 0.55,citric acid·H2O 0.52,ZnSO4·7H2O 0.10,MnSO4·H2O 0.076和H2SO4 1.75。
(5)醋酸培养用痕量元素溶液配方(g/L):Na2EDTA·2H2O 5,ZnSO4·7H2O 2.2,H3BO3 1.14,MnCl2·4H2O 0.5,FeSO4·7H2O 0.5,CoCl2·6H2O0.16,CuSO4·5H2O 0.16,(NH4)6Mo7O24·4H2O 0.11。
(6)醋酸-维生素母液(mg/L):盐酸硫胺素50,核黄素50,烟酸50,泛酸50,盐酸吡哆醇10,生物素20,叶酸20,对氨基苯甲酸50,氰基钴胺素50,硫辛酸50.用前经过0.22μm微孔膜过滤除菌。
实施例1:PTA表达重组圆红冬孢酵母菌株Rtcg-PTA的构建
产油酵母Rhodosporidium toruloides CGMCC 2.1389购自中国普通微生物菌种保藏管理中心。根据PTA的核苷酸序列设计以下引物,用于构建PTA在R.toruloides中表达的载体(引物名中带有EcoR V的下划线部分为EcoR V酶切位点,引物名中带有Spe I的下划线部分为Spe I酶切位点,斜体部分为His-Tag):
PTA-EcoV-F:CCATGGGATATCATGCACCACCACCACCACCACGCTGACCTCTTCTCGAC
PTA-spe I-R:GGACTAGTCTAGAGAGCCTGAGCCGCC
根据GPD-p的核苷酸序列设计以下引物,用于构建组成型克隆载体pZPK(引物Pgpd-Xbal I-F的下划线部分为XbaⅠ酶切位点,引物Pgpd-Eco V-R的下划线部分为EcoR V酶切位点)其中克隆GPD-p所用特异引物为:
Pgpd-Xbal I-F 5’-CTAGTCTAGATCCATGCTGCTGCGATCTGGGAGTG-3’
Pgpd-Eco V-R 5’-CCATGGGATATCTGTGACTGATCTGGTGTTGTTCTGA-3’
根据GPD-p的核苷酸序列设计以下引物,用于构建组成型克隆载体pZPK(引物Pgpd-Xbal I-F的下划线部分为XbaⅠ酶切位点,引物Pgpd-Eco V-R的下划线部分为EcoR V酶切位点)其中克隆GPD-p所用特异引物为:
Thsp-F
5’-CGAAAGAACACCACCATCACCATCACTAGACGATTCCGCCCCGTCTCACCTCGCAT-3’
Thsp-R
5’-GCATGCTGCAGGTCGACTCTAGAGGATCCCGCGCACTTCTCTGCACTGCATCTTTG-3’步骤一表达双元表达载体pZPK-GPD-PTA的构建
采用Pgpd-Xbal I-F和Pgpd-Eco V-R两个引物扩增GPD-p片段,经Xba I/EcoR V双酶切后连入同样酶切的pZPK(购自Biovector)。将经Xba I/Eco V酶切鉴定可释放出约0.8kb插入片段的重组质粒送TaKaRa测序,测序正确的重组质粒命名为pZPK-GPD。采用Thsp-F和Thsp-R两个引物扩增Thsp片段,经RF克隆方法插入pZPK-GPD载体(马斯佳,等.微生物学报2015,55,1505-1511)。将Thsp-F和Thsp-R菌落PCR可释扩增出约0.4kb插入片段的重组质粒送TaKaRa测序,测序正确的重组质粒命名为pZPK-GPD-MCS-Thsp。采用PTA-EcoV-F和PTA-spe I-R两个引物扩增PTA片段,经Spe I/Eco V双酶切后连入同样酶切的pZPK-GPD-MCS-Thsp(购自Biovector)。将经Spe I/Eco V酶切鉴定可释放出约1kb插入片段的重组质粒送TaKaRa测序,测序正确的重组质粒命名为pZPK-GPD-PTA(图2)。该表达载体所带有的抗性基因分别为潮霉素。其中GPD-p PCR克隆程序如下:首先,以R.toruloides基因组为模板,按照Prime STARMax 100uL,R.toruloides基因组40ng,20uM的Pgpd-Xbal I-F和Pgpd-Eco R V-R各2uL,加水至200uL,分别加入到PCR反应体系中,反应条件为:
PTA所采用的PCR克隆程序参数与GPD-p相同,Thsp不同之处在于72℃延伸时间为5s。
对测序正确的质粒采用电击转化的方式转化土壤农杆菌,所得转化菌株命名为AGL-GPD-PTA,然后利用土壤农杆菌介导转化的方式将PTA基因转化入R.toruloides,在含有潮霉素的YEPD平板上进行筛选。挑取转化子相应的圆红冬孢酵母工程菌株命名为Rtcg-PTA。在以50g/L葡萄糖为碳源的限氮培养基中进行发酵培养,待葡萄糖耗尽时收集菌体并提取油脂。与对照菌株R.toruloides CGMCC 2.1389相比,重组圆红冬孢酵母Rtcg-PTA胞内油脂含量由55%增加到了65%,油脂量由5.5g/L增加至7.5g/L。这证明PTA基因可促进圆红冬包酵母油脂含量显著增加。
其中,土壤农杆菌感受态制备及介导转化圆红冬孢酵母步骤参考文献进行(Lin XP,et al.FEMS Yeast Res.2014,14(6),547-555.)挑取转化子进行连续5代接种验证其稳定性,验证稳定的转化子经PCR验证正确后用于酵产油脂。
重组菌株Rtcg-PTA在50g/L葡萄糖为碳源的中发酵产油脂的过程如下:
1.挑取酵母菌株单菌落接种于50ml YEPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约5mL过夜培养物于50mL的50g/L葡萄糖为碳源限氮,使初始OD600nm=1.0,于30℃,200rpm培养,待葡萄糖耗尽时停止发酵;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)
实施例2:PTA表达重组圆红冬孢酵母菌株Rtat-PTA的构建
产油酵母Rhodosporidium toruloides ATCC 10788购自美国典型培养物保藏管理中心。根据PTA的核苷酸序列设计引物,PTA-EcoV-F和PTA-spe I-R用于构建PTA在R.toruloides中表达的载体pZPK-GPD-PTA,具体过程同实施例1。然后利用电击转化的方式将PTA基因转化入R.toruloides,在含有潮霉素的YEPD平板上进行筛选。挑取转化子在30g/L乙酸-限氮中进行发酵培养,产油脂。相应的圆红冬孢酵母工程菌株命名为Rtat-PTA。与对照菌株ATCC 10788相比,重组圆红冬孢酵母Rtat-PTA胞内油脂含量由24%增加到了35%,生物量由1.5g/L提高至7.5g/L。这证明PTA基因可促进圆红冬包酵母生物量和油脂含量显著增加。
其中,电击感受态制备及转化步骤如下:
1.挑取酵母菌株单菌落接种于5mL YEPD培养基中,30℃,200rpm培养过夜16h;
2.转接2mL过夜培养物于50mL的YEPD培养基中,于30℃200rpm培养过夜16h,直到细胞密度达到1×108细胞/mL(OD600nm=0.8-1.0);
以下3-7步操作均在0-4℃下进行:
3. 2000g离心10min收集菌体细胞;
4. 20mL冰预冷的无菌水洗涤菌体细胞2次,2000g离心10min收集菌体细胞;
5. 20mL冰预冷的1mol/L山梨醇洗涤菌体细胞2次,2000g离心10min收集菌体细胞;
6. 0.4mL冰预冷的1mol/L山梨醇重悬菌体细胞,50μl每管分装;
7.将细胞与待转化DNA(200-600ng,总体积≤5ul)转移到冰预冷的0.2cm间隙的电转杯中,以1.5KV、25uF、200Ω做脉冲转化;
8.迅速加入1mL冰预冷的1mol/L山梨醇于电转杯中,枪头轻轻吹吸混匀,于30℃培养1-3h;
9.将酵母菌涂布在山梨醇选择培养基平板上(山梨醇180g/l,YNB 1.7g/l,NH4SO45g/l,葡萄糖20g/l,组氨酸20mg/l,琼脂粉13g/l),于30℃培养3-6天,直到转化子出现。
重组菌株Rtat-PTA在乙酸为碳源培养基中发酵产油脂的过程如下:
1.挑取酵母菌株单菌落接种于50mL YPD培养基中,30℃,200rpm摇动培养过夜24h;
2.转接约10mL过夜培养物于100mL的YEPD培养基中,使初始OD600nm=1.05,于30℃,200rpm培养24h;然后按5%的接种量接种的工作体积为2L的3-L生物反应器,初始醋酸浓度为30g/L的限氮培养基中30℃,溶氧45%-55%,pH 7.0,进行发酵至醋酸耗尽;
3.生物量测定及油脂提取步骤参照文献(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)
实施例3:PTA重组粘红酵母的构建
Rhodotorula glutinis CGMCC 2.703购自中国普通微生物菌种保藏管理中心。利用AGL-GPD-PTA对粘红酵母进行转化,将PTA基因导入粘红酵母,具体流程同实施例1,经在潮霉素抗性平板筛选,最终获得粘红酵母工程菌株Rg-PTA。
将重组粘红酵母工程菌株Rg-PTA和出发菌株,分别接种于YEPD培养基中,28℃,200rpm,培养24h,然后以10%的接种量转接至50mL 70g/L的木糖-限氮培养基中,30℃,200rpm。结果发现,与对照菌株R.glutinis相比,粘红酵母工程菌株Rg-PTA在8d时将全部木糖耗完,而对照菌株R.glutinis则需要10.5d,才能将木糖消耗完毕。且粘红酵母工程菌株Rg-PTA胞内油脂含量由对照菌株45%增加到了65%,油脂得率由0.15提高至0.28。证明PTA基因可促进黏红酵母菌油脂含量显著增加。
所得油脂,参考文献制备得到脂肪酸甲酯(Li YH et al.Enzyme Microb.Technol.2007,41(3),312-317.)。分析发现其脂肪酸组成为:肉豆蔻酸2%,棕榈酸35%,棕榈油酸0.5%,硬脂酸11.5%,油酸45%,亚油酸3%,亚麻酸1%,该脂肪酸组成与大豆油转酯化产物的相似。因此,利用甲醇为底物生产的油脂,可作为生物柴油的原料。
实施例4:PTA重组胶红酵母的构建
胶红红酵母Rhodotorula mucilaginosa(Rhodotorul arubra)CGMCC2.1515购自中国普通微生物菌种保藏管理中心。利用AGL-GPD-PTA对R.mucilaginosa进行转化,将PTA基因导入粘红酵母,具体流程同实施例1,经在潮霉素抗性平板筛选,最终获得胶红酵母菌株Rm-PTA。
将重组CRm-PTA和出发菌株,分别接种于50mL YEPD培养基中,28℃,200rpm,培养24h,然后以10%的接种量转接至蔗糖-限氮培养基30℃,200rpm,每隔24h取样,待蔗糖耗尽时,补充30g/L蔗糖三次。结果发现,与对照菌株菌株R.mucilaginosa耗时8d相比,重组胶红酵母工程菌株Rm-PTA在5.5d时即结束发酵,且生物量提高了33%,达到40g/L,胞内油脂含量由38%增加到了49%。证明优化的PTA基因可促进胶红酵母油脂含量显著增加。
所得油脂,参考文献(Fu J et al.Chemsuschem,2011,4(4):481-486)方法,进行催化加氢处理,制备碳链长度在14-18的烃类混合物,作为航空燃料。
实施例5:PTA重组斯达氏油脂酵母Ls-PTA的构建
产油酵母斯达氏油脂酵母Lypomyces starkeyi CGMCC 2.1560购自中国普通微生物菌种保藏管理中心。利用AGL-GPD-PTA对L.starkeyi进行转化,将PTA基因导入L.starkeyi,具体流程同实施例1,经在潮霉素抗性平板筛选,最终获得斯达氏油脂酵母工程菌株Ls-PTA。
将重组斯达氏油脂酵母工程菌株Ls-PTA和出发L.starkeyi菌株接种分别接种于YEPD培养基中,28℃,200rpm,培养24h,然后以10%的接种量转接至工作体积为10L的15-L生物反应器。果糖-限氮培养基,初始果糖浓度为70g/L,30℃,溶氧40%-55%,pH 6.0,进行发酵,期间以果糖为碳源进行补料,每次补充结束时果糖浓度为70g/L,经过4次补料后结束发酵。结果发现,与对照菌株L.starkeyi相比,重组斯达氏油脂酵母工程菌株Ls-PTA发酵时间由11d缩短为7.4d,胞内油脂含量由50%增加到了70%,生物量由100g/L增加至120g/L。证明优化的PTA基因可促进斯达氏油脂酵母油脂含量显著增加。
所得油脂,参考文献(Voeste T et al.Journal of the American Oil Chemists Society,1984,61(2):350-352)制备得到脂肪醇。用于制备表面活性剂。
实施例6:PTA重组弯曲隐球酵母的构建
产油酵母Cryptococcus curvatus CGMCC 2.1389购自中国普通微生物菌种保藏管理中心。利用AGL-GPD-PTA对C.curvatus进行转化,将PTA基因导入C.curvatus,具体流程同实施例1,经在潮霉素抗性平板筛选,最终获得弯曲隐球酵母工程菌株Cc-PTA。
将重组弯曲隐球酵母工程菌株Cc-PTA和出发C.curvatus菌株接种分别接种于YEPD培养基中,28℃,200rpm,培养24h,然后以10%的接种量转接至工作体积为2L的3-L生物反应器。玉米秸秆水解液-限氮培养基初始葡萄糖浓度为30g/L,木糖浓度15g/L,阿拉伯糖1.8g/L,半乳糖1g/L,甘露糖1.2g/L。培养条件为30℃,溶氧45%-60%,pH 7.0。结果发现,与对照菌株C.curvatus相比,发酵时间缩短30%,生物量由20g/L增加至22.5g/L,重组Cc-PTA胞内油脂含量由55%增加到了69%。证明优化的PTA基因可促进弯曲隐球酵母油脂含量显著增加。
所得油脂,参照文献(Aoshima H et al.International Journal of Pharmaceutics,2005,293(1-2):25-34)方法,制备得到的润滑剂,可用作生产片剂药物的润滑剂。
实施例7:PTA重组皮状丝孢酵母Tc-PTA的构建
产油酵母皮状丝孢酵母Trichosporon cutaneum CGMCC 2.138购自中国普通微生物菌种保藏管理中心。利用AGL-GPD-PTA对T.cutaneum进行转化,将PTA基因导入T.cutaneum,具体流程同实施例1,经在潮霉素抗性平板筛选,最终获得皮状丝孢酵母工程菌株Tc-PTA尽量配以文字说明。
将重组皮状丝孢酵母工程菌株Tc-PTA和出发T.cutaneum菌株分别接种于YEPD培养基中,28℃,200rpm,培养24h,然后以15%(v/v)的接种量接种在甘油限氮培养基,初始甘油为70g/L,30℃,200rpm,pH 5.6,每隔24h取样,甘油耗尽即结束发酵。结果发现,与对照菌株T.cutaneum相比,重组皮状丝孢酵母工程菌株Tc-PTA发酵时间由10d缩短至7.5d,生物量由15g/L提高至20g/L胞内油脂含量由58%增加到了69%。证明优化的PTA 基因可促进皮状丝孢酵母油脂含量显著增加。
实施例8:PTA重组亚罗氏解脂酵母Yl-PTA的构建
亚罗氏解脂酵母Yarrowia lipolytica CGMCC 2.1398(购自中国普通微生物菌种保藏管理中心)。利用AGL-GPD-PTA对Y.lipolytica进行转化,将PTA基因导入Y.lipolytica,具体流程同实施例1,经在潮霉素抗性平板筛选,最终获得亚罗氏解脂酵母工程菌株Yl-PTA。
将重组亚罗氏解脂酵母工程菌株Yl-PTA和出发Y.lipolytica菌株分别接种于YEPD培养基中,28℃,200rpm,培养24h,然后以10%的接种量转接至工作体积为100mL的淀粉水解液-限氮培养基,发酵条件为总糖初始浓度50g/L 30℃,200rpm,pH 7.0,以2M NaOH调节pH。每隔24h取样一次。结果发现,与对照菌株Y.lipolytica相比,重组亚罗氏解脂酵母工程菌株Yl-PTA发酵时间由3.5d缩短至2.5d胞内油脂含量由12%增加到了29%,生物量由7g/L提高至12g/L。证明优化的PTA基因可促进Yl-PTA生物量的积累和油脂含量增加。
尽管示例性的实施方案已经对本发明进行具体地显示和描述,但是本领域的普通技术人员应该理解,在不背离由权利要求书所定义的本发明的精神和范围的条件下,可以在其中进行各种形式和细节的变化,可以进行各种实施方案的任意组合。
SEQUENCE LISTING
<110> 中国科学院大连化学物理研究所
<120> 一种促进产油酵母生产油脂的方法
<130>
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 972
<212> DNA
<213> 枯草芽孢杆菌
<220>
<221> DNA
<222> (1)..(972)
<400> 1
atggctgacc tcttctcgac cgtccaggag aaggtcgccg gcaaggacgt caagatcgtc 60
ttcccagagg gcctcgacga gcgcatcctc gaggctgtct cgaagctcgc cggcaacaag 120
gtcctcaacc ctatcgtcat cggcaacgag aacgagatcc aggctaaggc taaggagctc 180
aacctcaccc tcggcggcgt caagatctac gaccctcaca cctacgaggg catggaggac 240
ctcgtccagg ctttcgtcga gcgccgcaag ggcaaggcta ccgaggagca ggctcgcaag 300
gctctcctcg acgagaacta cttcggcacc atgctcgtct acaagggcct cgccgacggc 360
ctcgtctcgg gcgctgctca ctcgacggct gacaccgtcc gcccagctct ccagatcatc 420
aagaccaagg agggcgtcaa gaagacctcg ggcgtcttca tcatggctcg cggcgaggag 480
cagtacgtct tcgcggactg cgctatcaac atcgctccag actcgcagga cctcgccgag 540
atcgctatcg agtcggctaa caccgctaag atgttcgaca tcgagcctcg cgtcgctatg 600
ctctcgttct cgaccaaggg ctcggctaag tcggacgaga ccgagaaggt cgccgacgcc 660
gtcaagatcg ctaaggagaa ggctccagag ctcaccctcg acggcgagtt ccagttcgac 720
gccgctttcg tcccttcggt cgccgagaag aaggctccag actcggagat caagggcgac 780
gctaacgtct tcgtcttccc ttcgctcgag gccggcaaca tcggctacaa gatcgctcag 840
cgcctcggca acttcgaggc tgtcggccct atcctccagg gcctcaacat gccagtcaac 900
gacctctcgc gcggctgcaa cgctgaggac gtctacaacc tcgctctcat cacggcggct 960
caggctctct ag 972
<210> 2
<211> 50
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(50)
<400> 2
ccatgggata tcatgcacca ccaccaccac cacgctgacc tcttctcgac 50
<210> 3
<211> 27
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(27)
<400> 3
ggactagtct agagagcctg agccgcc 27
<210> 4
<211> 35
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(35)
<400> 4
ctagtctaga tccatgctgc tgcgatctgg gagtg 35
<210> 5
<211> 37
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(37)
<400> 5
ccatgggata tctgtgactg atctggtgtt gttctga 37
<210> 6
<211> 56
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(56)
<400> 6
cgaaagaaca ccaccatcac catcactaga cgattccgcc ccgtctcacc tcgcat 56
<210> 7
<211> 56
<212> DNA
<213> 人工合成
<220>
<221> DNA
<222> (1)..(56)
<400> 7
gcatgctgca ggtcgactct agaggatccc gcgcacttct ctgcactgca tctttg 56
- 还没有人留言评论。精彩留言会获得点赞!