一种永生化的牛精原干细胞系及其构建方法与流程
本发明属于细胞工程
技术领域:
,特别涉及一种永生化的牛精原干细胞系及其构建的方法。
背景技术:
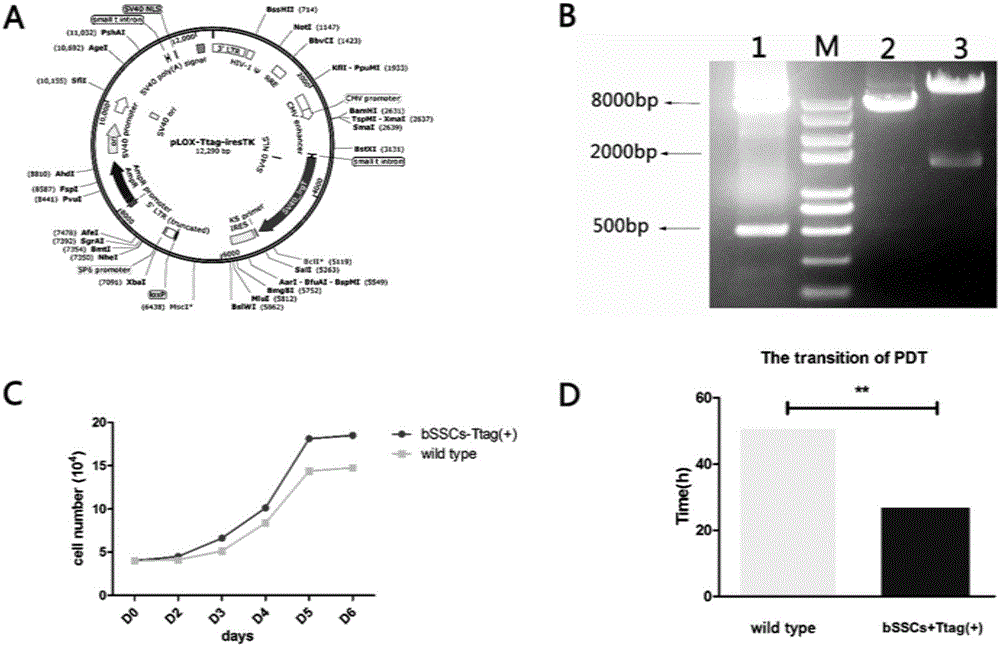
:雄性生殖干细胞,又称作精原干细胞(spermatogonialstemcells,SSCs),是位于睾丸曲细精管基膜上能通过自我更新维持自身群体数量的稳定,同时在体内定向分化并最终生成精子的一类成体干细胞。同时,它也能在特定条件下诱导去分化成为多能干细胞,这样就能绕过胚胎干细胞(embryonicstemcells,ESCs)治疗的理论与技术难题。与其他成体干细胞不同的是,它是雄性成年哺乳动物体内唯一能通过自然生殖过程将遗传信息传递给下一代的成体干细胞,因此,在生殖医学、干细胞生物学、物种保护等领域都将作其为重点来研究。西北农林科技大学陕西省干细胞研究中心在精原干细胞的研究上已开展了一定的基础工作。(Wu,Songetal.2013)(Zhu,Maetal.2014)等先后在奶山羊精原干细胞的分离纯化,培养基的筛选,以及细胞生物学,分子生物学鉴定方面做了大量的工作。并且发现了奶山羊雄性生殖干细胞表达多能性与生殖细胞的标记,具有增殖能力和向三胚层细胞分化的潜能,同时也发掘出在雄性生殖干细胞自我更新及分化机制研究中起重要作用的多个关键因子。技术实现要素:本发明解决的技术问题在于提供一种永生化的牛精原干细胞系及其构建的方法,永生化后的牛精原干细胞没有丢失精原干细胞的表型特征和生物学特性,且能够向三胚层以及精子样方向分化。本发明是通过以下技术方案来实现:一种永生化的牛精原干细胞系,是以牛精原干细胞作为宿主细胞,通过用pLOX-Ttag-iresTK慢病毒表达载体表达的慢病毒转导,转导后的牛精原干细胞表达SV40大T抗原,成为具有多向分化潜能的转化体。其细胞为成纤维样,呈多角形和短梭状,有两个或两个以上的核仁,细胞间存在接触抑制。牛精原干细胞系在传代培养35代以后SV40大T抗原还能够被表达。一种永生化的牛精原干细胞系的构建方法,包括以下步骤:1)将预处理的睾丸组织剪碎,加入10倍体积的CDD溶液中消化处理;然后等体积中和液中和,室温离心后弃上清,用DMEM+10%FBS+2mmol/L谷氨酰胺+100μmol/Lβ-巯基乙醇的溶液重新悬浮细胞后接种于培养皿上,37℃、5%CO2及饱和湿度条件下培养,再采用免疫磁珠抗体CD90分选获取纯化的牛精原干细胞;所述的CDD溶液包含2mg/mL胶原酶、20μg/mLDNase和2mg/mLDispase;所述的中和液为DMEM/F12+10%胎牛血清;2)验证好的pLOX-Ttag-iresTKT慢病毒表达载体和慢病毒包装组成成分质粒pVSVG、pAX共同转染293T细胞包装获得假慢病毒感染颗粒,用来转导细胞,并进一步检测。操作如下:⑴多聚赖氨酸溶液包被处理细胞培养皿,吸除多聚赖氨酸晾干培养皿后接种107个293T细胞。⑵待次日细胞生长至70-90%铺满培养皿时,换取新鲜温热培养液。⑶按照转染试剂转染体系,将目的载体、慢病毒辅助质粒共同转染进293T细胞。取质粒:pLOX-Ttag-iresTKT14μg;pVSVG7μg;pAX7μg,依次将转染组分别加入一个无菌洁净的玻璃离心管,混匀室温静置15min后逐滴加到293T细胞培养液中,轻轻摇匀。在换取新鲜培养液48h收取包含病毒颗粒的细胞上清液,0.45μm滤器过滤去除细胞碎片等杂质后,将此病毒液-80℃冻存或者用PG8000浓缩,以备后继试验。牛精原干细胞按照1×105细胞/35mm皿,上将牛精原干细胞按照1×105细胞/35mm皿上,12h后将含有10μg/mlpolybrene的病毒液溶液加入含有低血清培养皿中。24h后换上新鲜的培养液连续培养、传代3个月以上,直到细胞永生化,永生化后使用含血清的完全培养基。所述的低血清培养基组成成分为:DMEM/F12+10%KSR+0.1mmol/Lβ-巯基乙醇,2mmol/L谷氨酰胺,1%非必需氨基酸,1%FBS,100U/mL青霉素,100mg/mL链霉素.20ng/mLGDNF,20ng/mLbFGF,10ng/mLLIF。永生化的细胞使用的含有血清的完全培养基为DMEM/F12加入10%FBS、1mmol/L丙酮酸钠、0.1mmol/Lβ-巯基乙醇、2mmol/L谷氨酰胺、100U/ml青霉素,100mg/ml链霉素。所述的睾丸组织的处理为:将3月龄以上的睾丸组织经高浓度双抗(300U/mL青霉素,300mg/mL链霉素)清洗后转移到细胞培养室,经75%医用酒精浸泡1-2min;剪开白膜及睾丸组织,取出部分组织浸泡于PBS中,反复清洗3-4次后用剪刀剪碎。所述精原干细胞的纯化是原代差速贴壁法分离收集未贴壁的精原细胞,将收集的未贴壁精原细胞按如下步骤进行细胞分选:1)未贴壁精原细胞1200rpm室温离心5min,弃去培养液;2)离心所得细胞用PBS重悬后计数,按1×107/管分装,1200rpm室温离心5min,弃去PBS;3)离心沉淀所得细胞用20μL的CD90磁珠抗体加80μL的MACSBuffe重悬,4度孵育15min;4)孵育细胞1200rpm室温离心5min,收集上层一抗稀释液;5)细胞沉淀再用500μLMACSBuffer重悬成细胞悬液,用500μLMACSBuffer润洗MACS分选柱,待润洗的MACSBuffer将要流完时,及时缓慢滴加细胞悬液;6)收集流过分选柱的细胞悬液,获得CD90阴性精原细胞;待细胞悬液完全流过MACS分选柱后,再用500μLMACSBuffer缓慢润洗分选柱,然后取下分选柱,再向分选柱中滴加500μLMACSBuffer,收集用助推活塞推出的MACSBuffer,其中含有CD90阳性精原细胞,收集分选的牛精原干细胞接种到铺了Laminin的培养皿中培养,其培养基组成成分为:DMEM/F12+10%KSR+0.1mmol/Lβ-巯基乙醇,2mmol/L谷氨酰胺,1%非必需氨基酸,1%FBS,100U/ml青霉素,100mg/mL链霉素.20ng/mLGDNF,20ng/mLbFGF,10ng/mLLIF。通过pLOX-Ttag-iresTK慢病毒表达载体转导致牛精原干细胞得到连续传代3个月以上且能够表达SV40大T抗原。与现有技术相比,本发明具有以下有益的技术效果:1)本发明通过将pLOX-Ttag-iresTK慢病毒表达载体转染牛精原干细胞,使得重组后的牛精原干细胞表达SV40大T抗原,以解决分离出的牛精原干细胞随着传代次数的提高活力差和难以存活的问题,得到具有多向分化潜能的永生化的牛精原干细胞系。2)本发明筛选获得的永生化的牛精原干细胞系,其生长状况良好,细胞的生命力较之以前的大大提高,便于规模化的应用;在体外传代35代以上仍有较好的活力,保持分裂增殖,不发生凋亡,是一种永生化的细胞系,目前已能够传至45代。3)本发明筛选获得的永生化的牛精原干细胞系,其营养要求较低,原始分离得到的牛精原干细胞的培养需要10%的胎牛血清、GDNF、bFGF等各种生长因子,而现在只要求10%的胎牛血清,降低了培养的成本。4)将筛选获得的永生化的牛精原干细胞系,经过诱导后能够分化形成三胚层细胞,及其精子样细胞,将其移植到生精缺陷的受体小鼠睾丸中内,能在受体老鼠的睾丸中增殖形成克隆,并迁移到曲细精管基底膜。附图说明图1为牛精原干细胞形成的克隆及其相关标记基因和蛋白表达结果图;图2为永生化载体鉴定及永生化后细胞生长曲线结果图;图3为永生化牛精原干细胞(bSSCs-Ttag)系相关标记基因和蛋白表达结果图;图4为永生化牛精原干细胞(bSSCs-Ttag)系体外诱导分化能力检测结果图;图5为永生化牛精原干细胞(bSSCs-Ttag)系向精子细胞分化功能的检测结果图;图6为移植检测生殖干细胞功能检测结果图;图7为荧光显微镜检测结果图。具体实施方式本发明提供一种永生化的牛精原干细胞系,是以牛精原干细胞作为宿主细胞,通过将pLOX-Ttag-iresTK慢病毒表达载体转染牛精原干细胞,该细胞系在体外传代35代以上仍有较好的活力,保持分裂增殖,是一种永生化的细胞系。以下通过对永生化的牛精原干细胞系的构建、细胞形态特征、标志物的基因及免疫鉴定、诱导分化,以及移植到生精缺陷的受体小鼠睾丸中来做详细说明,所述是对本发明的解释而不是限定。1.牛精原干细胞(bSSCs)的分离及相关标记基因的鉴定1.1将取到的3月龄以上的睾丸组织经高浓度双抗(300U/mL青霉素,300mg/mL链霉素)清洗后转移到细胞培养室;经75%医用酒精短暂浸泡1-2min。剪开白膜及睾丸组织,取出部分组织浸泡于PBS中,反复清洗3-4次后用剪刀剪碎;加入10倍体积的CDD(2mg/mL胶原酶+20μg/mLDNase+2mg/mLDispase)37℃消化30min;然后加入等体积的DMEM/F12+10%胎牛血清(FBS)中和,2000r/min室温离心;5min后弃上清,用DMEM+10%FBS+2mmol/L谷氨酰胺+100μmol/Lβ-巯基乙醇的溶液重新悬浮细胞后接种于90mm培养皿上,37℃、5%CO2及饱和湿度条件下培养,得到含有精原干细胞的细胞群;然后采用免疫磁珠抗体CD90分选纯化精原干细胞;1.2CD90磁珠抗体分选富集精原干细胞原代差速贴壁法分离收集未贴壁的精原细胞(含有少量的精母细胞和精子细胞),将收集的未贴壁精原细胞按如下步骤进行细胞分选:1)未贴壁精原细胞1200rpm室温离心5min,弃去培养液;2)离心细胞用PBS重悬后计数,按1×107/管分装,1200rpm室温离心5min,弃去PBS;3)离心沉淀细胞用20μL的CD90磁珠抗体加80μL的MACSBuffe重悬,4度孵育15min;4)孵育细胞1200rpm室温离心5min,收集上层一抗稀释液;5)细胞沉淀再用500μLMACSBuffer重悬成细胞悬液,用500μLMACSBuffer润洗MACS分选柱,待润洗的MACSBuffer将要流完时,及时缓慢滴加细胞悬液;6)收集流过分选柱的细胞悬液,即为CD90阴性精原细胞;待细胞悬液完全流过分选柱后,再用500μLMACSBuffer缓慢润洗分选柱,然后从分选磁架上取下分选柱,再向分选柱中滴加500μLMACSBuffer,收集用助推活塞推出的MACSBuffer,其中即含有CD90阳性精原细胞,收集分选的牛精原干细胞接种到铺了Laminin的培养皿中培养,其中(图1B)为培养两周形成的克隆。1.2细胞免疫荧光检测将牛精原干细胞用4%多聚甲醛固定后,细胞免疫荧光染色进行牛精原干细胞特征性标志和胚胎干细胞标志的鉴定,同时以BSA为阴性对照进行染色。具体结果如图1所示。牛精原干细胞(bSSCs)的生殖标记基因(VASA)、干性标记基因(PLZF、GFRα-1、ETV-5、LIN28、PGP9.5)、胚胎干细胞标记基因(OCT/4、SOX-2、NANOG、KLF4)分别如图1A所示,结果表明:VASA、PLZF、GFRα-1、ETV-5、LIN28、PGP9.5、OCT/4、SOX-2、NANOG、KLF-4均为阳性。1.3RT-PCR检测以PCR扩增的第一链cDNA为模板,各个标志物相对应的引物(如表1所示)进行PCR扩增,然后对PCR扩增产物进行琼脂糖凝胶电泳检测。表1牛精原干细胞和胚胎干细胞相关标志物及其相应的PCR扩增引物标志物上游引物下游引物扩增TPLZF5'-CACCGCAACAGCCAGCACTAT-3'5'-CGGCATACAGCAGGTCATCCAA-3'127bp60β-actin5'-CGGCAATGAGCGGTTCC-3'5'-CGTGTTGGCGTAGAGGTCCT-3'142bp60SOX-25'-CCCGTGGTTACCTCTTCTTCC-3'5'-CGCTCTGGTAGTGCTGGGAC-3'145bp60Nanog5'-CCCGAAGCATCCAACTCTAGG-3'5'-GTCCGTGTCGAGGGTGTCA-3'93bp60LIN285'-CTGGAATCTATCCGAGTCACCG-3'5'GATGCTCTGGCAGAAATGGC-3'192bp60KLF-45'-TGCGGCAAAACCTACACG-3'5'-CCCACAACCATCCCAGTCA-3'96bp60OCT-45'-AAGGGCAAACGATCAAGCA-3'5'-AATGGGACCGAAGAGTACAGAGT-3”167bp60牛精原干细胞(bSSCs)标记基因的表达情况如图1C所示,各个标志物基因均被表达,说明其具有精原干细胞的特征。2、pLOX-Ttag-iresTKT慢病毒表达载体的鉴定pLOX-Ttag-iresTKT慢病毒表达载体购买于Addgene公司,pLOX-Ttag-iresTKT质粒全长12290bp(图2A),用NotI酶单酶切,用NotI酶和NotI和BamHI酶双酶切后进行电泳,及PCR鉴定所得片段长度和预期一致(图2B),电泳结果表明质粒完好,可以使用。3、永生化的牛精原干细胞(bSSCs)系的构建3.1牛精原干细胞(bSSCs)的永生化1)慢病毒的包装及病毒感染。验证好的pLOX-Ttag-iresTKT慢病毒表达载体和慢病毒包装组成成分质粒pVSVG、pAX共同转染293T细胞包装获得假慢病毒感染颗粒,用来转导细胞,并进一步检测。操作如下:1)多聚赖氨酸溶液包被处理细胞培养皿,吸除多聚赖氨酸晾干培养皿后接种107个293T细胞。2)待次日细胞生长至70-90%铺满培养皿时,换取新鲜温热培养液。3)按照转染试剂转染体系,将目的载体、慢病毒辅助质粒共同转染进293T细胞。取质粒:pLOX-Ttag-iresTKT14μg;pVSVG7μg;pAX7μg,依次将转染组分别加入一个无菌洁净的玻璃离心管,混匀室温静置15min后逐滴加到293T细胞培养液中,轻轻摇匀。在换取新鲜培养液后48h收取包含病毒颗粒的细胞上清液,0.45μm滤器过滤去除细胞碎片等杂质后,将此病毒液-80℃冻存或者用PG8000浓缩,以备后继试验。牛精原干细胞按照1×105细胞/35mm皿,上将牛精原干细胞按照1×105细胞/35mm皿上,12h后将含有10μg/mlpolybrene的病毒液溶液加入含有低血清培养皿中。24h后换上新鲜的培养液连续培养、传代3个月以上,直到细胞永生化,永生化后使用含血清的完全培养基。所述的低血清培养基组成成分为:DMEM/F12+10%KSR+0.1mMβ-巯基乙醇,2mmol/L谷氨酰胺,1%非必需氨基酸,1%FBS,100U/ml青霉素,100mg/ml链霉素.20ng/mlGDNF,20ng/mlbFGF,10ng/mlLIF。永生化的细胞使用的含有血清的完全培养基为DMEM/F12加入10%FBS、1mmol/L丙酮酸钠、0.1mmol/Lβ-巯基乙醇、2mmol/L谷氨酰胺、100mg/mL青霉素/链霉素。2)细胞群体倍增时间分析(Populationdoublingtime,PDT)牛精原干细胞连续传代,统计起始细胞数和培养48h后的细胞数。PDT的计算参考PDT=[log2/(logNt0-logN0)]×t,Nt=培养后的细胞数,N0=接种细胞数,t为培养时间。对细胞的群体倍增时间分析发现永生化的牛精原干细胞的群体倍增时间由50.9h缩短到了27.24h(图2C、D)说明其增殖能力显著地增强。3.2永生化牛精原干细胞系(bSSCs-Ttag)相关标记基因的鉴定3.2.1westernblotting鉴定牛精原干细胞相关基因的表达将第6代、第8代、第10代的牛精原干细胞bSSCs-Ttag用蛋白提取试剂盒提取细胞的总蛋白做Westernblotting。结果说明永生化后的牛精原干细胞bSSCs-Ttag能够成功的表达永生化基因(SV40)及精原干细胞标记基因(PGP9.5、OCT4)(如图3A所示)。3.2.2RT-PCR鉴定相关基因的表达牛精原干细胞(bSSCs)标记基因的表达情况如图3B所示,永生化基因(SV40)、干性标记基因(PLZF、LIN28、)、胚胎干细胞标记基因(OCT4、NANOG、KLF4)、增殖标记(PCNA)、分化标记基因(C-KIT)均被表达,说明永生化基因SV40成功的整合到细胞的基因组上,且建立的永生化牛精原干细胞(bSSCs-Ttag)没有丢失其生物学特性。3.2.3细胞免疫荧光鉴定相关基因的表达将牛精原干细胞用4%多聚甲醛固定后,细胞免疫荧光染色进行永生化牛精原干细胞(bSSCs-Ttag)相关标志基因的鉴定,同时以BSA为阴性对照进行染色。结果显示(如图3B)永生化牛精原干细胞(bSSCs-Tag)的生殖标记基因(VASA)、干性标记基因(PLZF、ETV-5、CD49f、PGP9.5)均能够表达。3.2.4永生化牛精原干细胞(bSSCs-Ttag)的体外分化能力检测将第13代的永生化的牛精原干细胞解离成单细胞悬液,用DMEMF/12+10%FBS+2mmol/LGlu+1%NEAA+100U/ml青霉素+100mg/ml链霉素的溶液按照800–1000细胞/25μL悬浮培养以形成EB(如图4A)。进一步分化时将EB接种在0.1%明胶处理的培养板上,用DMEM/F12+10%FBS+0.1mmol/Lβ-ME+2mmol/LGlu+1mmol/L丙酮酸钠+0.1mmol/LNEAA培养3–14天以探究其自发分化能力。细胞分化后免疫荧光染色检测NESTIN(外胚层)、ASM(中、内胚层)、PDX1(内胚层)均有出现部分阳性细胞,同时PCR检测结果显示NESTIN(外胚层)、ASM(中、内胚层)、PDX1(内胚层)均能够表达(如图4B、C所示)。3.2.5永生化牛精原干细胞(bSSCs-Ttag)向精子细胞分化功能的检测永生化牛精原干细胞形成EB后用RA诱导,诱导7d后出现精子样细胞(图5A)。细胞免疫荧光染色检测减数分裂各期细胞的表达情况,结果证实减数分裂前标记(STRA8)、减数分裂标记(DAZL)及减数分裂后标记(EXCO-2、ACR)都有表达(图5B),同时q-PCR结果显示经过RA诱导后的细胞其减数分裂前标记(STRA8)、减数分裂标记(SCP-3、DAZL)及减数分裂后标记(EXCO-2)均上调(图5C),这些结果证实了永生化牛精原干细胞(bSSCs-Ttag)具有分化为精子细胞的能力。3.2.6永生化牛精原干细胞(bSSCs-Ttag)移植检测生殖干细胞功能收集培养到第15代转导了GFP的永生化的牛精原干细胞(bSSCs-Ttag),用DMEM/F12+10%FBS的培养基重悬细胞,按照105细胞/睾丸的量将细胞注入生精缺陷的受体小鼠睾丸曲细精管中。2个月后收集移植后的小鼠睾丸,将曲细精管和固定、切片后的样品在荧光显微镜下镜检,照相记录结果。两个月后通过受体小鼠睾丸的切片检测,发现2个月后依然能够检测到永生化牛精原干细胞(bSSCs-Ttag)存在(如图6A,B、图7A,B所示)。证明永生化牛精原干细胞具有雄性生殖干细胞的功能。雄性生殖干细胞在机体内担负传递遗传信息的重担,在生殖医学、干细胞生物学、畜牧生产等领域具有重要的理论价值和广阔的应用前景。在睾丸曲细精管内,雄性生殖干细胞在维持自我更新的基础上,不断分化,经减数分裂产生源源不断的精子以维持雄性个体的生育能力。本发明将牛精原干细胞进行永生化,并且对永生化后的牛精原干细胞系bSSCs-Ttag进行相关基因的检测以及诱导分化,结果显示永生化后的牛精原干细胞系bSSCs-Ttag仍然具备雄性生殖干细胞的生物学特性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1