一种用于造血干细胞培养的滋养层的制备方法与流程
本发明涉及一种用于造血干细胞的滋养层的制备方法。
背景技术:
脐带血被认为是一种除了骨髓移植以外治疗血液系统疾病,尤其是血液系统肿瘤的重要资源。从1988年第一例临床成功移植脐带血以来,其应用随着细胞治疗研究的发展得到的了长足的进步。虽然相比骨髓和外周血,脐带血在造血重建中的应用比例仍然处于相对较低的水平,到目前为止,超过25000例脐带血成功移植的案例仍使人们对这一曾被丢弃的宝贵资源充满了信心。作为造血干细胞(Hematopoietic Stem Cell,HSC)的来源,脐带血对比骨髓和外周血有两个天然的优势,首先,脐带血移植的移植物抗宿主病(GVHD)风险远远小于其他两者,这对异体移植的成功有重要意义;其次,脐带血移植时的HLA配型要求很低,大大的降低了患者获取可用细胞源的难度。尽管如此,脐带血想要替代骨髓成为HSC最主要的来源并非易事,其中有两个问题是制约脐带血造血干细胞的主要原因,即数量不足和植入时间长。为了克服脐带血的这些不足之处,研究人员尝试了许多不同的方法,其中分离并体外扩增脐带血造血干细胞是目前被认为最有临床前景的手段。
间充质干细胞(MSC)是干细胞家族的重要成员,来源于发育早期的中胚层和外胚层,可以以其作为滋养层培养造血干细胞。但是,采用MSC作为滋养层培养造血干细胞时,MSC会大量增殖,并在培养一段时间后会大量脱落凋亡,产生的大量溶酶体等物质,并改变培养基pH值环境,极大的影响造血干细胞的扩增,并引起凋亡。有文献报道用丝裂霉素处理MSC细胞可以阻止其增殖,但残留的丝裂霉素会对将要扩增的造血干祖细胞造成非常不利的影响。
技术实现要素:
为了解决上述问题,本发明提供了一种新的用于造血干细胞的滋养层的制备方法。
本发明用于造血干细胞的滋养层的制备方法,步骤如下:
(1)取细胞培养板,包被胶原蛋白,得包被了胶原蛋白的细胞培养板;
(2)取间充质干细胞的细胞悬液,接种到步骤(1)中包被了胶原蛋白的细胞培养板中,培养至细胞融合度为70-90%时,即可。
步骤(1)中,所述胶原蛋白是鼠尾胶原蛋白。
步骤(1)中,每孔包被0.8-1.2ml胶原蛋白,优选为1ml胶原蛋白。
步骤(2)中,接种的间充质干细胞悬液的浓度为1×105~1.5×105个细胞/孔。
步骤(2)中,培养采用的培养基为用于造血干细胞培养的无血清培养基。
其中,所述无血清培养基培养为SFEM无血清培养基。
SFEM无血清培养基,购自stem cell公司。
本发明还提供了前述方法制备得到的滋养层。
本发明还提供了前述滋养层在培养造血干细胞中的用途。
本发明造血干细胞的培养方法,它是以前述滋养层为滋养层进行培养。
优选地,所述培养方法的步骤如下:取前述的滋养层,接种造血干细胞,加入无血清培养基,培养即可;所述无血清培养基是每1ml添加有50-100ngSCF、25-50ng TPO、10-50ng Flt-3L的SFEM无血清培养基。
本发明方法制备的滋养层,能够为造血祖干细胞(HSPC)的体外扩增提供有力的支持作用,显著提高HSPC的扩增效率,能够极大程度的缓解HSPC不足的问题,应用前景良好。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1本发明制备的MSC滋养层细胞增殖和细胞形态情况
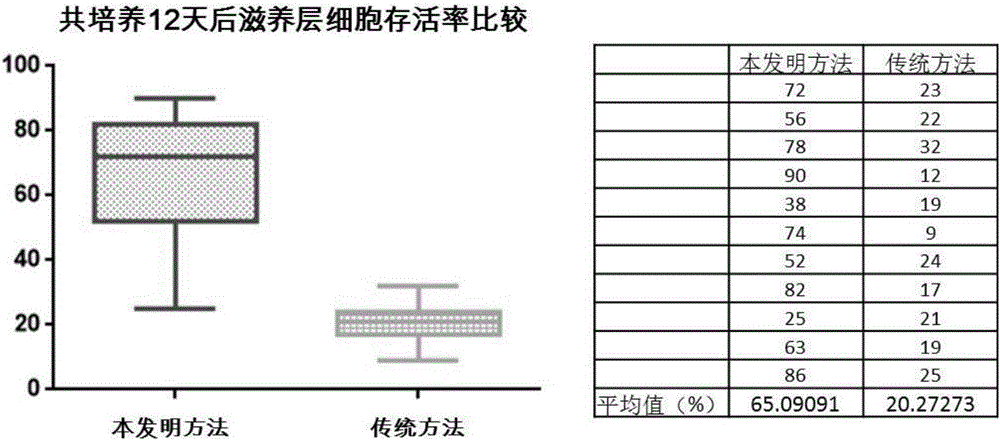
图2本发明制备的MSC滋养层细胞在共培养12天后的存活率情况
图3本发明制备的MSC滋养层共培养的造血干祖细胞在扩增12天后的情况
具体实施方式
主要仪器及试剂:
SFEM 无血清培养基,购自stem cell公司货号09650;
造血干细胞培养基:SFEM无血清培养基,购自stem cell公司;
SCF 干细胞生长因子
TPO 促血小板生成素
FLT-3 配体 FMS样酪氨酸激酶配体
以上三种细胞因子购自Peprotech公司;
胰酶,购自gbico公司;
Ficoll,购自天津市灏洋生物制品科技有限责任公司;
生理盐水,购自四川科伦药业股份有限公司;
CD34+细胞分离磁珠,购自Miltenyi公司。
实施例1 用于造血干细胞的滋养层的制备
1、间充质干细胞按照如下方法制备
(1)取新鲜脐带一根,放置于90mm玻璃平皿中,剪下一段长约10cm的脐带,倒入生理盐水,漂洗脐带,将表面血污洗去。
(2)用眼科剪将脐带剪至约1.5cm的小段并剖开,漂洗清除血管内血污,将脐带转入另一干净平皿中。
(3)倒入生理盐水,再次漂洗脐带;重复漂洗2-3次,除净血污。
(4)准备4-6个直径100mm塑料培养皿并标记,每皿中放入1段1.5cm长的脐带(多余的脐带组织丢弃)并加入2ml培养基(DMEM+F12+10%胎牛血清)。用眼科剪将脐带剪碎成肉糜状(2-3mm3的颗粒)。
(5)用剪刀将脐带碎块均匀的平铺在平皿上。将培养皿置于37℃,5%CO2培养箱中培养。(移动培养皿时,勿使组织碎块晃动)
(6)培养24小时后补加8ml培养基(DMEM+F12+10%胎牛血清);培养至第7天时进行半量换液,之后每3天进行半量换液。
(7)第10天观察细胞爬出情况,直至2个以上的皿中,10个细胞以上克隆数≥4,即可去除全部组织块;待平均汇合度达30-50%左右时进行传代。
(9)待P1代细胞生长至80%汇合度时进行消化冻存至液氮中待用。
2、脐带MSC细胞滋养层的制备方法
(1)制备移动浓度的MSC细胞悬液:
1)从液氮中取出冻存的P1代MSC置于37°水浴中迅速解冻细胞。
2)用3ml无血清培养基(MSC无血清培养基)稀释冻存液,并小心的轻轻混匀,将细胞悬液吸入10ml离心管中。
3)室温下离心,500g,3分钟。
4)吸去上清,用5ml无血清培养基充分混匀,台盼蓝染色计数细胞浓度。
5)将6x105个细胞(0.6x105个/ml)接种到10cm培养皿中。
6)37℃,5%CO2培养箱中培养48-60小时,每天观察细胞生长状态。
7)当在显微镜下观察细胞融合度达到80-90%时,从培养箱取出培养皿。
8)吸取培养基,用常温PBS小心洗细胞一次。
9)加入1ml胰酶消化细胞,在37℃培养箱中静置1分钟。
10)用1ml胎牛血清终止消化反应,再加入3ml无血清培养基,充分混匀细胞,将细胞悬液吸入10ml离心管中。
11)室温下离心,500g,3分钟。
12)吸去上清,用5ml SFEM无血清培养基充分混匀,得MSC细胞悬液,台盼蓝染色计数细胞浓度。
(2)取一个6孔板,每孔加入1ml鼠尾胶原蛋白(0.8-1.2ml均可),置于37℃培养箱中待用。
(3)从培养箱取出之前预处理过得6孔板,用无菌PBS洗两次。
(4)将MSC细胞悬液按照1x105个细胞/孔(1-1.5x105)接种到6孔板中,轻轻水平摇晃混匀。
(16)将6孔板置于37℃培养箱中,当细胞融合度达到70%时即可作为滋养层,接种CD34+造血干细胞。
实施例2 用于造血干细胞的滋养层的制备
1、间充质干细胞为市售产品。
2、脐带MSC细胞滋养层的制备方法
(1)制备移动浓度的MSC细胞悬液:
同实施例1。
(2)取一个6孔板,每孔加入0.8ml鼠尾胶原蛋白,置于37℃培养箱中待用。
(3)从培养箱取出之前预处理过得6孔板,用无菌PBS洗两次。
(4)将MSC细胞悬液按照1.5x105个细胞/孔接种到6孔板中,轻轻水平摇晃混匀。
(5)将6孔板置于37℃培养箱中,当细胞融合度达到80%时即可作为滋养层,接种CD34+造血干细胞。
实施例3 用于造血干细胞的滋养层的制备
1、间充质干细胞:制备方法同实施例1。
2、脐带MSC细胞滋养层的制备方法
(1)制备移动浓度的MSC细胞悬液:
同实施例1。
(2)取一个6孔板,每孔加入1.2ml鼠尾胶原蛋白,置于37℃培养箱中待用。
(3)从培养箱取出之前预处理过得6孔板,用无菌PBS洗两次。
(4)将MSC细胞悬液按照1.5x105个细胞/孔接种到6孔板中,轻轻水平摇晃混匀。
(5)将6孔板置于37℃培养箱中,当细胞融合度达到90%时即可作为滋养层,接种CD34+造血干细胞。
如下用实验例的方式来说明本发明的有益效果:
实施例1 采用本发明滋养层培养造血干细胞
一、实验方法
(一)造血干/祖细胞的获取
1.取新鲜脐带血100ml,用50ml离心管分装后在室温下900g 15分钟离心。
用移液管吸去上层的血浆部分,在加入与下层细胞等体积的生理盐水,2.在50ml离心管中按每管20ml的量加入Ficoll溶液,将上一步获得的血细胞悬液小心的滴加到Ficoll溶液上。
3.在室温下以400g,30min的条件进行离心。
4.离心完成后,吸出离心管中的白膜层部分,用生理盐水稀释到40ml体积,并用血细胞分类计数仪进行细胞计数。
5.通过计数结果,从细胞悬液中取出1×108单个核细胞,进行离心。
用10ml MACs Buffer洗涤细胞沉淀,离心900g,10min。
6.将离心后的上清液去掉,用300ul MACs Buffer重悬细胞沉淀。
向细胞悬液中先后加入100ul封闭液和100ul CD34+分选磁珠,充分混匀后在4℃条件下孵育30min。
7.用5ml MACs Buffer稀释洗涤细胞悬液,离心900g,10min去除离心上清。将分选细胞的磁力柱放置于磁力架,用1ml MACs Buffer润洗。
8.用1ml MACs Buffer重悬细胞,将细胞悬液加到磁力柱中。用1ml MACs Buffer洗磁力柱,重复3-5次。
9.将磁力柱从磁力架上取下,置于一个新的15ml离心管中,加入1ml MACs Buffer并用磁力柱塞迅速推入磁力柱管,将细胞冲洗到离心管中。
10.离心900g,10min,用无血清培养基重悬细胞,并用血球计数板机型计数。
取部分分选的CD34+细胞进行流式细胞检测,即为造血干/祖细胞。
(二)造血干细胞的培养
将前述步骤获得的CD34+细胞按照1-2×105/孔接种到实施例1制备的间充质干细胞滋养层的6孔板上,每孔加入2ml培养基(SFEM无血清培养基+50-100ng/ml SCF+25-50ng/ml TPO+10-50ng/ml Flt-3L三种因子),并同时以现有方法制备的MSC滋养层对照组。
现有方法制备MSC滋养层:用MSC培养基(lonza MSCBMCD Cat.00190620)培养MSC细胞,然后用胰酶消化,离心后重悬,按照1x104个/ml接种到六孔板中,置于37℃培养箱培养。待细胞融合度达到70%-80%时,加入丝裂霉素处理1小时,用PBS洗细胞两次后,加入培养基备用。
每3天补液到2ml体积,到第12天时收集培养细胞,并进行计数分析。
二、实验结果
1、滋养层的增殖速度
如图1所示,通过本发明所述的方法制备的MSC滋养层在培养48小时后,相比传统方法铺板的MSC,细胞增殖速度大大降低,细胞体积明显增大,胎盘蓝计数结果显示,本发明的方法在培养72小时候,细胞数量仅为传统方法的40%左右。
2、滋养层的凋亡情况
如图2所示,通过本发明所述的方法制备的MSC滋养层在加入CD34+细胞共同培养12天后,用胰酶将MSC消化下来后进行胎盘蓝染色技术,本发明的细胞的存活率远远大于传统方法制备的滋养层共培养相同时间的情况。
3、造血干细胞的增殖数量
如图3所示,通过本发明所述的方法制备的MSC滋养层共培养的CD34+造血干祖细胞在培养12天后增殖数量明显高于传统方法。扩增后细胞的死亡率也大大低于传统方法。
综上,本发明方法制备的滋养层,其本身的增殖速度慢,细胞死亡少,用其培养培养造血干细胞,造血干细胞的增殖数量明显高于传统方法制备的滋养层培养的增殖数量,具有良好的工业应用前景。
- 还没有人留言评论。精彩留言会获得点赞!