一种人胚胎干细胞快速定向分化至视网膜色素上皮细胞的方法与流程
本发明涉及一种细胞培养方法,具体涉及一种人胚胎干细胞快速定向分化至视网膜色素上皮细胞的方法。
背景技术:
视网膜色素上皮细胞(Retinal pigment epithelial cell,简称RPE细胞)是一层紧贴于视网膜视觉神经之外的色素细胞。融合的RPE细胞在显微镜下呈现单层六边形,细胞内含有密集的色素颗粒。RPE细胞具有多种细胞功能,例如,吸收光线,上皮性转运,离子缓冲,视觉环路,细胞吞噬,分泌及免疫调节,对于维持视网膜上各种视觉神经元细胞的正常功能有重要作用1-2。其中比较重要的功能有:1)上皮性转运:RPE细胞形成了血视网膜屏障(Blood retina barrier),它与双侧表面外的细胞紧密结合,并使视网膜内层独立于外部系统的影响,这对眼部精密调控环境中的高选择性物质转运以及神经信号转递有重要意义,同时,RPE细胞为感光细胞提供营养,调控离子浓度,排除水及其他代谢产物;2)针对感光细胞外段(Photoreceptor outer segment)的细胞吞噬作用(Phagocytosis):感光细胞持续暴露于光氧化刺激,会受到一定损伤,RPE细胞通过细胞吞噬作用不断将受损伤的外段吞噬并消化,以维持感光细胞的正常功能;3)分泌细胞因子:RPE细胞能分泌大量的各种因子和信号分子来与其周围的组织实行交流,如,成纤维生长因子,转化生长因子-β,类胰岛素生长因子-1,血小板源性生长因子,血管内皮生长因子以及色素上皮源性因子等,这些信号分子都有重要的生理病理学意义。如果RPE细胞出现功能性病变,将直接影响与其相关的视网膜,通常会导致视力损害,甚至盲症。最常见的视力疾病有老年黄斑变性和视网膜色素变性3。
老年黄斑变性(Age related macular degeneration,简称AMD)是一种与年龄相关的眼科疾病,其发病率高,常见于老年人群,是55岁以上的老年人视力低下致盲的最主要原因,严重影响老年人生活质量。在欧美地区55岁以上人群的患病率为1.63%,65岁以上的患病率约16%,75岁以上的患病率接近30%4-5。我国随着人口老龄化以及高血压和高血糖患者数量的增加,AMD患病人数也逐步上升。世界卫生组织曾发表报告,指出全世界至少有800万人由于晚期老年性黄斑变性而遭受视力严重损伤带来的痛苦。
AMD致病原因是人类视觉成像最敏锐的黄斑区产生衰退性病变。首先出现衰退的是视网膜下方的视网膜色素上皮细胞,随后是与视网膜色素上皮细胞直接相邻的视网膜感光细胞出现凋亡,导致视野正中的视力大幅度下降,甚至失明。AMD根据其临床表现不同分为萎缩型(又称干性)和渗出型(又称湿性)两型,干性主要为RPE细胞下堆积毒性沉淀等引起RPE细胞和感光细胞凋亡;湿性主要为脉络膜新生血管形成,侵入视网膜下,导致黄斑区出血并形成盘状脱离,最终形成盘状伤痕,导致视野中心视力的严重丧失。AMD确切的致病原因仍然不清,一些研究表明主要致病因素有环境和遗传方面的3,6。
与AMD的严重致盲性相对应的是缺乏有效治疗方法。对湿性AMD现在可采用抗新生血管药物进行治疗。但是对于干性AMD,目前无任何有效的治疗手段。一些临床研究表明使用复合维生素可以延缓黄斑形成,但是最终失明仍然是不可避免的。
人类胚胎干细胞(Human embryonic stem cell,简称hESC)作为一种全能性干细胞(Pluripotent stem cell),具有两种其他细胞没有的特性:一是可以无限分裂生长的自我更新能力;二是可以分化为人体所有其他细胞系的潜能。在特定的体外培养条件下,可以将hESC分化至不同功能的体细胞,进而形成不同的组织甚至是器官。胚胎干细胞所具有的这些潜能对医学界有着很强的应用前景。现代医学仍然对很多人类疾病束手无策,这类疾病的致病机理大多是因为失去一种或几种功能细胞,而人体又无法再生这些失去的细胞。如果将hESC 分化成这些失去的细胞并移植回病人,就有很大可能完全治愈这些原本没有任何希望的疾病,这些疾病包括:I型糖尿病,老年性痴呆,肌萎缩性脊髓侧索硬化症,表皮溶解水皰症,心脏衰竭,心肌梗塞,缺血性心肌炎以及镰刀型贫血等等7。同时胚胎干细胞还可以结合基因治疗,组织工程及药物开发等进行医疗或研究应用,因此胚胎干细胞的医疗应用前景十分广阔,有巨大的社会需求和市场潜力。
目前英国、美国、日本以及韩国的科学家在尝试移植hESC分化的RPE细胞(hESC-RPE)到病人的视网膜取代衰退的RPE细胞,以治疗AMD。韩国CHA University的科学家与美国制药公司Ocata Therapeutics合作,于2013年对四名AMD病人进行了治疗,其中三人显示出治疗效果,长期观察后未发现任何副作用8。日本理化研究所的科学家与神户市立中央市民医院合作,于2014年使用诱导全能性干细胞(Induced pluripotent stem cell,简称iPSC)分化的RPE细胞对一名AMD病人实施治疗14。英国科学家成立了以hESC-RPE治疗AMD的London Project to Cure Blindness,参与的研究和商业机构有Moorfields Eye Hospital、UCL Institute of Ophthalmology、National Institute for Health Research以及辉瑞制药公司,于2015年9月成功对一名AMD病人实施了移植手术,并计划在18个月内对10名病人进行治疗15。美国加州再生医学研究所资助了以hESC-RPE治疗AMD的California Project to Cure Blindness,参与的研究机构有University of Southern California、UC Santa Barbara、Caltech、City of Hope以及Cedar Sinai Hospital,与2016年开始准备临床一期实验。
在对AMD的干细胞治疗中,RPE细胞的分化技术具有重要的地位。RPE细胞的分化效率的高低,不同批次RPE细胞的产量是否稳定,RPE细胞的各项性状是否达到正常水平决定了随后的治疗效果的好坏。传统使用的自发分化RPE细胞的方法需要较长的时间,近年来有使用定向分化的方法来加速RPE细胞分化,但是分化效率依然较低,另外分化后的RPE细胞的成熟过程仍然需要很长时间9-13,这些缺点都不利于RPE细胞的临床医学应用。
技术实现要素:
有鉴于此,本发明提供了一种人胚胎干细胞快速定向分化至视网膜色素上皮细胞的方法,该方法能够在30天内将人胚胎干细胞诱导分化至成熟的视网膜色素上皮细胞,具有快速高效的优点。
本发明采取的技术方案如下:
1.一种人胚胎干细胞快速定向分化至视网膜色素上皮细胞的方法,包括如下步骤:
(1)首先进行人胚胎干细胞培养,当细胞生长至80%融合时弃去培养基,加入分化基础培养基,同时加入终浓度50ng/mL的Noggin因子、终浓度10ng/mL的DKK-1因子和终浓度10mM的烟酰胺继续培养;所述分化基础培养基按500mL计,组分及各组分含量为:
1×DMEM/F12培养基480mL,Supplement 10mL,100×N-2Supplement 5mL,100×MEM非必需氨基酸溶液5mL;所述DMEM/F12培养基中DMEM与F12的体积比为1∶1;
(2)分化后第3天弃去旧培养基,更换新的分化基础培养基,同时加入终浓度10ng/mL的Noggin因子、终浓度10ng/mL的DKK-1因子、终浓度10mM的烟酰胺和终浓度5ng/mL的bFGF继续培养;
(3)分化后第5天弃去旧培养基,更换新的分化基础培养基,同时加入终浓度10ng/mL的Noggin因子、终浓度10ng/mL的DKK-1因子、终浓度10mM的烟酰胺和终浓度5ng/mL的bFGF继续培养;
(4)分化后第7~8天,当细胞培养物中出现5~15%的神经干细胞时,弃去旧培养基,更换新的分化基础培养基,同时加入终浓度100ng/mL的激活素A和终浓度10μM的SU5402继续培养至分化后第14天,期间每2天更换一次培养基;
(5)分化后第15天部分细胞已分化至视网膜色素上皮细胞,弃去旧培养 基,更换成熟培养基继续培养至细胞培养物中出现大面积色素斑块;
所述成熟培养基按500mL计,组分及各组分含量为:1×IMDM培养基494.5mL,Supplement 5mL,按1∶1000的体积比稀释的化学成分确定的脂质浓缩物(Chemically defined lipid concentrate)0.5mL。
优选的,所述步骤(1)中人胚胎干细胞培养的器皿底部覆盖有一层Matrigel。
优选的,所述步骤(1)中使用Essential 8培养基培养人胚胎干细胞至80%融合,弃去培养基,用DMEM/F12培养基洗涤细胞后加入分化基础培养基。
优选的,所述步骤(1)中人胚胎干细胞生长至80%融合时,手工移除已分化的杂细胞。
优选的,所述步骤(4)中更换新的分化基础培养基之前先用DMEM/F12培养基对细胞进行洗涤。
优选的,所述人胚胎干细胞为H9细胞系。
2.Noggin因子在促进人胚胎干细胞快速定向分化至视网膜色素上皮细胞中的应用。
3.烟酰胺在促进人胚胎干细胞快速定向分化至视网膜色素上皮细胞中的应用。
4.SU5402在促进人胚胎干细胞快速定向分化至视网膜色素上皮细胞中的应用。
在本发明中,Noggin因子使用浓度范围可以为10~100ng/mL,DKK-1因子使用浓度范围可以为5~20ng/mL,烟酰胺使用浓度范围可以为5~15ng/mL,bFGF使用浓度范围可以为5~10ng/mL,激活素A使用浓度范围可以为80~120ng/mL,SU5402因子使用浓度范围可以为10~20μM。
Noggin为一种由脊索分泌的多肽蛋白,是神经系统和骨骼发育所必需的重要调控因子,动物模型证实缺失Noggin基因会导致脊髓神经管畸形等神经系统的缺陷。Noggin蛋白主要作用途径是通过结合并抑制生长因子TGF-β家族成 员,如BMP4等因子,来发挥各种调控作用。加入Noggin能有效提高胚胎干细胞分化到神经干细胞和视网膜干细胞的效率。
DKK-1是WNT信号通路的抑制分子,主要作用方式是抑制WNT通路上的信号受体LRP6,降低β-链蛋白的水平并提高OCT4的表达水平。DKK-1在头部,心脏以及上肢的发育中有重要作用。动物研究表明,DKK-1表达缺失会导致一系列神经系统缺陷,如眼睛发育缺失,嗅觉异常,前脑和中脑发育缺陷等。
成纤维细胞生长因子(FGF)是具有广泛生物活性和生理功能的多功能生长因子,对细胞生长和分化以及功能都有影响。尤其是在神经系统中,bFGF广泛存在并对神经元有维持生存和促进生长及受损神经元的修复与再生作用。在体外细胞培养中,bFGF和表皮生长因子(EGF)是诱导和维持神经干细胞正常生长所必需的培养基成分。
烟酰胺(Nicotinamide)是烟酸(维生素B3)的酰胺。在细胞中,烟酸被用于合成烟酰胺腺嘌呤二核苷酸(NAD)与烟酰胺腺嘌呤二核苷酸磷酸(NADP),而烟酰胺的转变途径与烟酸的途径非常相似,所以可作为NAD合成的前体。体外实验证实烟酰胺对神经细胞有保护作用,可以提高神经细胞生存率。
激活素A(Activin A)属于生长因子TGF-β家族的成员,主要由各种腺体,如生殖腺、脑垂体等分泌表达,皮肤组织受伤后愈合时也会高水平表达。其作用主要是促进各种非神经组织的形态发生。对RPE细胞所属的上皮组织的形态形成,极性化和生理功能有促进作用。
SU5402(2-[(1,2-二氢-2-氧代-3H-吲哚-3-亚基)甲基]-4-甲基-1H-吡咯-3-丙酸)是一种化学小分子,对FGF受体,VEGF受体和PDGF受体有抑制作用。bFGF是诱导和维持神经干细胞正常生长所必需的培养基成分,加入SU5402能够抑制视网膜神经元细胞的分化,从而提高RPE细胞分化效率。
如图1所示,胚胎干细胞分化到RPE细胞的过程可大致分为三个阶段,一是胚胎干细胞分化为外胚层的神经干细胞,二是由神经干细胞分化成视网膜干 细胞,最后由视网膜干细胞分化为两种不同的组织---主要由各种神经元细胞组成的视网膜和单层极性化的RPE细胞。由于RPE细胞来源于视神经组织,但又不是神经元细胞,所以RPE细胞在分化的过程中受到的调控较为复杂,分化前期需要特定调控因子促进神经组织形成,分化后期则需要其它调控因子来抑制神经组织的形成。因此,在促进人胚胎干细胞分化至RPE细胞时需要定点定时精细调节定向分化中的各种信号分子和生长因子。
本发明在上述前两个阶段采用Noggin蛋白、DKK-1、bFGF和烟酰胺促进神经干细胞及视网膜干细胞的生成,随后采用激活素A及SU5402促进视网膜干细胞快速分化成熟为RPE细胞,最后使用成熟培养基促使RPE细胞快速成熟,整个过程可以在30天内完成,既高效又快速。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍。
图1本发明所用信号分子及生长因子在促使人胚胎干细胞分化至RPE细胞中的作用及机制示意图;
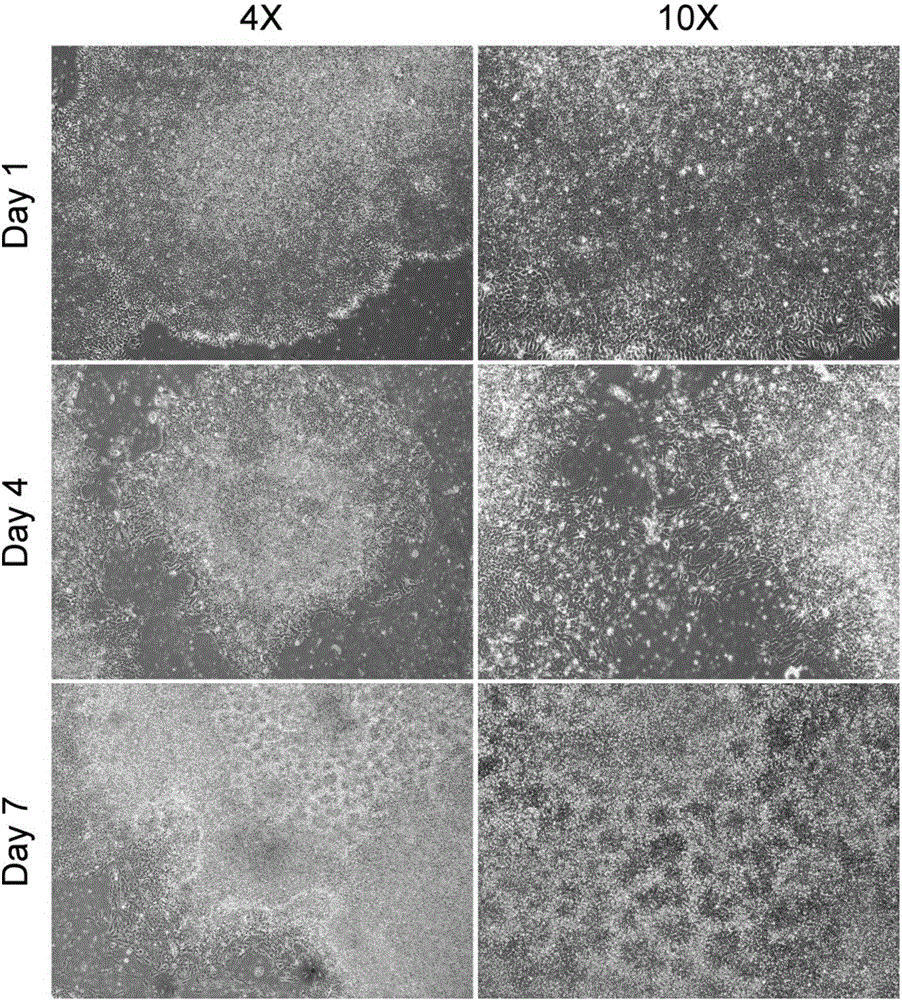
图2为人胚胎干细胞H9定向分化的第一阶段(1-7天)的细胞形态;第一天(Day 1),H9细胞在低倍镜(4×)下呈现典型未分化的胚胎干细胞群落形态;高倍镜(10×)下可见细胞群落为单层细胞;第四天(Day 4),细胞群落发生分化,低倍镜下细胞群落形态明显变化,群落边缘变得不光滑,群落形状不再是圆形,高倍镜下可见细胞群落中心出现多层细胞堆积,群落边缘的细胞形状变为细长;第七天(Day 7),细胞群落形态进一步变化,低倍镜下可见整个群落变为多层细胞堆积,高倍镜下可见大量典型的神经干细胞形态特征:玫瑰花状结构(neural rosette);
图3为人胚胎干细胞H9定向分化的第二阶段(第15天)的细胞形态;A,细胞培养物出现少量色素小斑块;B,低倍镜下的色素斑块(已成熟的RPE细 胞);C,高倍镜下的色素斑块(已成熟的RPE细胞);D,低倍镜下的无色素斑块(未成熟的RPE细胞);E,高倍镜下的无色素斑块(未成熟的RPE细胞),这些未成熟的RPE细胞已经呈现六边形的细胞轮廓,在相差显微镜下,细胞边缘呈现为高亮度;
图4人胚胎干细胞H9定向分化的第三阶段(第30天)的细胞形态;A,细胞培养物出现大量色素斑块;B,低倍镜下的色素斑块(已成熟的RPE细胞);C,高倍镜下的色素斑块(已成熟的RPE细胞);D,低倍镜下的无色素斑块(未成熟的RPE细胞);E,高倍镜下的无色素斑块(未成熟的RPE细胞);
图5人胚胎干细胞H9定向分化的最后(第60天)的细胞形态;A,细胞培养物出现大量色素斑块;B,低倍镜下的色素斑块(已成熟的RPE细胞);C,高倍镜下的色素斑块(已成熟的RPE细胞)。
具体实施方式
下面将结合附图对本发明技术方案的实施例进行详细的描述。
本发明所用人胚胎干细胞为H9细胞系;所述分化基础培养基按500mL计,组分及各组分含量为:
1×DMEM/F12培养基480mL,Supplement(简称B27)10mL,100×N-2 Supplement(简称N2)5mL,100×MEM非必需氨基酸溶液(MEM Non-Essential Amino Acids Solution,NEAA)5mL;所述DMEM/F12培养基中DMEM与F12的体积比为1∶1;
所述成熟培养基按500mL计,组分及各组分含量为:1×IMDM培养基494.5mL,Supplement 5mL,按1∶1000的体积比稀释的化学成分确定的脂质浓缩物(Chemically defined lipid concentrate,赛默飞,产品号11905031)0.5mL。
一种人胚胎干细胞快速定向分化至视网膜色素上皮细胞的方法,包括如下步骤:
(1)在Matrigel(Corning公司生产)覆盖的细胞培养用六孔板上,使用Essential 8培养基进行人胚胎干细胞H9细胞系培养,当细胞生长至80%融合时,弃去培养基,用DMEM/F12培养基洗涤细胞培养物一次后,每孔加入分化基础培养基2mL,同时加入终浓度50ng/mL的Noggin因子、终浓度10ng/mL的DKK-1因子和终浓度10mM的烟酰胺继续培养;
需注意的是,人胚胎干细胞生长至80%融合时,需先手工移除已分化的杂细胞;正常情况下培养的人胚胎干细胞都会有少量已分化细胞混杂于占多数的未分化的细胞中,正常培养6-8天后,细胞融合度达到80%或以上时,细胞培养产物中混杂的已分化细胞的数量将会达到比较高的比例(约5-20%),如果直接使用该细胞培养物进行RPE细胞定向分化,通常不会获得高的产率,这是因为已分化的细胞属于随机分化,有大量其它类型的体细胞,其中一些细胞类型,如成纤维细胞和内皮细胞具有很强的生长优势,如果不在分化的初期排除这些生长快速的杂细胞,那么最终的分化细胞产物中RPE细胞的比例将会很低,所以在开始进行分化前,应该首先进行显微镜检测,判断已分化细胞的比例,如果已分化细胞比例超过5%,则需要在手术显微镜下进行手工移除已分化细胞;手工移除时,应在手术显微镜下使用P10移液器和P10枪头,沿未分化细胞群落边缘划线,然后再使用枪头将划线区域内的已分化细胞铲除;细胞移除操作完成后,应使用新鲜培养基洗涤培养孔;
(2)分化后第3天弃去旧培养基,每孔加入分化基础培养基2mL,同时加入终浓度10ng/mL的Noggin因子、终浓度10ng/mL的DKK-1因子、终浓度10mM的烟酰胺和终浓度5ng/mL的bFGF继续培养;
(3)分化后第5天弃去旧培养基,每孔加入分化基础培养基2mL,同时加入终浓度10ng/mL的Noggin因子、终浓度10ng/mL的DKK-1因子、终浓度10mM的烟酰胺和终浓度5ng/mL的bFGF继续培养;
(4)分化后第7天,细胞培养物中出现5~15%的神经干细胞,胚胎干细胞已被诱导分化至神经干细胞和视网膜干细胞(见图2),移除旧培养基,用 DMEM/F12培养基洗涤一次细胞培养物后,更换新的分化基础培养基,每孔加入2mL,同时加入终浓度100ng/mL的激活素A和终浓度10μM的SU5402继续培养至分化后第14天,期间每2天更换一次培养基;
(5)分化后第15天部分细胞培养物出现浅棕色的色素小斑块,表明已经有部分细胞分化至RPE细胞(见图3);移除旧培养基后,使用RPE成熟培养基洗涤一次后,每孔加入RPE成熟培养基2mL继续培养,并且每2天更换一次新鲜培养基,直至细胞培养物中出现大面积的色素斑块(约在第45-60天,见图4和图5);
(6)待细胞培养物出现50%或更多深棕色色素斑块,即可分离纯化RPE细胞,可采用的分离纯化方法有两种:一、在手术显微镜下,使用手术剪刀将较大的色素斑块剪下并收集;二、使用多轮酶消化,分别移除其它种类的细胞后,再收集RPE细胞;使用手工取样或酶消化的方法分离纯化视网膜色素上皮细胞后,离心沉淀,将沉淀的细胞接种于RPE成熟培养基中,置37℃、5%CO2饱和湿度培养箱中培养;
(7)取1-3代视网膜色素上皮细胞鉴定细胞形态并测定分子标记,证实培养的是具有正常特征的视网膜色素上皮细胞。
培养过程中,需要注意的是定向分化第一天和第三天添加的信号分子和生长因子浓度的差异,由于Noggin是神经系统和骨骼发育所必需的重要调控因子,所以在RPE细胞定向分化的前期必需加入Noggin以提高神经组织分化的效率,但是如果一直保持高浓度的Noggin则有可能提高骨骼细胞分化的比例,所以在定向分化的第一天和第二天,使用高浓度的Noggin以确立分化的方向,随后使用低浓度的Noggin以降低骨骼细胞分化的比例。
成纤维细胞生长因子(FGF)是诱导和维持神经干细胞正常生长所必需的培养基成份,但是bFGF也是维持胚胎干细胞形态功能的必要调控因子,如果在定向分化第一天即加入bFGF则会显著延长分化的时间,不利于大规模快速高效的工业化生产,所以在定向分化的第一天和第二天,不加入bFGF以促使胚 胎干细胞快速进入分化阶段,待第三天,再加入bFGF诱导神经干细胞分化。
以上两种因子的浓度变化对高效快速定向分化RPE细胞有至关重要的影响,如果不能正确按时按量添加,分化效率会受到极大影响。
在定向分化的第5-7天,细胞培养物出现少量玫瑰花状结构(neural rosette,神经干细胞的典型形态特征)后,应及时换加Activin A和SU5402。
在定向分化前期(第1-6天)添加的因子群(Noggin,DKK-1,bFGF和Nicotinamide)具有强烈的促进神经组织分化的作用,但是由于所需的最终细胞产物RPE细胞不是神经细胞,所以需要在神经干细胞和视网膜干细胞出现后迅速转换分化方向,以提高RPE细胞的分化效率。转化分化方向(添加Activin A和SU5402)的时机尤为重要,根据实验经验,当整个细胞培养物出现少量(5-15%)玫瑰花状结构时,即为添加Activin A和SU5402的最佳时机。如果玫瑰花状结构比例高于25%时,细胞的分化方向则偏重于神经组织,大量最终细胞产物则是视网膜神经元细胞,甚至是脑神经元细胞。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
现有技术文献
1.Strauss,O.The retinal pigment epithelium in visual function.Physiol Rev 85,845-881(2005).
2.Bok,D.The retinal pigment epithelium:a versatile partner in vision.J Cell Sci Suppl 17,189-195(1993).
3.Zarbin,M.A.Current concepts in the pathogenesis of age-related macular degeneration.Arch Ophthalmol 122,598-614(2004).
4.Jager,R.D.,Mieler,W.F.&Miller,J.W.Age-related macular degeneration.N Engl J Med 358,2606-2617(2008).
5.de Jong,P.T.Age-related macular degeneration.N Engl J Med 355,1474-1485(2006).
6.Zajac-Pytrus,H.M.,Pilecka,A.,Turno-Krecicka,A.,Adamiec-Mroczek,J.&Misiuk-Hojlo,M.The Dry Form of Age-Related Macular Degeneration(AMD):The Current Concepts of Pathogenesis and Prospects for Treatment.Adv Clin Exp Med 24,1099-1104(2015).
7.Strauer,B.E.&Kornowski,R.Stem cell therapy in perspective.Circulation 107,929-934(2003).
8.Song,W.K.,et al.Treatment of macular degeneration using embryonic stem cell-derived retinal pigment epithelium:preliminary results in Asian patients.Stem Cell Reports 4,860-872(2015).
9.Klimanskaya,I.,et al.Derivation and comparative assessment of retinal pigment epithelium from human embryonic stem cells using transcriptomics.Cloning Stem Cells 6,217-245(2004).
10.Buchholz,D.E.,et al.Derivation of functional retinal pigmented epithelium from induced pluripotent stem cells.Stem Cells 27,2427-2434(2009).
11.Hirami,Y.,et al.Generation of retinal cells from mouse and human induced pluripotent stem cells.Neurosci Lett 458,126-131(2009).
12.Buchholz,D.E.,et al.Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium.Stem Cells Transl Med 2,384-393(2013).
13.Leach,L.L.,Buchholz,D.E.,Nadar,V.P.,Lowenstein,S.E.&Clegg,D.O.Canonical/beta-catenin Wnt pathway activation improves retinal pigmented epithelium derivation from human embryonic stem cells.Invest Ophthalmol Vis Sci 56,1002-1013(2015).
14.http://www.nature.com/news/next-generation-stem-cells-cleared-for-human-trial-1.15897
15.http://www.moorfields.nhs.uk/news/new-trial-wet-amd。
- 还没有人留言评论。精彩留言会获得点赞!