一种不对称共轭二炔的合成方法与流程
本发明属于有机合成技术领域,具体涉及一种不对称共轭二炔的合成方法。
背景技术:
共轭二炔烃是有机合成领域的重要原料和中间体,可以作为起始原料用于合成大环轮烯,共轭炔低聚物等。同时,还是多种天然产物和具有生物活性化合物的骨架结构。含有1,3-二炔结构的一些化合物已被确定有着高效抗肿瘤、抗菌、抗炎和抗HIV活性。例如:从茵陈蒿中分离出来的传统中药成分19-(2-呋喃基)-5,7-十九碳二炔酸等。
文献中报道过的合成不对称共轭二炔的方法主要有以下几种:
(一)2000年E.Negishi课题组利用Pd催化交叉偶联选择性合成非对称1,3-共轭二炔。
该实验方法虽然产率较高,但是却需要分三步才能合成共轭二炔,反应较复杂。
(二)2008年Lei课题组报道了钯催化的不对称共轭二炔的合成。该反应以溴代苯乙炔和端基炔为底物,Pd(dba)2为催化剂,一种烯基膦为配体,三乙胺为有机弱碱,并加入CuI作助催化剂。
该反应底物的适用性较广,有很好的选择性,产率较高。但此方法使用了贵金属催化剂和膦配体,合成成本高。
(三)2009年,Lei课题组在前期的工作基础上,通过加入NiCl2·2H2O做催化剂并加入CuI作助催化剂,配以TMEDA络合,使得能够得到较高产率的交叉偶联产物。
该实验方法不仅使用双金属催化剂,并且加入TMEDA配体络合,而且反应需要一种炔过量。
(四)2012年Ranu利用Cu-HAP配合物催化顺式溴代苯乙烯合成非对称的二炔。在此反应中,反式苯乙烯溴化物通常得到反式烯炔产物,而顺式苯乙烯溴化物通过消除反应产生的炔和另一种炔烃的交叉偶联,生成共轭二炔类化合物。
该实验方法利用特定结构的铜配合物,此配合物的合成较复杂。
(五)2013年谢美华课题组报到了镍催化的烷基格氏试剂与炔基砜的交叉偶联反应合成不对称1,3二炔。该合成中,1,4-二芳基1,3-二炔可以获得中度至良好的产率,而对于烷基取代的1,3-二炔产率较低(30-54%)。
该实验方法使用的烷基格氏试剂不稳定、不易操作。
(六)2014年Ranu课题组利用双金属无配体催化剂,通过Csp-Csp偶联合成不对称1,3-二炔。
该实验方法底物适应性广,但是使用了双金属催化剂。
综上所述,现有技术合成共轭二炔的方法虽然较多,但这些方法有些需要经过较为复杂的合成步骤;有些用的反应物不稳定,操作有一定的难度;有些反应时间过长,而且反应产率较低;有些使用有机膦药品易造成环境污染。更重要的是这类反应大都使用钯、镍等贵金属或双金属为催化剂,反应成本较为昂贵而且不可回收,不适用于工业生产。
因此,提供一种不对称共轭二炔的新型合成方法很有必要。
技术实现要素:
本发明的目的在于提供一种不对称共轭二炔的合成方法,利用氩气作保护气,纳米氧化铜催化顺式烯溴和端基炔直接反应制备不对称共轭二炔,合成方法成本低,原料易得,操作较为方便,效率高,使用范围广,适合多种底物反应,且催化剂能够回收再利用。
本发明提供的一种不对称共轭二炔的合成方法,包括以下步骤:
A、将催化剂与邻菲罗啉和强碱混合后,在氩气氛围中加入顺式烯溴、端基炔与溶剂,在140-150℃的条件下搅拌回流反应20-24h;
B、产物经萃取、干燥、浓缩后通过柱层析分离纯化,得到不对称共轭二炔。
步骤A中顺式烯溴、端基炔、催化剂、强碱、邻菲罗啉的摩尔比为1:1.2-1.5:0.05-0.1:2-2.5:0.15-0.2。
所述顺式烯溴与机溶剂的用量比为:1:2-4mmol/mL。
进一步的,步骤A中相对于1mmol的顺式烯溴,所述端基炔的用量1.2-1.5mmol,所述催化剂的用量为0.05-0.1mmol,所述强碱的用量为2-2.5mmol,所述邻菲罗啉的用量为0.15-0.2mmol,所述有机溶剂的用量为2-4mL。
步骤A中所述的顺式烯溴结构式为:
其中R1选自4-H、4-CH3、4-OCH3、3-OCH3、2-OCH3、4-Cl、3-Cl、2-Cl或4-CF3中的任意一个。
步骤A中所述端基炔的结构式为:
其中R2选自4-H、4-CH3、4-OCH3、3-OCH3、2-OCH3、4-Cl、3-Cl、2-Cl、4-Br、4-F、4-C(CH3)3中的任意一个。
步骤A中所述催化剂为梭形纳米氧化铜、氧化铜纳米粒子、片状纳米氧化铜、海参状纳米氧化铜或花状纳米氧化铜的任意一种,可以回收并循环使用,其中海参状纳米催化剂催化效果尤为显著。
步骤A中各种催化剂的具体制备方法如下:
取40mL的蒸馏水加入到100mL烧杯中,称取0.3194g的Cu(CH3COO)2·H2O固体置于烧杯中,在30℃磁力搅拌的情况下使其溶解,再缓慢滴入1M的NH3·H2O溶液调节pH值,将烧杯用保鲜膜包裹放于烘箱中,在65℃条件下反应24h冷却至室温,然后分别用蒸馏水和无水乙醇各清洗两遍,分离离心,60℃条件下真空干燥5h即可制得不同形貌的纳米氧化铜。此反应中pH为7得梭形纳米氧化铜;pH为8得海参状纳米氧化铜pH为8.5得片状纳米氧化铜;pH为9.5得花状纳米氧化铜。
步骤A中所述氧化铜纳米粒子的制备方法:取0.4525g的Cu(CH3COO)2溶于50mL无水乙醇中,待其溶解后置于容量60mL的聚四氟乙烯高压釜中在150℃条件下反应20h,冷却至室温,再分别用蒸馏水清洗2遍和无水乙醇清洗3遍,分离离心,室温条件下真空干燥得黑色粉末,即氧化铜纳米粒子。
步骤A中所述强碱为氢氧化钠、氢氧化钾、叔丁醇钠或碳酸铯中的任意一种。
步骤A中所述溶剂为二乙二醇二甲醚DGDE,N,N-二甲基甲酰胺DMF或二甲基亚砜DMSO中的任意一种。
步骤B具体为:将所得产物用石油醚、乙酸乙酯萃取,无水硫酸钠干燥,减压浓缩,得粗产物,以纯石油醚为展开剂,通过柱层析分离得到不对称1,3-共轭二炔。
所述不对称共轭二炔的结构式为其中R1选自4-H、4-CH3、4-OCH3、3-OCH3、2-OCH3、4-Cl、3-Cl、2-Cl或4-CF3中的任意一个,R2选自4-H、4-CH3、4-OCH3、3-OCH3、2-OCH3、4-Cl、3-Cl、2-Cl、4-Br、4-F、4-C(CH3)3中的任意一个。
优选的,所述不对称共轭二炔的合成方法,包括以下步骤:
A、将0.05mmol海参形纳米氧化铜、0.15mmol邻菲罗啉和2mmol氢氧化钠混合后,在氩气氛围中加入1mmol顺式烯溴、1.2mmol端基炔与3mL DGDE在145℃的条件下搅拌回流反应24h;
B、产物经萃取、干燥、浓缩后通过石油醚柱层析分离纯化,得到不对称共轭二炔。
与现有技术相比,本发明使用纳米氧化铜催化剂,简单易制,性能稳定,催化效果良好且能回收利用;原料以顺式溴代烯烃和端基炔进行反应,反应条件温和,不需要使用金属格氏试剂,也没有使用贵金属或双金属催化剂;此反应体系成本低廉,简单高效,环境友好,能够合成高产率的不对称共轭1,3二炔,有利于工业生产。
附图说明
图1为实施例1的核磁共振氢谱图;
图2为实施例1的核磁共振碳谱图;
图3为实施例2的核磁共振氢谱图;
图4为实施例2的核磁共振碳谱图;
图5为实施例3的核磁共振氢谱图;
图6为实施例3的核磁共振碳谱图;
图7为实施例4的核磁共振氢谱图;
图8为实施例4的核磁共振碳谱图;
图9为实施例5的核磁共振氢谱图;
图10为实施例5的核磁共振碳谱图;
图11为实施例6的核磁共振氢谱图;
图12为实施例6的核磁共振碳谱图;
图13为实施例7的核磁共振氢谱图;
图14为实施例7的核磁共振碳谱图;
图15为本发明的反应方程式。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不局限于这些实施例。实施例中,不同取代基的炔、邻菲罗啉、氢氧化钠、氢氧化钾、叔丁醇钠、碳酸铯、DGDE、DMF、DMSO为国药集团化学试剂有限公司产品。
实施例1
一种不对称共轭二炔的合成方法,包括以下步骤:
A、分别称取0.05mmol的梭形纳米氧化铜,0.15mmol邻菲罗啉,2mmol氢氧化钠放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次,在氩气保护下再依次加入1mmol顺式-1-(2-溴乙烯基)-4-叔丁基苯,1.2mmol 1-乙炔基-4-甲氧基苯和3mL二乙二醇二甲醚,在140℃条件下搅拌回流20小时;
B、停止反应后冷却至室温,用石油醚萃取3次,每次10mL石油醚,并将所得有机相用无水硫酸镁干燥,浓缩后,以石油醚作展开剂柱层析分离提纯得白色固体即1-叔丁基-4-[4-(4-甲氧基苯基)丁烷-1,3-二炔基]苯,产率80%,熔点为88-90℃。
产品结构式:
产品的核磁共振氢谱数据:
1H NMR(300MHz,CDCl3):δ7.48-7.45(m,4H),7.35(d,J=8.2Hz,2H),6.86(d,J=8.6Hz,2H),3.82(s,3H),1.34(s,9H);
产品的核磁共振碳谱数据:
13C NMR(75MHz,CDCl3):δ160.3,152.5,134.1,132.2,125.5,118.9,114.1,113.8,81.4,79.1,73.5,72.9,55.4,34.9,31.1。
实施例2
一种不对称共轭二炔的合成方法,包括以下步骤:
A、分别称取0.05mmol的海参形纳米氧化铜,0.15mmol邻菲罗啉,2mmol氢氧化钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次,在氩气保护下再依次加入1mmol顺式-1-(2-溴乙烯基)-4-甲基苯,1.2mmol 1-乙炔基-4-氟基苯和3mL N,N-二甲基甲酰胺,在140℃条件下搅拌回流20小时。
B、停止反应后冷却至室温,用石油醚萃取3次,每次10mL石油醚,并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯得白色固体即1-氟-4-[4-(4-甲基苯基)丁烷-1,3-二炔基]苯,产率85%,熔点为148-150℃。
产品结构式:
产品的核磁共振氢谱数据:
1H NMRδ7.53-7.49(m,2H),7.42(d,J=7.2Hz,2H),7.14(d,J=6.3Hz,2H),7.06-7.00(m,2H),2.36(s,3H);
产品的核磁共振碳谱数据:
13C NMR(CDCl3,75MHz):δ163.0(d,J=240.9Hz),139.6(d,J=15.3Hz),134.5,132.4,129.3,118.7(d,J=19.1Hz),115.9(d,J=21.8Hz),81.9,80.4,73.8,73.5,21.7.
实施例3
一种不对称共轭二炔的合成方法,包括以下步骤:
A、分别称取0.1mmol的片状纳米氧化铜,0.3mmol邻菲罗啉,4mmol氢氧化钠放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次,在氩气保护下再依次加入2mmol顺式-1-(2-溴乙烯基)苯,2.4mmol 1-乙炔基-4-氟基苯和4mL二乙二醇二甲醚,在140℃条件下搅拌回流20小时;
B、停止反应后冷却至室温,用石油醚萃取3次,每次10mL石油醚,并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即白色固体即1-[4-(4-氟基苯基)丁烷-1,3-二炔基]苯,产率61%,熔点为121-123℃。
产品结构式:
产品的核磁共振氢谱数据:
1H NMR(CDCl3,300MHz):δ7.53(d,J=5.3Hz,4H),7.36(s,3H),7.04(t,J=8.4Hz,2H);
产品的核磁共振碳谱数据:
13C NMR(CDCl3,75MHz):δ163.0(d,J=250.5Hz),134.5(d,J=8.3Hz),132.5,129.2,128.4,121.6,117.9(d,J=3.0Hz),115.8(d,J=22.5Hz),81.5,80.4,73.7,73.7。
实施例4
一种不对称共轭二炔的合成方法,包括以下步骤:
A、分别称取0.5mmol的花状纳米氧化铜,1.5mmol邻菲罗啉,20mmol氢氧化钠放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入10mmol顺式-1-(2-溴乙烯基)-4-甲氧基苯,12mmol苯乙炔和20mL二乙二醇二甲醚,在150℃条件下搅拌回流20小时。
B、停止反应后冷却至室温,用石油醚萃取3次,每次40mL石油醚,并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯得白色固体即1-[4-(4-甲氧基苯基)丁烷-1,3-二炔基]苯,产率61%,熔点为93-94℃。
产品结构式:
产品的核磁共振氢谱数据:
1H NMR(CDCl3,300MHz):δ7.46-7.53(m,4H),7.35(s,3H),6.86(d,J=8.2Hz,2H),3.83(s,3H);
产品的核磁共振碳谱数据:
13C NMR(CDCl3,75MHz):δ=160.3,134.0,132.3,129.0,128.4,121.9,114.1,113.6,81.8,81.0,74.2,72.7,55.2.
实施例5
一种不对称共轭二炔的合成方法,包括以下步骤:
A、分别称取0.5mmol的海参状纳米氧化铜,1.5mmol邻菲罗啉,20mmol氢氧化钠放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次,在氩气保护下再依次加入10mmol顺式-1-(2-溴乙烯基)-4-甲基苯,12mmol 1-乙炔基-4-氟基苯和20mL二甲基亚砜,在140℃条件下搅拌回流20小时;
B、停止反应后冷却至室温,用石油醚萃取3次,每次10mL石油醚,并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯得白色固体即1-氟-4-[4-(4-甲基苯基)丁烷-1,3-二炔基]苯,产率78%,熔点为148-150℃。
产品结构式:
产品的核磁共振氢谱数据:
1H NMRδ7.53-7.49(m,2H),7.42(d,J=7.2Hz,2H),7.14(d,J=6.3Hz,2H),7.06-7.00(m,2H),2.36(s,3H);
产品的核磁共振碳谱数据:
13C NMR(CDCl3,75MHz):δ163.0(d,J=240.9Hz),139.6(d,J=15.3Hz),134.5,132.4,129.3,118.7(d,J=19.1Hz),115.9(d,J=21.8Hz),81.9,80.4,73.8,73.5,21.7.
实施例6
一种不对称共轭二炔的合成方法,包括以下步骤:
A、分别称取0.025mmol的梭形纳米氧化铜,0.075mmol邻菲罗啉,1mmol叔丁醇钠放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次,在氩气保护下再依次加入0.5mmol顺式-1-(2-溴乙烯基)-4-氯基苯,0.6mmol 1-乙炔基-4甲氧基苯和2mL二乙二醇二甲醚,在140℃条件下搅拌回流24小时。
B、停止反应后冷却至室温,用石油醚萃取3次,每次10mL石油醚,并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯得淡黄色固体即
1-氯-4–[4-(4-甲氧基苯基)丁烷-1,3-二炔基]苯,产率80%,熔点为160-162℃。
产品结构式:
产品的核磁共振氢谱数据:
1H NMR(300MHz,CDCl3):δ7.49-7.43(m,4H),7.30(d,J=9.0Hz,2H),6.87(d,J=9.0Hz,2H),3.83(s,3H).
产品的核磁共振氢谱数据:
13C NMR(75MHz,CDCl3):δ160.1,135.1,134.2,133.6,128.8,120.5,114.2,113.5,82.4,79.8,75.2,72.5,55.4.
实施例7
一种不对称共轭二炔的合成方法,包括以下步骤:
A、分别称取0.1mmol的氧化铜纳米粒子,0.15mmol邻菲罗啉,2mmol碳酸铯放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次,在氩气保护下再依次加入1mmol顺式-1-(2-溴乙烯基)-4氯基苯,1.2mmol苯乙炔和3mL二乙二醇二甲醚,在150℃条件下搅拌回流20小时;
B、停止反应后冷却至室温,用石油醚萃取3次,每次10mL石油醚,并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯得白色固体即1-[4-(4-氯基苯基)丁烷-1,3-二炔基]苯,产率80%,熔点为151-152℃。
产品结构式:
产品的核磁共振氢谱数据:
1H NMR(300MHz,CDCl3):δ7.54-7.30(m,9H).
产品的核磁共振碳谱数据:
13C NMR(75MHz,CDCl3):δ135.4,133.7,132.5,128.9,128.5,121.6,120.3,82.1,80.3,74.9,73.6.
实施例8
一种不对称共轭二炔的合成方法,包括以下步骤:
A、分别称取0.05mmol的花状纳米氧化铜,0.15mmol邻菲罗啉,2mmol氢氧化钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次,在氩气保护下再依次加入1mmol顺式-1-(2-溴乙烯基)-4-甲氧基苯,1.2mmol 1-乙炔基-4-叔丁基苯和3mL二乙二醇二甲醚,在140℃条件下搅拌回流20小时;
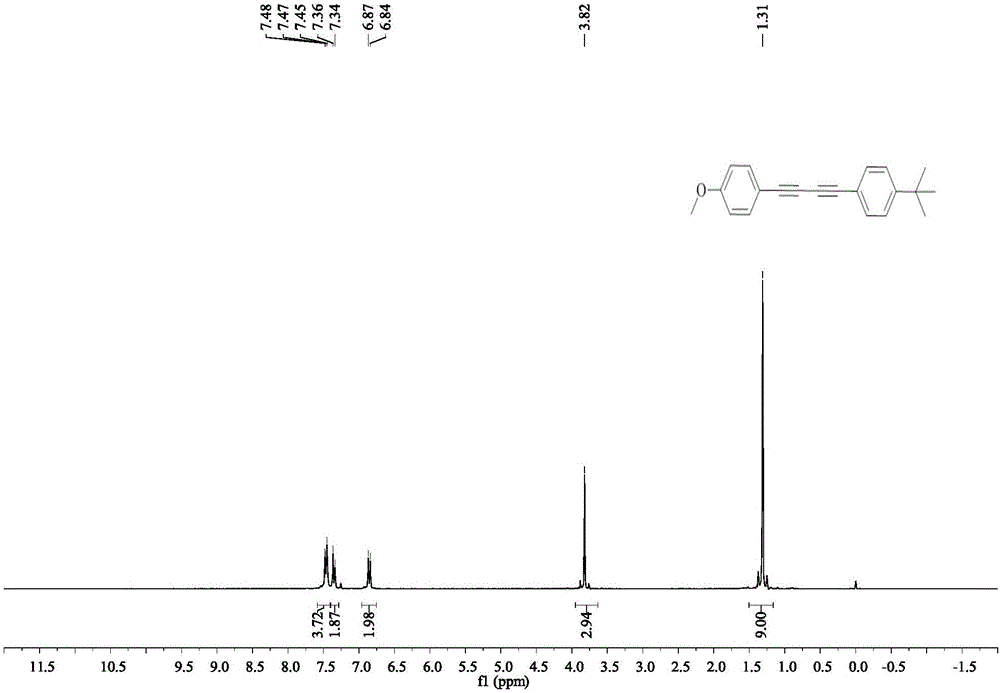
B、停止反应后冷却至室温,用石油醚萃取3次,每次10mL石油醚,并将所得有机相用无水硫酸镁干燥,浓缩,以石油醚作展开剂柱层析分离提纯得白色固体即1-叔丁基-4-[4-(4-甲氧基苯基)丁烷-1,3-二炔基]苯,产率80%,熔点为88-90℃。
产品结构式:
1H NMR(300MHz,CDCl3):δ7.48-7.45(m,4H),7.35(d,J=8.2Hz,2H),6.86(d,J=8.6Hz,2H),3.82(s,3H),1.34(s,9H);
13C NMR(75MHz,CDCl3):δ160.3,152.5,134.1,132.2,125.5,118.9,114.1,113.8,81.4,79.1,73.5,72.9,55.4,34.9,31.1。
- 还没有人留言评论。精彩留言会获得点赞!