一种高生长能力隐甲藻突变藻株的选育方法与流程
本发明属于生物
技术领域:
,是一种高生长能力隐甲藻突变藻株的选育方法。
背景技术:
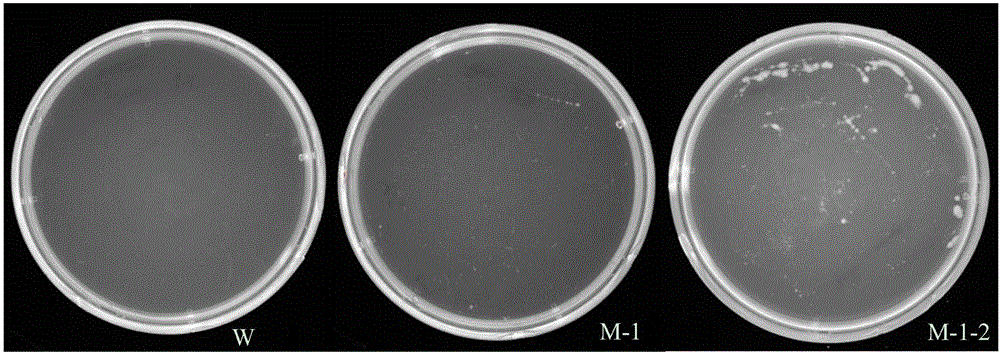
:由于多元不饱和脂肪酸对人体的生理功能起着重要作用,其研究和生产日益受到人们的重视。其中,ω-3类不饱和脂肪酸中的二十二碳六烯酸(Docosahexaenoicacid,DHA)是极为重要的一种具有高营养价值的脂肪酸,对婴儿大脑的正常发育、成人大脑功能的正常发挥有重要作用。此外,DHA对于人体视网膜以及人体心血管疾病预防起着重要作用。人体自身不能合成DHA,必须从食物中摄取。直至目前为止,深海鱼油一直是市售的DHA的主要来源。但这一主要来源有着一些致命的问题,比如海洋污染造成的对鱼油的安全性的担忧,鱼油质量会随着鱼的种类、捕捞季节和地点的不同而不同,含二十碳五烯酸(Eicosapentaenoicacid,EPA)、易受环境污染、纯化成本高,尤其是考虑到DHA的主要消费者是怀孕妇女和年幼的孩子,其可能的不利影响更令人担忧;此外,世界渔业资源的逐年萎缩对DHA的可持续性供应的影响也值得考虑;另外,鱼油的特殊气味也限制了从鱼油来源的DHA作为一种食品添加剂的应用。利用隐甲藻(Crypthecodiniumcohnii)发酵生产DHA,与传统鱼油来源相比,具有一系列优点,如发酵周期短,培养方式简单,微生物生长快,易于大规模培养;多不饱和脂肪酸含量高,产品质量稳定,氧化稳定性较好,不饱和脂肪酸成分单一,不含EPA或EPA含量低,易于分离纯化;同时克服了传统的从鱼油中获取DHA受原料、气候、产地、生产周期等诸多限制因素的影响。因此微生物发酵生产DHA可替代鱼油来源的DHA,具有广泛的应用前景。目前,实际隐甲藻发酵生产应用的藻种多数从自然界直接分离获得,性状较为单一,在发酵过程中难免发生藻株种质退化。而利用传统方法选育优良藻种,周期长,工作量大。因此,隐甲藻藻株种质的改进对于促进隐甲藻生产DHA产业的可持续发展是十分重要的。常压室温等离子体(ARTP)是指能够在大气压下产生温度在25-40℃之间的、具有高活性粒子(包括处于激发态的氦原子、氧原子、氮原子、OH自由基等)浓度的等离子体射流。由于ARTP本身的温度低、活性粒子浓度高且种类多样,且ARTP放电形式多样、设备简单、操作简易、运行成本低廉,加之ARTP本身对环境无污染和损害,所以常压室温等离子体(ARTP)诱变在生物领域应用越来越广泛。ARTP富含的活性能量粒子对菌株/植株/细胞等的遗传物质造成损伤,并诱发生物细胞启动SOS修复机制。SOS修复过程为一种高容错率修复,因此修复过程中会产生种类丰富的错配位点,并最终稳定遗传进而形成突变株。常规隐甲藻突变株的大多数筛选方法耗时较长,且工作量较大,效率不高。因此,寻求一种高效的筛选方法对于隐甲藻藻株的选育也是极为重要的。乙酰辅酶A羧化酶(AcetylCoAcarboxylase)是催化乙酰辅酶A+ATP+HCO3-→丙二酰辅酶A+ADP+Pi反应的生物素酶。此反应制约着脂肪酸合成第一阶段的速度,因此乙酰辅酶A羧化酶是脂肪酸合成的关键酶。而稀禾定(sethoxydim,2一[1一(乙氧基亚氨基)丁基]一5一[2一(乙硫基)丙基]-3-羟基-2-环己烯-1-酮)是该酶的抑制剂。稀禾定会抑制隐甲藻的脂肪酸合成而导致生长缓慢甚至死亡。到目前为止,没有使用稀禾定进行隐甲藻突变株进行筛选的报道。本发明发现,通过对隐甲藻进行常压室温等离子体(ARTP)诱变,然后利用脂肪酸合成中的关键酶(例如乙酰辅酶A羧化酶)的抑制剂(包括但不限于稀禾定)进行定向筛选,能够得到高生长能力的隐甲藻突变株。同时,本发明发现,利用适宜浓度的稀禾定对隐甲藻进行定向驯化,能够得到高生长能力的隐甲藻驯化株。总之,基于脂肪酸合成中的关键酶乙酰辅酶A羧化酶的抑制剂(包括但不限于稀禾定)的选择压力对隐甲藻藻株进行人工选育,能够高效快速地获得高生长能力的突变藻株。技术实现要素:本发明的目的是提供一种高生长能力的隐甲藻突变藻株的人工选育方法。本发明另一个目的是提供一种隐甲藻藻株人工驯化方法。本发明隐甲藻藻株人工选育方法,包括隐甲藻藻株常压室温等离子体(ARTP)诱变和在脂肪酸合成关键酶乙酰辅酶A羧化酶的抑制剂的选择压力下对藻株进行筛选,具体操作包括:1)利用常压室温等离子体诱变对隐甲藻藻株进行诱变:使用室温常压等离子体诱变仪对隐甲藻藻液进行诱变;2)将诱变处理后的隐甲藻藻液涂布于固体C9N2培养基上,在正常培养条件下进行培养,同时以未诱变处理的藻液作为对照;3)待藻落长出后,每块有效平板挑取较大菌落,再次保存至新的C9N2培养基固体平板上;4)将单菌落挑入液体C9N2培养基中培养;5)将隐甲藻诱变株藻液涂布于含有稀禾定的固体C9N2培养基上,正常培养条件下进行培养,同时以未诱变处理的藻液作为对照。根据平板上的藻落长出情况,挑选存活的藻落,即可得到高生物量的隐甲藻突变株;6)隐甲藻突变株的生长特性分析:将所得的隐甲藻突变株在C9N2的液体培养基中培养,鉴定突变株最大生物量是否高于原始出发藻株。所述藻种为隐甲藻属;所述抑制剂为稀禾定;所述诱变处理的隐甲藻细胞浓度为106~108个/mL,藻液内添加5%~20%甘油,等离子体发射源与样品之间距离为2mm,处理功率为100W,气流量为10SLM(10L/min),诱变处理时间为0~100s,诱变过程中稀释细胞,洗脱载片上藻株均使用液体C9N2培养基。所述步骤(2)所述固体C9N2培养基是由葡萄糖9g,酵母浸粉2g,海盐25g,琼脂15g,加水至1L而成,pH为6.5;所述步骤(4)所述液体C9N2培养基是由葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L而成,pH为6,5。所述步骤(5)和步骤(6)稀禾定的使用浓度为约5μmol/L~500μmol/L;步骤(4)和步骤(6)液体培养基中培养时,摇床参数设置为转速20~200rpm,温度4~40℃。一种隐甲藻藻株人工驯化方法,其特征在于在乙酰辅酶A羧化酶的抑制剂(例如稀禾定,但不限于稀禾定)的选择压力下对隐甲藻藻株进行驯化的方法,具体操作包括:1、将隐甲藻藻液涂布于含有不同浓度稀禾定的固体C9N2培养基上,正常条件下进行培养,同时以未加稀禾定的固体平板作为对照。根据平板上的藻落长出情况,确定稀禾定的最初适宜抑制浓度;2、将隐甲藻接种到含有适宜浓度稀禾定的液体C9N2培养基中,正常条件下培养;3、当隐甲藻细胞数量达到107~108个/mL时,进行传代;4、待隐甲藻能够在含某一浓度稀禾定培养基内正常生长时,适当提高稀禾定浓度继续培养;直至经过多次传代的藻株通过表性分析,其生长的最高生物量明显高于原始出发藻株。所述的藻种为隐甲藻属;步骤(1)所述固体C9N2培养基是由葡萄糖9g,酵母浸粉2g,海盐25g,琼脂15g,加水至1L而成,pH为6.5。所述步骤(2)所述液体C9N2培养基是由葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L而成,pH为6.5。所述步骤(1)和步骤(4)稀禾定的使用浓度为5μmol/L~500μmol/L。所述步骤(2)和步骤(4)液体培养基中培养时,摇床参数设置为转速20~200rpm,温度4~40℃。本发明一方面,本发明通过利用常压室温等离子体(ARTP)技术对隐甲藻进行诱变,然后利用脂肪酸合成中的关键酶的抑制剂(包括但不限于稀禾定)进行筛选,能够得到高生长能力的隐甲藻突变株。另一方面,本发明通过利用乙酰辅酶A羧化酶的抑制剂(例如稀禾定,但不限于稀禾定)的选择压力对隐甲藻藻株进行定向驯化,能够获得高生长能力的隐甲藻驯化株。另一方面,本发明所述的利用乙酰辅酶A羧化酶的抑制剂(包括但不限于稀禾定)作为选择压力对隐甲藻藻株进行定向驯化,即在含有适宜浓度稀禾定的液体培养基中培养隐甲藻,筛选和富集耐受乙酰辅酶A羧化酶抑制剂的突变株。首先,将隐甲藻藻液涂布于含有不同浓度稀禾定的固体C9N2培养基上,正常条件下进行培养,同时以未加稀禾定的固体平板作为对照。根据平板上的藻落长出情况,确定稀禾定的最初适宜抑制浓度;其次,将隐甲藻接种到含有适宜浓度稀禾定的液体C9N2培养基中,正常条件下培养;当隐甲藻细胞数量达到107~108个/mL时,进行传代;最后,待隐甲藻能够在含某一浓度稀禾定培养基内正常生长时,适当提高稀禾定浓度继续培养。经过一定代数的定向驯化,即可得到生长能力提高的隐甲藻驯化株。本发明隐甲藻突变株的生长特性分析,所得的隐甲藻突变株在C9N2液体培养基中(葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L,pH为6.5)培养,摇床设置参数为转速100~200rpm,温度24~28℃。步骤为:接种时取OD490nm为0.8的新鲜细胞5mL加入50mL培养基中,每组做3个平行样,用UV-1750分光光度计测定波长为490nm下的吸光值,每12h测量一次,绘制柱状图。本发明所使用的常压室温等离子体(ARTP)技术设备简单、操作简易、运行成本低廉,对环境无污染和损害,同时诱变效果明显;利用脂肪酸合成过程中的关键酶乙酰辅酶A羧化酶的抑制剂(包括但不限于稀禾定)进行定向筛选,大大减少了工作量,提高了筛选效率。因此,相对于传统的隐甲藻藻株选育,是一种高效、快捷的新方法。本发明所使用乙酰辅酶A羧化酶的抑制剂(包括但不限于稀禾定)作为选择压力对隐甲藻藻株进行定向驯化的方法,定向驯化效果明显,是一种高生长能力藻种的高效快速选育方法。附图说明图1隐甲藻ATCC30556第一轮诱变获得的突变株在含有10μmol/L稀禾定的C9N2固体平板上的生长图。图2隐甲藻ATCC30556第二轮诱变获得的突变株在含有20μmol/L稀禾定的C9N2固体平板上的生长图。图3C9N2培养基下隐甲藻原始出发藻株株与突变株的生长对比图(其中,培养基为C9N2:葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L,pH为6.5。培养至48h,原始出发藻株和突变株细胞的生长均达到最大值,其中一次突变株比原始出发藻株平均增长了10.28%,二次突变株比原始出发藻株平均增长了15.55%)。图4C27N6培养基下隐甲藻原始出发藻株与突变株的生长对比图(其中,培养基为C9N2:葡萄糖27g,酵母浸粉6g,海盐25g,加水至1L,pH为6.5。培养至96h,原始出发藻株和突变株细胞的生长均达到最大值,其中一次突变株比原始出发藻株平均增长了17.97%,二次突变株比原始出发藻株平均增长了20.31%)。图5C33N7.33培养基下隐甲藻原始出发藻株与突变株的生长对比图(其中,培养基为C9N2:葡萄糖33g,酵母浸粉7.33g,海盐25g,加水至1L,pH为6.5。培养至120h,原始出发藻株和突变株细胞的生长均达到最大值,其中一次突变株比原始出发藻株平均增长了14.10%,二次突变株比原始出发藻株平均增长了15.29%)。图6C9N2培养基下隐甲藻原始出发藻株与稀禾定驯化株的细胞干重对比图(其中,培养基为C9N2:葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L,pH为6.5。培养至48h,原始出发藻株和驯化株细胞的生长均达到最大值,其中出发藻株经过驯化60代后,对稀禾定耐受浓度从5μmol提高至20μmol,驯化株比原始出发藻株的细胞干重平均增长了22.97%)。具体实施方式下面的实施例是为了使本领域的技术人员更好地理解本发明但并不用于限制本发明。下面通过实施例并结合附图对本发明作进一步详细说明。本发明所述的利用常压室温等离子体对隐甲藻藻株进行诱变,即使用常压室温等离子体诱变仪进行诱变。其中,诱变处理的隐甲藻细胞浓度为106~108个/mL,藻液内添加5%~20%甘油,等离子体发射源与样品之间距离为2mm,处理功率为100W,气流量为10SLM,诱变处理时间为0~100s,诱变过程中稀释细胞,洗脱载片上藻株均使用液体C9N2培养基。所述诱变操作完成之后,将诱变处理后的隐甲藻藻液涂布于固体C9N2培养基(葡萄糖9g,酵母浸粉2g,海盐25g,琼脂15g,加水至1L,pH为6.5)上,在正常培养条件下进行培养,同时以未诱变处理的藻液作为对照。待藻落长出后,每块有效平板挑取较大菌落,再次保存至新的C9N2培养基固体平板上。将单菌落挑入液体C9N2培养基(葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L,pH为6.5)中培养。将隐甲藻诱变株藻液涂布于含有稀禾定的固体C9N2培养基上,正常培养条件下进行培养,同时以未诱变处理的藻液作为对照。根据平板上的藻落长出情况,挑选存活的藻落,即可得到生长能力改善的隐甲藻突变株。还可以将所述第一次诱变得到的隐甲藻突变株进行第二次诱变,重复上述步骤。筛选得到生长能力性状更为优秀的隐甲藻二次突变株。隐甲藻突变株的生长特性分析,所得的隐甲藻突变株在C9N2液体培养基中(葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L,pH为6.5)培养,摇床设置参数为转速100~200rpm,温度24~28℃。步骤为:接种时取OD490nm为0.8的新鲜细胞5mL加入50mL培养基中,每组做3个平行样,用UV-1750分光光度计测定波长为490nm下的吸光值,每12h测量一次,绘制柱状图。实施例1利用无锡源清天木生物科技有限公司研制的常压室温等离子体(ARTP)诱变仪,对隐甲藻(Crypthecodiniumcohnii)ATCC30556进行诱变。1.将隐甲藻藻液细胞浓度调整至106~108个/mL,稀释时使用液体C9N2培养基。稀释完毕后,添加终浓度为5~20%的甘油。2.于超净台内将金属载片置于酒精灯外焰适当灼烧,待冷却后放入一次性培养皿中,取10~20μL藻液均匀涂于金属载片上。3.将装有样品载片的培养皿放入ARTP诱变仪操作室内,用无菌镊子将载片置于对应孔位,并关闭操作室门。4.等离子体发射源与样品之间距离为2mm,处理功率为100W,气流量为10SLM,诱变处理时间为0~100s。设定处理时间,依次处理样品。5.样品处理完毕之后,用无菌镊子将载片放入装有1mL液体C9N2培养基的EP管中。6.将EP管在振荡器上震荡1~3min,使附着在载片上的藻液洗脱到液体内,形成新的藻液。7.对新的藻液进行适当稀释,取100μL涂布于固体培养基上。同时以未诱变处理藻液作为对照。8.将涂布的固体培养基平板放置于恒温培养箱内,温度25℃,黑暗条件下培养。9.待藻落长出后待藻落长出后,从每块有效平板中挑取藻落直径较大的藻株,再次保存至新的C9N2培养基固体平板上。10.将单菌落挑入液体C9N2培养基中培养,使用100mL三角瓶,装液量20mL。液体C9N2培养基是由葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L而成,pH为6.5。摇床参数设置为转速100~200rpm,温度24~28℃。11.将隐甲藻诱变株藻液涂布于含有稀禾定5μmol/L~200μmol/L的固体C9N2培养基上,放置于恒温培养箱内,温度24~28℃,黑暗条件下培养。固体C9N2培养基是由葡萄糖9g,酵母浸粉2g,海盐25g,琼脂15g,加水至1L而成,pH为6.5。12.隐甲藻突变株的生长特性分析,所得的隐甲藻突变株在C9N2液体培养基中培养。液体C9N2培养基是由葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L而成,pH为6.5。摇床设置参数为转速100~200rpm,温度24~28℃。步骤为:接种时取OD490nm为0.8的新鲜细胞5mL加入50mL培养基中,每组做3个平行样,用UV-1750分光光度计测定波长为490nm下的吸光值,每12h测量一次,绘制柱状图。确定得到的隐甲藻突变株生物量高于原始出发藻株。实施例2本实施例与实施例1基本相同,只是使用的初始藻株为实施例1所得到的隐甲藻突变株,进行第二轮诱变与筛选。实施例3隐甲藻突变株的生长特性分析,所得的隐甲藻突变株在不同葡萄糖浓度的液体培养基中培养。摇床设置参数为转速100~200rpm,温度24~28℃。步骤为:接种时取OD490nm为0.8的新鲜细胞5mL加入50mL培养基中,每组做3个平行样,用UV-1750分光光度计测定波长为490nm下的吸光值,每24h测量一次,绘制柱状图。表1不同葡萄糖浓度的隐甲藻培养基的配方培养基名称葡萄糖(g/L)酵母浸粉(g/L)海盐(g/L)C9N29225C27N627625C33N7.33337.3325实施例41.将隐甲藻藻液涂布于含有不同浓度稀禾定的固体C9N2培养基上,正常条件下进行培养,同时以未加稀禾定的固体平板作为对照。根据平板上的藻落长出情况,确定稀禾定的最初适宜抑制浓度。2.将隐甲藻接种到含有适宜浓度稀禾定的液体C9N2培养基中,正常条件下培养。3.当隐甲藻细胞数量达到107~108个/mL时,进行传代。4.待隐甲藻能够在含某一浓度稀禾定培养基内正常生长时,适当提高稀禾定浓度继续培养。5.隐甲藻驯化株的生长特性分析,所得的隐甲藻驯化株在C9N2液体培养基中培养。液体C9N2培养基是由葡萄糖9g,酵母浸粉2g,海盐25g,加水至1L而成,pH为6.5。摇床设置参数为转速100~200rpm,温度24~28℃。步骤为:接种时取OD490nm为0.8的新鲜细胞5mL加入50mL培养基中,每组做3个平行样,用UV-1750分光光度计测定波长为490nm下的吸光值,每12h测量一次,绘制柱状图。确定得到的隐甲藻突变株生物量高于原始出发藻株。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1