缺血性疾病治疗药的制作方法
本发明涉及新型的分泌信号、含有该分泌信号的转化用质粒、包含用该质粒进行了转化的厌氧菌的基因递送载体、含有该基因递送载体的药物组合物、以及利用了它们的缺血性疾病的诊断或治疗方法。
背景技术:
近年,在恶性肿瘤的治疗方法中,使用转化厌氧菌作为基因递送载体的方法受到关注,例如提出了使用进行了转化的梭菌属,向肿瘤部位递送将抗肿瘤物质的前药转换为抗肿瘤物质的酶的硝基还原酶的表达基因的方法等(参照专利文献1~3)。
但是,以往为了这些目的而使用的微生物都为将病原性的细菌突变化为低毒性而成的,不能否定进行回复突变化而回复为原来的病原性菌、发挥有害性的可能性,进而,由于运动性、侵袭性,存在不仅在疾病组织而且在正常组织也表现出作用而产生全身性的副作用症状的情况等,在安全性方面有可能存在问题。
因此,已知为存在于人的肠内、形成菌群的非病原性的肠内细菌中、极其安全的专性厌氧细菌的双歧乳杆菌受到关注,开发了以表达将抗肿瘤物质的5-氟尿嘧啶的前药的5-氟胞嘧啶转换为5-fu的酶的胞嘧啶·脱氨酶的方式进行了转化的双歧乳杆菌、以表达作为具有抗肿瘤性的蛋白质的tnfα的方式进行了转化的双歧乳杆菌(参照专利文献4~6)。
该转化双歧乳杆菌具有下述特点:在将其静脉内给予厌氧性的疾病的实体肿瘤动物模型的情况下,在低氧状态的厌氧的疾病组织特异性植活、增殖,在没有处于厌氧的环境下的正常组织快速消失(参照非专利文献1、2)。
另一方面,在缺血性疾病的治疗、特别是重症缺血的治疗中,尝试了想要通过使得血管生成、侧支循环发达来恢复血流的血管生成疗法。血管生成疗法若大致区分则存在细胞移植、蛋白质给药和基因治疗这三种治疗方法,但是从低侵袭性的观点考虑,近年特别是基因治疗受到关注。利用基因治疗实现的血管生成中,例如通过肌肉内注射、动脉内注入将编码有肝细胞增殖因子(hepatocytegrowthfactor:hgf)、血管内皮增殖因子(vascularendothelialgrowthfactor:vegf)等的基因导入到患部附近,促进患部附近的血管生成,由此使得血流恢复(例如参照非专利文献3、4)。
这些血管生成疗法,作为对于由于小动脉水平的障碍而不能实现血运重建或者效果不充分的患者、由于侵袭性的问题而不能进行外科的治疗的患者等的选择项之一受到关注,特别是关于利用基因治疗的血管生成疗法,近年进行了很多临床试验。
但是,以往的利用了基因治疗的血管生成疗法,由于没有病变部位特异性,适用时仍然需要解决很多问题,这些问题如下所述:不能进行全身给药,与缺血部位相比非缺血部位中的血管生成得到促进的偷窃现象令人担忧,基因导入效率、导入基因的表达期间的控制是困难的,存在由于血管生成而症状有可能恶化的并发症的情况下适用伴随有大的危险。
因此,本发明人等着眼于在厌氧的疾病组织特异性植活、增殖的厌氧菌,通过使用转化双歧乳杆菌,成功制作了仅特异性地集聚于缺血部位,在该缺血部位产生所希望的蛋白质,治愈的同时由病变部位消失而不会产生蛋白质的基因递送载体(专利文献7)。
现有技术文献
专利文献
专利文献1:美国专利第6416754号说明书
专利文献2:美国专利第6652849号说明书
专利文献3:美国专利申请公开2003/0103952号说明书
专利文献4:日本特开2002-97144号公报
专利文献5:国际公开第2007/136107号
专利文献6:国际公开第2011/093465号
专利文献7:国际公开第2013/008881号
非专利文献
非专利文献1:yazawaetal.,cancergenetherapy,7(2):269-274,2000.非专利文献2:yazawaetal.,breastcancerresearchandtreatment,66:165-170,2001.
非专利文献3:guptaetal.,circ.res.,105:724-736,2009.
非专利文献4:morishitaetal.,arteriosclerthrombvascbiol.,31:713-720,2011.
技术实现要素:
发明要解决的问题
本发明的目的在于,提供能够以目的蛋白质的高效率稳定地分泌表达的用于转化厌氧菌的转化用质粒、包含用该质粒进行了转化的厌氧菌的基因递送载体、含有该基因递送载体的药物组合物、以及利用了它们的缺血性疾病的诊断或治疗方法。
用于解决问题的方案
本发明人等在上述专利文献7中报告了,制作整合了编码有人fgf2的基因的转化用质粒pfgf12a,使用其进行了转化的专性厌氧菌、例如长双歧杆菌(bifidobacteriumlongum)105a/pfgf12a、短双歧杆菌(bifidobacteriumbreve)jcm1192/pfgf12a等,通过全身给药而仅在缺血性疾病部位特异性地集聚·生长,在该缺血性疾病部位能够表达·分泌人fgf2蛋白质(专利文献7)。
但是进一步继续研究中发现下述新问题:对于上述专利文献7中主要使用的用转化质粒pfgf12a进行了转化的双歧杆菌属细菌而言,表达蛋白质的分泌量不充分,另外分泌量也经时地降低等,稳定性欠缺。
因此,本发明人等为了解决该问题而继续深入研究,结果发现源自长双歧杆菌(bifidobacteriumlongum)的新型的分泌信号肽sp56及sp67,制作整合了编码有这些信号肽的基因的质粒,结果令人惊讶的是,用该质粒进行了转化的厌氧菌,与现有株相比,为蛋白质分泌表达格外高,即使长期培养也稳定地分泌表达蛋白质,即使反复进行继代培养也表现出高的质粒保持菌率的质粒,进一步继续研究,结果完成了本发明。
即,本发明涉及以下内容。
(1)一种转化用质粒,其为厌氧菌的转化用质粒,其包含启动子单元,含有编码有序列号1或序列号2所示的分泌信号肽的dna的分泌信号单元,和含有编码有对于缺血性疾病的诊断或治疗有用的蛋白质的dna的目的基因单元。
(2)根据(1)所述的转化用质粒,其中,对于缺血性疾病的诊断或治疗有用的蛋白质为选自由成纤维细胞增殖因子(fgf)、内皮细胞增殖因子(ecgf)、血管内皮增殖因子(vegf)、肝实质细胞增殖因子(hgf)、血管增殖因子(agf)、源自血小板的增殖因子(pdgf)、转化增殖因子β(tgfβ)、促血管新生蛋白因子、蝶素(ephrin)等具有血管生成促进活性的蛋白质、前列腺素类等与血管扩张相关的因子、粒细胞集落刺激因子(g-csf)、粒细胞-巨噬细胞集落刺激因子(gm-csf)等集落刺激因子、神经生长因子(ngf)、脑源性神经营养因子(bdnf)、神经营养因子3等神经营养因子、胰岛素样生长因子(igf)、源自血小板的血管内皮细胞增殖因子(pd-ecgf)组成的组中的一种。
(3)根据(1)或(2)所述的转化用质粒,其中,对于缺血性疾病的诊断或治疗有用的蛋白质为成纤维细胞增殖因子2(fgf2)。
(4)根据(1)~(3)所述的转化用质粒,其中,分泌信号单元还含有连接于编码有序列号1或序列号2所示的分泌信号肽的dna的3’末端、编码有间隔肽的dna。
(5)根据(4)所述的转化用质粒,其中,间隔肽以氨基酸长度1~25、由序列号5或序列号6所示的氨基酸序列的n末端的氨基酸开始的序列表示。
(6)根据(1)~(5)所述的转化用质粒,其中,分泌信号单元为编码有序列号9或序列号10所示的氨基酸序列的dna。
(7)根据(1)~(6)所述的转化用质粒,其中,转化用质粒为非穿梭质粒。
(8)根据(1)~(7)所述的转化用质粒,其中,启动子单元中含有的启动子为序列号13所示的碱基序列或该碱基序列的一个或多个碱基缺失、置换或附加而成的序列。
(9)根据(1)~(8)所述的转化用质粒,其中,转化用质粒以pfgf110(序列号14)或pfgf111(序列号15)的碱基序列表示。
(10)一种基因递送载体,其包含用(1)~(9)所述的转化用质粒进行了转化的厌氧菌。
(11)根据(10)所述的基因递送载体,其中,厌氧菌为双歧杆菌属细菌。
(12)根据(11)所述的基因递送载体,其中,双歧杆菌属细菌为长双歧杆菌(bifidobacteriumlongum)。
(13)一种药物组合物,其含有(10)~(12)所述的基因递送载体。
(14)根据(13)所述的药物组合物,其中,药物组合物还含有缺血性疾病部位中的基因递送载体的植活·增殖促进剂。
(15)根据(14)所述的药物组合物,其中,植活·增殖促进剂为选自由麦芽糖、乳果糖、阿拉伯糖、木糖、半乳糖、葡萄糖、乳糖、蜜二糖、松三糖、蜜三糖组成的组中的至少一种。
(16)一种用于诊断或治疗缺血性疾病的方法,其包括给予(10)~(12)所述的基因递送载体。
(17)根据(16)所述的方法,其中,给药为全身给药。
发明的效果
本发明的转化用质粒为具有新型的分泌信号的、对于用于诊断和/或治疗缺血性疾病的转化厌氧菌的制作有用的新型质粒,通过本发明的转化用质粒进行了转化的厌氧菌能够大量且稳定地分泌目的蛋白质。
而本发明的基因递送载体由于包含用本发明的转化用质粒进行了转化的厌氧菌,即使全身给药的情况下,也会在处于厌氧的环境下的缺血性疾病部位特异性地植活、增殖,可以在该疾病部位充分产生、分泌具有缺血性疾病的治疗活性的蛋白质。因此,作为基因递送载体,进而作为缺血性疾病治疗剂是极其有用的。另外,由于在缺血性疾病部位特异性地植活,即使是静脉注射等全身给药,也会在缺血性疾病部位特异性地集聚而发挥效果。因此,无需大量给药、多次给药,可以降低给药对象的负担。进而,缺血持续期间由于缺血性疾病部位的厌氧的环境得到维持而长期生长,而若一旦缺血缓解则已经并非厌氧的环境,因此不能生长而快速消失。
进而,本发明的基因递送载体由于基因递送载体其本身能够表达对于治疗有用的蛋白质,因此无需如以往那样考虑到对缺血性部位或其附近的细胞的基因导入效率,可以总是发挥高的蛋白质表达效率。进而,由于为特异性地递送到缺血性部位的载体,并发症的危险性也小。因此,与以往相比能够以进一步低侵袭性实施副作用小、安全性高的血管生成治疗。进而,通过使得本发明的基因递送载体同时表达标记物,也能够用于缺血性部位的诊断、处置的监测。进而,本发明的基因递送载体能够同时递送多种基因,认为通过整合给予多种有效的增殖因子,能够更有效地且非侵袭地进行治疗。
附图说明
图1表示关于人fgf2分泌穿梭质粒的制作的示意图。由pcd穿梭(shuttle)质粒,用hfgf2(带his标签)置换cd,制作pfgf-hu,进而在启动子与hfgf2基因之间插入sp26l20,制作phusp26l20-fgf2,由此处去除his标签,制作phusp26l20-fgf2-dhis。
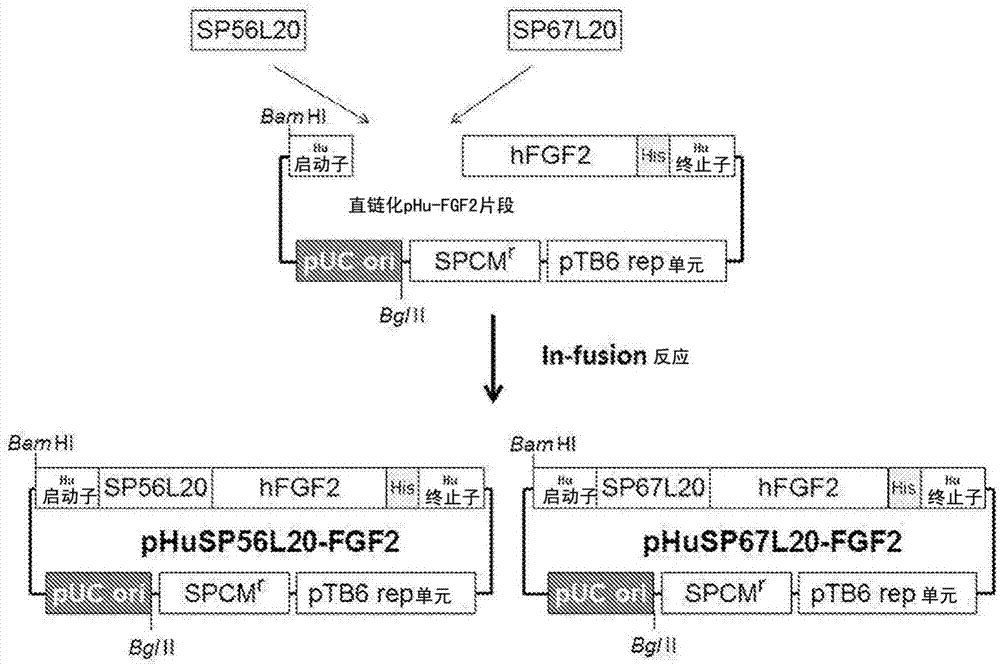
图2表示关于人fgf2(带标签)分泌穿梭质粒的制作的示意图。在直链化phu-fgf2片段插入sp56l20或sp67l20,分别制作phusp56l20-fgf2或phusp67l20-fgf2。
图3表示关于人fgf2(没有标签)分泌穿梭质粒的制作的示意图。在直链化phusp26l20-fgf2-dhis片段插入sp56l20或sp67l20,分别制作phusp56l20-fgf2-dhis或phusp67l20-fgf2-dhis。
图4表示关于人fgf2(没有标签)分泌非穿梭质粒的制作的示意图。由phusp56l20-fgf2-dhis和phusp67l20-fgf2-dhis分别去除pucori,制作pfgf110和pfgf111。
图5表示fgf110株和fgf111株培养上清液的蛋白质印迹的结果。m:分子量标记物、fgf110:fgf110株的培养上清液浓缩物、fgf111:fgf111株的培养上清液浓缩物、12a:fgf12a株的培养上清液浓缩物、r:重组人fgf2。对于fgf110株、fgf111株、fgf12a株,在与作为阳性对象的重组体(分子量约17kda)相同的位置确认了条带。
图6表示由sp56株和sp67株分泌的人fgf2蛋白质的nih/3t3细胞增殖促进活性。纵轴:表示450-630nm时的吸光度、横轴:表示人fgf2浓度(ng/ml)。由sp56、sp67株分泌的人fgf2与rhfgf2同样地具有浓度依存性的细胞增殖促进活性。
图7表示长期培养时的人fgf2分泌量推移。纵轴:fgf2分泌量(ng/ml)、横轴:培养时间。在2天、4天、7天中的任意一时点,fgf2分泌量由高到低的顺序为fgf110株、fgf111株、fgf12a株。fgf12a株的fgf2分泌量在培养第4天以后大幅降低,但是在fgf110株和fgf111株,直至最后为止观察到稳定的表达·分泌。
图8表示fgf110的血流改善效果。纵轴:患侧/健侧血流比、横轴:第2次手术后天数。在fgf110给药组中,在14天以后,与pbs、be穿梭(shuttle)组相比表现出显著的血流改善效果。该效果持续至36天为止。
具体实施方式
本发明涉及源自双歧杆菌属菌的新型的分泌信号肽和编码有该肽的分泌信号、含有该分泌信号的转化用质粒等。
以下对于本发明进行详细说明。
<转化用质粒>
本发明的转化用质粒的特征在于,通过新型的分泌信号单元的作用,能够更稳定地分泌更多的表达蛋白质,因此通过使用上述转化质粒,可以制作可以表达、以高效率分泌任意的目的蛋白质的优异的实用性高的进行了转化的厌氧菌。
一方案中,本发明涉及一种转化用质粒,其为用于转化厌氧菌的转化用质粒,该转化用质粒包含启动子单元,含有编码有序列号1或序列号2所示的分泌信号肽的dna的分泌信号单元,和含有编码有对于缺血性疾病的诊断或治疗有用的蛋白质(目的蛋白质)的dna的目的基因单元。
本说明书中,“厌氧菌”指的是具有厌氧的性质的细菌,“厌氧的性质”指的是能够在氧少或没有的条件下生长的性质。通常厌氧菌可以分类为即使在氧的存在下也能够生长的兼性厌氧菌、和在氧的存在下不能生长的专性厌氧菌,但是本发明的一方式中,优选为例如双歧杆菌属菌等专性厌氧菌。本发明的厌氧菌所具有的厌氧的性质可以为细菌天生所具有的性质、也可以通过突变、转化等突变化来得到。因此,本发明的一方式中,厌氧菌为以形成专性厌氧菌的方式突变化而成。例如即使为乳杆菌属等兼性厌氧菌,若突变化为专性厌氧性即可。
优选的方式中,本发明的转化用质粒用于转化双歧杆菌属细菌,进一步优选的方式中,用于转化长双歧杆菌(bifidobacteriumlongum)。
本说明书中,“表达弹夹”指的是用于使得质粒中含有的特定的蛋白质或肽片段表达的基因组,该组含有启动子单元和目的基因单元,进而可以任意含有其它的有用的单元。作为其它的有用的单元,可列举出例如编码有分泌信号等信号肽的基因、编码有目的基因所编码的蛋白质的分子伴侣蛋白的基因等。
本申请说明书中,“目的基因单元”指的是含有编码有目的的蛋白质(表达蛋白质)的基因的、与表达蛋白质相关的基因组。目的基因单元,除了编码有目的的蛋白质的基因以外,还可以含有其它的dna。作为目的基因单元中能够含有的其它的dna,虽然不限于此,但是可列举出例如his-tag等编码有标记表达蛋白质的肽的dna等。
本发明的质粒,以使得通过本发明的转化用质粒编码的蛋白质在厌氧菌体中产生、释放到菌体外而发挥治疗效果的方式含有分泌信号单元。
本申请说明书中,“分泌信号单元”指的是含有分泌信号序列的、编码有用于将表达蛋白质分泌到菌体外的氨基酸序列的基因组。本说明书中,仅称为“分泌信号”的情况下或者称为“分泌信号序列”的情况下指的是编码有分泌信号肽的基因或其dna序列。分泌信号单元,除了分泌信号序列之外例如还可以含有编码有插入到目的基因与分泌信号序列之间的间隔肽的dna等其它的dna。
本发明的分泌信号单元中含有的分泌信号序列为编码有sp56(序列号1)或sp67(序列号2)所示的新型的分泌信号肽的序列。需要说明的是,对应于序列号1和序列号2所示的分泌信号肽序列的分泌信号序列,除了分别以序列号3和序列号4表示的序列之外,还包括其简并序列。以下,本说明书中,称为“编码有氨基酸序列的dna”或“对应于氨基酸序列的碱基序列”等情况下,只要没有特别记载,则除了作为例子示出的特定序列之外,还意图包括其简并序列。
sp56(序列号1)或sp67(序列号2)所示的新型的分泌信号肽,为由长双歧杆菌(bifidobacteriumlongum)的注册于基因组数据库的全部氨基酸序列,使用分泌信号肽预测程序抽出候补,由该候补之中进一步选拔得到的分泌信号肽,通过本发明人等首次确认为有用的分泌信号肽。
本发明的分泌信号肽sp56和sp67具有特别优异的分泌活性,另外利用作为非病原性的专性厌氧菌的双歧乳杆菌发挥功能,因此编码有sp56和sp67的dna特别适用于厌氧的疾病、特别是缺血性疾病的诊断或治疗用厌氧菌的转化用质粒。因此,另外含有编码有sp56和sp67的dna的任意的转化用质粒也包含于本发明中。
一方式中,本发明的目的基因单元含有编码有对于缺血性疾病的诊断或治疗有用的蛋白质的dna作为表达蛋白质。
本说明书中,“缺血”指的是由于血管的狭窄、闭塞而供给到组织的动脉血量减少所导致的组织的氧·营养缺乏状态,持续性的缺血产生组织的萎缩、变性、坏死等。
本发明的转化用质粒主要合适地用于血管生成治疗、内脏器官的保护等改善由于缺血而引起的不优选的状态的处置方法。因此,本说明书中,“缺血性疾病”指的是无论自觉症状的有无,由于动脉的狭窄、闭塞而组织的缺血持续的状态或者由于上述缺血而引起的不优选的状态。作为缺血性疾病,虽然不限于此,但是可列举出例如心绞痛、心肌梗塞等缺血性心疾病、脑梗塞等脑缺血疾病、烟雾病等慢性脑缺血疾病、脊髓缺血疾病、缺血性结肠炎、肠系膜动脉闭塞症等缺血性肠疾病、闭塞性动脉硬化症、伯格氏病等下肢缺血疾病、糖尿性视网膜病等视网膜缺血疾病等。
本说明书中,“缺血性部位”指的是由于缺血而动脉血量、营养和氧减少的状态的部位,与“缺血性疾病部位”或“缺血性疾病组织”互换使用。
作为对于缺血性疾病的诊断或治疗有用的蛋白质,虽然不限于此,但是可列举出例如具有血管生成促进活性的蛋白质、与血管扩张相关的蛋白质等。作为具有血管生成促进活性的蛋白质,虽然不限于此,但是可列举出例如成纤维细胞增殖因子(fgf)、内皮细胞增殖因子(ecgf)、血管内皮增殖因子(vegf)、肝实质细胞增殖因子(hgf)、血管增殖因子(agf)、源自血小板的增殖因子(pdgf)、转化增殖因子β(tgfβ)、促血管新生蛋白因子、蝶素(ephrin)等,作为与血管扩张相关的因子,可列举出前列腺素类等。作为其它的对于治疗有用的蛋白质,可列举出集落刺激因子(例如粒细胞集落刺激因子(g-csf)、粒细胞-巨噬细胞集落刺激因子(gm-csf)等)、神经生长因子(ngf)、脑源性神经营养因子(bdnf)、神经营养因子(例如神经营养因子3等)、胰岛素样生长因子(igf)、源自血小板的血管内皮细胞增殖因子(pd-ecgf)等。作为对于缺血性疾病的诊断或治疗有用的蛋白质,特别优选为成纤维细胞增殖因子2(fgf2)。
本发明中,“启动子单元”指的是含有启动子和任意其它的与转录控制相关的区域的单元,作为其它的与转录控制相关的区域,可列举出例如操纵基因、终止子等。
本发明的启动子单元中含有的启动子若利用厌氧菌发挥功能则可以为任意的启动子,例如包括位于源自双歧乳杆菌的分泌信号的上游的启动子或利用双歧乳杆菌发挥功能的编码有组朊样dna结合蛋白质的基因的启动子(hupromoter)等。一方式中,本发明的启动子单元中含有的启动子例如可以为hu启动子(序列号13)、p37启动子(序列号16),优选为hu启动子。本发明的启动子单元中含有的启动子,在不会失去作为启动子的功能的范围内,可以以其碱基序列的一个或多个碱基缺失、置换或附加而成的序列(功能的同等物)表示。
本发明的一方式中,启动子单元含有终止子。作为能够含有的终止子,若利用双歧乳杆菌发挥功能则可以为任意的终止子,但是优选为利用双歧乳杆菌发挥功能的编码有组朊样dna结合蛋白质的基因的终止子(hu终止子),特别是最优选为以序列号38的碱基序列或者其一个或多个碱基缺失、置换或附加而成的序列所示的dna。
本发明的一方式中,分泌信号单元还含有连接于编码有分泌信号肽的dna的3’末端、编码有间隔肽的dna。
本说明书中,“间隔肽”指的是插入到分泌信号肽与目的蛋白质的n末端之间的肽。因此,编码有间隔肽的dna形成表达弹夹中、存在于分泌信号的下游侧且编码有目的蛋白质的基因的上游侧的dna。
通过存在间隔肽,目的蛋白质的分泌效率提高。因此优选的一方式中,间隔肽为1~25个氨基酸长度、更优选1~20个氨基酸长度、进一步优选5~20个氨基酸长度。对于间隔肽的序列没有特别限定,但是优选的是,sp56的情况下,为序列号5所示的肽或含有其n末端的部分肽,sp67的情况下,为序列号6所示的肽或含有其n末端的部分肽。
序列号5及6分别为由在长双歧杆菌(bifidobacteriumlongum)中通过sp56和sp67分泌的蛋白质的n末端~直至第25个氨基酸为止的序列构成的肽。上述的优选方式中,本发明的间隔肽,例如在sp56的情况下,可以为仅包含序列号5所示的肽的第1个氨基酸的1个氨基酸长度的部分序列、由序列号5的第1个氨基酸直至第15个氨基酸为止的15个氨基酸长度的部分序列、由序列号5的第1个氨基酸直至第20个氨基酸为止的20个氨基酸长度的部分序列、或者序列号5的25个氨基酸长度的全部序列所示的肽等,在sp67的情况下,可以为仅包含序列号6所示的肽的第1个氨基酸的1个氨基酸长度的部分序列、由序列号6的第1个氨基酸直至第15个氨基酸为止的15个氨基酸长度的部分序列、由序列号6的第1个氨基酸直至第20个氨基酸为止的20个氨基酸长度的部分序列、或者序列号6的25个氨基酸长度的全部序列所示的肽等。
需要说明的是,对应于序列号5和序列号6所示的氨基酸序列的碱基序列优选分别以序列号7和序列号8表示。
本发明的更优选的一方式中,分泌信号单元为编码有包含sp56和20个氨基酸份的间隔肽的序列号9所示的氨基酸序列、或者包含sp67和20个氨基酸份的间隔肽的序列号10所示的氨基酸序列的dna。需要说明的是,对应于序列号9和序列号10所示的氨基酸序列的碱基序列优选分别以序列号11和序列号12表示。
本发明的一方式中,作为转化用质粒,若包含启动子单元,含有编码有序列号1或序列号2所示的分泌信号肽的dna的分泌信号单元,和含有编码有对于缺血性疾病的诊断或治疗有用的蛋白质的dna的目的基因单元,为了转化厌氧菌而发挥功能,不会损害该菌的厌氧的性质,则能够使用任意质粒。但是,包含进行了转化的厌氧菌的基因递送载体形成药物的情况下,转化用质粒被水平转移到例如大肠杆菌等体内的其它细菌,通过水平转移的其它细菌复制质粒,其结果不能否定在没有意图的部位表达质粒所编码的蛋白质的危险性。因此,优选的方式中,转化用质粒为非穿梭质粒。
本说明书中,“穿梭质粒”指的是能够在2种以上的不同宿主中复制的质粒,与“穿梭载体质粒”互换使用。因此,“非穿梭质粒”指的是仅在1种宿主中能够复制的质粒。即,在上述方式中,转化用质粒仅具有利用转化对象的厌氧菌发挥功能的复制起点,不具有利用除此以外的菌发挥功能的复制起点,为不能利用大肠杆菌等转化厌氧菌以外的菌复制的质粒。
本发明的转化用质粒可以还含有其它的有用的基因。其它的有用的基因可列举出例如抗壮观霉素基因(spcm)等选择标记物基因、双歧乳杆菌质粒复制起点(ptb6)等复制起点、编码有gfp等标记蛋白质的基因等。
优选的方式中,本发明的转化用质粒为pfgf110(序列号14)或pfgf111(序列号15)。
本发明的转化用质粒例如可以如下所述制作。
例如根据通常的常规方法,向具有利用转化菌和转化菌以外的菌、例如双歧乳杆菌和大肠杆菌分别发挥功能的复制起点的穿梭质粒插入至少一种的启动子单元、分泌信号单元、编码有所希望的对于缺血性疾病的诊断或治疗有用的蛋白质的dna(目的基因单元),由此可以制作穿梭质粒。
接着根据需要,通过由该穿梭质粒去除转化菌以外的菌的复制起点,可以制作非穿梭质粒。
需要说明的是,上述各工序中的操作可以根据遗传工程学领域的公知方法进行。
<基因递送载体>
一方案中,本发明涉及包含用上述本发明的转化用质粒进行了转化的厌氧菌的基因递送载体。
本发明的基因递送载体为包含用本发明的转化用质粒进行了转化的上述厌氧菌的基因递送载体,可以在处于厌氧的环境下的组织内生长并且可以表达·分泌具有目的的活性的蛋白质。
本发明的基因递送载体由于在缺血性疾病部位特异性地植活,因此目的蛋白质必然地在缺血性疾病部位被特异性地表达·分泌。因此,可以表达用于缺血性疾病的诊断或治疗的蛋白质的本发明的基因递送载体可以有效地诊断或处置缺血性疾病。
本发明的基因递送载体由于在缺血性疾病部位特异性地植活,因此通过检出该基因递送载体的存在,能够诊断缺血性疾病部位。基因递送载体的检出例如可以通过标记基因递送载体来简便地进行。从用于疾病的诊断的观点考虑,检出优选侵袭性小,优选由于标记所导致的对生物体的不良影响小。因此,本发明的优选方式中,基因递送载体表达荧光蛋白质作为对于诊断有用的蛋白质。作为荧光蛋白质,可列举出各种绿色荧光蛋白质(gfp)、红色荧光蛋白质(rfp)等。
本发明的基因递送载体的前提在于对体内给药,因此需要所使用的厌氧菌不具有毒性或者毒性低。例如即使为梭菌属、沙门氏菌属等病原性的菌,若进行了非病原性化则也可以用于本发明。因此,本发明的一方式中,本发明的厌氧菌可以将病原性的菌突变化为低毒性而得到。但是,突变化为低毒性的细菌有可能回复突变化而回复到原来的病原性菌、发挥有害性,因此优选为天生非病原性的细菌。因此,本发明的优选方式中,厌氧菌使用非病原性的肠内细菌。
作为本发明中能够使用的非病原性肠内细菌,优选列举出双歧杆菌属菌(双歧乳杆菌)。作为双歧杆菌属细菌,可列举出例如青春双岐杆菌(bifidobacteriumadolescentis)、角形双歧杆菌(bifidobacteriumangulatum)、动物双岐杆菌(bifidobacteriumanimalis)、星状双歧杆菌(bifidobacteriumasteroides)、两岐双岐杆菌(bifidobacteriumbifidum)、牛双歧杆菌(bifidobacteriumboum)、短双歧杆菌(bifidobacteriumbreve)、链状双歧杆菌(bifidobacteriumcatenulatum)、猪双歧杆菌(bifidobacteriumchoerinum)、棒状双歧杆菌(bifidobacteriumcoryneforme)、家兔双歧杆菌(bifidobacteriumcuniculi)、龋齿双歧杆菌(bifidobacteriumdenticolens)、齿双歧杆菌(bifidobacteriumdentium)、没食子双歧杆菌(bifidobacteriumgallicum)、鸡双歧杆菌(bifidobacteriumgallinarum)、球双歧杆菌(bifidobacteriumglobosum)、印度双歧杆菌(bifidobacteriumindicum)、婴儿双岐杆菌(bifidobacteriuminfantis)、异形双歧杆菌(bifidobacteriuminopinatum)、乳酸双歧杆菌(bifidobacteriumlactis)、乳双歧杆菌(bifidobacteriumlactentis)、游离双歧杆菌(bifidobacteriumliberorum)、长双歧杆菌(bifidobacteriumlongum)、大双歧杆菌(bifidobacteriummagnum)、瘤胃双歧杆菌(bifidobacteriummerycicum)、最小双歧杆菌(bifidobacteriumminimum)、(bifidobacteriummongoliens)、微小粒双歧杆菌(bifidobacteriumparvulorum)、假链状双歧杆菌(bifidobacteriumpseudocatenulatum)、假长双歧杆菌(bifidobacteriumpseudolongum)、嗜冷双歧杆菌(bifidobacteriumpsychraerophilum)、小鸡双歧杆菌(bifidobacteriumpullorum)、反刍动物双岐杆菌(bifidobacteriumruminale)、反刍双歧杆菌(bifidobacteriumruminantium)、世纪双歧杆菌(bifidobacteriumsaeculare)、史卡杜维双歧杆菌(bifidobacteriumscardovii)、细长双歧杆菌(bifidobacteriumsubtile)、猪双歧杆菌(bifidobacteriumsuis)、萨玛茨德胡拉姆双歧杆菌(bifidobacteriumthermacidophilum)、嗜热双歧杆菌(bifidobacteriumthermophilum)等,最优选为长双歧杆菌(bifidobacteriumlongum)。
这些菌都为市售品或者可以由保藏组织容易地获得。例如长双歧杆菌(bifidobacteriumlongum)atcc-15707、两岐双岐杆菌(bifidobacteriumbifidum)atcc-11863、婴儿双岐杆菌(bifidobacteriuminfantis)atcc-15697等可以由美国模式培养物集存库(atcc、theamericantypeculturecollection)容易地获得。
另外,对于各菌的株也没有特别限定,例如对于长双歧杆菌(bifidobacteriumlongum)的株,可列举出长双歧杆菌(bifidobacteriumlongum)105-a株、长双歧杆菌(bifidobacteriumlongum)ae-194b株、长双歧杆菌(bifidobacteriumlongum)bs-601株、长双歧杆菌(bifidobacteriumlongum)m101-2株,其中,优选为长双歧杆菌(bifidobacteriumlongum)105-a株。
对于短双歧杆菌(bifidobacteriumbreve)的株,可列举出例如短双歧杆菌(bifidobacteriumbreve)标准株(jcm1192)、短双歧杆菌(bifidobacteriumbreve)as-1株、短双歧杆菌(bifidobacteriumbreve)i-53-8w株,其中,优选为短双歧杆菌(bifidobacteriumbreve)标准株、短双歧杆菌(bifidobacteriumbreve)as-1株。
对于婴儿双岐杆菌(bifidobacteriuminfantis)的株,可列举出例如婴儿双岐杆菌(bifidobacteriuminfantis)标准株(jcm1222)、婴儿双岐杆菌(bifidobacteriuminfantis)i-10-5株,其中,优选为婴儿双岐杆菌(bifidobacteriuminfantis)标准株、婴儿双岐杆菌(bifidobacteriuminfantis)i-10-5株。
另外,对于乳双歧杆菌(bifidobacteriumlactentis)的株,可列举出例如乳双歧杆菌(bifidobacteriumlactentis)标准株(jcm1220)。
本发明的基因递送载体,可以通过使用上述本发明的转化用质粒,根据遗传工程学领域的公知方法将进行转化的任意的厌氧菌转化来制作。
本发明的基因递送载体的制作,可以根据市售的实验书例如遗传子マニュアル(讲谈社)、高木康敬编遗传子操作实验法(讲谈社)、molecularcloningcoldspringharborlaboratory(1982)、molecularc1oning,2nded.coldspringharborlaboratory(1989)、methodsinenzymol.,194(1991)等中记载的方法进行。
<药物组合物>一方案中,本发明涉及含有上述本发明的基因递送载体的药物组合物。本发明的药物组合物,只要含有本发明的基因递送载体则没有特别限制。本发明的基因递送载体含有至少一种即可,也可以含有两种以上。进而,本发明的药物组合物可以与含有本发明的基因递送载体以外的表现出缺血性疾病治疗效果的化合物的药物组合物、缺血性疾病治疗剂组合来使用。
另外,本发明的药物组合物只要不会阻碍本发明效果则除了本发明的基因递送载体之外还可以含有任意的成分。作为这种任意成分,可列举出例如可药用的载体、赋形剂、稀释剂、基因递送载体的植活·增殖促进剂等。作为植活·增殖促进剂,虽然不限定于此,但是可列举出例如麦芽糖、乳果糖、阿拉伯糖、木糖、半乳糖、葡萄糖、乳糖、蜜二糖、松三糖、蜜三糖等本发明的基因递送载体中使用的转化菌能够滋生的糖等。
对于本发明的药物组合物的剂型没有特别限制,可列举出例如含有本发明的基因递送载体的液体制剂或固体制剂。液体制剂可以通过将本发明的基因递送载体的厌氧菌的培养液纯化,向其中根据需要加入适当的生理盐水或补液或者药物添加物,并填充于安瓿或小瓶等来制造。另外,固体制剂可以通过向液体制剂添加适当的保护剂,填充于安瓿或小瓶等后进行冷冻干燥或l干燥,或者向液体制剂添加适当的保护剂,进行冷冻干燥或l干燥后,将其填充于安瓿或小瓶等来制造。
作为本发明的药物组合物的给药方法,经口给药、非经口给药都能够实施,但是优选为非经口给药,例如可以进行静脉注射、皮下注射、局部注入、脑室内给药等,最优选为静脉注射、即全身给药。
本发明的药物组合物的基因递送载体的给药量,只要为对于在疾病部位可以生长并且表达有效治疗量的活性蛋白质而言充分的量则没有特别限制,但是从经济上的观点和尽可能避免副作用的观点考虑,优选在得到必要的治疗效果的范围内尽可能少。
本发明的药物组合物中的基因递送载体的给药量根据疾病的程度、患者的体重、年龄、性別适当选择,可以根据改善的程度适当增减。
例如,使用本发明的药物组合物时,根据所使用的厌氧菌的菌自身所示出的疾病治疗活性、所使用的厌氧菌所产生的具有疾病治疗活性的蛋白质等种类、和所使用的厌氧菌的该活性蛋白质的产生量等适当设定。
具体而言,例如静脉内给药的情况下,特别是要求降低由于菌块所导致的栓塞等危险,因此优选将尽可能低浓度的注射用制剂分为多次来分注或者用适当的补液稀释来持续注入。例如成人的情况下,对于本发明的厌氧菌的菌体每1kg体重将106~1012cfu分为1天1次~多次、1天~多天连续或者适当隔着间隔给药。更具体而言,对于含有本发明的双歧乳杆菌的菌体104~1010cfu/ml的制剂每1人成人将1~1000ml直接或者用适当的补液稀释、分为1天1次~数次、连续给药1天~数天。
另外,对疾病组织直接给药的局部给药的情况下,要求菌尽可能对全部疾病组织植活、增殖,因此优选将高浓度的注射剂给予到疾病组织的多个部位。例如成人的情况下,对于本发明的双歧乳杆菌的菌体每1kg体重将106~1012cfu1天1次~多次、根据需要1天~多天连续或者适当隔着间隔给药。更具体而言,对于含有本发明的双歧乳杆菌的菌体104~1010cfu/ml的制剂每1人成人将1~1000ml直接、1天数次根据需要1天~数天连续给药。
确认了治疗期间中疾病组织中的菌消失的情况下,暂时中断治疗,与上述同样地给予菌。
需要说明的是,本发明中的“x和y组合而成”中包括x和y形成不同的形态的情况、x和y形成相同的形态(例如含有x和y的形态)的情况中的任意一种情况。另外,x和y形成不同的形态的情况也包括x、y都还含有其它成分的情况。
本发明的基因递送载体在缺血性疾病部位特异性地植活、增殖,在没有处于厌氧的环境下的正常组织中不会增殖。因此,即使并非目的在于缺血性疾病部位的局部给药、也将基因特异性地递送到疾病部位。因此,从给药的简便、侵袭性低等观点考虑,优选本发明的药物组合物全身给药。
<诊断方法或治疗方法>
一方案中,本发明涉及一种用于诊断或治疗缺血性疾病的方法,其包括给予前述的任意一种基因递送载体。
通过使用本发明的基因递送载体,能够以高效率进行安全性高的诊断或治疗。
本发明的方法中,将本发明的基因递送载体给予具有缺血性疾病的对象。作为给药方法,经口给药、非经口给药都能够实施,但是优选为非经口给药,例如可以进行静脉注射、皮下注射、局部注入、脑室内给药等,最优选为静脉注射、即全身给药。
因此,本发明的方法的优选方式中,将本发明的基因递送载体全身给药。本发明的基因递送载体由于可以将基因特异性地递送到缺血性疾病部位,因此即使不使用导管、肌肉内注射等来对患部直接给药,而是利用静脉注射等进行全身给药的情况下,也可以在缺血性疾病部位特异性地植活、增殖而发挥效果。因此,能够进行即使与以往的治疗方法相比侵袭性也非常低的治疗。
实施例
以下通过参考例和实施例对于本发明进行更具体说明,但是本发明的技术范围不被这些例示所限定。
实施例1:分泌信号肽的鉴定按照以下的步骤,鉴定分泌信号肽sp56和sp67。对于源自注册于ncbi的基因组数据库(http://www.ncbi.nlm.nih.gov/genome/)的长双歧杆菌(bifidobacteriumlongum)ncc2705株的蛋白质的全部氨基酸序列,利用预测分泌信号的有无的信号序列预测程序signalp4.1server(http://www.cbs.dtu.dk/services/signalp/)进行解析。通过该解析,对于预测在蛋白质的n末端具有分泌信号肽序列的蛋白质的一部分的氨基酸序列,利用推定跨膜区(tm)的程序tmhmmserverv.2.0(http://www.cbs.dtu.dk/services/tmhmm-2.0/)进行拓扑分析。由该拓扑分析结果,选定推定在蛋白质的n末端存在tm的蛋白质。选定这些蛋白质作为预想具有tm的源自长双歧杆菌(bifidobacteriumlongum)ncc2705株的分泌信号肽。对应于所选定的分泌信号肽的氨基酸序列的长双歧杆菌(bifidobacteriumlongum)105a株的氨基酸序列中,由各蛋白质的氨基酸序列n末端直至通过signalp解析推定为蛋白酶切断推定部位的氨基酸序列为止作为各分泌信号肽序列(sp56和sp67)。另外,间隔肽序列为由各信号序列的c末端连接的20个氨基酸残基、将它们作为分泌信号单元。所使用的分泌信号单元的序列如以下所示。sp56和其间隔肽(序列号9)、sp67和其间隔肽(序列号10)。
实施例2:各种hfgf2分泌质粒的制作
质粒制作中使用的pcr用引物如表1所示。
[表1]
1.质粒pfgf-hu的制作
(1)人fgf2-histag插入片段(插入片段1)的制造
含有编码有在c末端融合组氨酸标签的人fgf2的dna的质粒“hfgf2inpuc57”由genscript公司获得。hfgf2的dna序列,为基于hfgf2(由genbankaccessionno.#nm_002006的aug开始翻译的约18kda的蛋白质)的氨基酸序列,将密码子最合适化于双歧乳杆菌用的人工dna序列(序列号31)。将该质粒hfgf2inpuc571ng作为模板,使用fgf4引物(正向)和fgf3引物(反向)的引物组进行pcr扩增。引物序列,以插入片段和载体片段的末端15bp重复的方式设计。各引物浓度设为0.2μm、反应容量设为50μl,使用primestarhs(premix)试剂盒(takarabioinc.)进行pcr扩增。作为扩增的程序,在98℃下10秒(变性反应)、在55℃下5秒(退火反应)、在72℃下30秒(延伸反应),将此作为1次循环,进行30次循环后,在72℃下进行30秒追加延伸反应,制造约0.5kbp的hfgf2-histag插入片段(插入片段1)。
(2)载体片段1的制造
将质粒pcd穿梭(国际公开号第2009/128272号)(序列号32)1ng作为模板,使用fgf1引物(正向)和fgf2引物(反向)的引物组,与上述同样地进行pcr扩增。但是,pcr的延伸反应在72℃下设为4分钟。载体片段1的长度为约3.9kbp。
(3)in-fusion反应
使用in-fusion(注册商标)hdcloning试剂盒(takarabioinc.制)将上述制造的插入片段1和载体片段1连接。即,向微型管添加上述载体片段50ng和插入片段13ng,进一步添加试剂盒内的5×in-fusionhdenzymepremix2μl、cloningenhancer1μl,利用0.1×te缓冲液(1mmtris-hcl、0.1mmedta、ph7.5)将反应液容量调整为10μl。将其在37℃下保温15分钟后,进一步在50℃下保温15分钟。其它的步骤根据试剂盒的产品说明书,制造in-fusion反应液1。
(4)大肠杆菌的转化和质粒pfgf-hu的dna序列确认
使用上述in-fusion反应液1,根据产品说明书进行大肠杆菌top10感应细胞(invitrogen)的转化。转化后的菌悬浮液涂布于含有75μg/ml壮观霉素的lb琼脂培养基,在37℃下培养一晩。利用含有75μg/ml壮观霉素的lb液体培养基将形成于上述琼脂培养基上的大肠杆菌菌落在37℃下振荡培养一晩,由此使用qiaprepspinminiprep试剂盒(qiagen公司制)抽提质粒。为了确定所抽提的质粒中的含有上述人fgf2表达弹夹的区域(5’-hu启动子-人fgf2蛋白质-his标签-hu终止子-3’)的序列,使用bigdye(注册商标)terminatorv3.1cyclesequencing试剂盒(appliedbiosystems公司制)进行序列反应。所抽提的质粒命名为pfgf-hu。
2.质粒phusp56l20-fgf2和phusp67l20-fgf2的制作
(1)sp56l20和sp67l20插入片段(插入片段2和3)的制造
将长双歧杆菌(bifidobacteriumlongum)105-a株的基因组dna作为模板,使用表1中记载的sp56-ins_f1引物(正向)和sp56-ins_r1_fgf引物(反向)的引物组,进行pcr扩增。引物序列以插入片段和载体片段的末端15bp重复的方式设计。各引物浓度设为0.2μm、反应容量设为20μl,使用primestarhs(premix)试剂盒(takarabioinc.)进行pcr扩增。作为扩增的程序,在98℃下10秒、在65℃下5秒、在72℃下20秒,将此作为1次循环,进行30次循环后,在72℃下进行30秒延伸反应,制造约0.2kbp的sp56l20插入片段扩增产物(插入片段2)。
对于sp67l20插入片段(插入片段3)而言,作为pcr扩增引物,使用sp67-ins_f1引物(正向)和sp67-ins_r1_fgf引物,除此之外与上述同样地制造。
(2)含有编码有人fgf2蛋白质的dna的载体片段2的制造
将质粒pfgf-hu作为模板,使用表1记载的fgf35引物(正向)和huprom_r引物(反向)的引物组,利用与上述插入片段的制造相同的方法进行pcr扩增。但是,pcr的反应容量设为50μl。作为扩增的程序,在98℃下10秒、在65℃下5秒、在72℃下4分钟30秒,将此作为1次循环,进行30次循环后,在72℃下进行30秒延伸反应,制造约4.3kbp的载体片段扩增产物。对于该pcr产物利用0.8%琼脂糖凝胶(含有溴化乙锭)进行电泳,利用uv照射的同时切出含有约4.3kbp的dna条带的凝胶。由该凝胶使用qiaquickgelextractionkit(qiagen公司制)抽提dna,作为载体片段2(直链化phu-fgf2片段、序列号33)。
(3)in-fusion反应
分别使用in-fusion(注册商标)hdcloning试剂盒(takarabioinc.制)将上述制造的插入片段2或插入片段3和载体片段2连接。即,向微型管添加上述载体片段扩增产物68ng和插入片段扩增产物6.15ng(插入片段2的情况)或6.55ng(插入片段3的情况),进一步添加试剂盒内的5×in-fusionhdenzymepremix2μl、cloningenhancer1μl,利用0.1×te缓冲液(1mmtris-hcl、0.1mmedta、ph7.5)将反应液容量调整为10μl。将其在37℃下保温15分钟后,进一步在50℃下保温15分钟。其它步骤根据试剂盒的产品说明书制造in-fusion反应液2。
(4)大肠杆菌的转化1和质粒phusp56l20-fgf2以及phusp67l20-fgf2的dna序列确认
使用上述in-fusion反应液2,根据产品说明书进行大肠杆菌hst16cr感应细胞(takarabioinc.制)的转化。转化后的菌悬浮液涂布于含有75μg/ml壮观霉素的lb琼脂培养基,在37℃下培养一晩。利用含有75μg/ml壮观霉素的lb液体培养基将形成于上述琼脂培养基上的大肠杆菌菌落在37℃下振荡培养一晩,由此使用qiaprepspinminiprep试剂盒(qiagen公司制)抽提质粒。所抽提的质粒中的含有上述人fgf2分泌表达弹夹的区域(5’-hu启动子-sp56l20-人fgf2蛋白质-his标签-hu终止子-3’)或(5’-hu启动子-sp67l20-人fgf2蛋白质-his标签-hu终止子-3’)的序列与上述1.(4)同样地进行。所抽提的质粒分别命名为phusp56l20-fgf2和phusp67l20-fgf2。各质粒含有人fgf2分泌表达弹夹的区域的序列分别如序列号34及35所示。
3.质粒phusp26l20-fgf2-dhis的制作
(1)sp26l20插入片段(插入片段4)的制造
将长双歧杆菌(bifidobacteriumlongum)105a的基因组dna80ng作为模板,使用hu_sp26_f引物(正向)和fgf_sp26l20_r引物(反向)的引物组,与上述2.(1)同样地进行pcr扩增。但是,pcr的延伸反应,在72℃下14秒、pcr溶液量设为20μl。插入片段的长度为约0.1kbp。
(2)in-fusion反应
使用上述制造的插入片段4和载体片段2,与上述2.(3)同样地进行in-fusion反应,制造in-fusion反应液3。但是,in-fusion反应中使用的载体量设为50ng、插入量设为4.2ng。
(3)大肠杆菌的转化2和质粒phusp26l20-fgf2的dna序列确认
使用上述in-fusion反应液3,利用与上述1.(4)相同的方法,进行大肠杆菌top10感应细胞的转化、由重组大肠杆菌抽提dna、含有人fgf2表达弹夹的区域(5’-hu启动子-sp26l20-人fgf2蛋白质-his标签-hu终止子-3’)的序列确定。所抽提的质粒命名为phusp26l20-fgf2。
(4)人fgf2插入片段(插入片段5)的制造
将质粒phusp26l20-fgf21ng作为模板,使用fgf35引物(正向)和fgf-his_r引物(反向)的引物组,与上述2.(1)同样地进行pcr扩增。但是,pcr的退火温度设为60℃、延伸反应在72℃下设为35秒。插入片段的长度为约0.5kbp。
(5)载体片段3的制造
将质粒phusp26l20-fgf21ng作为模板,使用fgf-his_f引物(正向)和fgf_sp26l20_r引物(反向)的引物组,与上述2.(2)同样地进行pcr扩增。但是,pcr的退火温度设为60℃、延伸反应在72℃下设为4分钟10秒。载体片段的长度为约4kbp。
(6)in-fusion反应
使用上述制造的插入片段5和载体片段3,与上述2.(3)同样地进行in-fusion反应,制造in-fusion反应液4。但是,in-fusion反应中使用的载体量设为20ng、插入量设为4ng。
(7)大肠杆菌的转化3和质粒phusp26l20-fgf2-dhis序列确认
使用上述in-fusion反应液4,利用与上述2.(4)相同的方法进行大肠杆菌的转化、由重组大肠杆菌抽提dna。使用所抽提的dna,进行含有人fgf2表达弹夹的区域(5’-hu启动子-sp26l20-人fgf2蛋白质-hu终止子-3’)的序列确定。所抽提的质粒命名为phusp26l20-fgf2-dhis。
4.质粒phusp56l20-fgf2-dhis和phusp67l20-fgf2-dhis的制作
(1)含有编码有人fgf2蛋白质的dna的载体片段4的制造
将质粒phusp26l20-fgf2-dhis作为模板,除此之外利用与上述2.(2)相同的方法进行pcr,制造载体片段4(直链化phusp26l20-fgf2-dhis片段、序列号36)。
(2)in-fusion反应
对于上述制造的插入片段2或3(sp56或sp67)和载体片段4利用与上述2.(3)相同的方法进行,制造in-fusion反应液5。但是,载体量设为75ng。
(3)大肠杆菌的转化4和质粒phusp56l20-fgf2-dhis以及phusp67l20-fgf2-dhis的dna序列确认
根据与上述2.(4)相同的步骤,使用上述in-fusion反应液5进行上述大肠杆菌hst16cr感应细胞的转化、由重组大肠杆菌抽提质粒。所抽提的质粒的全长序列的确定根据同样的步骤进行。所抽提的质粒命名为phusp56l20-fgf2-dhis和phusp67l20-fgf2-dhis。
5.质粒pfgf110和pfgf111的制作
(1)由质粒phusp56l20-fgf2-dhis和phusp67l20-fgf2-dhis去除pucori
上述质粒phusp56l20-fgf2-dhis或phusp67l20-fgf2-dhis3μg利用限制性内切酶bamhi(thermoscientific公司)和bglii(thermoscientific公司)消化,切断为约0.7kbp的含有pucori的dna片段和除此之外的部分(约3.8kbp)的两个片段。对于该反应液利用0.8%琼脂糖凝胶(含有溴化乙锭)进行电泳,照射uv的同时切出含有约3.8kbp的dna条带的凝胶。由该凝胶使用qiaquickgelextractionkit(qiagen公司制)抽提dna,它们分别作为直链化非穿梭质粒pfgf110和pfgf111。
(2)非穿梭质粒pfgf110和pfgf111的制作
上述直链化非穿梭质粒的自身连接使用rapiddnaligationkit(thermoscientific公司)如下所述进行。即,向上述直链化非穿梭质粒400ng加入上述试剂盒随附的5×rapidligationbuffer80μl、t4dnaligase8μl,利用0.1×te设为400μl。将其每80μl分注到5根微型管,22℃下反应5分钟,进行自身连接反应。将该反应液汇总为一,根据常规方法进行进行proteinasek处理、接着进行利用苯酚·氯仿进行的除蛋白质、氯仿抽提和醇沉淀。将进行了醇沉淀的dna溶解于0.1×te,作为非穿梭质粒pfgf110(序列号14)和pfgf111(序列号15)。
实施例3:重组双歧乳杆菌的制作
(1)fgf110株和fgf111株的制作
使用上述制作的非穿梭质粒pfgf110和pfgf111的dna溶液,通过电穿孔系统(genepulserii、bio-radlaboratories,inc.制)进行长双歧杆菌(bifidobacteriumlongum)105-a株的转化。电击(2kv、25μf、200ω)后,向小玻璃管(2mm间隙)即刻添加800μl的imr液体培养基和50μl的维生素c添加液(每100ml含有抗坏血酸35g、l-半胱氨酸盐酸盐一水合物2g和碳酸钠11g的溶液)的混合液,将其回收到灭菌过的2ml微型管。拧松该2ml管的盖,与脱氧·二氧化碳产生剂(anaeropack(注册商标)·kenki、mitsubishigaschemicalcompany,inc.制)一起装入到密闭容器,利用设定于37℃的培养箱保温3小时。
将保温后的各菌悬浮液涂布于含有75μg/ml壮观霉素的imr琼脂培养基。将这些板与上述脱氧·二氧化碳产生剂一起装入到密闭容器,利用设定于37℃的培养箱培养2天。
形成于上述含有壮观霉素的imr琼脂培养基上的菌落中,利用质粒pfgf110的转化体作为长双歧杆菌(bifidobacteriumlongum)105-a/pfgf110株(以下称为fgf110株)、利用质粒pfgf111的转化体作为长双歧杆菌(bifidobacteriumlongum)105-a/pfgf111株(以下称为fgf111株)。
(2)sp56株和sp67株的制作
使用穿梭质粒phusp56l20-fgf2和phusp67l20-fgf2,通过与上述(1)相同的方法,进行长双歧杆菌(bifidobacteriumlongum)105-a株的转化,分别得到长双歧杆菌(bifidobacteriumlongum)105-a/phusp56l20-fgf2株(以下称为sp56株)、和长双歧杆菌(bifidobacteriumlongum)105-a/phusp67l20-fgf2株(以下称为sp67株)。
(3)阴性对照株的制作
使用作为载体骨架的wo2011/093467中记载的pbe穿梭(shuttle)(序列号37),通过与上述(fgf110株和fgf111株的制作)相同的方法,进行长双歧杆菌(bifidobacteriumlongum)105-a株的转化,得到长双歧杆菌(bifidobacteriumlongum)105-a/pbe穿梭株(以下称为be穿梭(shuttle)株)。
实施例4:表达蛋白质的解析
(1)重组双歧杆菌属细菌的培养
将上述fgf110株、fgf111株和专利文献7(wo2013/008881)中记载的长双歧杆菌(bifidobacteriumlongum)105a/pfgf12a株(以下称为fgf12a株)接种于添加有壮观霉素(终浓度75μg/ml)和维生素c添加液100μl的mrs(becton,dickinsonandcompany制)液体培养基10ml,在37℃下进行24小时厌氧培养,作为活化培养液。接着,向dmem(catno.11885-084:lifetechnologiescorporation制):mrs以9:1的比率混合而成的培养基20ml添加维生素c添加液100μl、壮观霉素75μg/ml,接种上述活化培养液100μl。将其在37℃下进行15小时厌氧培养。
(2)样品制造
对于上述重组双歧乳杆菌培养液的上清液根据常规方法进行三氯乙酸(tca)沉淀,利用1×sds样品缓冲液再溶解。将其在95℃下进行3分钟加热处理,供于蛋白质印迹解析。
(3)蛋白质印迹
对于上述各培养上清液浓缩物(相当于培养上清液0.2ml)和作为阳性对照的重组人fgf2(peprotech公司、分子量17.2kda),利用mini-protean(注册商标)tgxtm凝胶(4~20%)(bio-radlaboratories,inc.制)进行电泳,使用iblot转移装置(lifetechnologiescorporation制)将凝胶转印到pvdf膜(membrane)(iblottransferstacks、lifetechnologiescorporation制)。将蛋白质印迹结束后的pvdf膜封闭(2%eclprimeblockingagent(gehealthcarejapan公司制)inttbs)。作为一次抗体,加入antifgf-2humanrabbitpoly(h-131、santacruzbiotechnologyinc.),4℃下振荡一晩。一次抗体反应后,对于膜利用ttbs重复约5分钟的洗涤6次,加入二次抗体goatanti-rabbitigghrp(santacruzbiotechnologyinc.),室温下振荡1小时。使用westernlightningultra(perkinelmerco.,ltd.制)使得抗体反应结束后的膜发光。对其利用图像装置(fluor-smax、bio-radlaboratories,inc.)进行解析。
(4)结果
结果如图5所示。对于fgf110株和fgf111株,确认了所预想的分子量约20kda的条带。
实施例5:由双歧乳杆菌进行了his-tag纯化的fgf2的生理活性测定
(1)由sp56株和sp67株的培养上清液纯化人fgf2
通过与上述实施例4相同的方法,进行sp56株和sp67株的培养。将该培养液离心分离,回收上清液,利用常规方法进行硫酸铵沉淀。进而,使用具有组氨酸标签的蛋白质用纯化试剂盒(talon(注册商标)metalaffinityresin、takarabioinc.制),进行了亲和纯化。对于其使用超滤过滤片(amiconultra-4、10k、millipore),将缓冲液置换为pbs,得到纯化人fgf2溶液。对于该纯化溶液中的人fgf2量使用quantikineelisafgf2basicimmunoassay(r&dsystems;dfb50)进行测定。
(2)sp56株和sp67株分泌物中的fgf2蛋白质的增殖促进活性
对于fgf2的生理活性而言,将由sp56株和sp67株的培养上清液如上所述纯化的人fgf2添加到nih/3t3细胞(小鼠成纤维用细胞株),利用细胞增殖促进活性进行评价。即,将nih/3t3细胞利用dmem培养基(10%(v/v)fbs)在37℃、5%co2的条件下培养后,利用dmem培养基(5%(v/v)fbs)接种于96孔板各1×103个,37℃下在5%co2的条件下培养24小时。接着,将源自上述sp56株和sp67株的人fgf2纯化物或重组hfgf2(r&dsystems),与以fgf2浓度为0.25ng/ml~10ng/ml的方式和dmem培养基(5%(v/v)fbs)混合的培养基更换。作为阴性对照,也同样地进行对替代fgf2溶液混合有pbs(-)的培养基的更换。将该板在37℃下在5%co2的条件下培养4天。
向上述板添加cellcountingkit-8(株式会社同仁化学研究所)各100μl后,进而在37℃下、5%co2的条件下保温2小时,测定波长450nm和630nm(参照波长)时的吸光度,由此测定对于上述nih/3t3细胞的细胞增殖促进活性。
(3)结果
结果如图6所示。
由sp56、sp67株分泌的人fgf2具有浓度依存性的细胞增殖促进活性。
实施例6:fgf2分泌量的稳定性比较
(1)方法
以1%将wo2013/008881中记载的长双歧杆菌(bifidobacteriumlongum)105a/pfgf12a株和上述fgf110株、fgf110株的甘油系接种于mrs(75μg/ml壮观霉素、1%维生素c添加液)培养基10ml,37℃下厌氧培养24小时,作为活化培养液。接着以1%将活化培养液接种于相同的培养基,同样地培养24小时作为继代培养液。以后每24小时重复同样的继代。
在人fgf2分泌量测定前一天,以0.5%将上述继代培养液接种于作为人fgf2测定用培养基的dmem:mrs(9:1)(含有75μg/ml壮观霉素、1%维生素c添加液)培养基,37℃下培养13小时。人fgf2分泌量测定在由甘油系的培养后第2天、第4天、第7天进行。
将人fgf2测定用培养基中的培养液离心分离,得到培养上清液。对于该培养上清液中的fgf2蛋白质量使用quantikineelisafgf2basicimmunoassay(r&dsystems;dfb50)进行测定。
(2)结果
结果如图7所示。
fgf2分泌量由高到低的顺序为fgf110株、fgf111株、fgf12a株。
fgf12a株在培养第4天以后,fgf2分泌量大幅降低。
实施例7:fgf110株给药慢性缺血模型小鼠患肢血流量的推移
为了验证本发明的基因递送载体在缺血性疾病部位的治疗效果,制作下肢缺血的小鼠模型,给予人fgf2分泌双歧乳杆菌进行研究。
(1)小鼠下肢缺血模型(necroticmodel)的制作
实验动物使用19周龄、雌性的balb/c小鼠(japanslc,inc.)。对于麻醉而言,将戊巴比妥(共立制药株式会社)稀释到2.5mg/ml的稀释物每20g体重0.4ml注射到腹腔内。麻醉的同时,将肝素钠(nipro)(用生理盐水稀释到50u/ml)0.2ml注射到腹腔内。由腹部进行小腿的除毛后,用9-0聚丙烯线将大腿动脉结扎,切除大腿动脉中枢。创内用生理盐水洗涤后,用6-0尼龙线缝合创伤。手后复温,皮下注射肝素0.2ml。在术后第1、2天也皮下注射肝素0.4ml。
初次术后第6天进行初次同样麻醉,肝素给药后,将大腿动脉末梢结扎、切除。与初次同样术后直至第2天为止进行肝素给药。另外由重组双歧乳杆菌给药后连日腹腔内给予10%麦芽糖1ml。
(2)利用激光多普勒血流计进行的血流测定
将小鼠麻醉后,使用激光多普勒血流计(moorinstruments公司制)进行血流测定。对于由距骨小腿关节以下直至指尖为止的血流,对于两侧将血流定量,以患侧/健侧比表示。血流测定将第2次手术作为0天,在2天、7天、14天、21天、36天进行。
(3)重组双歧乳杆菌的给药
向作为人fgf2分泌双歧乳杆菌的fgf110株的冷冻制剂添加pbs,调整菌浓度来使用。下肢缺血模型第2次手术作为0天,在3天、4天、11天、18天、25天、32天由尾静脉一天二次给予0.6×109cfu。作为对比组,设定等量给予be穿梭株的冷冻制剂的组、和等水分量(0.2ml)给予pbs的组。
(4)结果
fgf110给药组中,在14天以后示出与pbs、be穿梭组相比显著的血流改善效果。该效果持续至36天。(表2、图8)
[表2]
表2fgf110的血流改善效果
实施例8:用非选择培养基继代培养后的质粒保持稳定性
(1)方法
除了上述制作的fgf110株和fgf111株之外,以1%将作为阴性对照株的be穿梭株的甘油系接种于mrs(75μg/ml壮观霉素、1%维生素c添加液)培养基5ml,37℃下厌氧培养24小时,作为活化培养液。以1%将该活化培养液接种于相同的培养基,同样地培养24小时,作为前培养液。以后,接种于不含有壮观霉素的作为非选择培养基的mrs(含有1%维生素c添加液)培养基5ml,每24小时在相同培养基继代,重复非选择培养基中的继代培养。7次继代的培养液用厌氧性稀释液适当稀释,将其涂布于bl琼脂培养基,37℃下厌氧培养2天。
随机选择形成于bl琼脂培养基上的菌落100个,将这些菌落穿刺于bl-bs和bl琼脂培养基,37℃下厌氧培养1天。确认了各培养基上的穿刺痕迹中的双歧乳杆菌的生长,算出(bl-bs琼脂培养基上的生长部位)/(bl琼脂培养基上的生长部位)×100,作为质粒保持菌率。
(2)结果
结果如表3所示。测定质粒保持稳定性,结果fgf110株、fgf111株都表现出非常高的质粒保持菌率。
[表3]
表3质粒保持稳定性
产业上的可利用性
通过本发明的转化用质粒,能够提供能够目的蛋白质高、稳定地分泌表达的用于转化厌氧菌的转化用质粒。因此,与以往的方法相比,能够低侵袭、高效率地简便地进行血管生成疗法。另外,由于用上述质粒进行了转化的厌氧菌其本身形成基因递送载体,对目的部位的基因的导入效率等不会成为问题,与以往相比能够进行非常高效率的处置。由此,即使是对于高龄者等虽然本来血管生成疗法应该是有效的但是侵袭性高、全身性的副作用成为障碍而不能进行处置的对象等也能够有效地进行处置。
- 还没有人留言评论。精彩留言会获得点赞!