有机化合物、有机半导体材料、有机薄膜及制造方法、有机半导体组合物、有机半导体装置与流程
本发明涉及有机化合物(缩合多环芳香族化合物)、含有该有机化合物的有机半导体材料、有机薄膜及其制造方法、有机半导体组合物、以及有机半导体装置。
有机电子装置具有可挠性等特征,故近年来备受瞩目。作为有机电子装置的一例可举例如有机el元件、有机太阳能电池元件、有机光电转换元件及有机晶体管元件等,该等有机电子装置可通过印刷制程(溶液制程)而形成,故可在短时间内以低成本制作,备受期待。
要以印刷制程形成有机电子装置,含有有机半导体化合物的有机半导体材料需可溶于溶剂,将有机半导体材料溶液进行涂布/印刷并干燥溶剂,由此可形成半导体薄膜。迄今为止,所探讨的可溶性低分子半导体材料是含有硫或硒原子的缩合多环芳香族化合物,也尝试研究在苯并二噻吩(bdt)系化合物、苯并噻吩并苯并噻吩(btbt)系化合物及二萘并二噻吩(dntt)系化合物等的分子长轴导入烷链而使其可溶化(专利文献1-3、非专利文献1-4)。使用btbt的烷基衍生物时,在印刷制程中具有形成半导体薄膜的充分有机溶剂溶解度,但因相对于烷链长的缩合环数相对较少,因此在低温中容易引起相转移,而存在有机电子装置的耐热性劣化的问题。另一方面,使用增加缩合环数的dntt的烷基衍生物时,虽然可改善有机电子装置的耐热性,但在印刷制程中形成半导体薄膜用的有机溶剂溶解性不足。因此需要开发一种有机半导体材料(有机半导体化合物),即使增加缩合环数也具有可适用于印刷制程的充分溶解性,且所得有机电子装置具有高耐热性。
最近,提出有一种具备苯并噻吩并萘并噻吩(btnt)骨架的有机半导体材料,该骨架具有介于btbt与dntt中间的缩合环数(专利文献4-5)。
但是,专利文献4着眼于提升有机晶体管的移动率、开/关比及保存稳定性,且仅例示有机晶体管的特性,该晶体管通过将具有btnt骨架的化合物的氯仿溶液涂布于80℃的基板上的印刷制程而得。另外,专利文献5着眼于提升薄膜半导体的载体移动率及电流调变特性,该薄膜半导体是在溶液相中以约未满50℃的温度处理而得,且仅例示有机晶体管的特性,该有机晶体管是将维持在室温或其附近(<40℃)的具有btnt骨架的化合物溶液以旋转涂布而获得。专利文献4及5皆未具体记载有关具有btnt骨架的化合物在室温中的溶解性,也未提及有关具有btnt骨架的化合物溶液的保存稳定性。另外,专利文献4及5中并未提及有关可承受制造有机电子装置时的步骤的充分耐热性。
先前技术文献
专利文献
专利文献1:日本特开2008-258592号公报;
专利文献2:国际公开2008/047896;
专利文献3:国际公开2010/098372;
专利文献4:日本特开2010-34450号公报;
专利文献5:日本特表2014-531435号公报。
非专利文献
非专利文献1:chemistryletters,2008,vol.37,no.3,p.284-285;
非专利文献2:journaloftheamericanchemicalsociety,2007,vol.129,issue51,p.15732-15733;
非专利文献3:advancedmaterials,2011,vol.23,issue10,p.1222-1225;
非专利文献4:naturecommunications,2015年4月10日,vol.6,articlenumber6828。
技术实现要素:
发明要解决的问题
本发明的目的为提供室温下有机溶剂溶解性、溶液保存稳定性及耐热性优异的有机化合物、含有该有机化合物的有机半导体材料及有机半导体组合物、使用该有机半导体材料且可通过室温中印刷制程获得的有机薄膜及其制造方法、以及含有该有机薄膜而成的具有高移动率与耐热性的有机半导体装置。
解决问题的技术方案
即,本发明涉及:
[1]一种有机化合物,由通式(a)所表示。
(式中,r1及r2的任一者表示烷基、具有烷基的芳香族烃基或具有烷基的杂环基,另一者表示脂肪族烃基、芳香族烃基或杂环基。但排除r1及r2两者皆表示烷基的情形。)
[2]如前项[1]所记载的有机化合物,其中,r1及r2的任一者表示具有碳数2至16的烷基的芳香族烃基或具有碳数2至16的烷基的杂环基。
[3]如前项[2]所记载的有机化合物,其中,r1及r2的任一者为具有碳数4至12的烷基的芳香族烃基或具有碳数4至12的烷基的杂环基,并且另一者为芳香族烃基或杂环基。
[4]如前项[1]所记载的有机化合物,其中,r1及r2的任一者为碳数4至10的直链烷基,另一者为芳香族烃基或杂环基。
[5]如前项[1]所记载的有机化合物,其中,r1及r2的任一者为碳数6至12的支链烷基,另一者为芳香族烃基或杂环基。
[6]如前项[1]至[5]中任一项所记载的有机化合物,其中,在示差扫描量热法中,在未满150℃时未观测到表示相转移的波峰。
[7]如前项[1]至[6]中任一项所记载的有机化合物,其中,在25℃下在有机溶剂中的溶解度为0.3质量%以上。
[8]如前项[7]所记载的有机化合物,其中,有机溶剂为非卤素系有机溶剂。
[9]一种有机半导体材料,含有前项[1]至[8]中任一项所记载的有机化合物。
[10]一种有机薄膜,由前项[9]所记载的有机半导体材料构成。
[11]一种有机半导体组合物,含有前项[1]至[8]中任一项所记载的有机化合物及有机溶剂。
[12]如前项[11]所记载的有机半导体组合物,其中,有机化合物的含量为0.1至5质量%。
[13]一种有机薄膜的制造方法,包括将前项[11]或[12]所记载的有机半导体组合物涂布或印刷后进行干燥的步骤。
[14]一种有机半导体装置,其含有前项[10]所记载的有机薄膜而成。
[15]如前项[14]所记载的有机半导体装置,其是有机晶体管。
发明效果
本发明的有机化合物及含有该有机化合物的本发明的有机半导体材料,具有良好的室温下有机溶剂溶解性、溶液保存稳定性及耐热性,故适合用于制作有机半导体装置时的印刷制程。另外,含有本发明的有机化合物及有机溶剂的有机半导体组合物具有良好的室温下溶解性、保存稳定性及耐热性,故适合用于制作有机半导体装置时的印刷制程。另外,通过使用以该有机化合物而得的本发明的有机薄膜,可提供移动率及耐热性优异的本发明的有机半导体装置。另外,本发明的有机薄膜的制造方法可制造构成上述移动率及耐热性优异的有机半导体装置。
附图说明
图1是表示本发明的有机晶体管的结构形式例的概略图,(a)表示底接触-底闸极结构的有机晶体管、(b)表示顶接触-底闸极结构的有机晶体管、(c)表示顶接触-顶闸极结构的有机晶体管、(d)表示顶&底接触底闸极型有机晶体管、(e)表示静电感应型有机晶体管、(f)表示底接触-顶闸极结构的有机晶体管。
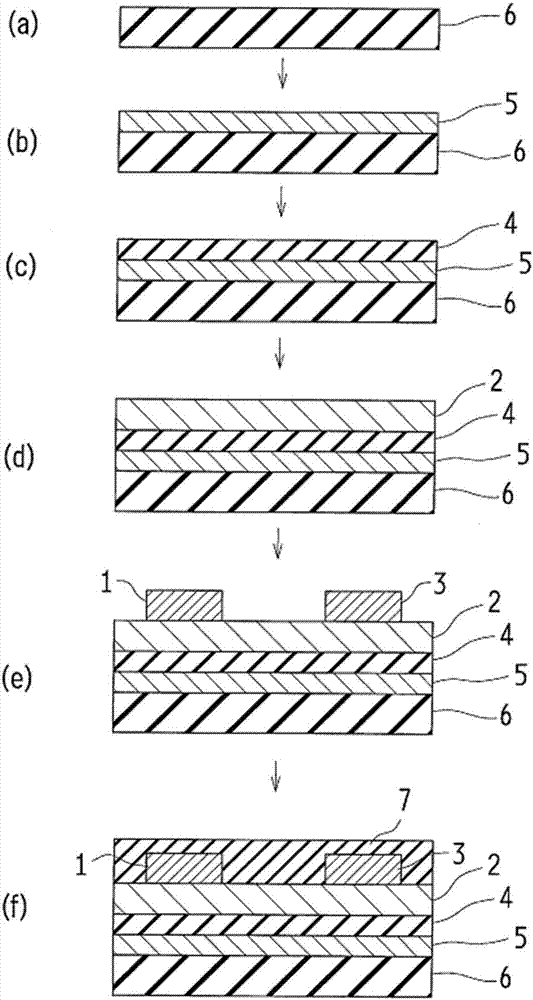
图2是制造本发明的有机晶体管的一例示形式用的步骤的概略图。
图3表示实施例6的有机晶体管的传导特性与输出特性。
具体实施方式
以下详细说明本发明。
本发明的有机化合物具有下述式(a)所示的结构。
式(a)中,r1及r2的任一者表示烷基、具有烷基的芳香族烃基或具有烷基的杂环基,另一者表示脂肪族烃基、芳香族烃基或杂环基的任一者。但排除r1及r2的两者皆为烷基的情形。前述“另一者表示的芳香族烃基或杂环基”可具有取代基。
式(a)的r1及r2表示的烷基除了直链或支链烷基外,也包括脂环式烷基,其具体例可举出甲基、乙基、丙基、异丙基、正丁基、异丁基、烯丙基、叔丁基、正戊基、正己基、正辛基、正癸基、正十二烷基、正十三烷基、正十四烷基、正鲸蜡基、正十七烷基、正丁烯基、2-乙基己基、3-乙基庚基、4-乙基辛基、2-丁基辛基、3-丁基壬基、4-丁基癸基、2-己基癸基、3-辛基十一烷基、4-辛基十二烷基、2-辛基十二烷基、2-癸基十四烷基、环己基、环戊基、金刚烷基及降冰片基等。优选为正丁基、正己基、正辛基、正癸基、正十二烷基、乙基己基、乙基辛基、丁基辛基及己基癸基等直链或支链烷基,更优选为正己基、正辛基、正癸基、2-乙基己基、3-乙基己基、3-乙基辛基或3-丁基辛基。
式(a)的r1及r2表示的烷基优选为碳数2至16的直链或支链烷基,更优选为碳数4至12的直链或支链烷基,又更优选为碳数4至10的直链烷基或碳数6至12的支链烷基,特优选为碳数6至10的直链或支链烷基,最优选为碳数6至10的直链烷基。
式(a)的r1及r2表示的具有烷基的芳香族烃基中的芳香族烃基,指从芳香族烃除去1个氢原子的残基,该芳香族烃基的具体例可举出苯基、萘基、蒽基、菲基、芘基及苯并芘基等。
式(a)的r1及r2表示的具有烷基的芳香族烃基中的芳香族烃基较优选为苯基或萘基,更优选为苯基。
式(a)的r1及r2表示的具有烷基的芳香族烃基中的烷基,可举出与式(a)的r1及r2表示的烷基相同者,较优选为碳数1至10的直链或支链烷基,更优选为碳数1至6的直链或支链烷基,又更优选为碳数1至6的直链烷基。
式(a)的r1及r2表示的具有烷基的芳香族烃基中的芳香族烃基上的烷基取代位置并无特别限定,但例如该芳香族烃基为苯基时,较优选形式是烷基取代位置为4位。
式(a)的r1及r2表示的具有烷基的杂环基中的杂环基,指从杂环除去1个氢原子的残基,该杂环基的具体例可举出吡啶基、吡唑基、嘧啶基、喹啉基、异喹啉基、吡咯基、吲哚啉基、咪唑基、咔唑基、噻吩基、呋喃基、哌喃基、吡啶酮基、苯并喹啉基、蒽喹啉基、苯并噻吩基、苯并呋喃基、噻吩并噻吩基等。
式(a)的r1及r2表示的具有烷基的杂环基中的杂环基较优选为吡啶基、噻吩基、苯并噻吩基或噻吩并噻吩基,更优选为噻吩基或苯并噻吩基,更优选为噻吩基。
式(a)的r1及r2表示的具有烷基的杂环基中的烷基可举例如与式(a)的r1及r2表示的烷基相同者,较优选为碳数1至10的直链或支链烷基,更优选为碳数4至8的直链或支链烷基,又更优选为碳数4至8的直链烷基。
式(a)的r1及r2表示的脂肪族烃基(另一者所示的脂肪族烃基)可举例如饱和或不饱和的直链、支链或环状烃基,其碳数较优选为1至30,更优选为1至20,又更优选为4至16。在此,饱和或不饱和的直链、支链或环状脂肪族烃基的具体例可举出甲基、乙基、丙基、异丙基、正丁基、异丁基、烯丙基、叔丁基、正戊基、正己基、正辛基、正癸基、正十二烷基、正十三烷基、正十四烷基、正鲸蜡基、正十七烷基、正丁烯基、2-乙基己基、3-乙基庚基、4-乙基辛基、2-丁基辛基、3-丁基壬基、4-丁基癸基、2-己基癸基、3-辛基十一烷基、4-辛基十二烷基、2-辛基十二烷基、2-癸基十四烷基、环己基、环戊基、金刚烷基及降冰片基等。饱和或不饱和的直链、支链或环状脂肪族烃基较优选为正丁基、正己基、正辛基、正癸基、正十二烷基、乙基己基、乙基辛基、丁基辛基及己基癸基等饱和的直链或支链烷基,更优选为正己基、正辛基、正癸基、2-乙基己基、3-乙基己基或3-乙基辛基。
式(a)的r1及r2表示的芳香族烃基(另一者表示的芳香族烃基)可举出苯基、萘基、蒽基、菲基、芘基、苯并芘基等,较优选为苯基、萘基或吡啶基,更优选为苯基或萘基,又更优选为苯基。
式(a)的r1及r2表示的芳香族烃基(另一者表示的芳香族烃基)可具有取代基。该可具有的取代基可举出前述烷基等,较优选为碳数1至6的直链或支链烷基,更优选为碳数1至6的直链烷基。
式(a)的r1及r2表示的杂环基(另一者表示的杂环基)可举出吡啶基、吡唑基、嘧啶基、喹啉基、异喹啉基、吡咯基、吲哚啉基、咪唑基、咔唑基、噻吩基、呋喃基、哌喃基、吡啶酮基、苯并喹啉基、蒽喹啉基、苯并噻吩基、苯并呋喃基等,较优选为吡啶基、噻吩基或苯并噻吩基,更优选为噻吩基或苯并噻吩基。
式(a)的r1及r2表示的杂环基(另一者表示的杂环基)可具有取代基。该可具有的取代基可举出前述烷基等,较优选为碳数1至6的直链或支链烷基,更优选为碳数1至6的直链烷基。
本发明的式(a)所示的有机化合物更优选为上述r1及r2个别较优选者的组合,又更优选为个别更优选者的组合。
具体而言,式(a)所示的有机化合物中,较优选为一种有机化合物,其中r1及r2的一者为具有碳数1至10的直链或支链烷基的苯基、或碳数1至16的直链或支链烷基,另一者为可具有碳数1至6的直链或支际的烷基的苯基、吡啶基、噻吩基或苯并噻吩基;更优选为一种有机化合物,其中r1及r2的一者为碳数4至16的直链或支链烷基,另一者为可具有碳数1至6的直链或支际的烷基的苯基、噻吩基或苯并噻吩基;又更优选为一种有机化合物,其中r1及r2的一者为碳数4至12的直链或支链烷基,另一者为可具有碳数1至6的直链或支际的烷基的苯基或苯并噻吩基;特优选为一种有机化合物,其中r1及r2的一者为碳数4至10的直链烷基或碳数6至12的支链烷基,另一者为可具有碳数1至6的直链或支链烷基的苯基;最优选为一种有机化合物,其中r1及r2的一者为碳数6至10的直链烷基,另一者为苯基。
式(a)所示的有机化合物例如可应用日本特开2011-256144号公报所记载的方法而合成。
以下表示本发明的式(a)所示的有机化合物的具体例,但本发明并不限定于这些。
式(a)所示的有机化合物的特征为在未满150℃时不具有相转移点。相转移点是表示液晶转移点、熔点、升华点等物质进行相转移的温度,通常在示差扫描量热法中的吸热峰表示其温度。尤其除了从固相改变为液相的熔点以外,较优选为显示向列相或层列a相等体积变化大的相变化的转移温度较高。本发明的化合物的相转移温度为150℃以上,更优选相转移温度为170℃以上,又更优选相转移温度为180℃以上,又再更优选相转移温度为200℃以上。
另外,式(a)所示的有机化合物要求可溶于有机溶剂。该有机溶剂只要可溶解式(a)所示的有机化合物则可使用,无特别限定,但考虑到环境问题等时,以实用而言较优选为非卤素系溶剂。另外,考虑到于有机溶剂溶解式(a)所示的有机化合物所得的溶液的稳定性时,要求室温下式(a)所示的有机化合物的溶解度要高于一定程度以上。在25℃,式(a)所示的有机化合物在有机溶剂的溶解度通常为0.1质量%以上,较优选为0.3质量%以上,更优选为0.5质量%以上,又更优选为0.7质量%以上。在25℃,式(a)所示的有机化合物在氯仿的溶解度通常为0.1质量%以上,较优选为0.3质量%以上,更优选为0.5质量%以上,又更优选为0.7质量%以上。在25℃,式(a)所示的有机化合物在甲苯的溶解度通常为0.1质量%以上,较优选为0.3质量%以上,更优选为0.5质量%以上,又更优选为0.7质量%以上。在25℃,式(a)所示的有机化合物在四氢萘的溶解度通常为0.1质量%以上,较优选为0.3质量%以上,更优选为0.5质量%以上,又更优选为0.7质量%以上。另外,溶液稳定性较优选为溶解后经过24小时之后仍未析出结晶,更优选为溶解后经过1周后也完全溶解。
有机溶剂也可使用氯仿、二氯甲烷、氯苯、二氯苯等卤素系溶剂,但较优选为非卤素系溶剂,可使用苯、甲苯、二甲苯、均三甲苯、乙基苯、四氢萘、环己基苯等芳香族烃类;二乙醚、四氢呋喃、苯甲醚、苯乙醚、丁基苯基醚等醚类;二甲基乙酰胺、二甲基甲酰胺、n-甲基吡咯啶酮等酰胺类等;丙酮、甲乙酮、甲基异丁基酮、环戊酮、环己酮等酮类;乙腈、丙腈、苯甲腈等腈类;甲醇、乙醇、异丙醇、丁醇、环己醇等醇类;乙酸乙酯、乙酸丁酯、安息香酸乙酯、碳酸二乙酯等酯类;己烷、辛烷、癸烷、环己烷、十氢萘等烃类等。
含有本发明的式(a)所示的有机化合物的有机半导体材料,适作为有机el元件、有机太阳电池元件、有机光电转换元件及有机晶体管元件等有机电子装置的有机薄膜材料而使用。有机半导体材料中的式(a)所示的有机化合物的含有量并无特别限定,但通常在有机半导体材料中为50质量%左右以上100质量%以下。
本发明的有机半导体组合物是将含有式(a)所示的有机化合物所成的有机半导体材料溶解或分散于上述有机溶剂。可使用的有机溶剂可为单一有机溶剂,也可混合多种有机溶剂使用。
有机半导体组合物中的式(a)所示的有机化合物的含量因有机溶剂的种类或所制作有机薄膜的膜厚而异,但相对于有机溶剂通常为0.1至5质量%,较优选为0.3至5质量%,更优选为0.5质量%以上。另外,本发明的有机半导体组合物只要可溶解或分散于上述有机溶剂即可,但较优选为溶解成为均匀溶液。
本发明的有机半导体组合物除了上述式(a)所示的有机化合物及有机溶剂以外,以改善有机晶体管特性及赋予其它特性等目的而可视需要含有其它添加剂。添加剂只要不妨碍作为半导体的功能则无特别限制。例如除了具有其它结构的半导体性材料、绝缘性材料以外,作为一例可举出用以控制流变的表面活性剂、增稠剂、及用以调整载体注入或载体量的掺杂物等。该等只要不阻碍作为组合物的稳定性,则可为高分子或小分子。该等添加剂的含量因其目的而异,故无法一概而论,但较优选为少于式(a)所示有机化合物的含量。
使用含有本发明的式(a)所示的有机化合物的有机半导体材料,而可制作有机薄膜。该有机薄膜的膜厚因其用途而异,但通常为0.1nm至10μm,较优选为0.5nm至3μm,更优选为1nm至1μm。
有机薄膜的形成方法可举出蒸镀法等干式制程或各种溶液制程等,但较优选为以溶液制程形成。溶液制程可举例如旋转涂布法、滴落涂布(drop-casting)法、浸涂法、喷涂法、柔版印刷、树脂凸版印刷等凸版印刷法;平版印刷法、干式平版印刷法、移印(padprint)法等平板印刷法;凹版印刷法等凹版印刷法;网版印刷法、油印印刷法、石印印刷法等孔版印刷法;喷墨印刷法、微触印刷法等,进一步可举出组合多种该等手法的方法。通过溶液制程而成膜时,较优选为将上述有机半导体组合物涂布或印刷后蒸发溶剂而形成有机薄膜。
可使用式(a)所示的有机化合物作为材料,而制作有机半导体装置。作为其一例而详细说明有机晶体管。
有机晶体管具有接于有机半导体的2个电极(源极及漏极),并以施加于称为闸极的另一个电极的电压而控制在电极间所流通的电流。
一般有机晶体管常使用将闸极以绝缘膜绝缘的结构(metal-insuiator-semiconductormis结构)。使用金属氧化膜作为绝缘膜的称为mos结构。其它也有介置有肖特基势垒(schottkybarrier)而形成闸极的结构(即mes结构),但有机晶体管常使用mis结构。
以下通过图1所示有机晶体管的数个形式例更详细说明有机晶体管,但本发明并不限于该等结构。
图1的各形式例的有机晶体管10a至10f中,1表示源极、2表示半导体层、3表示漏极、4表示绝缘体层、5表示闸极、6表示基板。另外,可根据有机晶体管的用途而适宜选择各层及电极的配置。有机晶体管10a至10d、10f是在与基板6并行的方向流通电流,故称为横型晶体管。有机晶体管10a称为底接触-底闸极结构,有机晶体管10b称为顶接触-底闸极结构。另外,有机晶体管10c是在半导体层2上设置源极1及漏极3、绝缘体层4,并进一步在其上形成闸极5,而称为顶接触-顶闸极结构。有机晶体管10d称为顶&底接触-底闸极型晶体管的结构。有机晶体管10f是底接触-顶闸极结构。有机晶体管10e是具有纵型结构的晶体管,即静电感应晶体管(sit)的示意图。该sit是电流流动平面状地扩散,故可一次移动大量的载体8。另外,因源极1与漏极3纵向配置,故可缩小电极间距离而高速回应。因此可较佳地适用于流通大电流、进行高速开关(switching)等用途。另外,图1中的有机晶体管10e中未记载基板,但通常在图1e中的源极1或漏极3的外侧设置基板。
说明各形式例中的各构成要素。
基板6必需保持形成在其上的各层不会剥离。例如可使用树脂板或树脂膜、纸、玻璃、石英、陶瓷等绝缘性材料;在金属或合金等导电性基板上通过涂布等而形成绝缘层的物质;以树脂及无机材料等各种组合所构成的材料等。可使用的树脂膜可举例如聚对苯二甲酸乙二酯、聚萘二甲酸乙二酯、聚醚砜、聚酰胺、聚酰亚胺、聚碳酸酯、纤维素三乙酸酯、聚醚酰亚胺等的膜。若使用树脂膜或纸则可使有机晶体管具有可挠性,可挠且变得轻量,而提升实用性。基板6的厚度通常为1μm至10mm,较优选为5μm至5mm。
源极1、漏极3、闸极5使用具有导电性的材料。例如可使用铂、金、银、铝、铬、钨、钽、镍、钴、铜、铁、铅、锡、钛、铟、钯、钼、镁、钙、钡、锂、钾、钠等金属及含有这些金属的合金;ino2、zno2、sno2、ito等导电性氧化物;聚苯胺、聚吡咯、聚噻吩、聚乙炔、聚对苯撑乙烯、聚二乙炔等导电性高分子化合物;硅、锗、砷化镓等半导体;炭黑、富勒烯、碳纳米管、石墨、石墨烯等。另外,导电性高分子化合物或半导体可进行掺杂。掺杂物可举例如盐酸、硫酸等无机酸;磺酸等具有酸性官能团的有机酸;pf5、asf5、fecl3等路易斯酸;碘等卤素原子;锂、钠、钾等金属原子等。硼、磷、砷等也常用作硅等无机半导体用的掺杂物。
另外,也可使用在上述掺杂物分散有炭黑或金属粒子等导电性复合材料。为了降低接触电阻,直接与半导体接触的源极1及漏极3重要的是选择适当功函数、或是表面处理等。
另外,源极1与漏极3之间的距离(通道长)是决定有机晶体管特性的重要因数,必须为适当的通道长。通道长较短则取出电流量增加,但会因为接触电阻的影响等而产生短通道效果,使得半导体特性降低。该通道长通常为0.01至300μm,较优选为0.1至100μm。源极1与漏极3之间的宽(通道宽)通常为10至5000μm,较优选为40至2000μm。另外,通过使源极1及漏极3的结构成为梳型结构等,而可使该通道宽形成更长的通道宽,并为了必要的电流量或有机晶体管10a至10f的结构等而需形成为适当长度。
说明源极1及漏极3个别的结构(形)。源极1与漏极3的结构可个别相同或相异。
底接触结构的情形,一般较优选使用光刻法而制作源极1及漏极3,又将源极1及漏极3形成长方体。最近通过各种印刷方法而提升印刷精度,使用喷墨印刷、凹版印刷或网版印刷等手法可高精度地制作源极1及漏极3。在半导体层2上具有源极1及漏极3的顶接触结构的情形,可使用阴影遮罩等并通过蒸镀而制作源极1及漏极3。使用喷墨等手法而直接印刷电极图案,由此也可形成源极1及漏极3。源极1及漏极3的长度与前述通道宽相同。源极1及漏极3的宽并无特别规定,但为了减少装置的面积,在可稳定电特性的范围内以短者为优选。源极1及漏极3的宽通常为0.1至1000μm,较优选为0.5至100μm。源极1及漏极3的厚度通常为0.1至1000nm,较优选为1至500nm,更优选为5至200nm。各电极1、3、5中可连结布线,但布线也以与电极1、3、5几乎相同的材料而制作。
绝缘体层4使用具有绝缘性的材料。具有绝缘性的材料例如可使用聚对二甲苯、聚丙烯酸、聚甲基丙烯酸甲酯、聚苯乙烯、聚乙烯苯酚、聚酰胺、聚酰亚胺、聚碳酸酯、聚酯、聚乙烯醇、聚乙酸乙烯酯、聚胺甲酸乙酯、聚砜、聚硅氧烷、氟树脂、环氧树脂、苯酚树脂等聚合物及组合该等的共聚物;氧化硅、氧化铝、氧化钛、氧化钽等金属氧化物;srtio3、batio3等强介电性金属氧化物;氮化硅、氮化铝等氮化物、硫化物、氟化物等介电体;或是分散有该等介电体粒子的聚合物等。为了减少漏电流,该绝缘体层4较优选为使用电绝缘特性高者。由此可使膜厚薄膜化并提高绝缘容量,而增加取出电流。另外,为了提升半导体的移动率,较优选为降低绝缘体层4表面的表面能量,并为无凹凸的平滑的膜。因此有时形成自我组织化单分子膜或2层的绝缘体层。绝缘体层4的膜厚因材料而异,但通常为0.1nm至100μm,较优选为0.5nm至50μm,更优选为1nm至10μm。
有机半导体层的半导体层2的材料,可使用通式(a)所示的有机化合物的至少一种化合物作为有机半导体材料。可使用先前所示的有机薄膜的形成方法而形成含有通式(a)所示的有机化合物的有机薄膜,并作为半导体层2。
半导体层2可形成为多层,但更优选为单层结构。在无损必要功能的范围内,半导体层2的膜厚越薄越好。在有机晶体管10a、10b及10d之类的横型有机晶体管中,只要具有特定以上膜厚,则有机晶体管的特性不依存于膜厚,但膜厚变厚则漏电流常会增加。为了显示必要功能,半导体层2的膜厚通常为1nm至1μm,较优选为5nm至500nm,更优选为10nm至300nm。
在有机晶体管中,例如可视需要在基板6与绝缘体层4之间、绝缘体层4与半导体层2之间、或是有机晶体管的外表面设置其它层。例如若在半导体层2上直接形成保护层或隔着其它层而形成保护层,则可减少湿度等外气的影响。另外,也有可提升有机晶体管的开/关比等可稳定电特性的优点。
上述保护层的材料并无特别限定,但较优选为使用例如以环氧树脂、聚甲基丙烯酸甲酯等丙烯酸系树脂、聚胺甲酸乙酯、聚酰亚胺、聚乙烯醇、氟树脂、聚烯烃等各种树脂所构成的膜;氧化硅、氧化铝、氮化硅等无机氧化膜;及以氮化膜等介电体所构成的膜,尤其较优选为氧、水分透过率及吸水率低的树脂(聚合物)。也可使用有机el显示器用而开发的气体屏蔽性保护材料。保护层的膜厚因应其目的而可选择任意膜厚,但通常为100nm至1mm。
另外,通过在积层有半导体层2的基板6或绝缘体层4预先进行表面改性或表面处理,而可提升有机晶体管的特性。例如通过调整基板6表面的亲水性/疏水性程度,而可改良成膜于其上的膜的膜质或成膜性。尤其,有机半导体材料会因为分子配向等膜的状态而大幅改变其特性。因此,通过对基板6、绝缘体层4等进行表面处理,而可控制与其后成膜的半导体层2的界面部分的分子配向,或是通过降低基板6或绝缘体层4上的捕集部位,而可改良载体移动率等的特性。
捕集部位是指未处理的基板6所存在的例如羟基之类的官能团,若存在如此官能团,则电子会被该官能团吸引,结果会降低载体移动率。因此,降低捕集部位对于改良载体移动率等的特性通常为有效的。
上述之类的用以改良特性的表面处理,可举例如以六甲基二硅氮烷、辛基三氯硅烷、十八烷基三氯硅烷等自组织化单分子膜处理;以聚合物等表面处理;以盐酸、硫酸、乙酸等酸处理;氢氧化钠、氢氧化钾、氢氧化钙、氨等碱处理;臭氧处理;氟化处理;氧或氩等的等离子处理;朗谬尔-布洛杰特(langmuir-blodgett,lb)膜的形成处理;其它绝缘体或半导体薄膜的形成处理;机械性处理;电晕放电等电处理;利用纤维等的摩擦处理等,也可进行组合这些处理。
这些形式中,例如设置基板6、绝缘体层4、半导体层2等各层的方法,可适宜采用前述真空制程、溶液制程。
接着,以下以图1(b)所示顶接触-底闸极型有机晶体管10b为例,根据图2说明本发明的有机晶体管装置的制造方法。该制造方法同样可适用于前述其它形式的有机晶体管等。
(有机晶体管的基板6及基板处理)
本发明的有机晶体管通过在基板6上设置必要的各种层及电极而制作(参照图2(a))。基板6可使用上述说明。也可在该基板6上进行前述表面处理等。在不妨碍必要功能的范围内,基板6的厚度以薄者为优选。基板6的厚度因材料而异,但通常为1μm至10mm,较优选为5μm至5mm。另外,视需要也可使基板具有电极的功能。
(闸极5的形成)
在基板6上形成闸极5(参照图2(b))。闸极5的材料可使用上述说明者。闸极5的成膜方法可使用各种方法,例如可采用真空蒸镀法、溅镀法、涂布法、热转印法、印刷法、溶胶凝胶法等。较优选为在成膜时或成膜后视需要进行图案化而成为所求形状。图案化的方法可使用各种方法,但可举例如组合光阻的图案化与蚀刻的光刻法等。另外,可利用使用阴影遮罩的蒸镀法;溅镀法;喷墨印刷、网版印刷、平版印刷、凸版印刷等的印刷法;微触印刷法等的软光刻术的手法;及组合复数种该等手法的手法而图案化。闸极5的膜厚因材料而异,但通常为0.1nm至10μm,较优选为0.5nm至5μm,更优选为1nm至3μm。另外,兼作为闸极5与基板6时,可增加上述膜厚。
(绝缘体层4的形成)
在闸极5上形成绝缘体层4(参照图2(c))。构成绝缘体层4的绝缘体材料使用上述说明的材料。形成绝缘体层4时可使用各种方法。可举例如旋转涂布、喷涂涂布、滴涂布、浇铸、棒涂布、刮刀涂布等涂布法;网版印刷、平版印刷、喷墨等印刷法;真空蒸镀法、分子束磊晶成长法、离子簇束法、离子镀法、溅镀法、大气压电浆法、cvd法等干式制程法。此外,可采用通过溶胶凝胶法;或铝上的氧化铝膜、硅上的氧化硅之类的金属上热氧化法等而形成氧化物膜的方法等。另外,在绝缘体层4与半导体层2相接的部分中,为了使两层2及4的界面中的构成半导体的分子,例如通式(a)所示的化合物的分子良好地配向,也可在绝缘体层4进行特定的表面处理。表面处理的手法可使用与基板6的表面处理相同者。因通过提升其电容而可增加取出的电量,故绝缘体层4的膜厚较优选为尽可能地薄的膜。此时,若形成薄的膜,则会增加漏电流,故在不损及其功能的范围内,以薄者为优选。绝缘体层4的膜厚通常为0.1nm至100μm,较优选为0.5nm至50μm,更优选为5nm至10μm。
(半导体层2的形成)
含有本发明的通式(a)所示的有机化合物的有机半导体材料,使用于半导体层2的形成(参照图2(d))。半导体层2的成膜可使用各种方法。具体而言可举出以浸涂法、模具涂布法、辊涂布法、棒涂布法、旋转涂布法等涂布法;喷墨法、网版印刷法、平版印刷法、微触印刷法等溶液制程的形成方法。
说明通过溶液制程成膜而获得半导体层2的方法。将本发明的通式(a)所示的有机化合物溶解于溶剂等,进一步视需要添加添加剂等,将所得组合物涂布于基板(绝缘体层4、源极1及漏极3的露出部)。涂布的方法可举出旋转涂布法、滴落涂布法、浸涂法、喷涂法、柔版印刷、树脂凸版印刷等凸版印刷法;平版印刷法、干式平版印刷法、移印法等平板印刷法;凹版印刷法等凹版印刷法;丝网印刷法、油印印刷法、石印印刷法等孔版印刷法;喷墨印刷法、微触印刷法等,进一步可举出组合多种这些手法的方法。
另外,作为类似涂布方法的方法,也可采用通过在水面上滴入上述组合物而制作有机半导体层的单分子膜,将该单分子膜移至基板并积层的lb法;以及将液晶或熔液状态的材料以2片基板夹住并以毛细管现象导入基板间的方法等。
制膜时,基板及组合物的温度等环境也为重要,有时会因基板及组合物的温度而改变有机晶体管的特性,故较优选为慎重选择基板及组合物的温度。基板温度通常为0至200℃,较优选为10至120℃,更优选为15至100℃。因非常依存于所使用组合物中的溶剂等,故必须谨慎小心。
在无损功能的范围内,通过该方法所制作的半导体层2的膜厚以薄者为优选。若半导体层2的膜厚变厚,则有漏电流变大的担忧。半导体层2的膜厚通常为1nm至1μm,较优选为5nm至500nm,更优选为10nm至300nm。
如此形成的半导体层2(参照图2(d))可通过后处理而进一步改良特性。例如通过热处理而可缓和成膜时所产生的膜中的应变、降低针孔等、及控制膜中的配列或配向,因该等理由而可谋求有机半导体特性的改善及稳定。制作本发明的有机晶体管时,为了提升特性,进行该热处理为有效。该热处理通过在形成半导体层2后加热基板而进行。热处理的温度并无特别限制,通常为室温至150℃左右,较优选为40至120℃,更优选为45至100℃。此时,热处理时间并无特别限制,但通常为10秒至24小时,较优选为30秒至3小时。此时,环境可为大气中、或氮、氩等非活性环境下。此外可通过溶剂蒸气而控制膜形状等。
另外,作为其它半导体层2的后处理方法,也可使用氧、氢等氧化性或还原性气体、氧化性或还原性液体等而处理,由此引发通过氧化或还原所造成的特性变化。例如可以增加或减少膜中的载体密度为目的而利用该方法。
另外,在称为掺杂的手法中,通过在半导体层2加入微量的元素、原子团、分子、高分子,可改变半导体层2的特性。例如可掺杂氧、氢、盐酸、硫酸、磺酸等酸;pf5、asf5、fecl3等路易斯酸;碘等卤素原子;钠、钾等金属原子;四硫富烯(ttf)、酞青素等供体化合物。这可通过使半导体层2接触该等气体、浸渍于溶液、或进行电化学的掺杂处理而达成。该等掺杂即使不是在制作半导体层2后进行,也可在合成有机化合物时添加、在使用有机半导体组合物而制作半导体层2的制程中在该有机半导体组合物中添加、或在形成半导体层2的步骤阶段等进行添加。另外,可在蒸镀时形成半导体层2的材料中添加掺杂所使用的材料,而进行共蒸镀;也可在制作半导体层2时混合于周围环境(在存在有掺杂材料的环境下制作半导体层2);另外,可将离子在真空中加速并碰撞膜而掺杂。
该等掺杂的效果可举出通过增加或减少载体密度而改变导电度、改变载体的极性(p型、n型)、改变费米能阶等。
(源极及漏极的形成)
源极1及漏极3的形成方法等可根据闸极5的情形而形成(参照图2(e))。另外,为了降低与半导体层2的接触电阻,而可使用各种添加剂等。
(保护层7)
若在半导体层2上形成保护层7,则可将外气影响降到最小,另外,有可稳定有机晶体管的电特性的优点(参照图2(f))。保护层7的材料使用前述者。保护层7的膜厚可根据其目的而采用任意膜厚,但通常为100nm至1mm。
将保护层7成膜时可采用各种方法,但保护层7为以树脂所构成时,例如可举出在涂布树脂溶液后干燥而形成树脂膜的方法;及将树脂单体涂布或蒸镀后进行聚合的方法等。成膜后可进行交联处理。保护层7为以无机物所构成时,也可使用例如以溅镀法、蒸镀法等真空制程的形成方法;或以溶胶凝胶法等溶液制程的形成方法。
有机晶体管中,除了在半导体层2上之外,也可在各层间视需要设置保护层7。该等层对有机晶体管的电特性会有稳定的作用。
由于将上述式(a)所示的有机化合物作为有机半导体材料使用,故可在较低温的制程制造有机晶体管。因此,在暴露于高温的条件下无法使用的塑料板、塑料膜等可挠性材质也可作为基板6使用。其结果可制造轻量、柔软性优异且不容易损坏的有机晶体管,可作为显示器的主动矩阵的开关装置等使用。
有机晶体管也可利用作为存储电路装置、信号驱动器电路装置、信号处理电路装置等数码装置或类比装置。另外,通过组合该等而可制作显示器、ic卡或ic标签等。另外,有机晶体管可通过化学物质等外部刺激而改变其特性,故也可作为感应器使用。
(实施例)
以下通过实施例详细说明本发明,但本发明并不限定于该等实施例。
以下操作中,非活性气体下的反应及测定使用无水蒸馏溶剂,其它反应及操作中使用市售一级或特级溶剂。另外,试剂视需要以无水蒸馏等精制,其它使用市售一级或特级试剂。以下表示所使用的分析机器及测定机器。核磁共振光谱的测定使用lambda-nmr(395.75mhz,σ值,ppm,内标准tms)进行。示差扫描量热测定使用示差扫描量热装置mettler-toleddsc1进行。
以下表示合成式(a)所示的有机化合物的实施例。
具体而言,在实施例1至3中以下述合成路线合成式(a)所示的有机化合物。
实施例1(上述具体例的no.3所示的本发明的有机化合物的合成)
在氮气环境下,在300ml烧瓶中加入2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩5.2g(10.7mmol)、五氧化二磷1.5g及三氟甲烷磺酸150ml,在室温下搅拌6小时。将反应液注入冰水并滤取所析出的固体。在300ml烧瓶中加入所滤取的固体及吡啶150ml,在回流下反应3小时。反应结束后放冷至室温,滤取所析出的固体,由此获得黄色固体的3.1g本发明的有机化合物1。该有机化合物1的产率为65%。
有机化合物1的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.89(t,3h)、1.24-1.42(m、6h)、1.71(quin、2h)、2.81(t,2h)、7.36-7.41(m、2h)、7.50(t、2h)、7.66(dd、1h)、7.71-7.73(m、2h)、7.78(s、1h)、7.85(d、1h)7.99(d、1h)、8.06(d、1h)、8.30(s、1h)、8.35(s、1h)
实施例2(上述具体例的no.10所示的本发明的有机化合物的合成)
除了使用2-(2-甲基亚磺酰基-5-己基-1-苯基)-6-苯基萘并[2,3-b]噻吩以代替2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩以外,进行与实施例1相同的处理,由此获得2.1g本发明的有机化合物2。该有机化合物2的产率为43%。
有机化合物2的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.91(t,3h)、1.32-1.42(m、6h)、1.73(quin、4h)、2.80(t,4h)、7.28(dd、1h)、7.39-7.44(m、1h)、7.50-7.55(m、2h)、7.70(d、1h)、7.62-7.81(m、3h)、7.85(d、1h)、8.00(d、1h)、8.22(d、1h)、8.39(s、1h)、8.41(s、1h)
实施例3(上述具体例的no.19所示的本发明的有机化合物的合成)
除了使用2-[2-甲基亚磺酰基-5-(2-苯并[2,3-b]噻吩基)-1-苯基]-6-己基萘并[2,3-b]噻吩以代替2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩以外,进行与实施例1相同的处理,由此获得3.1g本发明的有机化合物3。该有机化合物3的产率为58%。
有机化合物3的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.90(t,3h)、1.24-1.42(m、6h)、1.72(quin、2h)、2.83(t,2h)、7.34-7.41(m、3h)、7.69(s、1h)、7.78-7.89(m、5h)、7.98(d、2h)、8.19(d、1h)、8.31(s、1h)、8.38(s、1h)
实施例4(上述具体例的no.9所示的本发明的有机化合物的合成)
除了使用2-[5-(1-丁基)-2-甲基亚磺酰基-1-苯基]-6-苯基萘并[2,3-b]噻吩以代替2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩以外,进行与实施例1相同的处理,由此获得1.2g本发明的有机化合物4。该有机化合物4的产率为41%。
有机化合物4的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.98(t,3h)、1.38-1.48(m、2h)、1.68-1.76(m、2h)、2.80(t,2h)、7.29(dd、1h)、7.41(t、1h)、7.50-7.54(m、2h)、7.71(s、1h)、7.77-7.79(m、2h)、7.80(dd、1h)、7.85(d、1h)、8.01(d、1h)、8.22(s、1h)、8.40(s、1h)、8.41(s、1h)
实施例5(上述具体例的no.11所示的本发明的有机化合物的合成)
除了使用2-[2-甲基亚磺酰基-5-(1-辛基)-1-苯基]-6-苯基萘并[2,3-b]噻吩以代替2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩以外,进行与实施例1相同的处理,由此获得1.1g本发明的有机化合物5。该有机化合物5的产率为28%。
有机化合物5的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.89(t,3h)、1.28-1.44(m、10h)、1.69-1.77(m、2h)、2.80(t,2h)、7.29(dd、1h)、7.39-7.43(m、1h)、7.50-7.54(m、2h)、7.70(s、1h)、7.77-7.81(m、3h)、7.85(d、1h)、8.01(d、1h)、8.22(s、1h)、8.40(s、1h)、8.41(s、1h)
实施例6(上述具体例的no.5所示的本发明的有机化合物的合成)
除了使用2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-癸基萘并[2,3-b]噻吩以代替2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩以外,进行与实施例1相同的处理,由此获得2.5g本发明的有机化合物6。该有机化合物6的产率为35%。
有机化合物6的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.87(t,3h)、1.26-1.42(m、14h)、1.69-1.77(m、2h)、2.81(t,2h)、7.35-7.41(m、2h)、7.48-7.52(m、2h)、7.66(dd、1h)、7.70-7.72(m、2h)、7.77(s、1h)、7.84(d、1h)、8.00(d、1h)、8.06(s、1h)、8.29(s、1h)、8.35(s、1h)
实施例7(上述具体例的no.27所示的本发明的有机化合物的合成)
除了使用6-己基-2-[5-(4-甲基苯基)-2-甲基亚磺酰基-1-苯基]萘并[2,3-b]噻吩以代替2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩以外,进行与实施例1相同的处理,由此获得1.2g本发明的有机化合物7。该有机化合物7的产率为12%。
有机化合物7的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.89(t,3h)、1.24-1.40(m、6h)、1.69-1.77(m、2h)、2.43(s,3h)、2.81(t,2h)、7.30(d、2h)、7.36(dd、1h)、7.61(d、2h)、7.64(dd、1h)、7.77(s、1h)、7.84(d、1h)、7.97(d、1h)、8.04(d、1h)、8.29(s、1h)、8.34(s、1h)
实施例8(上述具体例的no.29所示的本发明的有机化合物的合成)
除了使用2-[5-(4-乙基苯基)-2-甲基亚磺酰基-1-苯基]-6-己基萘并[2,3-b]噻吩以代替2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩以外,进行与实施例1相同的处理,由此获得1.6g本发明的有机化合物8。该有机化合物8的产率为14%。
有机化合物8的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.88(t,3h)、1.29-1.42(m、9h)、1.68-1.77(m、2h)、2.72(q,2h)、2.81(t,2h)、7.32-7.34(m、2h)、7.37(dd、1h)、7.62-7.67(m、3h)、7.77(s、1h)、7.84(d、1h)、7.97(d、1h)、8.05(d、1h)、8.29(s、1h)、8.35(s、1h)
实施例9(上述具体例的no.34所示的本发明的有机化合物的合成)
除了使用2-[2-甲基亚磺酰基-5-(4-戊基苯基)-1-苯基]-6-苯基萘并[2,3-b]噻吩以代替2-(2-甲基亚磺酰基-5-苯基-1-苯基)-6-己基萘并[2,3-b]噻吩以外,进行与实施例1相同的处理,由此获得0.8g本发明的有机化合物9。该有机化合物9的产率为28%。
有机化合物9的核磁共振光谱的测定结果如下。
1h-nmr(400mhz,cdcl3)δ0.93(t,3h)、1.36-1.41(m、4h)、1.65-1.73(m、2h)、2.69(t,2h)、7.32(d、2h)、7.40-7.43(m、1h)、7.51-7.55、(m、2h)、7.65(d、2h)、7.68(dd、1h)、7.77-7.83(m、3h)、8.00(d、1h)、8.02(d、1h)、8.08(d、1h)、8.24(d、1h)、8.43(s、2h)
比较例1至3
将使用下述no.35所示化合物作为比较例1的有机化合物(与专利文献4所记载化合物类似的化合物),将使用下述no.36所示化合物作为比较例2的有机化合物(例示化合物1的取代位置相异的化合物),将使用下述no.37所示化合物作为比较例3的有机化合物(非专利文献4所记载的化合物)。
实施例10(示差扫描量热测定)
用以下方法对实施例1至6及8、9所得的有机化合物1至6及8、9、比较例1至3的有机化合物进行示差扫描量热测定。
称取有机化合物的粉末约2mg并封入铝锅中。将该等安装于示差扫描量热测定装置并加热至550℃。通过观测此时的吸热峰而观测转移点(峰顶温度;表示相转移的波峰)。结果示于表1。
表1
4个芳香环缩环的比较例3的有机化合物(与专利文献4所记载化合物类似的化合物)在150℃以下具有吸热峰(表示相转移的波峰)系,难谓具有充分耐热性,但5个芳香环化合物缩环的本发明的实施例1至6及8、9所得的有机化合物1至6及8、9的吸热峰在150℃以上(更详细而言,吸热峰较比较例3的有机化合物高40℃以上)均具有吸热峰,可知具有高耐热性。
实施例11(溶解度的测定)
用以下方法对实施例1至6及8所得的有机化合物1至6及8、比较例1至3的有机化合物进行溶解度的测定。
于小瓶(vial)称取有机化合物的粉末约1mg并正确计测重量。接着在25℃(室温)加入氯仿、甲苯、四氢萘,在完全溶解的时间点再次正确测定质量。将有机化合物的质量除以有机化合物加溶剂的合计质量再乘以100,作为溶解度。另外,溶解、不溶的判断通过目测确认。结果示于表2。
表2
由表2可知,相较于比较例2的有机化合物,本发明的实施例1所得的有机化合物1虽然仅有btnt骨架上的取代基的取代位置不同,但在25℃下有机溶剂中的溶解度最多高出10倍以上。另外,一般倾向为增加烷基链数时则在有机溶剂中的溶解度会提升、导入苯基时则在有机溶剂的溶解度会降低,但令人惊讶的是,相较于具有2条烷基链的比较例1的有机化合物而言,具有1条烷链、1个苯基的有机化合物1反而具有高溶解性。另外,由表2可知,相较于btnt骨架上的取代基的取代位置不同的比较例2的有机化合物,本发明的实施例2至6及8所得的有机化合物2至6及8在25℃下有机溶剂中的溶解度明显较高。由以上可知,本发明的有机化合物中,对于btnt骨架的取代基导入位置可非常有效地提升溶解度。
另外,由表2可知,相较于btnt骨架上的取代基的取代位置不同的比较例2的有机化合物,本发明的实施例1至6及8所得的有机化合物1至6及8的溶液保存稳定性较高。
实施例6(有机晶体管的特性评价)
使用实施例1、2、5及6所得的有机化合物1、2、5及6、比较例1及2的有机化合物制作有机晶体管,并评价晶体管特性。
使用实施例11所得的有机化合物1、2、5及6的溶液,在附有sio2热氧化膜的n掺杂硅晶片上,在25℃以旋转涂布法制作有机薄膜。接着在有机薄膜上使用阴影遮罩并真空蒸镀au,由此制作源极及漏极。所制作的有机晶体管中,设定通道长为50μm、通道宽为2.5mm。如此制作的有机晶体管为顶接触-底闸极结构,图1(b)表示其结构。另外,本实施例的有机晶体管中,附有sio2热氧化膜的n掺杂硅晶片中的sio2热氧化膜具有绝缘体层(4)的功能,n掺杂硅晶片兼具基板(6)及闸极(5)的功能。
有机晶体管的性能,是依存于在对闸极施加电位的状态下对源极与漏极之间施加电位时所流动的电流量。通过测定该电流值而可决定有机晶体管的特性的移动率。对作为绝缘体层的sio2热氧化膜施加闸极电场,结果在有机半导体层中产生载体种类的电特性,由表现该电特性的式(a)可算出移动率。
id=zμci(vg-vt)2/2l…(a)
在此,id为饱和源/漏电流值、z为通道宽、ci为绝缘体的电容、vg为闸极电位、vt为临界电位、l为通道长、μ为决定的移动率(cm2/vs)。ci由所使用的sio2绝缘膜的介电率而决定,z、l由有机晶体管的装置结构而决定,id、vg为测定有机晶体管的电流值时所决定,vt可由id、vg而求取。在式(a)代入各值,由此可算出各个闸极电位下的移动率。
将以上述方式制作的有机晶体管扫描至漏极电压-30v、闸极电压+20v至-80v,将表示此时漏极电流变化的转移曲线示于图3。另外,将由式(a)所算出的有机晶体管的空穴移动率、临界电压、开电流与关电流的比(“开/关比”)示于表3。
表3
由表3可知,与比较例2的有机化合物不同的是,本发明的实施例1、2、5及6所得的有机化合物1、2、5及6可适用于溶液制程,相较于在btnt骨架上导入2个烷基的比较例1的有机化合物,使用溶液制程所制作的有机晶体管显示50至250倍的移动率,并具有高移动率及大的开/关比。
由以上可知,相较于4个芳香环缩合的有机化合物,本发明的有机化合物群的耐热性优异,相较于btnt骨架上的取代基的取代位置不同的有机化合物,本发明的有机化合物群在室温下在有机溶剂中的溶解性及溶液的保存稳定性优异,相对于在btnt骨架上导入2个烷基的有机化合物,本发明的有机化合物群可赋予有机晶体管高移动率及大的开/关比的优异的有机半导体材料。
工业实用性
如以上所述,本发明可提升有机化合物(缩合多环芳香族化合物)及有机半导体材料在室温下在有机溶剂中的溶解性、溶液的保存稳定性、耐热性及空穴移动率,故可利用溶液制程,且可提供高耐热的有机化合物(缩合多环芳香族化合物)及有机半导体材料。因此,本发明可利用于有机晶体管装置、二极管、电容器、薄膜光电转换装置、色素增敏太阳能电池、有机el装置等领域。
附图符号的说明
图1及图2中,名称相同则赋予相同符号。
1源极
2半导体层
3漏极
4绝缘体层
5闸极
6基板
7保护层
10a至10f有机晶体管。
本发明在不超出其精神或主要特征的范围内可以其它各种方式实施。因此,在各方面而言,上述实施例仅为例示,不应限定解释。本发明的范围示于权利要求书,而不受说明书本文的任何拘束。另外,属于权利要求书的均等范围的变形或变更皆包括于本发明的范围内。
另外,本申请根据2015年3月23日于日本申请的专利申请日本特愿2015-59624而主张优先权。本说明书所引用的所有刊物、专利及专利申请(包括上述日本专利申请)的内容直接引用而并入本说明书。
- 还没有人留言评论。精彩留言会获得点赞!