培养和/或使造血干细胞分化为祖细胞的方法及其用途与流程
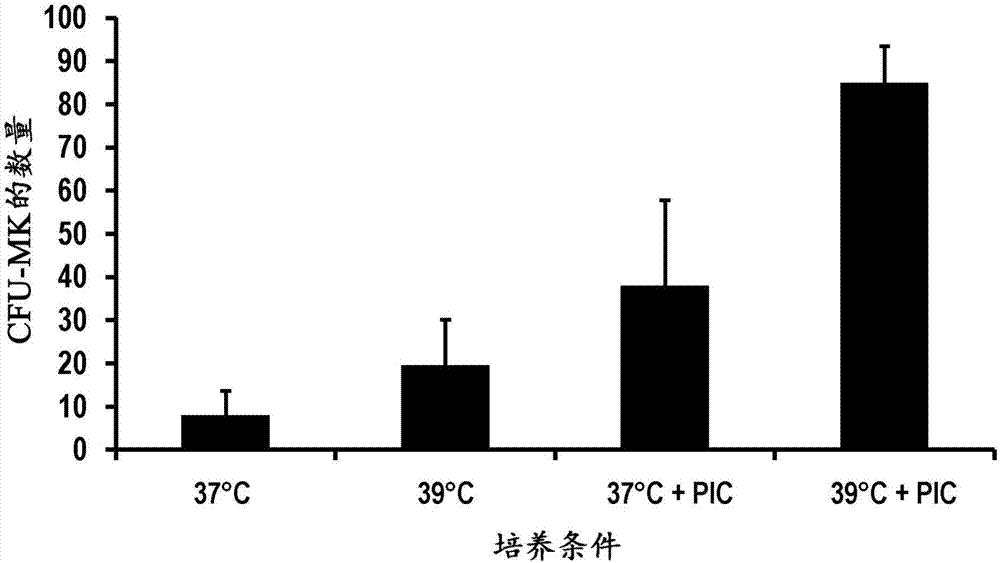
本说明书涉及造血干细胞。更具体地,本说明书涉及在轻度高温(例如,在38℃与40℃之间)和在造血干细胞扩增的嘧啶并吲哚衍生物激动剂存在下培养造血干细胞。发明背景造血干细胞(hsc)来源于中胚层,并负责产生见于血液中的所有细胞组分,无论是髓系还是淋巴系。hsc分化为共同髓样祖细胞(cmp)和共同淋巴样祖细胞(clp)。cmp产生红系、粒细胞系、单核细胞系、巨核细胞系和树突系细胞,而clp衍生t和b淋巴细胞、浆细胞、自然杀伤细胞和淋巴样树突细胞。髓系细胞的终末分化最终导致产生和更新红细胞、粒细胞、单核细胞、髓源树突细胞和血小板。此外,hsc(原始或长期)具有自我更新能力,因此确保为个体整个生命期充足地供应祖细胞和终末分化的血细胞。这些细胞自我更新的能力导致了医学领域的重大进展,即hsc移植作为患有血液学癌症或骨髓衰竭的患者的治疗模式。历史上,骨髓是hsc的主要来源,且至今仍是骨髓更换的重要细胞来源。从那以后,来自g-csf动员捐赠者的脐带血和外周血也用作hsc来源。与其在临床中的使用并行,hsc已经成为目的在于在实验室中体外培养、扩增、分化为各种谱系的细胞和产生血液组分的紧张研究工作的主题。这种研究发现了几种谱系特异性细胞因子,现在常用于各种培养方法中,允许优先地使造血干细胞朝特定谱系生长和/或分化。此外,已发现,在发热样轻度高温(39℃而非37℃标准温度)下,在巨核细胞诱导细胞因子混合物存在下培养hsc导致朝巨核细胞系加速扩增和分化(proulx等人,2004)。最近,因为能够扩增长期造血干细胞的能力而鉴别了一类嘧啶并吲哚化合物(fares等人,2014)。尽管有了这些进展,体外扩增hsc和优先地朝特定髓系分化还有许多缺点。例如,还是很难体外扩增hsc,同时维持原始表型和受控分化。细胞有效地扩增和维持得到特定谱系也还是一个挑战。例如,以现今的技术水平,实现体外产生血液组分所需的扩增水平仍是不足的。此外,当前的培养方法通常产生异质细胞群体,不适合特定临床适应症的医学应用。特定干细胞和祖细胞群体的体外产生将需要实质性改进方能在临床中使用它们。因此,需要能够大规模体外扩增,同时允许控制造血干细胞和祖细胞分化为用于临床使用的均质细胞群体的方向和程度以及大规模产生的方法和技术。本说明书引用了许多文献,所述文献的内容以引用的方式整体并入本文。发明概述本说明书缘起于出乎意料地发现可以在轻度高温(例如,在38℃与40℃之间)和在造血干细胞扩增的嘧啶并吲哚衍生物激动剂存在下有利地培养造血干细胞(hsc)。组合使用轻度高温和嘧啶并吲哚衍生物在本文示出协同地起作用,以促进cd34+hsc(包括长期hsc)扩增和/或分化为“谱系待发(lineage-primed)”或祖细胞,和/或维持(例如,髓样祖细胞、巨核细胞祖细胞)。实际上,在一些实施方案中,当使用有利于造血干细胞自我更新的培养基时,示出轻度高温和造血干细胞扩增的嘧啶并吲哚衍生物激动剂的组合使hsc(cd34+细胞)呈指数级扩增。不受理论的约束,本文公开的结果表明,轻度高温结合使用嘧啶并吲哚化合物保留嘧啶并吲哚化合物的抗分化效果,同时加强轻度高温孵育温度的刺激效果。在其他实施方案中,当使用有利于朝巨核细胞系分化的培养条件时,还示出了轻度高温与造血干细胞扩增的嘧啶并吲哚衍生物激动剂的组合指数级地增加hsc分化为祖细胞(例如,髓样祖细胞、巨核细胞祖细胞)。不受理论的约束,本文公开的结果表明,嘧啶并吲哚化合物在成熟巨核细胞阶段之前阻断hsc的高温诱导的分化,和/或优先扩增和维持巨核细胞祖细胞。因此,在一些实施方案中,可以移除嘧啶并吲哚化合物,且细胞可以在轻度高温条件下进一步繁殖,从而产生更同步的细胞群体。因此,本说明书可以涉及以下方面:1.一种用于培养造血干细胞的体外方法,所述方法包括:(a)在含造血干细胞扩增的嘧啶并吲哚衍生物激动剂的细胞培养基中繁殖所述造血干细胞;和(b)在38℃与40℃之间的孵育温度下孵育所述造血干细胞。2.方面1的方法,其中所述造血干细胞是cd34+造血干细胞。3.方面1或2的方法,其中所述造血干细胞来自:(a)脐带血;(b)骨髓;(c)外周血;(d)诱导多能干细胞;(e)胚胎干细胞;(f)从非造血起源的分化细胞转分化;(g)经基因修饰的造血干细胞;(h)永生化造血干细胞;(i)其他多能或多潜能细胞来源;或(j)其任何组合。4.方面3的方法,其中所述造血干细胞来自动员外周血细胞。5.方面3的方法,其中所述造血干细胞来自非动员外周血细胞。6.方面4或5的方法,其中所述造血干细胞来自去白细胞(leukoreduction)、减白细胞(deleukocytation)和/或其他外周血血液纯化或加工后的残余细胞。7.方面1至6中任一项的方法,其中在含造血干细胞扩增的嘧啶并吲哚衍生物激动剂的细胞培养基中,和/或在38℃与40℃之间的孵育温度下,孵育所述造血干细胞至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天。8.方面1至7中任一项的方法,其中所述孵育温度是39℃。9.方面1至8中任一项的方法,其中所述造血干细胞扩增的嘧啶并吲哚衍生物激动剂是:(a)嘧啶并[4,5-b]吲哚衍生物;(b)(1r,4r)-n1-(2-苄基-7-(2-甲基-2h-四唑-5-基)-9h-嘧啶并[4,5-b]吲哚-4-基)环己烷-1,4-二胺;(c)4-(3-(哌啶-1-基)丙基氨基)-9h-嘧啶并[4,5-b]吲哚-7-甲酸甲酯;(d)4-(3-(哌啶-1-基)丙基氨基)-9h-嘧啶并[4,5-b]吲哚-7-甲酸甲酯盐酸盐;(e)(a)至(d)中任一个的药学上可接受的盐、溶剂化物、前药或立体异构体;或(f)(a)至(e)的任何组合。10.方面1至9中任一项的方法,其中所述细胞培养基包含干细胞因子(scf);促血小板生成素(tpo);或scf和tpo两者。11.方面1至9中任一项的方法,其中所述方法是用于扩增造血干细胞,且其中所述细胞培养基是造血干细胞培养基。12.方面11的方法,其中所述造血干细胞培养基包含:人类fms样酪氨酸激酶3配体(flt3);干细胞因子(scf);促血小板生成素(tpo);低密度脂蛋白(ldl);或其任何组合。13.方面1至9中任一项的方法,其中所述方法是用于培养造血干细胞以产生巨核细胞祖细胞,且其中所述细胞培养基是促进造血干细胞朝巨核细胞系分化的培养基。14.方面13的方法,其中所述促进造血干细胞朝巨核细胞系分化的培养基包含:干细胞因子(scf);促血小板生成素(tpo);人类fms样酪氨酸激酶3配体(flt3);il-6;il-9;或其任何组合。15.方面1至9中任一项的方法,其中所述方法是用于培养造血干细胞以产生髓样祖细胞,且其中所述细胞培养基是促进造血干细胞朝髓样祖细胞系分化的培养基。16.方面1至15中任一项的方法,其进一步包括:(c)移除所述造血干细胞扩增的嘧啶并吲哚衍生物激动剂,并继续在38℃与40℃之间的孵育温度下或在约37℃的孵育温度下繁殖所述细胞,从而使所述细胞同步。17.一种体外扩增的细胞群体,其是:(a)通过方面11或12的方法产生的扩增的造血干细胞群体;(b)巨核细胞祖细胞群体:(i)通过方面13或14的方法产生的;和/或(ii)包含至少40%、45%、50%、55%、60%、65%、70%、75%或80%的cd34+/cd41+细胞;(c)通过方面15的方法产生的髓样祖细胞群体;(d)通过方面16的方法产生的同步细胞群体;或(e)(a)至(d)的任何组合。18.方面17的体外扩增的细胞群体,用于在受试者移植中使用。19.方面17的体外扩增的细胞群体,其中:(a)所述扩增的造血干细胞群体是用于在造血干细胞移植中使用,或用于制造用于相同目的的治疗组合物;(b)所述巨核细胞祖细胞群体是用于在治疗血小板减少症中使用,或用于制造用于相同目的的治疗组合物;或(c)所述髓样祖细胞群体是用于在髓样祖细胞移植中使用,或用于制造用于相同目的的治疗组合物。20.以下的用途:(a)方面17的扩增的造血干细胞群体用于造血干细胞移植;(b)方面17的巨核细胞祖细胞群体用于治疗血小板减少症;或(c)方面17的髓样祖细胞群体用于髓样祖细胞移植。21.一种药物组合物,其包含:(a)方面17的扩增的造血干细胞群体;(b)方面17的巨核细胞祖细胞群体;或(c)方面17的髓样祖细胞群体。一般定义提供标题和其他标识符(例如,(a)、(b)、(i)、(ii)等)只是为了便于阅读说明书和权利要求书。说明书或权利要求中的标题或其他标识符的使用不一定要求该步骤或元素按字母或数字顺序或它们提供的顺序进行。在权利要求书和/或说明书中,当与术语“包含(comprising)”连用时,词语“一个/一种(a或an)”的使用可以指“一个/一种(one)”,但也与“一个/一种或多个/多种(oneormore)”、“至少一个/一种(atleastone)”和“一个/一种或超过一个/一种(oneormorethanone)”的意思一致。使用术语“约”指某一数值包括用于测定该数值的装置或方法的误差的标准偏差。一般来说,术语“约”意指至多10%的可能变动。因此,某一数值的1%、2%、3%、4%、5%、6%、7%、8%、9%和10%的变动被包括在术语“约”之内。除非另外指明,否则当在某一范围之前使用术语“约”适用于该范围的两端。如本说明书和权利要求书中所用,词语“包含(comprising)”(和包含的任何形式,诸如“包含(comprise)”和“包含(comprises)”)、“具有(having)”(和具有的任何形式,诸如“具有(have)”和“具有(has)”)、“包括(including)”(和包括的任何形式,诸如“包括(includes)”和“包括(include)”)或“含有(containing)”(和含有的任何形式,诸如“含有(contains)”和“含有(contain)”)是包容性的或是开放性的,且不排除额外、未列举的元素或方法步骤。本说明书的其他目的、优点和特征将在阅读其具体实施方案的以下非限制性描述后变得更加明显,所述具体实施方案仅以举例方式参照附图而给出。附图简述在附图中:图1示出cd34+/cd41+巨核细胞祖细胞随cd34+细胞在促进朝巨核细胞系分化的条件下培养的时间变化的倍数扩增。测试了四种条件:(1)“37℃”:在标准温度下,不存在造血干细胞扩增的嘧啶并吲哚衍生物激动剂(pic);(2)“37℃+pic”:在标准温度下,存在35nmpic;(3)“39℃”:在轻度高温下,不存在pic;或(4)“39℃+pic”:在轻度高温下,存在35nmpic。图2示出图1中在四种测试培养条件下产生的巨核细胞菌落形成单位(cfu-mk)的数量,如通过标准cfu-mk分析测定。图3(a)示出cd34+造血干细胞随cd34+细胞在促进造血干细胞扩增同时限制分化的条件下培养的时间变化的倍数扩增。测试了四种条件:(1)“37℃”:在标准温度下,不存在造血干细胞扩增的嘧啶并吲哚衍生物激动剂(pic);(2)“37℃+pic”:在标准温度下,存在35nmpic;(3)“39℃”:在轻度高温下,不存在pic;或(4)“39℃+pic”:在轻度高温下,存在35nmpic。图3(b)示出cd34+/cd45ra-长期造血干细胞(lt-hsc)随以初始经纯化cd34+细胞群体开始在促进造血干细胞扩增同时限制分化的条件下培养的时间变化的倍数扩增。测试了四种条件:(1)“37℃”:在标准温度下,不存在造血干细胞扩增的嘧啶并吲哚衍生物激动剂(pic);(2)“37℃+pic”:在标准温度下,存在35nmpic;(3)“39℃”:在轻度高温下,不存在pic;或(4)“39℃+pic”:在轻度高温下,存在35nmpic。图4-6示出cd34+/cd41+细胞(巨核细胞祖细胞)在14天内在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下的倍数扩增。由脐带血cd34+细胞(图4)、动员外周血cd34+细胞(图5)或骨髓cd34+细胞(图6)进行扩增。图7示出cd34+/cd41+细胞(巨核细胞祖细胞)在14天内在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在另一种造血干细胞扩增的嘧啶并吲哚衍生物激动剂(pic2)下的倍数扩增。图8和9分别示出用在轻度高温的条件下和在有利于优先地扩增巨核细胞(mk)祖细胞(cd41+细胞)的培养基中体外扩增的人类脐带血cd34+细胞移植的免疫缺陷小鼠中在第5天和第2.5周时的人类血小板产生结果。“mk-6m”:输注在不存在pic下产生的六百万个cd41+细胞;“(mk+pic)-1m”:输注在存在pic下产生的一百万个cd41+细胞;“(mk+pic)-6m”:输注在存在pic下产生的六百万个cd41+细胞;和“pbs”:输注磷酸盐缓冲盐水作为对照。破折号右边的数字表示每种条件下人类血小板平均数/μl血液。图10示出脐带血来源的cd71+细胞(红细胞前体)在14天内在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下的倍数扩增。图11示出总细胞(总细胞扩增)在14天内在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下的倍数扩增。图12和13分别示出cd34+细胞(hsc)和cd34+/cd71+细胞(红系祖细胞)在14天内在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下的倍数扩增。图14示出在补充有可商购获得的cc110细胞因子混合物(图14a)或自制(hm)细胞因子混合物(图14b)的培养基中培养的脐带血来源的cd34+细胞(造血干细胞)的倍数扩增。在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下培养该细胞。图15示出在补充有cc110细胞因子混合物(图15a)或自制(hm)细胞因子混合物(图15b)的培养基中培养的脐带血来源的cd34+/cd45ra-(长期造血干细胞;lt-hsc)细胞的倍数扩增。在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下培养该细胞。图16示出在补充有cc110细胞因子混合物(图16a)或自制(hm)细胞因子混合物(图16b)的stemspantmsfem培养基中培养的脐带血来源的cd34+细胞(造血干细胞)的倍数扩增。在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下培养该细胞。图17示出在补充有cc110细胞因子混合物(图17a)或自制(hm)细胞因子混合物(图17b)的stemspantmsfemii养基中培养的脐带血来源的cd34+细胞(造血干细胞)的倍数扩增。在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下培养该细胞。图18示出在补充有cc110细胞因子混合物(图18a)或自制(hm)细胞因子混合物(图18b)的stemspantmacf培养基中培养的脐带血来源的cd34+细胞(造血干细胞)的倍数扩增。在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下培养该细胞。图18c示出在补充有bs1细胞因子混合物的stemspantmsfem培养基中,在轻度高温下和在存在(“39”)或不存在(“ctl”)pic下培养的cbcd34+/cd45ra-细胞(长期造血干细胞;lt-hsc)的倍数扩增。图19、20和21分别示出cd34+细胞(造血干细胞)、cd34+/cd45ra-细胞(lt-hsc)和cd34+/cd38-/cd45ra-细胞在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic2下培养7、10和14天后的倍数扩增。图22示出cd34+/cd38-/cd45ra-细胞在轻度高温(39℃)和pic下培养14天后的倍数扩增。图23、24和25分别示出动员外周血来源的cd34+细胞(造血干细胞)、cd34+/cd45ra-细胞(lt-hsc)和cd34+/cd38-/cd45ra-细胞在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下培养10、14和17天后的倍数扩增。图26、27和28分别示出人类骨髓来源的cd34+细胞(造血干细胞)、cd34+/cd45ra-细胞(lt-hsc)和cd34+/cd38-/cd45ra-细胞在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下培养10、14和17天后的倍数扩增。图29示出cd34+/aldhbright细胞在存在(“39”)或不存在(“37”)轻度高温和/或存在或不存在pic下培养21天内的倍数扩增。发明详述本说明书缘起于出乎意料地发现包括轻度高温(例如,在38℃与40℃之间)和存在造血干细胞扩增的嘧啶并吲哚衍生物激动剂的细胞培养条件协同地起作用,以促进造血干细胞(hsc)扩增和/或分化为祖细胞(例如,髓样祖细胞、巨核细胞祖细胞)。实际上,在一些实施方案中,示出轻度高温和造血干细胞扩增的嘧啶并吲哚衍生物激动剂的组合使造血干细胞呈指数级扩增。此外,在一些实施方案中,这个组合还示出使hsc呈指数级增长地分化为祖细胞(例如,髓样祖细胞、巨核细胞祖细胞)。在一些方面,本说明书涉及用于培养造血干细胞的体外方法,该方法包括:(a)在含造血干细胞扩增的嘧啶并吲哚衍生物激动剂的细胞培养基中繁殖所述造血干细胞;和(b)在轻度高温条件下(例如,在38℃与40℃之间的孵育温度下)孵育造血干细胞。在一些实施方案中,该方法可以进一步包括:(c)移除造血干细胞扩增的嘧啶并吲哚衍生物激动剂,并继续在38℃与40℃之间的孵育温度下繁殖细胞,从而产生更同步的细胞群体。如本文所使用,“造血干细胞”或“hsc”是指具有多潜能性(即,可以产生见于血液中的所有细胞组分,诸如白细胞、红细胞、血小板等)和自我更新能力的细胞。使用cd34作为阳性选择标记允许富集造血干细胞,且因此,在一些实施方案中,可将cd34+细胞用作造血干细胞。除cd34之外,多种其他造血干细胞标记可以单独使用或组合使用,以通过本领域已知的方法(例如,facs、免疫磁性粒子)鉴别、富集和/或分离给定hsc群体。可用于此目的的其他标记的例子包括cd133/ac133+、lin-、aldhhi或aldhbright、cd38-、cd71-、hla-dr-、cd33-、cd117/c-kit+、cd59+、cd90/thy-1+和cd49f+。具体地,在一些实施方案中,可以利用诸如cd34+/cd45ra-、cd34+/cd38-/cd45ra-和cd49f+等的标记鉴别、富集和/或分离长期造血干细胞(lt-hsc)。此处未列的其他标记也可以用于鉴别、富集和/或分离给定hsc群体,且这些标记也被认为在本说明书的范围内。在一些实施方案中,hsc可以分离自或来源于脐带血;骨髓;外周血;诱导多能干细胞;胚胎干细胞;通过非造血分化细胞的转分化获得的细胞;经基因修饰的hsc;永生化或工程化的hsc;其他多能或多潜能细胞来源;或其任何组合。在一些实施方案中,hsc可以分离自或来源于动员外周血细胞(例如经g-csf动员)。在一些实施方案中,hsc可以分离自或来源于未动员外周血细胞(即,尚未经例如g-csf动员的外周血细胞)。在一些实施方案中,hsc可以分离自或来源于动员或未动员外周血细胞去白细胞和/或减白细胞后留下的细胞(例如,血小板去除装置的去白细胞室中留下的细胞,或从全血收集套组的去白细胞过滤器回收的细胞;这些去白细胞装置原本是要抛弃的)。应当理解,本说明书可应用到来自各种来源以及纯化、处理和/或浓缩方法的hsc。本文描述了这类来源和方法的非限制性例子,但也可以根据本说明书使用未在本文明确提到的其他hsc来源。如本文所使用,术语“繁殖”是指体外培养细胞(例如,造血干细胞)来达到特定目的,诸如扩增某一细胞群体(例如,hsc和/或cd34+细胞),和/或促进细胞朝期望的细胞系(例如,巨核细胞系、或源自髓样祖细胞的其他谱系)分化。在一些实施方案中,“繁殖”可以指小型“实验室规模”细胞培养或较大规模细胞培养(例如,使用生物反应器)。在一些实施方案中,可以选择用于繁殖细胞的细胞培养基的组成来促进某一特定细胞类型(例如,hsc和/或cd34+细胞)的扩增,或促进朝期望的细胞系(例如,巨核细胞系,或源自髓样祖细胞的其他谱系)分化。在一些实施方案中,本说明书的细胞培养基可以包含一种或多种细胞因子。在一些实施方案中,该细胞因子可以包含:干细胞因子(scf);促血小板生成素(tpo);或两者。如本文所使用,措辞“促进朝...分化”是指细胞朝某一特定终点分化的一般方向,但不一定达到该终点(即,细胞最终分化为完全分化的成熟细胞)。本领域的技术人员一般知道这些培养基和添加剂(例如,影响朝特定谱系扩增和/或分化的不同细胞因子混合物和/或其他细胞培养基组分)。技术人员可以商购获得许多合适的培养基和添加剂。例如,对于本说明书语境下分化有限的cd34+细胞培养和扩增,可以在多种可商购获得的培养基(诸如stemspantmacf、sfem或sfemii)中繁殖细胞,并补充可商购获得的细胞因子混合物(诸如cc110(干细胞技术公司(stemcelltechnologies),加拿大不列颠哥伦比亚省温哥华))。在一些实施方案中,可以制备自制(hm)细胞因子混合物,其可包含:人类fms样酪氨酸激酶3配体(flt3)(例如,100ng/ml)、干细胞因子(scf)(例如,100ng/ml)、促血小板生成素(tpo)(例如,50ng/ml)、低密度脂蛋白(ldl)(例如,10μg/ml)或其任何组合。能够在本说明书语境下的自我更新条件下繁殖hsc(例如,cd34+细胞)的这类细胞培养基/细胞因子混合物等在本文被称为“造血干细胞培养基”。然而,可以使用其他类型的细胞培养基和/或添加剂(例如,细胞因子混合物),且本说明书不应局限于本发明实施例中所采用的细胞培养基。对于在本说明书语境下朝巨核细胞系培养和分化,可在培养基(诸如stemspantmacf或sfem培养基(stemcelltm技术公司))中培养经纯化cd34+细胞,补充细胞因子混合物,诸如robert等人,2011中描述的ompc细胞因子混合物或cortin等人,2005中描述的bs1巨核细胞扩增和分化细胞因子混合物。ompc细胞因子混合物包括tpo(例如,35ng/ml)、scf(例如,10ng/ml)和人类flt3(11ng/ml)。bs1细胞因子混合物包括tpo(例如,30ng/mltpo)、scf(1ng/ml)、il-6(例如,7.5ng/ml)和il-9(例如,13.5ng/ml)。在本说明书语境下促进hsc朝巨核细胞系分化的这类细胞培养基/细胞因子混合物等在本文被称为“促进造血干细胞朝巨核细胞系分化的培养基”。然而,可以使用其他类型的细胞培养基和/或添加剂(例如,细胞因子混合物),且本说明书不应局限于本发明实施例中所采用的细胞培养基。在一些实施方案中,本文描述的不同细胞扩增方法或细胞群体可一起使用以获得更大功效(例如,以产生待输注或移植到受试者中的细胞群体,以促进例如血小板加速恢复)。在一些实施方案中,该细胞可以繁殖至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天。在一些实施方案中,本说明书的方法能够使造血干细胞繁殖至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天,而不会明显丧失细胞活力和/或“干性(stemness)”。如本文所使用,措辞“明显丧失细胞活力”是指细胞死亡速率大于细胞扩增速率,使得不再观察到感兴趣的总活细胞的净扩增。本领域的技术人员将认识到,可以改变细胞培养基来适应特定扩增和/或分化需求。在一些实施方案中,该细胞培养基可以是非分化培养基。在一些实施方案中,轻度高温和添加造血干细胞扩增的嘧啶并吲哚衍生物激动剂可以在不同时间点组合和/或持续可变的时间长度(例如,同时和/或在给定体外培养期间采用轮流方式),这取决于期望的培养结果。这些变型在本说明书的一些实施方案的范围内,其中该变型导致细胞扩增的量相对于只使用轻度高温或造血干细胞扩增的嘧啶并吲哚衍生物激动剂培养hsc给定的体外培养期有所提高。因此,在一些实施方案中,本说明书涉及用于扩增造血干细胞的方法,且其中所述细胞培养基是造血干细胞培养基。在一些实施方案中,用于体外扩增造血干细胞的方法可用于从脐带血扩增hsc,以达到足量细胞来成功地植入在成人中。在一些实施方案中,本说明书涉及用于扩增造血干细胞的体外方法,该方法包括:(a)在含造血干细胞扩增的嘧啶并吲哚衍生物激动剂的造血干细胞培养基中繁殖所述造血干细胞;和(b)在38℃与40℃之间的孵育温度下孵育所述造血干细胞,其中所得造血干细胞扩增的水平比单独在(a)或(b)下培养造血干细胞所能获得的要高。在一些实施方案中,使hsc扩增至少20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900或1000倍(例如,培养5与21天之间)。在一些实施方案中,hsc是长期再植hsc(lt-hsc),诸如cd34+/cd45ra-细胞、cd34+/cd38-/cd45ra-或cd49f+细胞。在一些实施方案中,使lt-hsc扩增至少2、5、10、15、20、30、40、50、60、70、80、90、100或200倍(例如,培养5与21天之间)。技术人员将理解,所得扩增倍数的实际值可根据许多因素而变化,诸如起始材料细胞的质量和/或数量。这些变型都在本说明书的范围内。在一些实施方案中,本说明书涉及用于培养造血干细胞以产生髓样祖细胞的方法,且其中所述细胞培养基是促进造血干细胞朝髓样祖细胞分化的培养基。如本文所使用,“髓样祖细胞”是指能够被诱导分化为一种或多种巨核细胞、一种或多种红细胞、一种或多种肥大细胞或一种或多种原粒细胞的造血细胞。在一些实施方案中,髓样祖细胞可作为cd34+/cd41+细胞(巨核细胞祖细胞)鉴别。在一些实施方案中,本说明书涉及用于培养造血干细胞以产生髓样祖细胞的体外方法,该方法包括:(a)在促进造血干细胞朝髓样祖细胞分化的细胞培养基中繁殖所述造血干细胞,所述细胞培养基包含造血干细胞扩增的嘧啶并吲哚衍生物激动剂;和(b)在38℃与40℃之间的孵育温度下孵育所述造血干细胞,其中所得髓样祖细胞的水平比单独在(a)或(b)下培养造血干细胞所能获得的更高。在一些实施方案中,可促进髓样祖细胞分化为巨核细胞。在一些实施方案中,使髓样祖细胞扩增至少20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900或1000倍(例如,培养5与21天之间)。技术人员将理解,所得扩增倍数的实际值可根据许多因素而变化,诸如起始材料细胞的质量和/或数量。这些变型都在本说明书的范围内。在一些实施方案中,本说明书涉及用于培养造血干细胞以产生巨核细胞祖细胞的方法,且其中所述细胞培养基是促进造血干细胞朝巨核细胞系分化的培养基。如本文所使用,“巨核细胞祖细胞”是指能够被诱导分化为一种或多种巨核细胞的造血细胞。在一些实施方案中,本说明书涉及用于培养造血干细胞以产生巨核细胞祖细胞的体外方法,该方法包括:(a)在促进造血干细胞朝巨核细胞系分化的细胞培养基中繁殖所述造血干细胞,所述细胞培养基包含造血干细胞扩增的嘧啶并吲哚衍生物激动剂;和(b)在38℃与40℃之间的孵育温度下孵育所述造血干细胞,其中所得巨核细胞祖细胞的水平比单独在(a)或(b)下培养造血干细胞所能获得的要高。在一些实施方案中,可促进巨核细胞祖细胞分化为血小板或血小板样片段。在一些实施方案中,使巨核细胞祖细胞扩增至少20、30、40、50、60、70、80、90或100倍(例如,培养5与14天之间)。技术人员将理解,所得扩增倍数的实际值可根据许多因素而变化,诸如起始材料细胞的质量和/或数量。这些变型都在本说明书的范围内。在一些方面,本说明书涉及在“造血干细胞扩增的嘧啶并吲哚衍生物激动剂”存在下繁殖细胞。如本文所使用,这个措辞是指与嘧啶并吲哚共享一定结构相似度的小分子化合物,它们具有刺激hsc扩增的能力。应理解,所谓“造血干细胞扩增的嘧啶并吲哚衍生物激动剂”,细胞培养基中存在充足浓度或剂量的该化合物来引起期望的效果(例如,刺激hsc扩增和/或与使用本说明书语境下的轻度高温协同)。在一些实施方案中,嘧啶并吲哚衍生物可以是“嘧啶并[4,5-b]吲哚衍生物”。先前已经在例如wo1993/020078;wo1995/019970;wo1997/002266;wo1998/042708;wo2000/066585;wo2003/037898;wo2004/058764;wo2005/037825;wo2006/116733;wo2008/055233;wo2009/004329和wo2010/006032中描述了此类衍生物。在一些实施方案中,嘧啶并[4,5-b]吲哚衍生物可以是例如fares等人,2014或wo2013/110198中描述的化合物,诸如(1r,4r)-n1-(2-苄基-7-(2-甲基-2h-四唑-5-基)-9h-嘧啶并[4,5-b]吲哚-4-基)环己烷-1,4-二胺[um171]或4-(3-(哌啶-1-基)丙基氨基)-9h-嘧啶并[4,5-b]吲哚-7-甲酸甲酯[um729]。示出此类化合物刺激cd34+/cd45ra-动员外周血细胞扩增,所述细胞在长期再植hsc(lt-hsc)中富集,而不充当芳烃受体(ahr)路径的抑制剂(fares等人,2014)。因此,在一些实施方案中,嘧啶并吲哚衍生物可包括cd34+/cd45ra-细胞扩增的ahr路径依赖性嘧啶并[4,5-b]吲哚衍生物激动剂。在一些实施方案中,造血干细胞扩增的嘧啶并吲哚衍生物激动剂可作为在载体如dmso中的原液制备。在一些实施方案中,造血干细胞扩增的嘧啶并吲哚衍生物激动剂的浓度可以是从10、15、20、25或30nm至50、60、70、80、90、100、150、200、250、300、350、400、450、500、600、700、800、900或1000nm。造血干细胞扩增的嘧啶并吲哚衍生物激动剂的浓度可以基于分子潜能进行修改,且此处未明确列举的其他浓度也在本说明书的范围内。在一些实施方案中,上述任何嘧啶并吲哚衍生物的药学上可接受的盐、溶剂化物、前药或立体异构体也可以在本说明书的范围内。如本文所使用,术语“前药”是指在代谢(例如,体内)时产生期望的活性化合物的化合物。通常,前药无活性,或比期望活性化合物的活性小,但可以提供有利的加工、给予或代谢性质。除非另外指明,否则提到特定化合物也包括其前药。在一些实施方案中,本说明书的嘧啶并吲哚衍生物可与其他化合物组合使用,诸如芳烃受体(ahr)的拮抗剂(例如,sr1:4-[2-[[2-苯并[b]噻吩-3-基-9-(1-甲基乙基)-9h-嘌呤-6-基]氨基]乙基]-苯酚)。在一些实施方案中,芳烃受体化合物的拮抗剂(例如,sr1)可作为在载体如dmso中的原液制备。在一些实施方案中,芳烃受体化合物的拮抗剂(例如,sr1)可以按例如100与1000nm之间、200与900nm之间、300与800nm之间、400与800nm之间、450与750nm之间、700与800nm之间、或450与550nm之间使用。在一些方面,本说明书涉及在轻度高温下繁殖细胞。在一些实施方案中,“轻度高温”是指在38℃与40℃之间,优选地39℃的孵育温度下繁殖细胞。当然,技术人员将理解,可以允许在上述温度之外有短暂变化,只要细胞总体上是在比给定细胞群体的推荐温度(例如,一般37℃)高1℃-3℃的温度下培养/繁殖即可。在一些实施方案中,使该细胞在轻度高温下维持至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天。在一些实施方案中,使该细胞在轻度高温下连续维持至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天。在一些方面,本说明书涉及体外扩增的细胞群体,其是通过本文定义的方法产生的扩增的造血干细胞、髓样祖细胞、巨核细胞祖细胞群体或其任何组合。在一些实施方案中,本说明书的不同体外扩增的细胞群体可以组合得到更大的治疗益处(例如,促进血小板加速恢复)。在一些实施方案中,本说明书的体外扩增的细胞群体可以包含至少40%、45%、50%、55%、60%、65%、70%、75%或80%的cd34+/cd41+细胞。在一些方面,本说明书涉及本文描述的体外扩增的细胞群体用于移植到受试者中的用途,或用于制造供移植到受试者中的治疗组合物的用途。在一些实施方案中,体外扩增的细胞群体可以是用于在造血干细胞移植中使用,或用于制造用于相同目的的治疗组合物的扩增的造血干细胞群体。在一些实施方案中,体外扩增的细胞群体可以是用于在治疗血小板减少症中使用,或用于制造用于相同目的的治疗组合物的巨核细胞祖细胞群体。因此,在一些方面,本说明书涉及药物组合物,其包含:如本文定义的扩增的造血干细胞、髓样祖细胞或巨核细胞祖细胞群体。在一些实施方案中,药物组合物可以包含药学上可接受的载体,诸如标准缓冲盐水(例如,约135-150mmnacl)。其他合适的载体包括但不限于水、缓冲水、0.4%盐水、0.3%甘氨酸等。适用于递送本说明书的培养干细胞的其他载体描述在例如remington'spharmaceuticalsciences,mackpublishingco.,philadelphia,pa.,18thed.(1995)中。本说明书的其他目的、优点和特征将在阅读其具体实施方案的以下非限制性描述后变得更加明显,所述具体实施方案仅以举例方式参照附图而给出。实施例实施例1:实施例2-5的材料和方法1.1材料除非另外指明,否则所有化学品都是购自西格玛奥德里奇公司(sigma-aldrich)(加拿大安大略省奥克维尔)。1.2从人类脐带血分离并培养cd34+细胞通过阳性选择,根据标准程序从人类脐带血分离cd34+细胞。以大约105个细胞/ml的密度将来自单个单元或从几个单元脐带血汇集的经纯化cd34+细胞接种在24孔板的1ml适当培养基中。在整个培养期间通过稀释和/或培养基更换将细胞维持在105-106个细胞/ml的密度下。为了朝巨核细胞系培养和分化,在补充有抗生素和先前描述的“bs1”细胞因子混合物(cortin等人,2005)的stemspantmacf培养基(stemcelltm技术公司,加拿大不列颠哥伦比亚省温哥华)中培养经纯化cd34+细胞,并在第6、10和14天进行细胞计数。对于cd34+细胞培养和扩增,在限制分化的同时,使细胞在补充有stemspantmcc110细胞因子混合物(stemcelltm技术公司)的stemspantm-acf培养基(stemcelltm技术公司)中生长,并在第4、7、10、14、17和21天计数。根据制造商的指示,用nc-250tm活力和细胞计数分析系统(chemometec公司,加州戴维斯)测量细胞计数和活力。1.3细胞表型分析在指示的天数,用下组的经标记初级抗体,通过流式细胞术测定细胞表型:cd34-fitc、cd45ra-apc、cd41a-apc、cd42b-pe和cd235-pe。1.4cfu-mk分析在指示的天数收集生长在stemspantmacf+bs1培养基中的细胞等分试样,并根据制造商的指示用来自stemcelltm技术公司的megaculttmc试剂盒测定cfu-mk。实施例2:在轻度高温和嘧啶并吲哚化合物pic组合下培养增加巨核细胞祖细胞扩增如实施例1.2的一般描述分离cd34+细胞并培养朝巨核细胞系分化。为测定轻度高温与嘧啶并吲哚化合物的组合对巨核细胞祖细胞(mkp)细胞扩增的影响,在37℃或39℃下和在补充和没有35nm(最终浓度)嘧啶并吲哚化合物的细胞培养基存在下培养cd34+细胞:在本文称作“pic”。如实施例1.3中所述用流式细胞术监测cd34+/cd41+mkp细胞随时间推移的扩增情况。如图1中所示,在37℃下在存在(“37℃+pic”)或不存在(“37℃”)pic下培养的细胞具有不足5倍扩增的cd34+/cd41+mkp细胞,如在轻度高温下不存在pic下(“39℃”)培养的细胞一样。有意思且出乎意料的是,轻度高温与pic的组合(“39℃+pic”)导致cd34+/cd41+mkp细胞到第14天扩增接近100倍,cd34+/cd41+细胞的纯度一般高于40%(数据未示出)。这些结果示出了轻度高温与嘧啶并吲哚化合物组合对刺激从cd34+细胞扩增mkp细胞的强效协同效应。实施例3:在轻度高温和嘧啶并吲哚化合物pic组合下培养产生更均质巨核细胞祖细胞群体如实施例1.3中所述在第6、10和14天通过流式细胞术测定实施例2中分离和培养的cd34+细胞的更彻底细胞表型谱。结果汇总在表1中,示出了带有指示细胞表面标记或标记组合的细胞的百分比。表1.在有利于mkp细胞扩增的条件下培养的cd34+细胞的表型分析如表1中所示,与在标准温度下在不存在(“37℃”)或存在(“37℃+pic”)pic下培养cd34+细胞相比,或与在轻度高温但没有pic(“39℃”)下培养细胞相比,在轻度高温下和在pic存在下(“39℃+pic”)培养cd34+细胞在第6、10和14天得到更大比例的cd34+/cd41+mkp细胞。更具体地,在轻度高温下和在pic存在下(“39℃+pic”)培养14天的cd34+细胞得到76.5%的cd34+/cd41+mkp细胞,而只使用pic(“37℃+pic”)或只使用轻度高温(“39℃”)分别只得到11%和10%的cd34+/cd41+mkp细胞。这些结果示出,可以通过在有利于分化为巨核细胞祖细胞的条件下培养cd34+造血干细胞获得巨核细胞祖细胞的更均质细胞群体,其中通过组合嘧啶并吲哚化合物和39℃的孵育温度改变标准培养条件。此外,如表1中所示,在39℃下在pic存在下(“39℃+pic”)生长的培养物在第14天只有27%的细胞具有成熟巨核细胞特有的表型cd41+/cd42+,而在39℃下在不存在pic下(“39℃”)生长的培养物具有68%的cd41+/cd42+成熟巨核细胞。在37℃下在pic存在下(“37℃+pic”)生长的培养物在第14天时事实上没有cd41+/cd42+成熟巨核细胞,而在37℃c下在不存在pic下(“37℃”)生长的培养物具有44%的cd41+/cd42+成熟巨核细胞。这些结果表明,嘧啶并吲哚化合物在成熟cd41+/cd42+巨核细胞阶段之前阻断高温诱导的cd34+细胞分化,和/或优先地扩增和维持cd34+/cd41+巨核细胞祖细胞。因此,在一些实施方案中,可以移除嘧啶并吲哚化合物,且细胞可以在轻度高温条件下进一步繁殖,从而产生更同步的细胞群体。不受理论的约束,组合轻度高温和pic时所得细胞表型的分布强烈表明,两种效应子协同地起作用以推进并维持cd34+细胞朝巨核细胞系分化至祖细胞水平,使得在培养14天后,cd34+/cd41+mkp代表整个群体中的大多数细胞。实施例4:在轻度高温和嘧啶并吲哚化合物下组合培养提高cfu-mk数量从如实施例2中所述分离和培养的经纯化cd34+细胞开始,通过实施例1.4中所述标准祖细胞分析来分析39℃孵育温度和pic嘧啶并吲哚化合物单独或组合对所得cfu-mk数量的影响。如图2中所示,与分别测试的条件(“39℃”或“37℃+pic”)相比,39℃孵育温度和pic的组合效应(“39℃+pic”)产生更多数量的cfu-mk。更具体地,“39℃+pic”所得cfu-mk数量是培养物在37℃和pic(“37℃+pic”)下生长时数量的两倍多,且是培养物在39℃下在不存在pic(“39℃”)下生长时所得cfu-mk数量的四倍多。此外,从在39℃和pic(“39℃+pic”)下培养的细胞获得的cfu-mk数量大于加和分别测试的条件(“39℃”和“37℃+pic”)的cfu-mk数量所能获得的数量。这些结果示出,轻度高温和pic的组合协同作用,以增加所得cfu-mk的数量。这种未预见的效应尤其有意思,因为当前技术不足以在体外扩增具有cfu-mk潜能的细胞。实施例5:在轻度高温和嘧啶并吲哚化合物pic组合下培养增加cd34+细胞扩增,同时维持它们的原始表型分离cd34+细胞并在适合维持它们自我更新,同时限制它们分化为祖细胞的培养基(补充有stemspantmcc110细胞因子混合物的stemspantmacf,如实施例1.2中所述)中培养。在37℃或39℃下,在补充有或没有35nm(最终浓度)嘧啶并吲哚化合物pic的细胞培养基中培养cd34+细胞。如图3(a)中所示,在37℃无pic(“37℃”)下培养的细胞在培养期间的任何时间得到扩增最少的cd34+细胞。用pic补充细胞培养基在第21天增加扩增至100-200倍。引人注目地,虽然在39℃无pic(“39℃”)下培养的细胞产生最小的cd34+细胞的细胞扩增,但在39℃下在存在pic(“39℃+pic”)下培养细胞导致cd34+细胞扩增急剧增加,在第21天时扩增1000倍多。这些结果示出了轻度高温与嘧啶并吲哚化合物对cd34+细胞扩增的强效协同效应。这些结果示出了轻度高温与嘧啶并吲哚化合物对cd34+细胞扩增的强效协同效应。如实施例1.3中所述在第4、7、10、14、17和21天通过流式细胞术测定扩增的cd34+细胞的细胞表型谱。结果汇总在表2中,示出了带有指示细胞表面标记或标记组合的细胞的百分比。表2.在有利于cd34+细胞扩增而分化有限的条件下培养的cd34+细胞的表型分析*n/d:未测定。表2中提供的表型分析结果表明,轻度高温与pic的组合处理并未导致细胞增加朝巨核细胞系和红系(cd235+)分化,这表明在一定程度上维持了“干性”。不受理论的约束,这些结果共同表明,轻度高温结合使用嘧啶并吲哚化合物保留嘧啶并吲哚化合物的抗分化效果,同时加强39℃孵育温度对细胞体外扩增的刺激效果。图3(a)中提供的结果来自整个cd34+细胞群体。少量cd34+/cd45ra-细胞群体被认为代表真正的长期造血干细胞(lt-hsc)。综合全细胞扩增的结果和表2的结果,允许测定cd34+/cd45ra-lt-hsc的绝对数目和倍数扩增。如图3(b)中所示,cd34+/cd45ra-lt-hsc的扩增通过在39℃下,在pic化合物存在下(“39℃+pic”)培养细胞得到有效增强。这个结果证明,可将轻度高温与造血干细胞扩增的嘧啶并吲哚激动剂的协同效应用于多种目的和衍生几种造血系。实施例6:实施例7-16的材料和方法6.1cd34+细胞来源在获得捐赠者的书面知情同意书后,按照我们机构的研究伦理委员会指南收集人类脐带血(cb)。首先在ficoll-hypaquetm密度梯度(ge医疗集团(gehealthcare))分离单核细胞(mnc),然后在cryostorcs10tm培养基(干细胞技术公司)中冷冻保存在-180℃下。汇集从六份到八份cb解冻的mnc,然后分离cd34。通过阳性选择,用easyseptmcd34富集试剂盒,根据制造商指示(干细胞技术公司)富集cbcd34+细胞。从allcells购买人类骨髓和g-csf动员外周血cd34+细胞。6.2培养cd34+富集细胞并使之朝巨核细胞系分化以100000个细胞/ml将人类cd34+富集细胞(纯度≥90%)接种在24孔板的扩增培养基中,该培养基由(1)补充有ompc细胞因子混合物(robert等人,2011)的stemspantmacf(acf;干细胞技术公司)或(2)补充有bs1巨核细胞扩增和分化混合物的stemspantmsfem(干细胞技术公司)(cortin等人,2005)组成。ompc由35ng/ml促血小板生成素(tpo;菲尔丹治疗剂公司(feldantherapeutics))、10ng/ml干细胞因子(scf;派普泰克公司(peprotech))和11ng/ml人类fms样酪氨酸激酶3配体(flt3,派普泰克公司)组成。bs1由1ng/mlscf、30ng/mltpo、7.5ng/mlil-6和13.5ng/mlil-9(菲尔丹治疗剂公司)组成。将培养物维持在潮湿气氛,5%co2,37℃或39℃下,如实施例中所示。每3到4天用新鲜培养基以300000个细胞/ml稀释细胞。通过溶解在dmso中制备pic和pic2原液,然后按以下最终有效浓度直接加到培养细胞中:pic:35nm(参见实施例2);pic2:500nm(参见实施例7.4)。6.3培养cd34+富集细胞并使之朝红系分化以100000个细胞/ml将人类cbcd34+富集细胞(纯度≥90%)接种在24孔板的扩增培养基中,该培养基由补充有20ng/mlscf(派普泰克公司)和2u/ml红细胞生成素(epo;菲尔丹治疗剂公司)的eave基础培养基(iscove改良的杜氏培养基(imdm)、20%bit(10ng/ml牛血清白蛋白、10μg/ml牛胰腺胰岛素、200μg/ml人类转铁蛋白;干细胞技术公司)、0.1mg/ml低密度脂蛋白(干细胞技术公司)、50μm2-巯基乙醇)组成。将培养物维持在潮湿气氛,5%co2,37℃或39℃下,如实施例中所示。每3到4天用新鲜培养基以300000个细胞/ml稀释细胞。通过溶解在dmso中制备pic原液,然后以35nm的最终有效浓度直接加入培养细胞中。6.4在有利于自我更新的条件下培养cd34+富集造血干细胞以500000个细胞/ml将人类cd34+富集细胞(纯度≥90%)接种在24或96孔板的三种扩增培养基中的一种中,该培养基由stemspantmacf(acf)、sfem或sfemii(干细胞技术公司)组成,补充有cc110(干细胞技术公司)或由100ng/ml人类flt3(派普泰克公司)、100ng/mlscf(派普泰克公司)、50ng/mltpo(菲尔丹治疗剂公司)和10μg/ml低密度脂蛋白(ldl,干细胞技术公司)组成的自制(hm)细胞因子混合物。将培养物维持在潮湿气氛,5%co2,37℃或39℃下,如实施例中所示。每3到4天用新鲜培养基以500000个细胞/ml稀释细胞。通过溶解在dmso中制备pic和pic2原液,然后按以下最终有效浓度直接加到培养细胞中:pic:35nm;pic2:500nm。6.5分析培养细胞通过添加溶液18(吖啶橙和dapi溶液,chemommetec)并使用检测用nucleocountertmnc-250(chemommetec)测定细胞计数和活力。对于在有利于朝mk谱系分化的条件下扩增的细胞而言,利用以下抗体检测表面标记:cd34-fitc、cd41a-apc和cd42b-pe。所有抗体都是购自bd生物科学公司(bdbiosciences),购自免疫技术公司(immunotech)的cd34-fitc除外。使用7aad作为活力染料。所有样品在accuritmc6流式细胞仪(bd生物科学公司)上分析,并用fcsexpress5flowresearch版软件从每个样品需要的至少15000个活细胞事件分析原始数据。用megacult-ctm,根据制造商指示(干细胞技术公司)分析菌落形成单位巨核细胞(cfu-mk)。对于在有利于朝红系分化的条件下扩增的细胞而言,利用以下抗体检测表面标记:cd34-fitc、cd71-apc和cd235-pe。所有抗体都是购自bd生物科学公司,购自免疫技术公司的cd34-fitc除外。使用7aad作为活力染料。所有样品在accuritmc6流式细胞仪(bd生物科学公司)上分析,并用fcsexpress5flowresearch版软件从每个样品需要的至少15000个活细胞事件分析原始数据。对于在有利于自我更新的条件下扩增的细胞而言,利用以下抗体检测表面标记:cd34-pe、cd45ra-fitc和cd38-bv421。所有抗体都是购自bd生物科学公司,购自免疫技术公司的cd34-pe除外。用aldefluortm试剂盒(干细胞技术公司),根据制造商指示标记醛脱氢酶(aldh)阳性细胞。使用7aad作为活力染料。所有样品在facs-cyflowml系统(希森美康株式会社(sysmex))上分析,并用fcsexpress5flowresearch版软件从每个样品需要的至少15000个活细胞事件分析原始数据。6.6将cd41+细胞移植到小鼠中,并评估骨髓植入从杰克逊实验室(thejacksonlaboratory)(缅因州巴港)购买七至九周龄雌性nod.cg-prkdcscidil2rgtm1wjl/szj(nsg)小鼠。通过尾静脉注射在补充有bs1混合物的stemspantmsfem培养基中扩增10天的cbcd34+富集细胞给经亚致死照射的小鼠(250cgy,137cs)静脉内移植。每个实验包括用pbs注射的小鼠作为骨髓植入的阴性对照。用于评估骨髓(bm)植入和人类血小板产生的实验组和对照组由至少6只小鼠组成。移植后12至16周之间通过冲刷股骨和胫骨评估植入到小鼠骨髓中的人类细胞,并通过流式细胞术,使用以下抗体分析新分离的bm细胞:人类cd45-pe-cy7、小鼠cd45-pe、人类cd41-apc、人类cd33-apc、人类cd34-pe、人类cd235-pe、人类cd3-fitc。使用7aad作为活力染料。用bd裂解溶液,按照制造商指示裂解红细胞。6.7分析移植小鼠中的人类血小板产生用edta涂布毛细管(蒙德公司(drummond))从麻醉小鼠收集眼球后静脉丛血。评估移植小鼠中人类血小板产生由两个不同步骤组成。第一步,通过在全血中用大鼠抗小鼠cd41-fitc抗体给鼠科血小板染色测定鼠科血小板计数。然后将样品最终以1/18000稀释在pbs/1%bsa中,并通过流式细胞术,用bdaccuritmc6仪器分析鼠科血小板的浓度。第二步,在富血小板血浆(prp)中测量人类血小板的比例。通过将全血稀释在pbs(1/2)中,并以800rpm离心30秒制备prp。用小鼠抗人类cd41-apc和大鼠抗小鼠cd41-fitc抗体给十微升prp染色。然后在bdaccuritmc6仪器上分析样品;在点图的血小板区域获取至少400000个事件。6.8将通过在有利于自我更新的条件下体外培养cbcd34+细胞获得的新cbcd34+细胞或其后代移植到小鼠中,并评估骨髓植入从杰克逊实验室(缅因州巴港)购买七至九周龄雌性nod.cg-prkdcscidil2rgtm1wjl/szj(nsg)小鼠。通过尾静脉注射经体外扩增12天的新cd34+富集cb细胞或它们的细胞后代给经亚致死照射的小鼠(250cgy,137cs)静脉内移植。每个实验包括用pbs注射的小鼠作为骨髓植入的阴性对照。实验组和对照组由至少5只小鼠组成。移植后27周时通过冲刷股骨和胫骨评估植入到小鼠骨髓中的人类细胞,并通过流式细胞术,使用以下抗体分析新分离的bm细胞:人类cd45-pe-cy7、小鼠cd45-pe、人类cd33-bv421、人类cd19-fitc、人类cd34-pe和人类cd3-fitc。使用7aad作为活力染料。实施例7:不同来源的cd34+细胞对cd34+/cd41+巨核细胞祖细胞在轻度高温和嘧啶并吲哚化合物下扩增的影响7.1组合使用轻度高温和pic导致来自脐带血cd34+细胞的巨核细胞祖细胞协同扩增如实施例6.1中所述从人类脐带血(cb)获得人类cd34+富集细胞,并在如实施例6.2中所述补充有ompc细胞因子混合物的stemspantmacf培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.5中所述测定细胞计数和活力。图4示出cd34+/cd41+细胞(巨核细胞祖细胞)在不同测试培养条件下14天内的倍数扩增。这些结果示出了组合使用轻度高温(39℃)和pic对来自脐带血cd34+细胞的cd34+/cd41+细胞的扩增的协同效应。7.2组合使用轻度高温和pic导致来自动员外周血cd34+细胞的巨核细胞祖细胞协同扩增如实施例6.1中所述获得人类g-csf动员外周血cd34+细胞,并在如实施例6.2中所述补充有bs1巨核细胞扩增和分化混合物的stemspantmsfem培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic培养(参见实施例2)下。如实施例6.5中所述测定细胞计数和活力。图5示出cd34+/cd41+细胞(巨核细胞祖细胞)在不同测试培养条件下14天内的倍数扩增。这些结果示出了组合使用轻度高温(39℃)和pic对来自动员外周血cd34+细胞的cd34+/cd41+细胞的扩增的协同效应。7.3组合使用轻度高温和pic导致来自骨髓cd34+细胞的巨核细胞祖细胞协同扩增如实施例6.1中所述获得人类骨髓cd34+细胞,并在如实施例6.2中所述补充有bs1巨核细胞扩增和分化混合物的stemspantmsfem培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.5中所述测定细胞计数和活力。图6示出cd34+/cd41+细胞(巨核细胞祖细胞)在不同测试培养条件下14天内的倍数扩增。这些结果示出了组合使用轻度高温(39℃)和pic对来自骨髓cd34+细胞的cd34+/cd41+细胞的扩增的协同效应。7.4组合使用轻度高温和pic2导致来自脐带血cd34+细胞的巨核细胞祖细胞协同扩增如实施例6.1中所述从人类脐带血(cb)获得人类cd34+富集细胞,并在如实施例6.2中所述补充有bs1细胞因子混合物的stemspantmsfem培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物“pic2”下培养:4-((3-(哌啶-1-基)丙基)氨基)-9h-嘧啶并[4,5-b]吲哚-7-甲酸甲酯(“um729”)。如实施例6.5中所述测定细胞计数和活力。图7示出cd34+/cd41+细胞(巨核细胞祖细胞)在不同测试培养条件下14天内的倍数扩增。这些结果示出了组合使用轻度高温(39℃)和pic2对cbcd34+/cd41+细胞的扩增的协同效应。实施例8:输注体外扩增的mk祖细胞后在小鼠中产生人类血小板如实施例6.2中所述在轻度高温下和在有利于优先地扩增mk祖细胞的条件下通过体外扩增cbcd34+细胞制备人类cd41+细胞;stemspantmsfem培养基补充有供体外扩增的bs1细胞因子混合物。如实施例6.6中所述将培养10天后获得的测量剂量的cd41+细胞移植到nsg小鼠中。通过在输注在有利于优先地扩增mk祖细胞的条件下体外扩增的cbcd34+细胞后五天或2.5周计数鼠科血液中人类血小板测定人类血小板产生,如实施例6.2中所述。图8和9分别示出小鼠中5天和2.5周时短期人类血小板产生的结果,其中“mk-6m”:输注利用stemspantmsfem+bs1混合物产生的六百万个cd41+细胞;“(mk+pic)-1m”:输注利用补充有pic的stemspantmsfem+bs1混合物产生的一百万个cd41+细胞;“(mk+pic)-6m”:输注利用补充有pic的stemspantmsfem+bs1混合物产生的六百万个cd41+细胞;和“pbs”:输注磷酸盐缓冲盐水作为对照。破折号右边的数字表示每种条件下人类血小板平均数/μl血液。实施例9:红细胞分化培养基对cd34+细胞在轻度高温和pic下扩增的影响如实施例6.1中所述从人类脐带血(cb)获得人类cd34+富集细胞,并在如实施例6.3中所述红细胞分化培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.5中所述测定细胞计数和活力。9.1pic对cd71+细胞(红细胞前体)在红细胞分化培养基中扩增的影响图10示出cbcd71+细胞(红细胞前体)在不同测试培养条件下14天内的倍数扩增。使用轻度高温(39℃)导致cd71+红细胞前体扩增增加(参见图10,“37”对“39”和“37+”pic”对“39+pic”)。然而,添加pic导致cd71+红细胞前体扩增减少(参见图10,“37”对“37+pic”和“39”对“39+pic”)。图11示出总细胞(总细胞扩增)在不同测试培养条件下14天内的倍数扩增。使用轻度高温(39℃)导致总细胞扩增增加(参见图11,“37”对“39”和“37+pic”对“39+pic”)。然而,添加pic导致总细胞扩增减少(参见图11,“37”对“37+pic”和“39”对“39+pic”)。9.2轻度高温和pic对cd34+细胞(hsc)和cd34+/cd71+细胞(红系祖细胞)在红细胞分化培养基中扩增的加性效应图12和13分别示出cd34+细胞和cd34+/cd71+细胞(红系祖细胞)在不同测试培养条件下14天内的倍数扩增。有意思的是,这些结果示出使用轻度高温(39℃)和pic对cbcd34+细胞(图12)和cbcd34+/cd71+细胞(红系祖细胞)(图13)在红细胞分化培养基中扩增都有加性效应。实施例10:不同细胞因子混合物对cd34+细胞(hsc)和cd34+/cd45ra-细胞(lt-hsc)在轻度高温和pic下扩增的影响实施例5中提供的结果示出,当使用补充有可商购获得的cc110细胞因子混合物的stemspantmacf培养基时,组合使用轻度高温(39℃)和pic导致cd34+细胞扩增增加,同时限制它们分化。这个实施例中提供的结果示出,利用自制(hm)细胞因子混合物,cbcd34+hsc在轻度高温(39℃)和pic下可以获得协同扩增。如实施例6.1中所述从人类脐带血(cb)获得人类cbcd34+富集细胞,并在一般如实施例6.4中所述有利于自我更新的条件下,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.5中所述测定细胞计数和活力。图14示出在补充有cc110细胞因子混合物(图14a)或自制(hm)细胞因子混合物(图14b)的stemspantmacf培养基中培养的cbcd34+细胞(造血干细胞)的倍数扩增。图15示出在补充有cc110细胞因子混合物(图15a)或自制(hm)细胞因子混合物(图15b)的stemspantmacf培养基中培养的cbcd34+/cd45ra-(长期造血干细胞;lt-hsc)细胞的倍数扩增。表3示出在补充有自制(hm)或cc110细胞因子混合物的stemspantmacf培养基中培养cbcd34+细胞14天后每个指示的hsc亚群的百分比。表3.在补充有hm或cc110细胞因子混合物的stemspantmacf培养基中培养的cd34+细胞的表型分析实施例11:不同基本培养基和细胞因子混合物对cd34+细胞(hsc)和cd34+/cd45ra-细胞(lt-hsc)在轻度高温和pic下扩增的影响这个实施例中提供的结果示出,利用可商购获得的培养基和不同细胞因子混合物,cbcd34+hsc和cd34+/cd45ra-lt-hsc在轻度高温(39℃)和pic下可以获得协同扩增。如实施例6.1中所述从人类脐带血(cb)获得人类cbcd34+富集细胞,并在一般如实施例6.4中所述有利于自我更新的条件下,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.5中所述测定细胞计数和活力。图16示出在补充有cc110细胞因子混合物(图16a)或自制(hm)细胞因子混合物(图16b)的stemspantmsfem培养基中培养的cbcd34+细胞(造血干细胞)的倍数扩增。图17示出在补充有cc110细胞因子混合物(图17a)或自制(hm)细胞因子混合物(图17b)的stemspantmsfemii培养基中培养的cbcd34+细胞(造血干细胞)的倍数扩增。图18示出在补充有cc110细胞因子混合物(图18a)或自制(hm)细胞因子混合物(图18b)的stemspantmacf培养基中培养的cbcd34+细胞(造血干细胞)的倍数扩增。图18c示出在补充有bs1细胞因子混合物的stemspantmsfem培养基中,在轻度高温下和在存在(“39”)或不存在(“ctl”)pic下培养的cbcd34+/cd45ra-细胞(长期造血干细胞;lt-hsc)的倍数扩增。表4示出来自在利用cc110或自制(hm)细胞因子混合物的多种基本培养基中培养的cbcd34+细胞的长期造血干细胞(lt-hsc)(cd34+/cd45ra-)的倍数扩增。表4.在多种基本培养基和细胞因子混合物中培养的cd34+/cd45ra-细胞(lt-hsc)的扩增表5示出源自在补充有cc110或自制(hm)细胞因子混合物的培养基(sfem、sfemii或stemspanacf(acf))中培养14天的cbcd34+细胞的每个指示的hsc亚群的百分比。表5.在不同基本培养基中和在不同细胞因子混合物中培养的cd34+细胞的表型分析图18c示出在补充有bs1细胞因子混合物的stemspantmsfem培养基中培养的cbcd34+/cd45ra-细胞(长期造血干细胞;lt-hsc)的倍数扩增。这些结果示出,已知促进巨核细胞祖细胞(cd34+/cd41+)扩增的细胞培养基也能够扩增自我更新lt-hsc。实施例12:组合使用轻度高温和pic2或pic对cd34+细胞(hsc)、cd34+/cd45ra-细胞(lt-hsc)和cd34+/cd38-/cd45ra-细胞的扩增的影响如实施例6.1中所述从人类脐带血(cb)获得人类cbcd34+富集细胞,并在一般如实施例6.4中所述有利于自我更新的条件下,在补充有自制(hm)细胞因子混合物的stemspantmacf培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic2下培养(参见实施例7.4)。如实施例6.5中所述测定细胞计数和活力。图19、20和21分别示出cd34+细胞(造血干细胞)、cd34+/cd45ra-细胞(lt-hsc)和cd34+/cd38-/cd45ra-细胞(majeti等人,2007)在培养7、10和14天后的倍数扩增。图22示出cd34+/cd38-/cd45ra-细胞在轻度高温(39℃)和pic下培养14天后对cbcd34+/cd38-/cd45ra-细胞在补充有自制(hm)细胞因子混合物的stemspantmacf培养基中培养14天后的扩增的倍数扩增。数据代表四个独立实验的平均值。实施例13:组合使用轻度高温和pic对动员外周血(mpb)cd34+(hsc)、cd34+/cd45ra-(lt-hsc)和cd34+/cd38-/cd45ra-细胞的扩增的影响如实施例6.1中所述获得人类g-csf动员外周血cd34+富集细胞,并在一般如实施例6.4中所述有利于自我更新的条件下,在补充有自制(hm)细胞因子混合物的stemspantmacf培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.5中所述测定细胞计数和活力。图23、24和25分别示出cd34+细胞(造血干细胞)、cd34+/cd45ra-细胞(lt-hsc)和cd34+/cd38-/cd45ra-细胞在培养10、14和17天后的倍数扩增。实施例14:组合使用轻度高温和pic对骨髓cd34+(hsc)、cd34+/cd45ra-(lt-hsc)和cd34+/cd38-/cd45ra-细胞的扩增的影响如实施例6.1中所述获得人类骨髓(bm)cd34+富集细胞,并在一般如实施例6.4中所述有利于自我更新的条件下,在补充有自制(hm)细胞因子混合物的stemspantmacf培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.5中所述测定细胞计数和活力。图26、27和28分别示出cd34+细胞(造血干细胞)、cd34+/cd45ra-细胞(lt-hsc)和cd34+/cd38-/cd45ra-细胞在培养10、14和17天后的倍数扩增。实施例15:组合使用轻度高温和pic对cbcd34+/aldhbright细胞的扩增的影响如实施例6.1中所述从人类脐带血(cb)获得人类cbcd34+富集细胞,并在一般如实施例6.4中所述有利于自我更新的条件下,在补充有自制(hm)细胞因子混合物的stemspantmacf培养基中,在存在或不存在轻度高温(39℃)和/或存在或不存在嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.5中所述测定细胞计数和活力。图29示出cd34+/aldhbright细胞在培养21天后的倍数扩增。这些结果表明,组合使用轻度高温和pic导致hsc的这个亚群的协同扩增。实施例16:将在轻度高温和pic下体外扩增的人类cbcd34+细胞(hsc)移植和植入到免疫缺陷小鼠中如实施例6.1中所述从人类脐带血(cb)获得人类cbcd34+富集细胞,并在一般如实施例6.4中所述有利于自我更新的条件下,在补充有自制(hm)细胞因子混合物的stemspantmacf培养基中,在存在轻度高温(39℃)和嘧啶并吲哚化合物pic下培养(参见实施例2)。如实施例6.8中所述将新cbcd34+细胞或已经扩增12天的cbcd34+细胞移植到免疫缺陷小鼠中。与只移植pbs的小鼠相比,观察到移植体外扩增cbcd34+细胞的小鼠的骨髓中的人类cd45+细胞百分比增加,表明移植成功(数据未示出)。参考文献cortinetal.,(2005).efficientinvitromegakaryocytematurationusingcytokinecocktailsoptimizedbystatisticalexperimentaldesign.exphematol33(10):1182-1191.faresetal.,(2014).cordbloodexpansion.pyrimidoindolederivativesareagonistsofhumanhematopoieticstemcellself-renewal.science345(6203):1509-1512.majetietal.,(2007).identificationofahierarchyofmultipotenthematopoieticprogenitorsinhumancordblood.cellstemcell1(6):635-645.proulxetal.,(2004).increasedmegakaryopoiesisinculturesofcd34-enrichedcordbloodcellsmaintainedat39degreesc.biotechnolbioeng88(06):675-680.robertetal.,(2011).glycoproteinibαreceptorinstabilityisassociatedwithlossofqualityinplateletsproducedinculture.stemcellsanddevelopment20(03):379-390.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1