核酸检测用设备和核酸检测方法与流程
本发明涉及核酸检测用设备和核酸检测方法。
背景技术:
随着基因工程的发展,基因检查被用于病原体或癌细胞的检测、细胞动力学的分析、体质检查、药品的有效性检查等。基因检查一般由标本的采集工序、从标本制备核酸的工序、核酸的扩增反应工序和/或标记反应工序、经扩增和/或标记的核酸的检测工序构成。
在检测工序中,开发并利用了能够在固相载体上捕获、检测经扩增和/或标记的核酸的横向流动型(lateralflow-type)(专利文献1)、浸渍棒型(dipstick-type)(专利文献2)和阵列型(array-type)(专利文献3)等核酸检测用设备。这些核酸检测用设备中通常设计有用于检测目标核酸的扩增和/或标记反应产物的目标检测部、和用于检测作为对照的预先添加的对照核酸(内部标准物质)的扩增和/或标记反应产物的对照检测部。对照检测部用于评价扩增反应和/或标记反应是否正常进行,具体而言,通过检测对照检测部中的信号,评价酶等试剂是否正常发挥功能、以及实验操作是否没有问题且恰当地进行,并用于确认检查结果的可靠性。
现有技术文献
专利文献
专利文献1:日本特开2013-247968号公报
专利文献2:日本特开2014-057565号公报
专利文献3:日本特开2004-502929号公报
技术实现要素:
发明所要解决的课题
本发明者们发现,现有的核酸检测用设备中,即使试剂或实验操作没有问题,应在对照检测部中得到的信号也可能消失或降低。
用于解决课题的方法
本发明者们惊奇地查明,例如在多重pcr等中,如果反应体系内存在大量的目标核酸,则有时目标核酸会优先扩增,对照核酸的扩增反应和/或标记反应受到抑制,对照检测部的信号消失或变得微弱。
进而发现,通过在核酸检测用设备的对照检测部中除了对照核酸以外,还一并捕获、检测至少一种目标核酸,可防止对照检测部的信号消失或降低,从而能够稳定地获得高的信号。进而,制作利用了本方法的核酸检测用设备,完成了本发明。
即,本发明如下所述。
(1)一种核酸检测用设备,其特征在于,其具有一个以上的目标检测部和对照检测部;其中,在所述目标检测部中固定有用于捕获目标核酸的探针,并且在所述对照检测部中固定有用于捕获对照核酸的探针和用于捕获所述目标核酸的一种以上的探针。
(2)在(1)所述的核酸检测用设备的更优选方式中,所述目标核酸和所述对照核酸是经过扩增工序后的扩增反应产物。
(3)在(1)所述的核酸检测用设备或(2)所述的优选方式的核酸检测用设备的更优选方式中,所述探针是核酸或蛋白。
(4)在(1)所述的核酸检测用设备或者(2)或(3)所述的优选方式的核酸检测用设备的更优选方式中,所述设备是色谱型设备。
(5)一种核酸检测用试剂盒,其包含(1)所述的核酸检测用设备或(2)~(4)中任一项所述的优选方式的核酸检测用设备、对照用模板核酸、核酸扩增酶、核酸扩增反应用试剂、核酸检测反应用试剂。
(6)一种核酸检测方法,其用于检测一种以上的目标核酸和对照核酸;其包含:
(a)使用引物和模板核酸、核酸扩增反应用试剂,在同一反应容器内同时进行核酸扩增反应,对所述一种以上的目标核酸和所述对照核酸进行扩增的工序;
(b)使所述一种以上的目标核酸与固定在固相载体上的目标检测部的探针结合的工序;
(c)使所述一种以上的目标核酸和所述对照核酸与固定在所述固相载体上的对照检测部的一种以上的探针结合的工序;
(d)对所捕获的所述目标核酸和所述对照核酸进行标记,并检测来自所述目标核酸和所述对照核酸的信号的工序。
(7)在(6)所述的核酸检测方法的更优选方式中,所述探针是核酸或蛋白。
作为本申请优先权基础的日本专利申请号2015-167198号的公开内容包含在本说明书中。
发明效果
根据本发明,由于可防止核酸检测用设备中的对照检测部的信号消失或降低而能够稳定地得到高的信号,因此可容易地确认检查结果的可靠性。
附图说明
图1是本发明的横向流动型设备的图(俯视图)。
图2是本发明的浸渍棒型设备的图。
图3是本发明的阵列型设备的图。
图4是本发明的实施例2的图。
图5是本发明的比较例2、8的图。
图6是本发明的实施例4的图。
图7是本发明的比较例4的图。
图8是本发明的实施例5的图。
图9是本发明的比较例5的图。
图10是本发明的实施例7的图。
图11是本发明的比较例7的图。
图12是本发明的实施例8的图。
图13是本发明的横向流动型设备的图(截面图)。
具体实施方式
以下说明可用于本发明的核酸检测方法的标本的采集、从标本制备核酸、核酸的扩增以及核酸的检测的优选方式。
<标本的采集工序>
对于作为用于检测目标核酸的存在的对象的标本,只要是有含有核酸可能的标本,则没有特别限制。例如可列举出动物或植物的细胞、组织、全血、血清、淋巴液、骨髓液、组织液、尿、精液、阴道液、羊水、泪液、唾液、汗、乳汁等体液,外泌体等细胞来源的囊泡、粪便、咽喉液、痰、细菌、病毒、类病毒等。关于标本的采集,可以利用以往公知的各种方法。
本发明中的核酸大致分为天然型核酸和非天然型核酸,“天然型核酸”是指以核苷酸为基本单元、各核苷酸之间通过糖的3’位和5’位碳的磷酸二酯键连接的多核苷酸。作为天然型核酸,可列举出dna或rna等脱氧核糖核苷酸或核糖核苷酸的聚合物。“非天然型核酸”是指除了上述天然的核苷酸之外,还进一步包含非天然的核苷酸的核酸,非天然的核苷酸是指核苷酸的碱基部分等经过人工改性的核苷酸或与人工制作的核苷酸具有类似性质的核苷酸类似物,例如可列举出黄嘌呤核苷类和二氨基嘧啶类等。
本发明中的目标核酸是指作为检测对象的核酸,只要含有目标序列,则没有特别限定,可例示出来自上述标本的基因组dna、质粒dna、ctdna(cfdna)、mrna、mirna、lncrna或扩增子等。本说明书中,有时将对标本中所含的目标核酸进行扩增而得到的扩增反应产物也称为“目标核酸”。
本发明中的对照核酸是指在检测目标核酸时用于确认操作、试剂没有问题的作为内部标准使用的核酸,只要是发挥该功能的核酸,则没有特别限定。本发明中,有时将对在核酸扩增反应中用作模板核酸的对照用模板核酸进行扩增而得到的扩增反应产物也称为“对照核酸”。
<从标本制备核酸的工序>
对于从标本中制备在后述的工序a中用作模板核酸的核酸的工序,只要能够从标本中提取或分离、精制核酸,则其方法没有特别限定。作为提取方法的一个例子,可列举出利用热或超声波等的物理破碎、利用碱性试剂、有机溶剂、表面活性剂等药品的破碎,利用溶菌酶或蛋白酶k等酶的破碎。作为分离、精制的一个例子,可例示出结合洗脱法、沸石等离子交换树脂、离心分离等,但只要是使用制备后的核酸作为模板核酸、其后的核酸扩增反应等生化反应可没有问题地进行的方法,则没有特别限定。另外,也可以省略该工序,直接将标本作为模板核酸的供给源供给至核酸扩增反应。
<核酸的扩增工序(工序a)>
本发明方法的工序a是使用引物和模板核酸、核酸扩增反应用试剂(核酸扩增试剂)、在同一反应容器内同时进行核酸扩增反应而将上述一种以上的目标核酸和上述对照核酸扩增的工序。
工序a中,模板核酸含有有含有目标核酸可能的核酸(典型地为来自上述标本的核酸)和对照核酸。作为模板核酸,有时将添加到核酸扩增反应体系中的对照核酸也称为“对照用模板核酸”。
“在同一反应容器内同时进行核酸扩增反应”是指在一个反应容器内一起进行上述一种以上的目标核酸的核酸扩增反应和上述对照核酸的核酸扩增反应。因此,工序a中使用的引物包含能够分别扩增一个以上的目标核酸的引物组和能够扩增对照核酸的引物组。
工序a优选是使用带标记物的引物组作为上述引物进行核酸扩增反应、制备带有两种标记物的扩增反应产物的工序。
带标记物的引物表示在引物上带有标记物的核酸扩增用引物,可以用于制备带有标记物的扩增反应产物。
本发明中的引物是指特异性识别目标核酸或对照核酸、成为核酸扩增反应中的伸长起点的5~80个碱基的单链核酸。具体而言,各引物的碱基序列是目标核酸或对照核酸的目标碱基序列(扩增对象碱基序列)中的3’末端侧,或是可与目标碱基序列的互补碱基序列中的3’末端侧发生杂交的序列,一般是与目标碱基序列的3’末端侧的碱基序列互补的碱基序列,或者是与目标序列的互补碱基序列的3’末端侧互补的碱基序列。这里,“目标碱基序列”是目标核酸或对照核酸的待检测的碱基序列或其互补碱基序列,当目标核酸或对照核酸是双链核酸时,是指双链核酸中任一条链的核酸的碱基序列。引物只要能够与目标核酸或对照核酸特异性结合,则也可以具有碱基缺失、插入和错配部位。这里规定的碱基序列的“3’末端侧”是指包含该规定碱基序列的3’末端的碱基的由连续多个碱基(典型地为5~80个碱基)构成的部分碱基序列。
本发明中,碱基序列x与碱基序列y“能够杂交”是指在严格条件下,包含碱基序列x的多核苷酸(特别是dna)与包含碱基序列y的多核苷酸(特别是dna)杂交而与不含碱基序列y的多核苷酸不发生杂交。即,杂交是指特异性杂交。这里,“严格条件”是指形成所谓的特异性杂交体而不形成非特异性杂交体的条件。严格条件例如可以根据本发明中的引物和其互补链的熔解温度tm(℃)和杂交溶液的盐浓度等来确定,例如可以参照greenandsambrook,molecularcloning,4thed(2012),coldspringharborlaboratorypress。具体而言,可以根据在southern杂交时的温度、溶液中所含的盐浓度以及在southern杂交的洗涤工序时的温度、溶液中所含的盐浓度来设定严格条件。更详细而言,作为严格条件,例如在杂交工序中,钠浓度为25~500mm,优选为25~300mm,温度为比由多核苷酸序列确定的tm稍低的温度(例如比tm低0~约5℃的温度),例如为40~68℃、优选为40~65℃。更具体地,杂交可以在1~7×ssc、0.02~3%sds、温度为40℃~60℃下进行。另外,也可以在杂交之后进行洗涤工序,洗涤工序例如可以在0.1~2×ssc、0.1~0.3%sds、温度为50~65℃下进行。
用于扩增目标核酸的引物构成为能够将用于标记的标记物与用于结合于固相载体的标记物结合而成的目标核酸生成为扩增反应产物。因此,可以使用一对带标记物的引物。另外,在一对引物中的一个或二者上未带有标记物的情况下,为了通过扩增反应生成含有带标记物的核苷酸的目标核酸的扩增反应产物,可以使用含有带有标记物的核苷酸源的核酸扩增反应用试剂。
同样地,用于扩增对照核酸的引物构成为能够将用于标记的标记物与结合于固相载体的标记物结合而成的对照核酸生成为扩增反应产物。因此,可以使用一对带标记物的引物。另外,在一对引物中的一个或二者上未带有标记物的情况下,为了通过扩增反应生成含有带标记物的核苷酸的对照核酸的扩增反应产物,可以使用含有带有标记物的核苷酸源的核酸扩增反应用试剂。
这里,“用于标记的标记物”是指能够与后述的标记探针中的探针结合的标记物。另外,“用于结合于固相载体的标记物”是指能够与固定在后述的固相载体上的探针结合的标记物。
标记物为用于将用于标记扩增反应产物的物质或扩增反应产物结合到固相上而使用的物质,表示其本身不发出信号的物质。例如可列举出核酸、生物素、包括dig(地高辛)或fitc(异硫氰酸荧光素)等在内的半抗原、糖链等。当将单链的核酸作为标记物时,为了不因核酸扩增反应而被双链化,优选在标记物与引物之间插入由聚合酶反应抑制区域构成的间隔物结构。对于由聚合酶反应抑制区域构成的间隔物结构,只要能够抑制由聚合酶引起的核酸伸长反应并使标记物保持单链结构,则没有特别限定。例如除了偶氮苯修饰之外,还可列举出烷基链或聚氧化烯链、反向碱基修饰等各种天然或非天然型修饰的插入等。作为标记物使用的核酸的碱基数没有特别限定,例如可以为5~80。作为带标记物的核苷酸源,可列举出带有生物素或上所述半抗原的dntp(dutp、dctp等)。
本发明中的核酸扩增反应例如以pcr法等为代表,只要可扩增特定的核酸序列,则任何反应都可以。除pcr法外,可例示出lcr(ligasechainreaction,连接酶链反应)法、sda(stranddisplacementamplification,链替代扩增反应)法、rca(rollingcircleamplification,滚环扩增)法、cpt(cyclingprobetechnology,环状探针技术)法、q-betareplicaseamplificationtechnology(q-β复制扩增技术)法、ican(isothermalandchimericprimer-initiatedamplificationofnucleicacids,嵌合引物介导的核苷酸恒温扩增)法、lamp(loop-mediatedisothermalamplificatonofdna,环介导的dna恒温扩增)法、nasba(nucleicacidsequence-basedamplificationmethod,基于核酸序列的扩增法)法、及tma(transcriptionmediatedamplificationmethod,转录介导的扩增法)法、rpa(recombinasepolymeraseamplification,重组酶聚合酶扩增)法、siba(strandinvasionbasedamplification,基于链侵入的扩增)法等公知的方法。q-β复制扩增技术法、rca法、nasba法、sda法、tma法、lamp法、ican法、rpa法、siba法等是在恒定温度下进行扩增反应的方法,其他的pcr法或lcr法等是通过温度循环进行扩增反应的方法。
核酸扩增反应中使用的核酸扩增反应用试剂含有核酸扩增酶和核酸扩增反应所需的其它成分。
作为核酸扩增反应中使用的酶,没有特别限定,可以适当使用市售的聚合酶等。作为核酸扩增酶的一个例子,可列举出e.coli来源的dna聚合酶i、t4dna聚合酶、t7dna聚合酶、taqdna聚合酶,koddna聚合酶、pfudna聚合酶、bstdna聚合酶、bsudna聚合酶、phi29dna聚合酶、bcabestdna聚合酶、逆转录酶、sp6rna聚合酶、t7rna聚合酶、t3rna聚合酶等,但并不限于这些。
关于核酸扩增反应用试剂的其它成分后述。
通过上述工序a,作为核酸扩增产物分别得到了带有两种标记物的一种以上的目标核酸(其中,模板核酸中含有目标核酸的情况)和对照核酸。在各目标核酸或对照核酸中,上述两种标记物是上述用于标记的标记物和用于结合于固相载体的标记物。工序a中得到的各目标核酸和对照核酸的核酸扩增产物通常分别是各目标核酸或对照核酸被双链化且带有所述两种标记物的核酸扩增产物。
<核酸的检测工序(工序b、c、d)>
本发明的核酸检测方法除了上述工序a之外,还包括下述工序b、c、d。
(b)使上述一种以上的目标核酸与固定在固相载体上的目标检测部的探针结合的工序;
(c)使上述一种以上的目标核酸和上述对照核酸与固定在所述固相载体上的对照检测部的一种以上的探针结合的工序;
(d)对所捕获的上述目标核酸和上述对照核酸进行标记,并检测来自上述目标核酸和上述对照核酸的信号的工序。
工序a之后进行的这些工序b、c、d的顺序没有特别限定,可以同时进行部分或全部。
本说明书中,将工序b、c、d统称为“核酸的检测工序”。
核酸的检测工序典型地为,首先通过在上述扩增工序中得到的带有两种标记物的扩增反应产物(目标核酸和对照核酸)中的一个标记物与标记探针的结合形成复合物,然后利用另一个标记物将该复合物捕获在固相载体上,检测来自扩增反应产物的信号。
本发明中的探针是能够与标记物特异性结合的物质,可例示出抗dig或fitc等半抗原标记物的抗体、抗生物素标记物的抗生物素蛋白(也可以是链霉亲和素)、针对单链核酸标记物的互补链等,只要能够特异性识别标记物并结合,则没有特别限定。本发明中,探针优选是抗体、抗生物素蛋白等蛋白、或针对单链核酸标记物的互补链等核酸。作为探针使用的核酸的碱基数没有特别限定,例如可以为5~80。
本发明中的标记探针是指探针与发出检测用信号的标记物质结合而成的物质。对于标记物质,可以适当选择使用以往公知的标记物质。例如可列举出荧光化合物、放射性同位素、电化学活性化合物、金属胶体粒子、着色粒子、颜料或染料等着色剂等。工序d中的信号的检测可以通过与标记物质对应的方法进行。信号的检测可以通过测定器或目视进行。例如,当使用金胶体粒子作为标记物质时,将伴随金胶体粒子的凝聚的红色着色作为信号进行检测。
本发明中的扩增反应产物(可以是扩增反应产物和标记探针的复合物)在固相载体上的捕获通过附加在扩增反应产物上的另一个标记物与固定在固相载体上的探针的结合来进行。将探针固定到本发明中的固相载体上的方法没有特别限制。例如,单链核酸探针可以通过其3’末端固定在载体上,也可以通过5’末端固定在载体上,也可以通过除各末端部以外固定在载体上,也可以通过一个以上的部分固定在载体上,也可以通过蛋白固定在载体上。作为这种通过蛋白固定的方法,可例示出在固相载体上涂布链霉亲和素,将生物素修饰探针固定的所谓的利用了生物素-抗生物素蛋白反应的方法。固定在固相载体上的探针可以具有对于载体的表面而言适当的间隔物。
<核酸检测用设备>
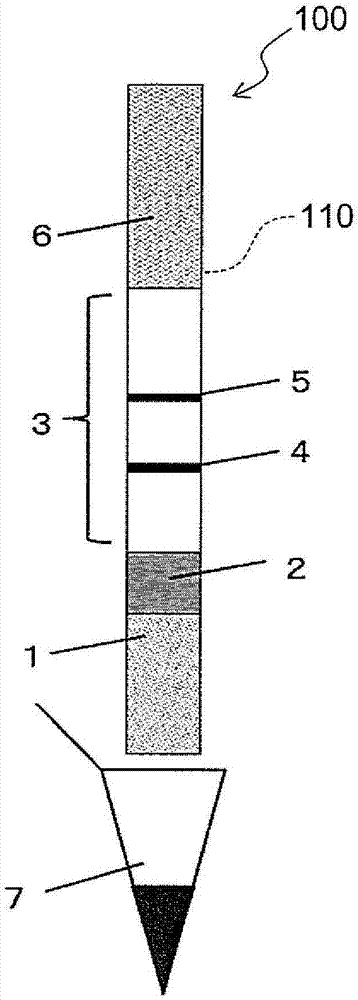
作为本发明中的核酸检测用设备的一个实施方式,可示出横向流动型设备(100)的示意图(俯视图为图1、截面图为图13)。只要能够检测出带标记物的扩增反应产物,则设备形状没有特别限定,作为其他形态,可例示出浸渍棒型设备(图2)、阵列型设备(图3)等。这些实施方式的核酸检测用设备都是色谱型设备的例子。这里,色谱型设备是指色谱载体形式的核酸检测用设备。
图1的横向流动型设备(100)是在塑料制的基材(110)上依次叠置用于添加带有标记物的扩增反应产物的样品垫(1)、配置有标记探针的结合垫(2)、固相载体(3)和吸收垫(6)而成的。固相载体(3)具有各自独立的一个以上的目标检测部(4)和对照检测部(5)。本发明中,为了方便起见,将样品垫一侧定义为上游,将吸收垫一侧定义为下游。
本发明中,目标检测部(4)表示固定有探针的区域,该探针特异性捕获来自带标记物的目标核酸的扩增反应产物。另外,对照检测部(5)表示固定有除了特异性捕获来自带有标记物的对照核酸的扩增反应产物的探针之外,还包括特异性捕获来自目标核酸的扩增反应产物的一种以上的探针的区域。被对照检测部捕获的来自目标核酸的扩增反应产物的种类和数量没有特别限定。
本发明中的对照检测部的位置没有特别限定,在横向流动型设备或浸渍棒型设备中,优选位于比目标检测部更靠下游的位置。
样品垫(1)、结合垫(2)、固相载体(3)及吸收垫(6)由塑料、玻璃、纤维素、硝化纤维素、尼龙、聚醚砜、聚偏氟乙烯和滤纸等多孔质体等的材质构成。它们可以由相同的材质构成,也可以由不同的部件构成。另外,载体的形状没有特别限定,优选为平板状。
由核酸的扩增工序获得的带有两种标记物的扩增反应产物被添加到样品垫(1)中。作为添加方法,可以直接滴加核酸扩增反应后的反应液,也可以与适当的展开溶液(例如磷酸缓冲液、tris缓冲液、good’s缓冲液、ssc缓冲液)混合后滴加。展开溶液中根据需要还可以含有表面活性剂、盐、蛋白、糖、核酸等。添加到样品垫(1)中的带标记物的扩增反应产物通过毛细管现象从图1中的样品垫(1)展开到吸收垫(6)的方向。
带有两种标记物的扩增反应产物从含有标记探针的结合垫(2)中通过时,与标记探针接触,通过一个标记物与标记探针结合。
接着,与标记探针结合了的扩增反应产物从固相载体(3)中通过时,通过另一个标记物与固定在固相载体上的探针的结合而被捕获到固相载体上。来自对照核酸的扩增反应产物仅被捕获到固相载体上的对照检测部(5),而来自目标核酸的扩增反应产物则被捕获到固相载体上的目标检测部(4)和对照检测部(5)这二者。由此,在由利用了多重pcr的核酸检测用设备进行的检测中,在反应体系内存在大量的目标核酸的条件下,即使在目标核酸优先扩增、对照核酸的扩增反应被抑制的情况下,来自目标核酸的扩增反应产物不仅在目标检测部、而且在对照检测部也被捕获而发出信号,因此可以防止对照检测部的信号消失或降低。
另外,只要是解决防止对照检测部的信号消失或降低这个课题的方法,则不限于提供对照检测部中固定有两种以上探针的设备的方法。例如,即使使用对照检测部固定有一种探针的设备,也能够解决该问题。为了使具有被目标检测部特异性捕获的标记物的目标核酸和具有被对照检测部特异性捕获的标记物的目标核酸这两种扩增,若分别设计针对它们的带标记物的引物并构建多重pcr体系,则即使使用对照检测部固定有一种探针的设备,也能够通过该检测部捕获上述两种中的一种扩增反应产物。因此,通过该方法也可以解决该课题。
关于使用了本发明的核酸检测用设备的结果判定,通过测定器或目视检测来自经过扩增和/或标记反应的目标核酸和对照核酸的信号,根据得到的结果进行判定。例如,当使用金胶体粒子作为标记物质时,将伴随金胶体粒子的凝聚的红色着色作为信号进行检测、判定。
作为本发明中的核酸检测用设备的其他形状,可列举出图2所示的浸渍棒型核酸检测用设备(100)、图3所示的阵列型核酸检测用设备(100)等。另外,也可以在横向流动型设备(100)、浸渍棒型设备(100)的固相载体(3)上具有多个阵列区域(4,5)。这些多个阵列区域可以分别固定有相同的探针,也可以分别固定有单独的探针。核酸检测用设备的形状也可以考虑捕获、检测的方式来设定。例如,在浸渍棒型设备(100)的情况下,对于供给到通常使用的微管的扩增和/或标记产物的溶液,优选具有能够浸渍设备的前端部(在图示的例子中为样品垫(1)一侧的端部)的宽度和形状。
<核酸检测用试剂盒>
关于本发明中的核酸检测用设备,除了核酸检测用设备之外,还可以是包含对照用模板核酸、核酸扩增酶、核酸扩增反应用试剂、核酸检测反应用试剂等、核酸检测所需的试剂类的检测试剂盒。本试剂盒中含有的对照用模板核酸的保存状态可以是液体、冷冻、干燥品的任意状态。检测试剂盒还可以进一步含有上述引物。
核酸扩增反应用试剂中含有核酸扩增酶、基质、缓冲液等成分,作为基质的一个例子,可列举出datp、dttp、dctp、dgtp、dutp、生物素标记dctp、生物素标记dutp等,但并不限于这些。作为缓冲液,优选含有镁、钾、缓冲剂、表面活性剂、还原剂等的缓冲液。核酸扩增反应用试剂的保存状态可以是液体、冷冻、干燥、冷冻干燥等的任意状态。
关于核酸检测反应用试剂(核酸检测用试剂),只要是用于检测的试剂则可以是任意试剂,例如可列举出上述展开溶液、标记抗体溶液、显色基质溶液、荧光基质溶液等,但并不限于这些。保存状态可以是液体、冷冻的任意状态。
实施例
以下,举出实施例具体地说明本发明。但是,本发明并不限定于这些实施例的技术范围。
在以下的实施例和比较例中,作为核酸检测用设备,制作并使用了图1所示方式的核酸检测用设备100。
<实施例1>
(1)标记探针和结合垫的制作
将5.5ml的goldcolloid(40nm,9.0×1010(粒子数/ml))((britishbiocellinternational公司制造)与100μm的硫醇化dna(序列号1)60μl混合,在50℃下孵育16小时。16小时后,添加250μl的0.1m磷酸缓冲液(ph为7.0)、150μl的1mnacl,在50℃下孵育24小时。24小时后,离心(5000g、15℃、20分钟),除去上清。添加6ml的5mm磷酸缓冲液(ph为7.0),颠倒混合后,再次离心(5000g、15℃、20分钟)。除去6ml的上清,加入1.5ml的5mm磷酸缓冲液(ph为7.0)。将该溶液作为结合有硫醇化dna和金胶体粒子的标记探针溶液。将制备的溶液添加到玻璃纤维制垫上使其均匀,然后用真空干燥机干燥,将其作为含有标记探针的结合垫2。
以下示出本工序中使用的硫醇化dna。
·硫醇化dna:5’-ctataaacccagtgaaaaatgttgcca-sh-3’(序列号1)。
(2)固定有探针的固相载体的制作
本实施例中的核酸检测用设备100具有从上游线状设置在固相载体3上的目标检测部4和对照检测部5。
目标检测部4通过将加入有100μm探针a(序列号2)200μl、2.5mg/ml的链霉亲和素200μl、1%bsa溶液100μl的混合溶液、对照检测部5通过将加入有100μm探针a(序列号2)和100μm探针b(序列号3)各200μl、2.5mg/ml链霉亲和素200μl、1%bsa溶液100μl、5mm磷酸缓冲液300μl的混合溶液用分配器线状涂布在作为固相载体的硝基纤维素膜(商品名:hi-flow180,millipore公司制)3上的两个部位,然后在40℃下风干30分钟来制作。
以下示出本工序中使用的探针。
·探针a:5’-atcacacattagctgtcactcgatgca-biotin-3’(序列号2)
·探针b:5’-tcaaagtcattgtaagtccgtactag-biotin-3’(序列号3)
(3)核酸检测用设备的制作
在由背衬片材构成的基材110上贴合本实施例(2)中制作的作为固相载体的硝基纤维素膜3、本实施例(1)中制作的结合垫2,作为试样添加部的通用性的样品垫1、用于吸收已展开的试样或标记物质的吸收垫6,制作能够检测经过扩增工序的扩增反应产物的核酸检测用设备100。
<比较例1>
对照检测部5线状涂布加入有100μm探针b(序列号3)200μl、2.5mg/ml链霉亲和素200μl、1%bsa溶液100μl、5mm磷酸缓冲液300μl的混合溶液,除此以外,以与实施例1同样的方法制作核酸检测设备100。比较例1的核酸检测用设备100除了配置于对照检测部5的探针不同以外,与实施例1的核酸检测设备100具有同样的结构。
<实施例2>
本实施例中,将序列号4记载的puc19(takarabio公司制造)设定为检测对象的目标核酸,将序列号5记载的λ噬菌体dna(eurofinsgenomics公司制造)设定为对照核酸。以各自为模板,使用带有单链核酸标记物的引物进行pcr,然后将扩增反应产物应用到实施例1中制作的设备100,检测从扩增反应产物和标记探针结合形成的复合物发出的显色信号。其检测方式如图4所示。在以下说明中使用的图4~12中,分别将核酸检测设备100的俯视图示于右侧,将俯视图的x-x’线剖面的示意图示于左侧,各截面示意图中省略基材110,同时为了便于说明,将样品垫1、结合垫2、固相载体3、目标检测部4、对照检测部5及吸收垫6的尺寸的比例适当变更进行绘制。
(1)带有单链核酸标记物的引物的设计
本研究中使用的带有单链核酸标记物的引物由与各核酸结合的引物主体部和在其5’末端侧通过聚合酶反应抑制区域(x)附加的单链核酸标记物构成。
作为用于扩增puc19的引物主体部,设计了puc19正向引物(序列号6)和puc19反向引物(序列号7)。另外同样,作为用于扩增λ噬菌体dna的引物主体部,设计了λ噬菌体dna正向引物(序列号12)和λ噬菌体dna反向引物(序列号13)。
此外,在各引物主体部的5’末端侧通过作为聚合酶反应抑制区域(x)的偶氮苯附加单链核酸标记物,设计带有单链核酸标记物的引物。作为puc19用的带有单链核酸标记物的引物,设计了在puc19正向引物的5’末端侧通过偶氮苯附加有单链核酸标记物t1(序列号8)的引物t1-x-f1(序列号10)、和在puc19反向引物上附加有单链核酸标记物t2(序列号9)的引物t2-x-r1(序列号11)。作为λ噬菌体dna用的带有单链核酸标记物的引物,设计在λ噬菌体dna正向引物上附加有单链核酸标记物t3(序列号14)的引物t3-x-f2(序列号15)和在λ噬菌体dna反向引物中附加有单链核酸标记物t2(序列号9)的引物t2-x-r2(序列号16)。
以下示出本研究中设计的引物的序列。
·puc19正向引物:5’-ggaaacagctatgaccatga-3’(序列号6)
·puc19反向引物:5’-tctatgcggcatcagagcag-3’(序列号7)
·标记物序列t1:5’-tcgagtgacagctaatgtgtgatt-3’(序列号8)
·标记物序列t2:5’-atttttcactgggtttatagt-3’(序列号9)
·引物t1-x-f1:5’-tcgagtgacagctaatgtgtgattxggaaacagctatgaccatga-3’(序列号10)
·引物t2-x-r1:5’-atttttcactgggtttatagtxtctatgcggcatcagagcag-3’(序列号11)
·λ噬菌体dna正向引物:5’-aagttctcgctggaagaggt-3’(序列号12)
·λ噬菌体dna反向引物:5’-aggattagaaggtcgaaccgt-3’(序列号13)
·标记物序列t3:5’-gtacggacttacaatgactttgat-3’(序列号14)
·引物t3-x-f2:5’-gtacggacttacaatgactttgatxaagttctcgctggaagaggt-3’(序列号15)
·引物t2-x-r2:5’-atttttcactgggtttatagtxaggattagaaggtcgaaccgt-3’(序列号16)
其中,x用下式(x)表示。
【化学式1】
(2)使用了带有单链核酸标记物的引物的pcr
使用上述引物组进行pcr。将序列号10、11的引物组、序列号15、16的引物组各15pmol、10pg的puc19和1pg的λ噬菌体dna加入到0.2ml的pcr用管中,按照takaraextaq(注册商标)(takarabio公司制造)的说明书,制备100μl的pcr样品液(a)。同样,制备含有上述引物组和100pg的puc19、1pg的λ噬菌体dna的pcr样品液(b),和含有上述引物组和1000pg的puc19、1pg的λ噬菌体dna的pcr样品液(c)。然后,将各管放置在热循环仪(geneamppcrsystem9700(appliedbiosystem公司制造))上,在95℃下热处理5分钟后,进行95℃30秒、55℃30秒、72℃30秒的循环35次,得到扩增反应产物。另外,制备代替puc19而含有灭菌水、1pgλ噬菌体dna的溶液,同样地进行pcr,制成阴性对照(d)。
(3)由核酸检测用设备检测扩增反应产物
将本实施例(2)中制备的(a)~(d)的扩增反应产物分别不通过加热等进行改性地应用到实施例1中制作的核酸检测用设备100的样品垫1上,进行检测试验。关于结果的判定,在应用后,10分钟后利用chromatoreaderc100166-10(浜松photonics公司制造)测定线的着色强度,进行判定。将该结果示于表1中。另外,表2中示出了chromatoreader测定值的判定标准。表2中的◎是着色极浓、目视确认容易的程度,○为尽管着色淡、但目视确认容易的程度,△为着色淡、目视确认虽然可以但有些困难的程度,×为不着色、无法目视确认的程度。在本说明书中,也可以将◎表示“4”、将○表示“3”、将△表示“2”、将×表示“1”。
表1
表2
<比较例2>
除了使用比较例1中制作的设备100以外,用与实施例2同样的方法检测显色信号。其检测方式如图5所示、判定结果如表1所示。
由于实施例1中制作的设备100的对照检测部5固定有包括固定在目标检测部4的探针8在内的两种探针8、9,因此由目标检测部4检测的目标核酸产生的信号也能被对照检测部5检测出。由此发现,能够防止目标核酸的优先扩增引起的对照检测部5的信号降低,即使在存在1000pg那样大量的目标核酸的情况下,也可以容易地检测出对照检测部5的信号。另一方面,当使用比较例1中制作的设备100时,在存在1000pg那样大量的目标核酸的情况下,对照检测部5的信号消失,无法判断是否适当地进行了pcr。
<实施例3>
(1)结合垫的制作
使用用1%bsa溶液稀释了8倍的goldcolloid(streptavidinconjugate,80nm、9.0×1010(粒子数/ml))(funakoshi公司制造)溶液,以与实施例1(1)的方法同样的方法制作结合垫2。
(2)固定有探针的固相载体的制作
目标检测部4使用加入有100μm探针a(序列号2)200μl,1mnacl200μl、1%bsa溶液100μl、5mm磷酸缓冲液500μl的混合溶液,对照检测部5使用加入有100μm探针a(序列号2)和100μm探针b(序列号3)各200μl、1mnacl200μl、1%bsa溶液100μl、5mm磷酸缓冲液300μl的混合溶液,用与实施例1(2)同样的方法制作固定有探针的固相载体3。
(3)核酸检测用设备的制作
使用由背衬片材构成的基材110、实施例1(2)中制作的固定有探针的硝基纤维素膜3和本实施例(1)中制作的结合垫2,用与实施例1(3)同样的方法制作核酸检测用设备100。
<比较例3>
对照检测部5线状涂布加入有100μm探针b(序列号3)200μl、1mnacl200μl、1%bsa溶液100μl、5mm磷酸缓冲液300μl的混合溶液,除此以外,用与实施例3同样的方法制备核酸检测设备100。
<实施例4>
与实施例2同样,将puc19(takarabio公司制造)设定为检测对象的目标核酸,将λ噬菌体dna(eurofinsgenomics公司制造)设定为对照核酸。以各自为模板,使用带有单链核酸标记物的正向引物和生物素修饰反向引物进行pcr,然后将扩增反应产物应用到实施例3中制作的设备100中,并检测从扩增反应产物和标记探针结合形成的复合物发出的显色信号。其检测方式如图6所示。
(1)生物素修饰引物的设计、带有单链核酸标记物的引物的选择
作为puc19正向引物,选择实施例2(1)中设计的序列号10的引物。另外,作为puc19反向引物,设计了引物主体部的5’末端侧进行了生物素修饰的引物biotinylated-r1(序列号17)。作为λ噬菌体dna正向引物,选择实施例2(1)中设计的序列号15的引物。另外,作为λ噬菌体dna反向引物,设计了对引物主体部的5’末端侧进行了生物素修饰的引物biotinylated-r2(序列号18)。
这些带有单链核酸标记物的引物和生物素修饰引物委托tsukubaoligoservice株式会社合成得到。
以下示出本研究中设计的引物组。
·引物biotinylated-r1:5’-biotin-tctatgcggcatcagagcag-3‘(序列号17)
·引物biotinylated-r2:5-biotin-aggattagaaggtcgaaccgt-3’(序列号18)
(2)使用了生物素修饰引物、带有单链核苷酸标记物的引物的pcr
使用(1)中设计的序列号10、17的引物组、序列号15、18的引物组,按照实施例2(2)记载的制备方法制备(a)~(d)的样品,在与实施例2(2)同样的条件下实施pcr。
(3)由核酸检测用设备检测扩增反应产物
将本实施例(2)中制备的(a)~(d)的扩增反应产物分别不通过加热等进行改性地应用到实施例3中制作的核酸检测用设备100的样品垫1上,进行检测试验。对于结果的判定,在应用后,10分钟后利用chromatoreaderc100166-10(浜松photonics公司制造)测定线的着色强度,进行判定。将该结果示于表3。
表3
<比较例4>
除了使用比较例3中制作的设备100以外,用与实施例4同样的方法检测显色信号。其检测方式如图7所示、结果如表3所示。
由于实施例3中制作的设备100的对照检测部5固定有包括固定在目标检测部4上的探针8在内的两种探针8、9,因此由目标检测部4检测的目标核酸产生的信号也能被对照检测部5检测出。由此,能够防止目标核酸的优先扩增引起的对照检测部5的信号降低,即使存在1000pg那样大量的目标核酸的情况下,也可以容易地检测出对照检测部5的信号。另一方面,当使用比较例3中制作的设备100时,在存在1000pg那样大量的目标核酸的情况下,对照检测部5的信号消失,无法判断是否适当地进行了pcr。
<实施例5>
与实施例2同样,将puc19(takarabio公司制造)设定为目标核酸,将λ噬菌体dna(eurofinsgenomics公司制造)设定为对照核酸。使用各自的模板、引物组、包含生物素标记16-dutp(rocheappliedscience公司制造)作为反应基质的dntp进行pcr,然后将扩增反应产物应用到实施例3中制作的设备100上,检测从扩增反应产物和标记探针结合形成的复合物发出的显色信号。将实施例3中制作的设备100的检测方式示于图8。
(1)带有单链核酸标记物的引物的选择
作为puc19正向引物,选择序列号10的引物,作为puc19反向引物,选择序列号7的引物。作为λ噬菌体dna正向引物,选择序列号15的引物,作为λ噬菌体dna反向引物,选择序列号13的引物。
(2)使用了带有单链核酸标记物的引物和生物素标记16-dutp的pcr
进行使用了上述引物组的pcr。序列号7、10的引物组、序列号13、15的引物组、附加在takaraextaq(注册商标)(takarabio公司制造)上的dntp、以及生物素标记16-dutp(rocheappliedscience公司制造),根据实施例2(2)记载的制备方法制备(a)~(d)的样品,在与实施例2(2)同样的条件下进行pcr。
(3)由核酸检测用设备检测扩增反应产物
将本实施例(2)中制备的(a)~(d)的扩增反应产物分别不通过加热等进行改性地应用到实施例3中制作的核酸检测用设备100的样品垫1上,进行检测试验。对于结果的判定,在应用后,10分钟后利用chromatoreaderc100166-10(浜松photonics公司制造)测定线的着色强度,进行判定。对于结果的判定,在应用后,10分钟后利用chromatoreaderc100166-10(浜松photonics公司制造)测定线的着色强度,进行判定。将该结果示于表4。
表4
<比较例5>
除了使用比较例3中制作的设备100以外,用与实施例5同样的方法检测显色信号。其检测方式如图9所示、结果如表4所示。
由于实施例3中制作的设备100的对照检测部5固定有包括固定在目标检测部4上的探针8在内的两种探针8、9,因此由目标检测部4检测的目标核酸产生的信号也能被对照检测部5检测出。由此,能够防止因目标核酸的优先增加而引起的对照检测部5的信号降低,即使在存在1000pg那样大量的目标核酸的情况下,也可以容易地检测出对照检测部5的信号。另一方面,当使用比较例3中制作的设备100时,在存在1000pg那样大量的目标核酸的情况下,对照检测部5的信号消失,无法判断是否适当地进行了pcr。
<实施例6>
(1)固定有探针的固相载体的制作
作为目标检测部4中使用的探针混合溶液,制备含有2.0mg/ml的抗dig抗体(rocheappliedscience公司制造)、2.5%蔗糖、20mmtbs(ph为8.0)的溶液。作为对照检测部5中使用的探针混合溶液,制备含有1.0mg/ml的抗dig抗体(rocheappliedscience公司制造)和抗fitc抗体(rocheappliedscience公司制造)、2.5%蔗糖、20mmtbs(ph为8.0)的溶液。使用各溶液,以与实施例1(2)同样的方法制作固定有探针的固相载体3。
(2)核酸检测用设备的制作
使用由背衬片材构成的基材110、作为本实施例(1)中制作的固相载体的硝基纤维素膜3和实施例1(1)中制作的结合垫2,以与实施例1(3)同样的方法制作核酸检测用设备100。
<比较例6>
作为对照检测部5中使用的探针混合溶液,制备加入有2.0mg/ml的抗fitc抗体(rocheappliedscience公司制造)、2.5%蔗糖、20mmtbs(ph为8.0)的混合溶液,线状涂布该混合溶液,除此以外,以与实施例6同样的方法制备核酸检测设备100。
<实施例7>
与实施例2同样,将puc19(takarabio公司制造)设定为目标核酸,将λ噬菌体dna(eurofinsgenomics公司制造)设定为对照核酸。在使用各模板、引物组进行pcr之后,将扩增反应产物应用到实施例6中制作的设备100上,检测从扩增反应产物和标记探针结合形成的复合物发出的显色信号。将使用了实施例6中制作的设备100的检测方式示于图10。
(1)dig修饰引物、fitc修饰引物的设计以及带有单链核酸标记物的引物的选择
作为puc19正向引物,设计了对引物主体部的5’末端侧进行了dig修饰的引物dig-f1(序列号19)。另外,作为puc19反向引物,选择序列号11的引物。作为λ噬菌体dna正向引物,设计了对引物主体部的5’末端侧进行了fitc修饰的引物fitc-f2(序列号20)。另外,作为λ噬菌体dna反向引物,选择序列号16的引物。
这些dig修饰引物、fitc修饰引物、带有单链核酸标记物的引物委托tsukubaoligoservice株式会社合成得到。
以下示出本研究中设计的引物组。
·引物dig-f1:5’-dig-ggaaacagctatgaccatga-3’(序列号19)
·引物fitc-f2:5’-fitc-aagttctcgctggaagaggt-3’(序列号20)
(2)使用了dig修饰引物、fitc修饰引物、带有单链核酸标记物的引物的pcr
进行使用了上述引物组的pcr。使用序列号11、19的引物组、序列号16、20的引物组,按照实施例2(2)记载的制备方法制备(a)~(d)的样品,在与实施例2(2)同样的条件下进行pcr。
(3)由核酸检测用设备检测扩增反应产物
将本实施例(2)中制备的(a)~(d)的扩增反应产物分别不通过加热等进行改性地应用到实施例6中制作的核酸检测用设备100的样品垫1上,进行检测试验。对于结果的判定,在应用后,10分钟后利用chromatoreaderc100166-10(浜松photonics公司制造)测定线的着色强度,进行判定。将该结果示于表5。
表5
<比较例7>
除了使用比较例6中制作的设备100以外,用与实施例6同样的方法检测显色信号。其检测方式如图11所示、结果如表5所示。
由于实施例6中制作的设备100的对照检测部5固定有包括固定在目标检测部4上的探针21在内的两种探针21、22,因此由目标检测部4检测的目标核酸产生的信号也能被对照检测部5检测出。由此,能够防止因目标核酸的优先增加而引起的对照检测部5的信号降低,即使存在1000pg那样大量的目标核酸的情况下,也可以容易地检测出对照检测部5的信号。另一方面,当使用比较例6中制作的设备100时,在存在1000pg那样大量的目标核酸的情况下,对照检测部5的信号消失,无法判断是否适当地进行了pcr。
<实施例8>
本实施例中,不是像此前的实施例那样将对照核酸捕获用和目标核酸捕获用这两种探针固定在对照检测部5的方法,而是通过构建标记物种类不同的两种目标核酸进行扩增的扩增反应体系,防止对照检测部5的信号的降低。具体而言,设计带标记物的引物,使具有能被目标检测部4特异性捕获的标记物的目标核酸、和具有能被对照检测部5特异捕获的标记物的目标核酸这两种目标核酸扩增,成为两种中的一种目标核酸能被对照检测部5捕获的设计。本实施例的检测方式示于图12。如图12所示,上述两种目标核酸中的一种的扩增反应产物被对照检测部5捕获。
与实施例2同样,将puc19(takarabio公司制造)设定为目标核酸,将λ噬菌体dna(eurofinsgenomics公司制造)设定为对照核酸。进行pcr后,将扩增反应产物应用到比较例1中制作的设备100上,检测从扩增反应产物和标记探针结合形成的复合物发出的显色信号。
(1)带有单链核酸标记物的引物的设计和选择
本研究中,准备两种引物组作为puc19引物组。首先,选择序列号10、11的引物作为第一个引物组。另外,设计在序列号6的正向引物的5’末端侧通过作为聚合酶反应抑制区域(x)的偶氮苯附加有单链核酸标记物t3(序列号14)的引物t3-x-f1(序列号21),将序列号11、21的组作为第二个引物组。作为λ噬菌体dna引物组,选择序列号15、16的引物组。这些带有单链核酸标记物的引物委托tsukubaoligoservice株式会社合成得到。
以下示出本研究中设计的引物。
·引物t3-x-f1:5’-gtacggacttacaatgactttgatxggaaacagctatgaccatga-3’(序列号21)
(2)使用了带有单链核酸标记物的引物的pcr
使用本实施例(1)中设计的序列号10、11的引物组、序列号11、21的引物组和序列号15、16的引物组这3种,按照实施例2(2)记载的制备方法制备(a)~(d)的样品。使用这些样品,在与实施例2(2)同样的条件下进行pcr。
(3)由核酸检测用设备检测扩增反应产物
将本实施例(2)中制备的(a)~(d)的扩增反应产物分别不通过加热等进行改性地应用到比较例1中制作的核酸检测用设备100的样品垫1上,进行检测试验。对于结果的判定,在应用后,10分钟后利用chromatoreaderc100166-10(浜松photonics公司制造)测定线的着色强度,进行判定。将该结果示于表6。
表6
<比较例8>
用与比较例2同样的方法检测显色信号。其检测方式如图5所示、结果如表6所示。
实施例8中,制备具有能被目标检测部4特异性捕获的标记物的目标核酸和具有能被对照检测部5特异性捕获的标记物的目标核酸这两种目标核酸,作为检测用设备100,使用目标检测部4、对照检测部5均固定有一种探针的设备。本实施例中,由于目标核酸不仅能被目标检测部4、而且能被对照检测部5检测出,因此如表6所示,即使在存在1000pg的目标核酸和1pg的对照核酸的条件下,也能够在对照检测部5中检测出来自目标核酸的信号。因此发现,通过制备具有两种标记物的目标核酸,能够防止对照检测部5的信号消失或降低。另一方面,比较例8中,在存在1000pg那样大量的目标核酸的情况下,对照检测部5的信号消失,无法判断是否适当地进行了pcr。
以上,参照实施方式和比较方式说明了本发明,但本发明不限于上述实施方式、比较方式。使用浸渍棒型设备100、阵列型设备100进行检测的方法、对经扩增和/或标记的产物进行热处理而以单链状态进行检测的方法、甚至使用糖链作为标记物、使用凝集素作为固定在载体上的探针的方法也能够实施本实施方式。
符号说明
1.样品垫
2.结合垫
3.保持有探针的载体
4.目标检测部
5.对照检测部
6.吸收垫
7.装有样品的试管
8.目标核酸捕获用探针
9.对照核酸捕获用探针
10.序列号8记载的标记物序列
11.目标核酸扩增反应产物
12.序列号1中记载的硫醇化dna
13.序列号9中记载的标记物序列
14.金胶体粒子
15.对照核酸扩增反应产物
16.序列号14中记载的标记物序列
17.生物素
18.链霉亲和素
19.5’末端结合dig
20.5’末端结合fitc
21.目标核酸捕获用抗dig抗体
22.对照核酸捕获用抗fitc抗体
100.设备
110.背衬片材
本说明书中引用的所有刊物、专利和专利申请通过引用而直接纳入本说明书中。
序列表
<110>株式会社钟化
<120>核酸检测用设备和核酸检测方法
<130>b150547
<150>jp2015-167198
<151>2015-08-26
<160>21
<170>patentinversion3.5
<210>1
<211>27
<212>dna
<213>artificial
<220>
<223>thioldna
<220>
<221>modified_base
<222>(27)..(27)
<223>modifiedwiththiol.
<400>1
ctataaacccagtgaaaaatgttgcca27
<210>2
<211>27
<212>dna
<213>artificial
<220>
<223>probea
<220>
<221>modified_base
<222>(27)..(27)
<223>modifiedwithbiotin.
<400>2
atcacacattagctgtcactcgatgca27
<210>3
<211>26
<212>dna
<213>artificial
<220>
<223>probeb
<220>
<221>modified_base
<222>(26)..(26)
<223>modifiedwithbiotin.
<400>3
tcaaagtcattgtaagtccgtactag26
<210>4
<211>2686
<212>dna
<213>cloningvectorpuc19
<223>template
<400>4
gcgcccaatacgcaaaccgcctctccccgcgcgttggccgattcattaatgcagctggca60
cgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatgtgagttagct120
cactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaat180
tgtgagcggataacaatttcacacaggaaacagctatgaccatgattacgccaagcttgc240
atgcctgcaggtcgactctagaggatccccgggtaccgagctcgaattcactggccgtcg300
ttttacaacgtcgtgactgggaaaaccctggcgttacccaacttaatcgccttgcagcac360
atccccctttcgccagctggcgtaatagcgaagaggcccgcaccgatcgcccttcccaac420
agttgcgcagcctgaatggcgaatggcgcctgatgcggtattttctccttacgcatctgt480
gcggtatttcacaccgcatatggtgcactctcagtacaatctgctctgatgccgcatagt540
taagccagccccgacacccgccaacacccgctgacgcgccctgacgggcttgtctgctcc600
cggcatccgcttacagacaagctgtgaccgtctccgggagctgcatgtgtcagaggtttt660
caccgtcatcaccgaaacgcgcgagacgaaagggcctcgtgatacgcctatttttatagg720
ttaatgtcatgataataatggtttcttagacgtcaggtggcacttttcggggaaatgtgc780
gcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagac840
aataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaacatt900
tccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccag960
aaacgctggtgaaagtaaaagatgctgaagatcagttgggtgcacgagtgggttacatcg1020
aactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaa1080
tgatgagcacttttaaagttctgctatgtggcgcggtattatcccgtattgacgccgggc1140
aagagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcaccag1200
tcacagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgccataa1260
ccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaaggagc1320
taaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccgg1380
agctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatggcaa1440
caacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaa1500
tagactggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctg1560
gctggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattgcag1620
cactggggccagatggtaagccctcccgtatcgtagttatctacacgacggggagtcagg1680
caactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagcatt1740
ggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcattttt1800
aatttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaac1860
gtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgag1920
atcctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcgg1980
tggtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagca2040
gagcgcagataccaaatactgttcttctagtgtagccgtagttaggccaccacttcaaga2100
actctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgctgcca2160
gtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgc2220
agcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctaca2280
ccgaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaa2340
aggcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttc2400
cagggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagc2460
gtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcgg2520
cctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttat2580
cccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgca2640
gccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaaga
<210>5
<211>120
<212>dna
<213>lambdaphargedna
<220>
<223>template
<400>5
atttcgctataagttctcgctggaagaggtagttttttcattgtactttaccttcatctc60
tgttcattatcatcgcttttaaaacggttcgaccttctaatcctatctgaccattataat120
<210>6
<211>20
<212>dna
<213>artificial
<220>
<223>puc19forwardprimer
<400>6
ggaaacagctatgaccatga20
<210>7
<211>20
<212>dna
<213>artificial
<220>
<223>puc19reverseprimer
<400>7
tctatgcggcatcagagcag20
<210>8
<211>24
<212>dna
<213>artificial
<220>
<223>tagsequencet1
<400>8
tcgagtgacagctaatgtgtgatt24
<210>9
<211>21
<212>dna
<213>artificial
<220>
<223>tagsequencet2
<400>9
atttttcactgggtttatagt21
<210>10
<211>45
<212>dna
<213>artificial
<220>
<223>primert1-x-f1
<220>
<221>misc_feature
<222>(25)..(25)
<223>nistheazobenzenerepresentedbyformula(1)of
thespecification.
<400>10
tcgagtgacagctaatgtgtgattnggaaacagctatgaccatga45
<210>11
<211>42
<212>dna
<213>artificial
<220>
<223>primert2-x-r1
<220>
<221>misc_feature
<222>(22)..(22)
<223>nistheazobenzenerepresentedbyformula(1)of
thespecification.
<400>11
atttttcactgggtttatagtntctatgcggcatcagagcag42
<210>12
<211>20
<212>dna
<213>artificial
<220>
<223>lambdaphargednaforwardprimer
<400>12
aagttctcgctggaagaggt20
<210>13
<211>21
<212>dna
<213>artificial
<220>
<223>lambdaphargednareverseprimer
<400>13
aggattagaaggtcgaaccgt21
<210>14
<211>24
<212>dna
<213>artificial
<220>
<223>tagsequencet3
<400>14
gtacggacttacaatgactttgat24
<210>15
<211>45
<212>dna
<213>artificial
<220>
<223>primert3-x-f2
<220>
<221>misc_feature
<222>(25)..(25)
<223>nistheazobenzenerepresentedbyformula(1)of
thespecification.
<400>15
gtacggacttacaatgactttgatnaagttctcgctggaagaggt45
<210>16
<211>43
<212>dna
<213>artificial
<220>
<223>primert2-x-r2
<220>
<221>misc_feature
<222>(22)..(22)
<223>nistheazobenzenerepresentedbyformula(1)of
thespecification.
<400>16
atttttcactgggtttatagtnaggattagaaggtcgaaccgt43
<210>17
<211>20
<212>dna
<213>artificial
<220>
<223>primerbiotinylated-r1
<220>
<221>modified_base
<222>(1)..(1)
<223>modifiedwithbiotin.
<400>17
tctatgcggcatcagagcag20
<210>18
<211>21
<212>dna
<213>artificial
<220>
<223>primerbiotinylated-r2
<220>
<221>modified_base
<222>(1)..(1)
<223>modifiedwithbiotin.
<400>18
aggattagaaggtcgaaccgt21
<210>19
<211>20
<212>dna
<213>artificial
<220>
<223>primerdig-f1
<220>
<221>modified_base
<222>(1)..(1)
<223>modifiedwithdig.
<400>19
ggaaacagctatgaccatga20
<210>20
<211>20
<212>dna
<213>artificial
<220>
<223>primerfitc-f2
<220>
<221>modified_base
<222>(1)..(1)
<223>modifiedwithfitc.
<400>20
aagttctcgctggaagaggt20
<210>21
<211>45
<212>dna
<213>artificial
<220>
<223>primert3-x-f1
<220>
<221>misc_feature
<222>(25)..(25)
<223>nistheazobenzenerepresentedbyformula(1)of
thespecification.
<400>21
gtacggacttacaatgactttgatnggaaacagctatgaccatga45
- 还没有人留言评论。精彩留言会获得点赞!