一种利用Q‑PCR检测混合益生菌中益生菌种类和含量的方法与流程
本发明涉及微生物发酵领域,具体涉及乳杆菌混合发酵后应用荧光定量PCR (Q-PCR)检测混合益生菌中益生菌种类和含量的方法。该方法可以用于菌体混合发酵后,对发酵液中各种菌体的生长情况及生长量作出定性、定量的有效评价。
背景技术:
益生菌是一类定植于人体肠道、生殖系统内,能产生确切健康功效从而改善宿主微生态平衡,对人体健康有重要作用的活的微生物的总称,广泛应用于食品、保健品和药品生产中。近年来,肠道微生物的研究越来越受到生物界的重视,异军突起成为了热门的研究领域。现已有大量献报道肠道微生物中的有益菌在预防和治疗疾病、改善胃肠环境等方面有显著作用。目前世界上研究的功能最强大的产品主要是复合活性益生菌,其广泛应用于生物工程、工农业、食品安全以及生命健康领域。本发明研究发现复合乳杆菌发酵能够调节肠道中微生物的平衡并且还能促进营养物质的吸收。
在正常的情况下,我们肠道内的有益菌群和有害菌群是处于一个相对平衡的状态的,它们相互制约、相互依赖地共存,维系着人体微生态的平衡。一旦肠道内菌群失去平衡,即有害菌群占优势时,食物中的蛋白质及其它物质会被转化成有害物质,这些物质会引起一些疾病发生,最常见的就是便秘、腹泻等。便秘的发生与结肠的PH值息息相关,有益菌通过降低结肠的pH值使之偏向于酸性,降低有害菌群的数量,调节肠道的正常蠕动,从而改善便秘。腹泻是肠道内菌群紊乱引起的排泄异常极端症状,严重时腹泻会引起脱水和身体电解质紊乱等,长期的慢性腹泻还会导致贫血、维生素缺乏、营养不良、抵抗力下降等。益生菌可迅速缓解腹泻,产酸,创造出一个不利于有害病毒和细菌存在的环境,抑制病原微生物的生存与生长;在肠粘膜形成紧密的微生物膜,阻挡致病菌入侵。
目前对多菌复合的发酵乳样本中乳杆菌的定性、定量检测方面缺乏科学、合理、快速的检测方法。传统生理生化办法易受选择培养基、培养条件、菌种特性等因素影响检测效率有限制。乳酸菌活菌数量是评价活性乳酸菌制晶质量的重要指标,平板菌落计数法是微生物学中最常见、最标准的一种活菌计数方法,但操作繁琐.耗时费力。在分子生物学检测方法中,荧光定量 PCR 技术更因具有快速、可定量、灵敏度高、重复性好、能检出死活细菌等特点成为了肠道微生态研究中重要的分子生物学方法之一。
利用荧光定量PCR检测混合益生菌,荧光定量 PCR 技术因具有快速、可定量、灵敏度高、重复性好、能检出死活细菌等特点成为了肠道微生态研究中重要的分子生物学方法之一。虽然国内外已有不少关于定量 PCR 检测方法建立与应用的报道,但系统的建立多种肠道菌群定量 PCR检测方法的研究较少。因此,本发明研究以肠道细菌16S rRNA为目的基因,引入对 PCR 反应影响更小的SYBR-Green I荧光染料,旨在系统的建立用于检测唾液乳杆菌、发酵乳杆菌、植物乳杆菌、鼠李糖乳杆菌、短双歧杆菌、副干酪乳杆菌、干酪乳杆菌、粪肠乳杆菌、纳豆芽孢杆菌、保加利亚乳杆菌以及肠道菌群总量的定量 PCR 方法,以期为肠道菌群的研究提供快速、特异、可定量的检测手段,为微生物相关的卫生安全性评价,益生菌开发以及其他与肠道菌群有关的研究提供技术支持。
技术实现要素:
为了解决现有技术存在的问题,本发明的目的是提供一种检测混合益生菌中菌种类型和含量的方法。
为了实现本发明目的,本发明提供了一种利用Q-PCR检测混合益生菌中菌种类型和含量的方法,所述方法为:将混合益生菌在MRS培养基中发酵,进行Q-PCR检测。
前述方法具体技术方案包括以下步骤:
(1)MRS培养基配置:准确称量葡萄糖、蛋白胨、牛肉膏、酵母膏 、乙酸钠、磷酸氢二钾、柠檬酸氢二铵、硫酸镁、硫酸锰、吐温-80 等药品,搅拌至溶解,115 ℃灭菌30 min;
(2)益生菌的发酵培养:将各菌种单独培养得种子液,将种子液等比混合后加至灭菌MRS培养基中;
(3)引物的设计:根据每种益生菌16S rRNA中DNA特异性基因片段设计引物;
(4)基因组的提取:利用 Easy Bacteria Genomic DNA Kit提取混合菌基因组
(5)荧光定量PCR:设置荧光阈值、PCR条件等参数,测量得到Ct值,换算成活菌数。
本发明以利用荧光定量PCR方法在混合益生菌中精确检测益生菌。设计特异性引物,能够准确的检测益生菌的生长和活菌数,从而为之后制备益生菌微生态制剂提供定量依据。
附图说明
图1:植物乳杆菌、干酪乳杆菌、保加利亚乳杆菌,粪肠乳杆菌、发酵乳杆菌、唾液乳杆菌、纳豆芽孢杆菌单菌发酵菌的活菌数。
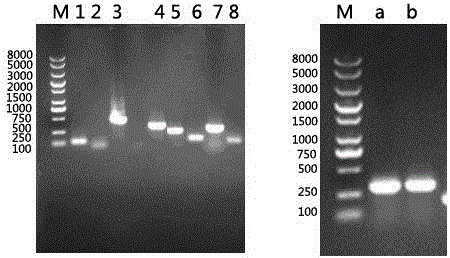
图2: 植物乳杆菌、干酪乳杆菌、保加利亚乳杆菌,粪肠乳杆菌、发酵乳杆菌、唾液乳杆菌、纳豆芽孢杆菌PCR后结果。
图3: 荧光定量PCR方法检测混合益生菌的结果。
具体实施方式
以下通过实例形式的具体实施方式对本发明作进一步的详细说明。
实施例1:
(1)混合益生菌的发酵:精准称量MRS培养基中成分(葡萄糖、蛋白胨、牛肉膏、酵母膏、乙酸钠、磷酸氢二钾、柠檬酸氢二铵、硫酸镁、硫酸锰、吐温-80) 115 ℃灭菌30 min。将各菌种单独培养得种子液,将种子液等比混合后,按照3%(V:V)的接种比接种到MRS发酵培养基中,发酵12小时;
(2)基因组提取:将步骤(1)制备得到的发酵溶液取出1ml,12000转/min离心1分钟,弃上清。先用500 μL 70%乙醇将菌体重悬,冰浴20min,加入溶菌酶重悬,37 ℃孵育60 min,加入蛋白酶,55℃孵育15min,加入RnaseA静置2 min,加入Binding Buffer 400μL混匀,加入到离心柱中,弃掉流出液,先后用Wash Buffer和Clean Buffer洗涤两次,用Elution Buffer 洗脱DNA。提取的基因组用1%琼脂糖凝胶电泳检测;
(3)引物的设计:通过网站NCBI获得各种菌体的16SrDNA序列,根据BLAET对比结果寻找出各个益生菌的特异性片段,使用软件Primer5设计相应引物;
(4)标准曲线的建立:以鼠李糖乳杆菌为例,使用鼠李糖乳杆菌标准菌株,按照1)中所述培养方法培养标准菌株,按照2)中提取基因组的具体方法,获得鼠李糖乳杆菌基因组。使用鼠李糖乳杆菌特异引物进行PCR,获得大量鼠李糖乳杆菌特异DNA片段,2%琼脂糖凝胶电泳检测PCR条带大小,并准确切割条带,通过胶回收以获得高纯度的PCR条带。使用NANODROP 1000TM UV/VIS Spectrophotometer 测定胶回收产物浓度。对该胶回收产物进行梯度稀释,稀释后的各梯度同时进行荧光定量PCR,建立以log(DNA拷贝数/μL)为横坐标、Ct值为纵坐标的标准曲线;拷贝数计算公式如下:拷贝数=【6.02×1023×胶回收产物浓度(g/μL)×模板体积(μL)】/【660×PCR片段碱基数(bp)】
(5)荧光定量PCR检测:将混合基因组稀释105倍,荧光定量PCR反应体系为模板1μL、10μM上游引物0.4μL、10μM下游引物0.4μL、superReal PreMix plus10μL、RoXReference Dye 0.4μL、ddH2O 7.8μL。PCR体积20μL。荧光定量PCR:94℃预变性30秒、94℃变性5秒、60℃退火34秒、72℃延伸10秒,变性退火延伸循环40次,得到Ct值,根据标准曲线和阳性对照得活菌数。
- 还没有人留言评论。精彩留言会获得点赞!