一种制备4‑氨基喹啉衍生物的方法与流程
本发明属于有机化学领域,涉及一种4-氨基喹啉衍生物,具体来说是一种制备4-氨基喹啉衍生物的方法。
背景技术:
喹啉广泛存在于生物界,喹啉可从煤焦油的洗油或萘油中提取。喹啉系萘状含氮杂环化合物。即在1-位上N 原子替代了CH,故又称氮杂萘, 喹啉在医药和染料工业有着重要的应用。目前,文献报道喹啉的合成路线有多条,其中传统的工业化生产路线为煤焦油提取法。由于受到资源限制和提取设备复杂,加上煤焦油中喹啉及其同系物品种有限,不能得到想要得到的含喹啉环的化合物,化学合成法应运而生。目前已开发出多种行之有效的工业化化学合成路线,关于喹啉类化合物的报道均是采用高温、强酸等条件,得到最终产物。这种方法条件苛刻,过程繁琐,后处理麻烦等。因此,一种高效的合成喹啉化合物的反应是非常有应用前景的。
技术实现要素:
针对现有技术中的上述技术问题,本发明提供了一种制备4-氨基喹啉衍生物的方法,所述的这种制备4-氨基喹啉衍生物的方法要解决现有技术中的制备4-氨基喹啉衍生物的方法工艺复杂、过程繁琐,后处理麻烦、能耗高的技术问题。
本发明提供了一种制备4-氨基喹啉衍生物的方法,包括如下步骤:
(1)称取亚铜催化剂、邻氨基苯甲腈、添加剂、无取代基或带取代基端炔化合物、无取代基或带取代基苯磺酰叠氮,所述的添加剂为三乙胺、四甲基乙二胺、1,8-二氮杂二环十一碳-7-烯、碳酸钾或者碳酸铯中的任意一种,所述的带取代基的端炔为2-甲氧基苯乙炔、3-甲基苯乙炔、4-甲基苯乙炔、2-氯苯乙炔、3-氯苯乙炔、4-甲氧基苯乙炔、4-乙基苯乙炔、4-氟苯乙炔、苯乙炔、1-己炔或者1-辛炔中的任意一种;所述的带取代基的苯磺酰叠氮为4-甲基苯磺酰叠氮;所述的无取代基或带取代基的苯磺酰叠氮、无取代基或带取代基的端炔、邻氨基苯甲腈的摩尔比为1~1.2:1~1.2:1~1.2,所述的亚铜催化剂的摩尔数为无取代基或带取代基端炔化合物摩尔数的5% ~ 10%,所述的添加剂的摩尔数为无取代基或带取代基端炔化合物的摩尔数的1-2倍;
(2)在一个反应容器中加入亚铜催化剂、邻氨基苯甲腈,氮气置换三次后加入有机溶剂,最后将无取代基或带取代基端炔化合物、无取代基或带取代基的苯磺酰叠氮加入,氮气下加入添加剂,滴加完毕后在室温至100℃下,反应3h ~ 6h,反应进程用薄层色谱进行跟踪;
(3)反应结束后,将混合物过滤,然后浓缩,再进行柱层析分离,得到最终产物4-氨基喹啉衍生物。
进一步的,所述的铜盐催化剂为CuCl、CuBr、CuI、Cu2O。
进一步的,所述的有机溶剂为1,4-二氧六环。
进一步的,在步骤3)中,用石油醚/乙酸乙酯进行洗涤,洗涤2~4次,滤液合并后浓缩,再进行柱层析分离,得到最终产物4-氨基喹啉衍生物。
本发明的反应方程式如下描述:
本发明采用端炔、邻氨基苯甲腈和对甲苯磺酰叠氮(TsN3)一步反应法,得到带有不同有取代基的氨基化合物。反应在金属亚铜的催化下,氮气保护下滴加三乙胺,1,4-二氧六环溶剂中加热得到产物。
本发明的取代基:R1主要有甲基、乙基、氟、氯、溴、碘等供电子基和吸电子基; R 2主要是甲基供电子基。
本发明和已有技术相比,其技术进步是显著的。本发明采用了“一锅法”制备4-氨基喹啉衍生物,大大提高了反应效率,后处理简单,具有较好的工业化应用前景。
附图说明
图1为 N-(4-氨基-3-苯基 - 喹啉-2-基)-4-甲基苯磺酰胺的核磁共振氢谱。
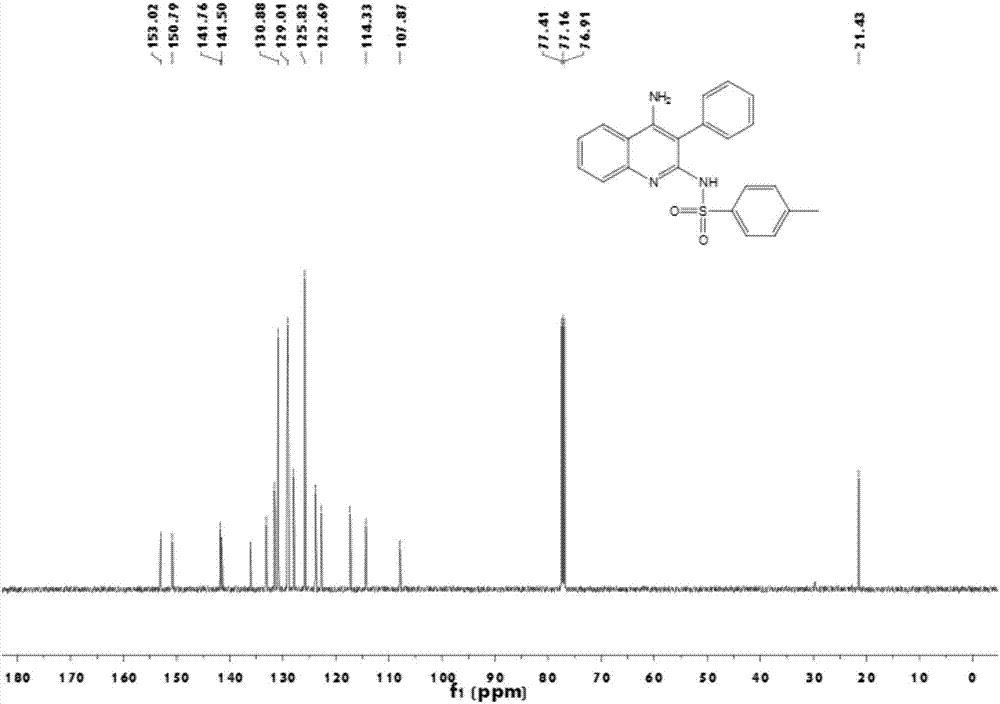
图2 为N-(4-氨基-3-苯基 - 喹啉-2-基)-4-甲基苯磺酰胺的核磁共振碳谱。
具体实施方式
下面通过实施例对本发明进一步阐述,但并不限制本发明。
实施例1
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、苯乙炔22μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N-(4-氨基-3-苯基 - 喹啉-2-基)-4-甲基苯磺酰胺,产率为85%。
1H NMR (500 MHz, CDCl3) δ = 11.61 (s, 1H), 7.71 (t, J=10.0 Hz, 3H), 7.51 (t, J=7.5 Hz, 1H), 7.29 (t, J=7.5 Hz, 3H), 7.21 (t, J=7.5 Hz, 1H), 7.20 – 7.14 (m, 3H), 7.11 (d, J=7.5 Hz, 2H), 5.34 (s, 2H), 2.35 (s, 3H); 13C NMR (126 MHz, CDCl3) δ = 153.0, 150.8, 141.8, 141.5, 136.0, 133.1, 131.5, 130.9, 129.1, 129.0, 127.9, 125.8, 123.8, 122.7, 117.3, 114.3, 107.9, 21.4; HRMS (m/z) [M + H]+ calcd for C22H19N3O2S 390.1285, found 390.1276
图1、图2分别是化合物N-(4-氨基-3-苯基 - 喹啉-2-基)-4-甲基苯磺酰胺的核磁共振氢谱和核磁共振碳谱。
实施例2
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、4-甲氧基苯乙炔39μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N- [4-氨基-3-(4-甲氧基苯基)- 喹啉-2-基] -4-甲基苯磺酰胺,产率为42%。
1H NMR (500 MHz, DMSO) δ = 11.42 (s, 1H), 8.22 (d, J=10.0 Hz, 1H), 7.73 (d, J=10.0 Hz, 1H), 7.68 – 7.57 (m, 3H), 7.35 (t, J=7.5 Hz, 1H), 7.26 (d, J=10.0 Hz, 2H), 7.03 (q, J=10.0 Hz, 4H), 6.69 (s, 2H), 3.81 (s, 3H), 2.31 (s, 3H); 13C NMR (126 MHz, DMSO) δ = 158.5, 152.5, 151.7, 141.9, 141.0, 135.8, 132.1, 131.5, 129.0, 125.6, 125.3, 123.5, 123.2, 117.7, 114.3, 114.1, 105.8, 55.0, 20.8; HRMS (m/z) [M + H]+ calcd for C23H21N3O3S 420.1382, found 420.1380
实施例3
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、3-甲基苯乙炔25μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N-(4-氨基-3-间甲苯基 - 喹啉-2-基)-4-甲基苯磺酰胺,产率为68%。
1H NMR (500 MHz, CDCl3) δ = 11.72 (s, 1H), 7.73 (d, J=10.0 Hz, 2H), 7.69 (d, J=5.0 Hz, 1H), 7.56 (t, J=7.5 Hz, 1H), 7.32 (d, J=10.0 Hz, 1H), 7.26 – 7.17 (m, 4H), 7.09 (d, J=5.0 Hz, 1H), 6.95 (s, 2H), 5.24 (s, 2H), 2.37 (s, 3H), 2.29 (s, 3H); 13C NMR (126 MHz, CDCl3) δ = 153.1, 150.4, 141.8, 138.7, 136.2, 132.9, 131.6, 129.1, 127.8, 126.0, 123.9, 122.3, 117.5, 114.4, 108.6, 21.5; HRMS (m/z) [M + H]+ calcd for C23H21N3O2S 404.1432, found 404.1436
实施例4
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、2-甲氧基苯乙炔25μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N- [4-氨基-3-(2-甲氧基苯基)- 喹啉-2-基] -4-甲基苯磺酰胺,产率为45%。
1H NMR (500 MHz, CDCl3) δ = 11.78 (s, 1H), 7.71 (d, J=10.0 Hz, 2H), 7.63 (d, J=10.0 Hz, 1H), 7.55 (t, J=7.5 Hz, 1H), 7.32 (t, J=5.0 Hz, 2H), 7.24 (d, J=7.5 Hz, 1H), 7.15 (d, J=5.0 Hz, 2H), 7.07 (d, J=5.0 Hz, 1H), 6.98 (t, J=7.5 Hz, 1H), 6.91 (d, J=10.0 Hz, 1H), 5.01 (s, 2H), 3.53 (s, 3H), 2.34 (s, 3H) ; 13C NMR (125 MHz, CDCl3) δ = 157.6, 153.3, 150.1, 141.7, 141.5, 136.3, 132.3, 131.3, 123.0, 128.9, 125.9, 123.6, 121.8, 121.4, 121.3, 117.6, 114.3, 111.7, 105.7, 55.5, 21.4. HRMS (m/z) [M + H]+ calcd for C23H21N3O3S 420.1382, found 420.1383
实施例5
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、2-氯苯乙炔23μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N- [4-氨基-3-(2-氯 - 苯基)- 喹啉-2-基] -4-甲基苯磺酰胺,产率为74%。
1H NMR (500 MHz, DMSO) δ = 11.39 (s, 1H), 8.25 (d, J=5.0 Hz, 1H), 7.76 (d, J=10.0 Hz, 1H), 7.67 (t, J=7.5 Hz, 1H), 7.58 (t, J=10.0 Hz, 3H), 7.45 – 7.33 (m , 3H), 7.25 – 7.16 (m, 3H), 6.79 (s, 2H), 2.30 (s, 3H); 13C NMR (126 MHz, DMSO) δ = 152.3, 151.6, 141.8, 141..0, 136.2, 134.6, 133.2, 132.7, 131.7, 129.6, 128.9, 127.6, 125.4, 123.5, 123.2, 117.8, 114.0, 103.6, 20.8; HRMS (m/z) [M + H]+ calcd for C22H18ClN3O2S 424.0886, found 424.0917
实施例6
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、3-氯苯乙炔23μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N- [4-氨基-3-(3-氯 - 苯基)- 喹啉-2-基] -4-甲基苯磺酰胺,产率为70%。
1H NMR (501 MHz, DMSO) δ = 11.42 (s, 1H), 8.25 (d, J=10.0 Hz, 1H), 7.76 (d, J=10.0 Hz, 1H), 7.66 (t, J=7.5 Hz, 1H), 7.59 (d, J=10.0 Hz, 2H), 7.47 (t, J=7.5 Hz, 1H), 7.42 (d, J=10.0 Hz, 1H), 7.37 (t, J=7.5 Hz, 1H), 7.26 (d, J=10.0 Hz, 2H), 7.10 (d, J=10.0 Hz, 2H), 6.88 (s, 2H), 2.31 (s, 3H); 13C NMR (126 MHz, DMSO) δ = 152.1, 151.7, 141.9, 141.0, 136.1, 133.1, 131.7, 131.1, 130.5, 129.7, 129.0, 127.4, 125.2, 123.5, 123.3, 117.9, 114.1, 104.7, 20.8; HRMS (m/z) [M + H]+ calcd for C22H18ClN3O2S 424.0886, found 424.0881
实施例7
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、4-氟苯乙炔38μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N- [4-氨基-3-(4-氟苯基)- 喹啉-2-基] -4-甲基苯磺酰胺,产率为50%。
1H NMR (500 MHz, CDCl3) δ = 11.77 (s, 1H), 7.69 (d, J=10.0 Hz, 2H), 7.64 (d, J=5.0 Hz, 1H), 7.59 (t, J=7.5 Hz, 1H), 7.35 (d, J=10.0 Hz, 1H), 7.30 (d, J=7.5 Hz, 1H), 7.17 (d, J=5.0 Hz, 4H), 7.08 (t, J=10.0 Hz, 2H), 5.05 (s, 2H), 2.35 (s, 3H); 13C NMR (126 MHz, CDCl3) δ = 163.6, 161.6, 153.3, 150.1, 141.9, 141.5, 136.3, 132.9, 132.8, 131.8, 129.20, 128. 9, 128.9, 125.9, 124.0, 121.9, 117.8, 116.4, 116.2, 114.3, 107.7, 21.5; HRMS (m/z) [M + H]+calcd for C22H18FN3O2S 408.1182, found 408.1170
实施例8
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、4-乙基苯乙炔42μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N- [4-氨基-3-(4-乙基 - 苯基)- 喹啉-2-基] -4-甲基苯磺酰胺,产率为68%。
1H NMR (500 MHz, DMSO) δ = 11.45 (s, 1H), 8.23 (d, J=5.0 Hz, 1H), 7.73 (d, J=10.0 Hz, 1H), 7.63 (dd, J=5.0, 5.0 Hz, 3H), 7.36 (t, J=7.5 Hz, 1H), 7.27 (dd, J=10.0, 7.5 Hz, 4H), 7.05 (d, J=5.0 Hz, 2H), 6.66 (s, 2H), 2.67 (q, J=7.5 Hz, 2H), 2.31 (s, 3H), 1.26 (t, J=7.5 Hz, 3H); 13C NMR (126 MHz, DMSO) δ = 152.4, 151.5, 142.6, 141.9, 141.0, 135.8, 131.5, 130.9, 130.8, 129.0, 128.1, 125.3, 123.5, 123.2, 117.7, 114.1, 106.1, 27.9, 20.8, 15.1; HRMS (m/z) [M + H]+ calcd for C24H23N3O2S 418.1589, found 418.1592
实施例9
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、4-甲基苯乙炔25μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N-(4-氨基-3-对甲苯基 - 喹啉-2-基)-4-甲基苯磺酰胺,产率为60%。
1H NMR (500 MHz, CDCl3) δ = 11.72 (s, 1H), 7.71 (d, J=5.0 Hz, 2H), 7.64 (d, J=10.0 Hz, 1H), 7.55 (t, J=7.5 Hz, 1H), 7.31 (d, J=10.0 Hz, 1H), 7.23 (t, J=7.5 Hz, 1H), 7.16 (t, J=7.5 Hz, 4H), 7.04 (d, J=5.0 Hz, 2H), 5.15 (s, 2H), 2.34 (s, 3H), 2.32 (s, 3H); 13C NMR (126 MHz, CDCl3) δ = 153.3, 150.2, 141.8, 141.6, 137.9, 136.2, 131.6, 130.7, 129.9, 129. 9, 129.1, 126.0, 123.8, 122.1, 117.6, 114.4, 108.6, 21.5, 21.4; HRMS (m/z) [M + H]+ calcd for C23H21N3O2S 404.1432, found 404.1427
实施例10
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、1-己炔23μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N-(4-氨基-3-甲基 - 喹啉-2-基)-4-甲基苯磺酰胺,产率为40%。
1H NMR (500 MHz, DMSO) δ = 11.35 (s, 1H), 8.14 (d, J=10.0 Hz, 1H), 7.70 (d, J=5.0 Hz, 2H), 7.67 (d, J=5.0 Hz, 1H), 7.59 (t, J=7.5 Hz, 1H), 7.33 (t, J=7.5 Hz, 1H), 7.26 (d, J=10.0 Hz, 2H), 7.08 (s, 2H), 2.30 (s, 3H), 1.23 (s, 6H), 0.79 (d, J=5.0 Hz, 3H); 13C NMR (126 MHz, DMSO) δ = 152.3, 150.9, 142.1, 141.0, 135.2, 130.8, 129.0, 125.3, 123.2, 122.6, 117.6, 114.1, 104.8, 29.3, 23.4, 22.0, 20.8, 14.0; HRMS (m/z) [M + H]+ calcd for C20H23N3O2S 370.1589, found 370.1587
实施例11
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、1-辛炔29μL和对甲苯磺酰叠氮20μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N-(4-氨基-3-甲基 - 喹啉-2-基)-4-甲基苯磺酰胺,产率为40%。
1H NMR (501 MHz, CDCl3) δ = 11.75 (s, 1H), 7.86 (d, J=7.5 Hz, 2H), 7.62 (d, J=8.0 Hz, 1H), 7.55 (t, J=7.5 Hz, 1H), 7.31 (t, J=7.5 Hz, 2H), 7.22 (d, J=5.0 Hz, 2H), 5.06 (s, 2H), 2.63 (t, J=7.5 Hz, 2H), 2.38 (s, 3H), 1.46 –1.37(m, 2H), 1.35 – 1.27 (m, 4H), 1.22 (s, 2H), 0.85 (t, J=6.0, 3H); 13C NMR (126 MHz, CDCl3) δ = 153.6, 148.8, 141.8, 135.5, 130.9, 129.2, 126.0, 123.8, 121.0, 117.6, 114.4, 108.3, 31.9, 29.5, 27.2, 24.8, 22.7, 21.5, 14.2; HRMS (m/z) [M + H]+ calcd for C22H27N3O2S 398.1902, found 398.1900
实施例12
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、苯乙炔22μL和苯磺酰叠氮19μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N-(4-氨基-3-苯基 - 喹啉-2-基)- 苯磺酰胺,产率为70%。
1H NMR (500 MHz, DMSO) δ = 11.51 (s, 1H), 8.25 (d, J=8.5 Hz, 1H), 7.74 (dd, J=8.5, 7.0 Hz, 3H), 7.65 (t, J=7.0 Hz, 1H), 7.46 (dd, J=7.0, 7.0 Hz, 5H), 7.37 (dd, J=6.5, 8.0 Hz, 2H), 7.14 (d, J=7.5 Hz, 2H), 6.71 (s, 2H); 13C NMR (126 MHz, DMSO) δ = 152.3, 151.7, 144.7, 136.0, 133.7, 131.6, 131.0, 128.8, 128.6, 127.4, 125.2, 123.6, 123.3, 117.9, 114.1, 106.3; HRMS (m/z) [M + H]+ calcd for C21H17N3O2S 376.1119, found 376.1128
实施例13
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、4-甲氧基苯乙炔39μL和苯磺酰叠氮19μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N- [4-氨基-3-(4-甲氧基苯基)- 喹啉-2-基] - 苯磺酰胺,产率为35%。
1H NMR (500 MHz, DMSO) δ = 11.45 (s, 1H), 8.22 (d, J=8.0 Hz, 1H), 7.74 (d, J=8.5 Hz, 1H), 7.70 (d, J=8.5 Hz, 2H), 7.65 (t, J=7.5 Hz, 1H), 7.50 – 7.44 (m, 3H), 7.36 (t, J=8.0 Hz, 1H), 7.02 (q, J=9.0 Hz, 4H), 3.81 (s, 3H); 13C NMR (126 MHz, DMSO) δ = 158.5, 152.5, 151.9, 144.8, 135.8, 132.1, 131.5, 131.0, 128.6, 125.6, 125.2, 123.5, 123.2, 117.8, 114.3, 114.1, 105.9, 55.0; HRMS (m/z) [M + H]+ calcd for C22H19N3O3S 406.1225, found 406.1219
实施例14
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、3-氯苯乙炔24μL和苯磺酰叠氮19μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N- [4-氨基-3-(3-氯苯基)- 喹啉-2-基] - 苯磺酰胺,产率为75%。
1H NMR (500 MHz, DMSO) δ 11.46 (s, 1H), 8.26 (d, J=8.0 Hz, 1H), 7.78 (d, J=8.5 Hz, 1H), 7.69 (t, J=8.5 Hz, 3H), 7.51 – 7.45 (m, 4H), 7.42 (d, J=8.5 Hz, 1H), 7.38 (t, J=7.5 Hz, 1H), 7.12 – 7.08 (t, J=7.5 Hz, 2H), 6.90 (s, 2H); 13C NMR (126 MHz, DMSO) δ = 152.1, 151.8, 144.7, 136.0, 133.1, 131.7, 131.1, 131.0, 130.5, 129.7, 128.6, 127.4, 125.1, 123. 6, 123.3, 117.9, 114.1, 104.7; HRMS (m/z) [M + H]+ calcd for C21H16ClN3O2S 410.0730, found 410.0725
实施例15
在10ml 的反应管中加入CuCl催化剂2mg,邻氨基苯甲腈23mg、3-甲基苯乙炔25μL和对甲苯磺酰叠氮19μL,然后加入1,4-二氧六环1ml,氮气置换后将三乙胺40mg滴加入反应管。反应混合物在70℃加热4h,将混合物过滤,用石油醚/乙酸乙酯(体积比5/1, 10mL)进行洗涤三次,滤液合并后浓缩,进行柱层析分离,洗脱剂为石油醚/乙酸乙酯(体积比2/1)600ml,得到最终产物N-(4-氨基-3-间甲苯基 - 喹啉-2-基)- 苯磺酰胺,产率为80%。
1H NMR (500 MHz, CDCl3) δ = 11.68 (s, 1H), 7.82 (d, J=7.0 Hz, 2H), 7.67 (d, J=7.5 Hz, 1H), 7.54 (t, J=7.5 Hz, 1H), 7.39 (dd, J=6.5, 7.0 Hz, 3H), 7.30 (d, J=8.0 Hz, 1H), 7.20 (d, J=7.5 Hz, 2H), 7.06 (d, J=7.0 Hz, 1H), 6.91 (s, 2H), 5.22 (s, 2H), 2.25 (s, 3H); 13C NMR (126 MHz, CDCl3) δ = 153.1, 150.5, 144.5, 138.7, 136.1, 132.9, 131.6, 131.3, 129.0, 128.9, 128.5, 127.7, 125.9, 123.9, 122.3, 117.6, 114.6, 108.6, 21.5; HRMS (m/z) [M + H]+ calcd for C22H19N3O2S 390.1276, found 390.1275
以上所述内容仅为本发明构思下的基本说明,而依据本发明的技术方案所做的任何等效变换,均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!