一种用于输注糖尿病的活性间充质干细胞注射液的制作方法
本发明属于生物医药领域,尤其涉及一种糖尿病样微环境激活的间充质干细胞的制备,一种用于输注糖尿病的活性间充质干细胞注射液及其用于糖尿病药物的应用。
背景技术:
糖尿病是一种复杂的代谢疾病,随着现代生活方式的改变,糖尿病的发病率居高不下。2016年世界卫生组织糖尿病数据显示,仅中国就有1.376亿成人患有糖尿病,发病率高达10%,其中,95%是2型糖尿病(t2d)。t2d的主要病因包括靶组织中的胰岛素抵抗,胰岛素分泌相对不足,以及随后胰岛β细胞功能的减退。目前用于t2d的传统疗法包括胰岛素敏化剂改善高血糖和使用外源性胰岛素来补充胰岛素不足,虽然这些药物可以改善高血糖或暂时改善对靶组织中胰岛素的反应,但它们在延缓进行性β细胞功能障碍方面不是非常有效,因此无法稳定血糖,患者需终身使用降糖药或胰岛素。胰岛移植为治愈糖尿病提供了可能性,但由于胰岛来源受限,且配型困难,手术成功率低,治疗后需要长期服用抗免疫排斥药物,限制了此技术的广泛应用。长期的血糖增高,更会引起各个器官的并发症产生,糖尿病的高致残率、高死亡律已引起高度重视。因此,糖尿病治疗亟待寻找一种新的治疗方法。
间充质干细胞(msc)是最重要的多能成体干细胞之一,具有自我更新和自我分化潜能,以及分泌多种因子参与损伤的组织与器官的修复与再生而被广泛应用于多种疾病的治疗。mscs在体内或体外特定的诱导条件下,可分化为胰岛、神经、血管内皮、骨、软骨、肌肉、肝脏、心肌等多种组织细胞,除此之外,mscs还具有低免疫原性和独特的免疫调节作用,能逃避免疫识别、抑制免疫应答。msc可以从骨髓、脂肪、胎盘脐带等多种组织中获得,具有易于分离培养,体外连续传代培养及冷冻保存后仍保持其分化潜能及增值能力的特点。
干细胞的重要特征之一是能够进行不对称分裂,干细胞所处的微环境对分裂过程起着重要的调控作用。环境因素维持着干细胞的特征、为干细胞的自我更新提供了合适的外部条件,并且影响干细胞的自我更新和自我分化。环境因素负反馈触发mscs的反应机制,产生修复与再生。已经有研究表明,msc可能发挥治疗糖尿病的作用,增加胰岛素分泌和校正高血糖(r.h.lee,m.j.seo,r.l.reger,j.l.spees,a.a.pulin,s.d.olson,d.j.prockop,multipotentstromalcellsfromhumanmarrowhometoandpromoterepairofpancreaticisletsandrenalglomeruliindiabeticnod/scidmice,proc.natl.acad.sci.usa103(2006)17438–17443.f.ezquer,m.ezquer,d.contador,m.ricca,v.simon,p.conget,theantidiabeticeffectofmesenchymalstemcellsisunrelatedtotheirtransdifferentiationpotentialbuttotheircapabilitytorestoreth1/th2balanceandtomodifythepancreaticmicroenvironment,stemcells30(2012)1664–1674.)。
然而,目前的mscs,无论来源于脐带,还是自体骨髓或脂肪组织,均不是特异修复t2d的,这在很大程度上限制了mscs的治疗效果。前期的文献报道,无论临床试验还是动物实验,用mscs的输注治疗t2d均无法使高血糖恢复至正常水平,且经过一定的时间后血糖又有不同程度的升高。
基于上述问题,本发明进行研究,对mscs进行处理,得到一种糖尿病样微环境负反馈调节激活的间充质干细胞注射液,用于输注治疗t2d。
技术实现要素:
针对通用型的间充质干细胞(mscs)输注液治疗2型糖尿病(t2d)存在效率不高的问题,本发明提供了一种糖尿病样微环境激活的间充质干细胞制备方法,一种用于输注糖尿病的活性间充质干细胞注射液,其制备方法和在用于糖尿病药物中应用。
为实现上述发明目的,本发明采用下述技术方案予以实现:
一种活性间充质干细胞,其为糖尿病样微环境激活的间充质干细胞,所述糖尿病样微环境为终浓度为20~50mmol/l的葡萄糖溶液和终浓度为0.2~0.4mmol/l棕榈酸溶液。
所述间充质干细胞为脐带间充质干细胞、脂肪间充质干细胞、骨髓间充质干细胞。
一种活性间充质干细胞的制备方法:其包括的步骤为:a)将分离提取的间充质干细胞在无血清培养基中培养至融合达40~50%的单层细胞;b)在步骤a)的所述单层细胞中加入终浓度20~50mmol/l的葡萄糖溶液和终浓度为0.2~0.4mmol/l棕榈酸溶液;c)培养所述单层细胞融合达75~80%时,移去培养上清液,用胰蛋白酶-edta消化,所述间充质干细胞收缩脱离瓶壁,加入所述移去的培养上清液,中和所述胰蛋白酶-edta,再使用移液管轻轻吹打,将细胞悬液移入50ml无菌离心管;d)加入无菌生理盐水,离心并使用所述生理盐水洗涤三次,获得糖尿病样微环境激活的间充质干细胞。
进一步的,所述步骤b)中葡萄糖的终浓度为30mmol/l,棕榈酸的终浓度为0.2mmol/l。所述步骤c)中所述单层细胞融合达75~80%,所用培养时间为48±2小时。
进一步的,所述步骤d)中,加入50ml生理盐水,测定的糖尿病样微环境激活的间充质干细胞的浓度为5×105~2×106。
所述间充质干细胞选自脐带、骨髓、脂肪组织,所述干细胞活力保持在95%以上。
一种用于输注糖尿病的活性间充质干细胞注射液,其包括以下组分:数量为
5×105~2×106个/ml的糖尿病样微环境激活的间充质干细胞、质量体积比为1~5%的人血白蛋白、质量体积比为1~5%的复方维生素、质量体积比为1~8%的甘露醇、质量体积比为0.5~2.5%的葡萄糖和余量的生理盐水。
对上述技术方案的进一步改进,所述用于输注糖尿病的活性间充质干细胞注射剂中所述糖尿病样微环境激活的间充质干细胞为在无血清培养基中培养至融合达40~50%的单层细胞时加入终浓度为20~50mmol/l的葡萄糖溶液和终浓度为0.2~0.4mmol/l棕榈酸溶液,连续培养48±2小时的间充质干细胞。
所述间充质干细胞选自脐带、骨髓、脂肪组织或其组合,所述干细胞活力保持在95%以上。
一种用于输注糖尿病的活性间充质干细胞注射液的制备方法,其包括a)预先制备人血白蛋白、甘露醇注射液、复方维生素注射液和葡萄糖注射液,并4℃预冷备用;b)按照质量体积比配制人血白蛋白、甘露醇注射液、复方维生素注射液和葡萄糖注射液;c)将糖尿病样微环境激活的间充质干细胞重悬于步骤b)所述的注射液中,并加入余量的生理盐水。
上述的用于输注糖尿病的活性间充质干细胞注射液在制备治疗糖尿病药物中的应用,其特征在于,所述糖尿病为2型糖尿病。所述干细胞注射液采用单次或多次输注的方案,且在所述间充质干细胞注射液在2小时内使用完毕。
本发明的有益效果:
与现有技术相比,本发明的优点和积极效果是:本发明采用间充质干细胞,采用dm样微环境对其进行培养预处理,激活干细胞负反馈调节机制,明显增强了间充质干细胞各种生长因子的分泌,明显降低了血糖和大鼠的糖耐量,修复t2d大鼠受损的胰岛,并改善了t2d大鼠肾脏和肺脏并发症症状。本发明制备的激活的间充质干细胞,经过简单的预处理,干细胞特性未见变化,本制备体系易于质量控制,易于产业化。本发明采用激活的间充质干细胞注射液优化治疗方案,采用多次输注治疗的策略,显著减轻了糖尿病症状。通过本发明提供了技术方案,明显提高了mscs输注治疗t2d的效率,使得t2d的高血糖恢复到接近正常水平并改善t2d并发症的症状。
附图说明:
图1.不同治疗组空腹大鼠中血糖浓度变化图。w表示周。
图2.不同治疗组最后一次输注完毕后大鼠中血清胰岛素和血清c肽的浓度。a:elisa评估的t2d大鼠中的血清胰岛素的浓度;b:elisa评估的t2d大鼠中的血清c肽浓度。
图3.msc输注完毕后9周通过ogtt测定的t2d大鼠中的葡萄糖代谢变化图。
图4.t2d大鼠、msc治疗组以及激活的msc治疗组大鼠胰岛病理切片比较图。
图5.a:免疫荧光染色切片中观察到的t2d大鼠中的胰岛计数;b:免疫荧光染色切片中观察到的胰岛β细胞计数。
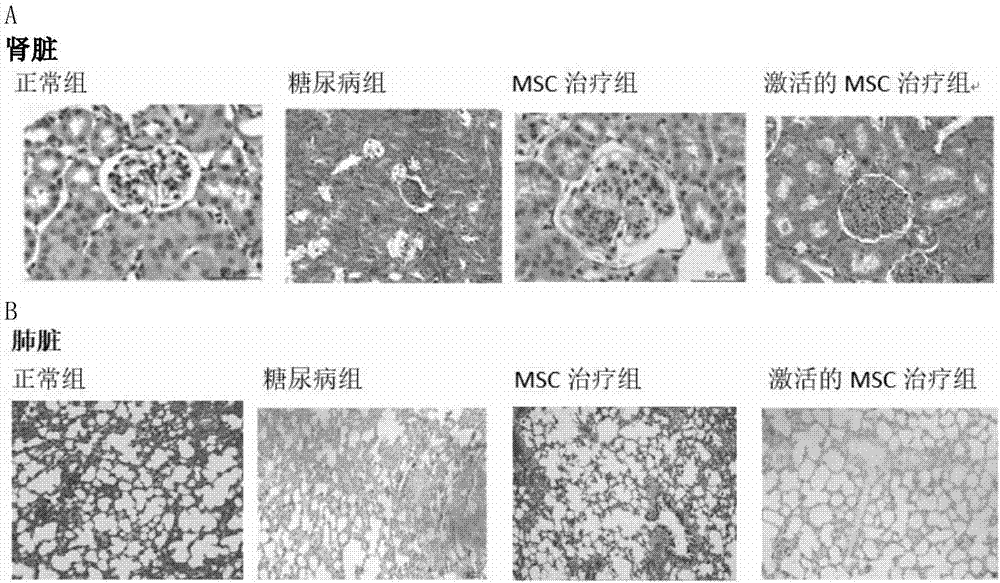
图6.a:t2d大鼠、msc治疗组和激活的msc治疗组大鼠肾脏的he染色切片比较图b:t2d大鼠、msc治疗组和激活的msc治疗组大鼠肺脏的he染色切片比较图。
具体实施方式
下面以具体实施方式对发明作进一步详细说明
本发明参照特定的实施例进行了描述,但是,很显然仍可以做出各种修改和变换而不违背本发明的精神和范围。因此,本发明的说明书和附图应该认为是说明性的而非限制性的。
实施例1.间充质干细胞的制备
一、脐带间充质干细胞的制备
在超净工作台中进行操作,取新鲜足月健康胎儿脐带,用含2倍100u/ml青霉素和链霉素的生理盐水冲洗去除血渍,将华尔通氏胶剥离,剪成1立方毫米以下块状,均匀涂布,缓慢加入10ml无血清培养基,置37℃、体积分数为5%的二氧化碳、饱和湿度培养箱中培养。将原代细胞培养7天后,更换无血清培养液,培养至细胞达到70%的融合,移去无血清培养液,添加浓度分别为0.25%和0.1%的胰蛋白酶-乙二胺四乙酸钠(edta)消化1min,脐带msc收缩脱离瓶壁,此时加入先前移去的培养上清液,中和胰蛋白酶-edta溶液,并使用移液管轻轻吹打,将脐带msc悬液移入50ml离心管中。1000rpm离心8min,去除上清液;重新加入无血清完全培养基将msc重悬,并计数。按照1传1.5接种10cm培养皿。msc培养融合70%左右时参照上述方法传代培养。
选择第四代培养的msc,在对数生长期,且细胞融合程度不超过80%时按照传代的要求消化、中和、洗涤、收集细胞,采用细胞冻存液(90%胎牛血清和10%二甲亚砜(dmso))重悬msc,充分混匀,每管1ml分装于冻存管密封。将冻存管置于装有异丙醇的冻存盒中,于-80℃冰箱过夜,次日移入液氮罐保存。
msc复苏的步骤为:取出msc冻存管,立即浸入37℃温水中溶解;取适量无血清培养基混悬细胞并离心,弃去上清液;细胞重悬于无血清培养基中,并接种于培养皿中,于37℃、体积分数为5%的二氧化碳、饱和湿度培养箱中培养。
二、骨髓间充质干细胞的制备
采用常规方法于髂前上棘穿刺点,用骨穿针抽取50ml骨髓液,注入50ml的无菌离心管中;用等量含20u/ml肝素的pbs液稀释,并沿管壁加入等体积的比重为1.073g/ml的淋巴细胞分离液;2000rmp离心30min,吸取单个核细胞层;无菌生理盐水离心洗涤2次,每次1000rpm离心5min,弃去上清液,取沉淀;将上述得到的骨髓msc,用无血清培养基混悬,计数细胞,按5×106个/ml接种于的培养瓶中,置37℃体积分数为5%的二氧化碳、饱和湿度的培养箱中培养。培养3天后,更换无血清培养液,弃去未贴壁细胞,以后每3天1次更换培养液;7~9天后,骨髓msc融合达50%~60%时,进行第一次传代。移去无血清培养液,采用浓度分别为0.25%和0.1%的胰蛋白酶-edta37℃消化1min,骨髓msc收缩脱离瓶壁,加入先前移去的培养上清液,中和胰蛋白酶-edta,并使用移液管轻轻吹打,将骨髓间充质细胞悬液移入50ml无菌离心管中。1000rpm离心8min,弃去上清液;重新加入无血清完全培养基重悬,计数,按照1传1-1.5接种10cm培养皿。骨髓msc培养融合70%左右时如上述方法传代培养。
三、脂肪间充质干细胞的制备
按照常规方法分离腹部白色脂肪组织,剔除可见微血管及肌肉组织,无菌pbs洗涤三遍,然后用无菌剪刀将脂肪组织剪碎至1立方毫米以下的糊状,添加无菌消化液(含有0.1%胶原酶ⅰ型和0.05%胰蛋白酶的无血清dmem培养基),37℃水浴中匀速搅拌45-50min,至组织块消化干净;200目筛网过滤收集滤液,然后使用含有10%胎牛血清(fbs)的低糖dmem培养基等量中和,1500rpm离心10min,弃去上清液;以1×106个/ml的细胞密度,用无血清培养基重悬脂肪msc,并接种于培养瓶中,37℃、体积分数为5%二氧化碳、饱和湿度培养箱中培养,当脂肪msc生长至接近80%融合时,使用0.25%胰蛋白酶溶液消化msc细胞,以1:3的接种比例接种到新的培养瓶中进行传代培养。脂肪msc融合至不超过80%,1000rpm离心8min,弃去上清液,重新加入无血清完全培养基重悬msc,计数,按照1传1-1.5接种10cm培养皿。脂肪msc培养融合70%左右时如上述方法传代培养。
实施例2.糖尿病样微环境激活的间充质干细胞的制备
糖尿病样微环境激活的间充质干细胞为加入一定浓度的葡萄糖溶液和棕榈酸溶液,培养一定时间后,测量培养的间充质干细胞数量,如果间充质干细胞的浓度能够达到5×105~2×106个/ml,表明葡萄糖和棕榈酸溶液已成功激活间充质干细胞。棕榈酸的浓度为0.2~0.4mmol/l;葡萄糖溶液的浓度为20~50mmol/l。
一、糖尿病样微环境激活的脐带间充质干细胞的制备
(1)
将实施例1中制备的脐带msc在第四代细胞培养至40~50%单层细胞时,加入葡萄糖溶液和棕榈酸溶液,葡萄糖终浓度为20~50mmol/l,棕榈酸浓度为0.2~0.4mmol/l,连续培养48±2小时;单层细胞融合达75%~80%时,移去培养上清液,用浓度分别为0.25%和0.1%的胰蛋白酶-edta37℃消化1min,脐带msc收缩脱离瓶壁,加入先前移去的培养上清液,中和胰蛋白酶-edta,并使用移液管轻轻吹打,将脐带msc悬液移入50ml无菌离心管;加入等量的无菌生理盐水,离心,并用无菌生理盐水离心洗涤三次。第一次使用无菌生理盐水洗涤时,取脐带msc样品进行计数,并测定活细胞比例,测定的msc数量约为5×105~2×106个/ml,表明终浓度为20~50mmol/l的葡萄糖溶液和终浓度为0.2~0.4mmol/l棕榈酸溶液能够成功激活脐带msc,获得dm样微环境激活的脐带msc。
(2)
将实施例1中制备的脐带msc在第四代细胞培养至40~50%单层细胞时,加入葡萄糖溶液和棕榈酸溶液,葡萄糖终浓度为30mmol/l,棕榈酸浓度为0.2mmol/l,连续培养49小时;单层细胞融合达75%~80%时,移去培养上清液,用浓度分别为0.25%和0.1%的胰蛋白酶-edta37℃消化1min,脐带msc收缩脱离瓶壁,加入先前移去的培养上清液,中和胰蛋白酶-edta,并使用移液管轻轻吹打,将脐带msc悬液移入50ml无菌离心管;加入等量的无菌生理盐水,离心,并用无菌生理盐水离心洗涤三次。第一次使用无菌生理盐水洗涤时,取脐带msc样品进行计数,并测定活细胞比例,测定的msc数量约为8×105个/ml,表明终浓度为30mmol/l的葡萄糖溶液和终浓度为0.2mmol/l棕榈酸溶液能够成功激活脐带msc,获得dm样微环境激活的脐带msc。
二、dm样微环境激活的脂肪间充质干细胞的制备
将实施例1中制备的脂肪msc在第四代细胞培养至40~50%单层细胞时,加入葡萄糖溶液和棕榈酸溶液,葡萄糖终浓度为20~50mmol/l,棕榈酸浓度为0.2~0.4mmol/l,连续培养48±2小时;单层细胞融合达75%~80%时,移去培养上清液,用浓度分别为0.25%和0.1%的胰蛋白酶-edta37℃消化1min,脂肪msc收缩脱离瓶壁,加入先前移去的培养上清液,中和胰蛋白酶-edta,并使用移液管轻轻吹打,将脂肪msc悬液移入50ml无菌离心管;加入等量的无菌生理盐水,离心,并用无菌生理盐水离心洗涤三次。第一次使用无菌生理盐水洗涤时,取脂肪msc样品进行计数,并测定活细胞比例,测定的msc数量约为5×105~2×106个/ml,表明终浓度为20~50mmol/l的葡萄糖溶液和终浓度为0.2~0.4mmol/l棕榈酸溶液能够成功激活脂肪msc,获得dm样微环境激活的脂肪msc。
三、dm样微环境激活的骨髓间充质干细胞的制备
将实施例1中制备的骨髓msc在第四代细胞培养至40~50%单层细胞时,加入葡萄糖溶液和棕榈酸溶液,葡萄糖终浓度为20-50mmol/l,棕榈酸浓度为0.2-0.4mmol/l,连续培养48+2小时;单层细胞融合达75%~80%时,移去培养上清液,用浓度分别为0.25%和0.1%的胰蛋白酶-edta37℃消化1min,骨髓msc收缩脱离瓶壁,加入先前移去的培养上清液,中和胰蛋白酶-edta,并使用移液管轻轻吹打,将骨髓msc悬液移入50ml无菌离心管;加入等量的无菌生理盐水,离心,并用无菌生理盐水离心洗涤三次。第一次使用无菌生理盐水洗涤时,骨髓msc样品进行计数,并测定活细胞比例,测定的msc数量约为5×105~2×106个/ml,表明终浓度为20~50mmol/l的葡萄糖溶液和终浓度为0.2~0.4mmol/l棕榈酸溶液能够成功激活骨髓msc,获得dm样微环境激活的骨髓msc。
实施例3.糖尿病样微环境激活的间充质干细胞注射液的制备
一种dm样微环境激活的间充质干细胞注射液,其包括以下组分:数量为5×105~2×106个/ml的dm样微环境激活的间充质干细胞,质量体积比为1~5%人血白蛋白,质量体积比为1~8%甘露醇注射液,质量体积比为1~5%复方维生素注射液,质量体积比为1~5%的50%葡萄糖注射液和余量为生理盐水。
如配制100mldm样微环境激活的间充干细胞注射液,该注射液包括人血白蛋白原液5ml(质量体积比终浓度为1%)、甘露醇注射液2ml、复方维生素注射液3ml、50%葡萄糖注射液5ml、生理盐水85ml、dm样微环境激活的msc。除dm样微环境激活的msc外,注射液其余成分需提前配制,并4℃预冷备用。msc最终重悬注射液中,制成单细胞悬液,每毫升注射液中dm样微环境激活的msc的数量为5×105~2×106个。该制备好的dm样微环境激活的msc在2~10℃条件中,2小时内细胞保持为单细胞悬液状态,且细胞活力(台盼蓝染色计活力)保持在95%以上。本发明所述质量体积比均代表质量(g)与体积(ml)的比例。
人血白蛋白、复方维生素、甘露醇、葡萄糖均为临床注射液成分,可为细胞提供营养、利于细胞的新陈代谢、维持良好的干细胞体外微环境。
本发明的dm样微环境激活的msc注射液非常利于激活的msc在体外混悬状态下微环境的稳定,利于干细胞维持活性,且临床输注安全。dm样微环境激活的msc在此混悬液中可短时间保持较高的活力,最大程度维持干细胞的特性,使得输注到体内的细胞能发挥更大的治疗潜能。
实施例4.sd大鼠2型糖尿病模型的建立
采用高脂肪、高糖饮食连续喂养大鼠30~40天,而后辅以40mg/kg注射链脲菌素(stz)。用血糖仪测定大鼠鼠尾血糖浓度,选取连续2次血糖浓度高于16.7mmol/l的大鼠作为糖尿病模型。
实施例5.糖尿病样微环境激活的间充质干细胞注射液移植治疗2型糖尿病大鼠
采用完全随机法将已成模的糖尿病大鼠分为3组、每组6只,每两周1次、连续5次输注。(1)糖尿病空白治疗组,1ml无细胞混悬液动物尾静脉注射;(2)未处理间充质干细胞注射液治疗组,按上述方法制备的间充质干细胞,直接收获不做任何处理而制备的注射液1ml尾静脉注射;(3)dm样微环境激活的间充质干细胞注射液1ml尾静脉注射。3组动物模型均于治疗前及治疗后测定空腹血糖、体总指数,并于每周检测一次,ogtt检测后处死大鼠,取胰岛进行石蜡包埋后he染色观察胰岛再生,取肝脏和肺脏进行组织切片染色检查。
试验结果:
1)糖尿病样微环境激活的间充质干细胞注射液明显改善了t2d大鼠的高血糖状况
如图1所示,正常大鼠中,血糖维持在较低水平,约为5mmol/l;而空白治疗组的t2d大鼠中,血糖浓度维持在较高的水平,约为25~30mmol/l;msc治疗的两组中,随着输注次数的增加及治疗时间的延长,t2d大鼠中血糖的浓度逐渐降低。dm样微环境激活的msc治疗组中,t2d大鼠中血糖浓度较未处理的msc治疗组降低的更快,在输注4次后,即治疗7周时,t2d大鼠中血糖浓度达到几乎正常水平,未经处理的mscs大鼠组血糖浓度下降较慢。
连续多次dm样微环境激活的msc输注9周后,与空白治疗组中相比,t2d大鼠中血清胰岛素和c-肽水平显著增加,且明显高于未处理的msc治疗组中。dm样微环境激活的msc治疗组的血清胰岛素基本接近正常水平(图2a和b)。
msc输注完成后9周,采用口服葡萄糖耐性试验(ogtt)测定不同治疗组中t2d大鼠的葡萄糖代谢,结果表明多次输注激活的msc显著改善t2d大鼠葡萄糖代谢,且效果比未经处理的msc输注更加显著(图3)。
这些数据表明多次dm样微环境激活msc输注可以降低t2d大鼠的血糖浓度,改善高血糖状况,使t2d大鼠的血糖水平恢复至接近正常水平,增加t2d大鼠中血清胰岛素和c-肽水平,并且治疗后在正常血糖水平维持至少9周。
2)多次静脉输注糖尿病样微环境激活的msc注射液修复受损的胰岛
通过对胰岛素/胰高血糖素的双标记免疫荧光染色法检测多次输注dm样微环境激活的msc对t2d大鼠损伤的胰岛修复的影响。结果显示,msc的注射不论是预处理组还是未处理组,均较好的修复t2d大鼠的胰岛损伤,而dm样微环境激活的msc对损伤的胰岛的改善具有更明显的意义。dm样微环境激活的msc输注后,损伤的胰岛逐渐恢复至接近正常(图4);同时胰岛计数和胰岛素阳性细胞比率同样恢复到几乎正常水平(图5a和b)。这些数据表明,多次dm样微环境激活的msc输注可以使t2d大鼠中损伤的胰岛修复至接近正常状态。
3)多次输注糖尿病样微环境激活的msc注射液改善了t2d大鼠受损的肾脏和肺脏的结构功能。
通过对处死的大鼠的肾脏和肺脏的组织切片的观察,如图6a和b所示,发现,相较于空白治疗组和未处理的msc治疗组,dm样微环境激活的msc治疗组的肾小球体积明显减小,肾小管上皮细胞坏死脱落和水肿状况明显改善,更接近于正常大鼠肾脏组织切片形态。相较于空白治疗组和未处理的msc治疗组,激活的msc治疗组的大鼠肺脏形态得到明显改善,肺泡大小更加均匀,更接近于正常大鼠的肺脏组织。
本发明利用干细胞微环境诱导其修复能力的理论,通过采用高糖高脂条件激活分离提取于脐带、脂肪组织、骨髓组织中的间充质干细胞,制备可用于治疗2型糖尿病的注射液。提供的干细胞注射液静脉输注到t2d大鼠后,能够有效降低大鼠血糖浓度,修复再生胰岛beta细胞,从数目与功能基本接近正常水平,并且修复了t2d大鼠肾脏和肺脏的结构功能,显示了极好的治疗效果。本发明的干细胞注射液,针对t2d发病主要病因胰岛受损与持续高血糖,从主要致病的源头出发,从而达到解决t2d根本问题。由于不受伦理限制、免疫原性低、制备方法成熟,因此在未来的临床实践中,使用本发明制备的激活的间充质干细胞注射液,具有广阔的前景。
- 还没有人留言评论。精彩留言会获得点赞!