培养上皮细胞的组合物及其保持上皮样细胞形态中的应用的制作方法
本发明涉及一种细胞培养组合物,尤其涉及一种用于上皮细胞培养的组合物,在体外培养的环节中,使上皮细胞保持上皮样细胞形态,以利于细胞移植。
背景技术:
上皮细胞最主要的功能就是形成动态的屏障来调剂组织内细胞之间的物质和信号的传递。
视网膜色素上皮细胞(Retinal Pigment Epithelium,RPE细胞)是位于脉络膜和视网膜神经层之间的一层单层细胞,在维持光感受器细胞和视网膜正常功能上发挥重要作用,包括:吸收杂散光,形成脉络膜和视网膜之间的屏障,产生视觉色素,给神经视网膜提供营养,以及吞噬光感受器细胞脱落的外节段(Physiol.Rev.2005,85,845~881)。RPE细胞降解或受损是产生色素性视网膜炎,老年性黄斑病变,斯特格氏病等疾病的原因(Adv.Exp.Med.Biol.2012,724,15~36)。很多延缓RPE细胞降解的研究正在进行,而采用细胞治疗的方法来取代受损伤的RPE细胞也许是治疗这些疾病最有效的方法(Invest.Ophthalmol.Vis.Sci.2009,50,1848~1855;Br.J.Ophthalmol.2010,94,1337~1343)。
在组织原位,RPE细胞具一般上皮细胞的形态,形成紧密的铺路石样单层结构。但是体外培养和传代培养的RPE细胞很容易发生形态的改变,从而导致上皮向间充质转化(Epithelial-Mesenchymal Transition,EMT)的发生,最终形成纤维样形态改变。RPE细胞发生形态改变通常伴随着功能的丧失和改变,比如:屏障功能,膜极性功能等(Methods Mol.Biol.2013,945,45~65;PloS one 2011,6,e23322;Mol.Vis.2008,14,1414~1428)。
技术实现要素:
本发明的一个目的在于提供一种培养上皮细胞的组合物,以利于上皮细胞的体外培养,避免上皮向间充质转化现象的发生。
本发明的另一个目的在于提供一种培养RPE细胞的组合物,以利于RPE细胞的体外培养,避免其向间充质转化现象的发生。
本发明的再一个目的在于提供一种组合物在保持上皮样细胞形态中的应用,在上皮细胞的体外培养中保持上皮样细胞形态,避免上皮向间充质转化现象的发生。
本发明的又一个目的在于提供一种组合物在保持RPE细胞形态中的应用,在RPE细胞的体外培养中保持上皮样细胞形态,避免上皮向间充质转化现象的发生。
一种培养上皮细胞的组合物,包括0.2v/v%~2v/v%基质胶(Matrigel)和50ng/mL~150ng/mL激活素A(Activin A)。
本发明提供的组合物,基质胶优先选择1v/v%。
本发明提供的组合物,激活素优先选择100ng/mL。
本发明提供的组合物用于上皮细胞的体外培养,对体外培养的上皮细胞培养板于0.2v/v%~2v/v%基质胶中孵育,培养基中加入50ng/mL~150ng/mL激活素A进行处理。
本发明提供的组合物用于上皮细胞的体外培养,细胞按密度为1×106个/孔于培养板中培养。
本发明提供的组合物用于上皮细胞的体外培养,培养基为含有10w/w%FBS,100U/mL P/S的高糖DMEM培养基(DMEM/HG)。
本发明提供的组合物,适用于上皮细胞的体外培养,尤其适用于RPE细胞体外培养,保持上皮样细胞形态,膜极性和屏障功能,以及细胞的正常表型和吞噬功能。
本发明技术方案实现的有益效果:
本发明提供的组合物,适用于上皮细胞体外培养,能使上皮细胞维持正常的上皮样形态。分离培养的RPE细胞经过Matrigel和Activin A(MA)处理,能较好的维持紧密结合上皮样细胞形态至少10代以上。同时这些细胞能正常表达RPE特异性标志蛋白,并具有正常吞噬FITC标记光感受器外节段和膜极性功能。
附图说明
图1为本发明组合物用于上皮细胞培养于倒置显微镜下所观察到的RPE细胞形态,其中:A为group-A组(未经过MA处理)的RPE细胞在P2,P4,P6,P8和P10代呈现梭型结构;B为group-B组(经过MA处理)的RPE细胞在P0,P2,P4,P6,P8和P10代能维持很好的上皮样结构;C为经过Matrigel或Activin A处理的RPE细胞在P4代呈现上皮和梭型的混合结构;
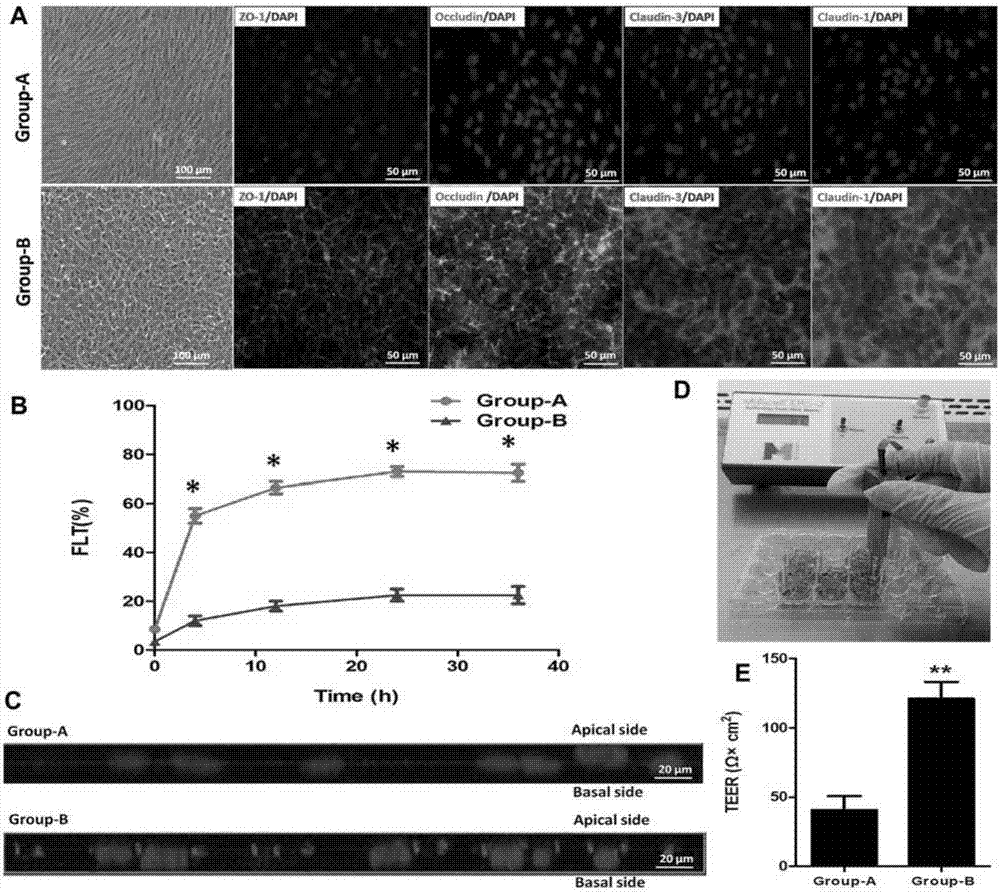
图2为Matrigel和Activin A处理对RPE细胞紧密结合结构、极性和屏障功能的影响,其中:A为免疫荧光检测group-A组和group-B组的RPE细胞紧密结合蛋白ZO-1,Occludin,Claudin-3和Claudin-1表达情况图;B为荧光素纳渗漏检测在不同时间点4小时、12小时、24小时和36小时group-A组和group-B组RPE细胞荧光渗漏值;C为带Z轴三维共聚焦显微镜检测group-A组和group-B组RPE细胞ZO-1免疫荧光染色后的膜极性;D为典型的检测上皮细胞电阻模型(TEER);E为TEER检测评估group-A组和group-B组RPE细胞的动态屏障功能;
图3为Matrigel和Activin A处理对RPE表型和吞噬功能的影响,其中:A为免疫荧光检测group-A组和group-B组RPE的CRALBP,EMMPRIN,Mitf,Otx2,Tyrosinase和RPE-65的表达图;B为group-A组和group-B组RPE细胞的吞噬FITC-POS,同时进行免疫荧光ZO-1染色图;C为通过波长490nm的多孔酶标仪定量检测两组吞噬FITC-POS后的荧光值。
具体实施方式
以下结合附图详细描述本发明的技术方案。本发明实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围中。
RPE细胞的分离与培养方法如下:
来自三位平均年龄在45岁的女性供体眼球。同意书已从每位供体者家属获取,并获得暨南大学伦理学委员会的同意。同时所有的人体相关组织的处理都严格遵守赫尔辛基宣言。
在供体死亡3个小时内,眼球被迅速摘除,按照文献报道的方法通过0.25%EDTA胰蛋白酶消化并离心的方法进行RPE细胞的提取(Invest.Ophthalmol.Vis.Sci.2006,47,3612~3624)。离心收集的细胞沉淀通过含有10%FBS,100U/mL P/S的高糖DMEM培养基(DMEM/HG)进行重悬,然后将细胞悬液转移到培养瓶中放置到37℃二氧化碳培养箱中进行培养。培养10天左右可达到100%融合。接着对细胞进行0.25%EDTA胰蛋白酶消化传代,细胞以密度为1×106个/孔种植到新的6孔板(孵育或不孵育0.2v/v%~2v/v%基质胶,本实施例中使用1%v/v%Matrigel)中。用新鲜的DMEM/HG(添加或不添加50ng/mL~150ng/mL激活素A,本实施例中使用100ng/mLActivinA)每隔三天换液一次的方式传代培养。RPE被培养在未孵育过1v/v%Matrigel的培养板上,且换液时,培养基中未添加100ng/mL Activin A,记为:group-A;RPE细胞被培养在孵育过1v/v%Matrigel的培养板上,且换液时培养基中添加100ng/mL ActivinA,记为:group-B。
免疫荧光法检测方法如下:
待RPE细胞体外培养达到融合后,吸弃上清,磷酸缓冲盐溶液(PBS)洗1遍,分别加入4%多聚甲醛室温下孵育15分钟,然后PBS洗3遍,每遍5分钟,再加入含有0.1%Triton-X 100和3%的牛血清白蛋白(BSA)的PBS室温进行膜通透化处理1小时。然后不洗涤直接加入一抗:鼠单克隆CRALBP抗体(1∶350),鼠单克隆EMMPRIN抗体(1∶100),兔多克隆Miff抗体(1∶100),鼠单克隆Otx2抗体(1∶500),兔多克隆Tyrosinase抗体(1∶100),鼠单克隆RPE-65抗体(1∶1000),和鼠单克隆ZO-1抗体(1∶500)4℃孵育过夜。然后PBS洗3次,每次5分钟,接着加入二抗:Cy3标记羊抗兔IgG抗体(1∶100)和Cy3标记羊抗鼠IgG抗体室温孵育2小时。之后PBS洗3次,每次5分钟,接着加入DAPI染色液室温避光孵育15分钟。最后PBS洗3次,每次5分钟,直接倒置荧光显微镜下观察拍照。
荧光素钠渗漏检测方法如下:
荧光素钠渗漏被用来检测上皮细胞的屏障功能按照已经报道的文献方法进行操作(Toxicol.In Vitro1997,11,399~405)。group-A组和group-B组的RPE在P2代分别以1×106个/孔的密度种植到0.4μm的inserts(适合6孔板)上,然后将inserts放入到特制的培养板中,加入培养基后,37℃二氧化碳培养箱培养7天直到细胞达到100%融合。然后吸弃上清,加入4v/v%多聚甲醛室温下固定15分钟,然后用PBS洗涤2遍。然后每个inserts中分别加入500μL荧光素钠溶液(10μg/mL)在37℃二氧化碳培养箱孵育0小时、4小时、12小时、24小时或36小时,在不同的时间点收集渗漏到下面培养板中的总的荧光素钠溶液。不同点收集的荧光素钠溶液的总的荧光值通过酶标仪进行检测(激发波长为485nm;发射波长为530nm)。其中不同时间点通过未经过1v/v%Matrigel孵育处理的inserts荧光素钠的总荧光值作为group-A组的100%对照,而不同时间点通过经过1v/v%Matrigel孵育处理的inserts荧光素钠的总荧光值作为group-B组的100%对照。那么各个时间点各组的荧光渗漏值(FLT)则是根据他们的渗漏的荧光素钠的荧光值/对应的100%对照。
上皮细胞电阻模型(TEER)检测方法如下:
TEER被用来检测上皮细胞动态屏障功能按照已经报道的文献方法进行操作(Invest Ophthalmol.Vis.Sci.2008,49,788~799)。group-A组和group-B组的RPE细胞在P2代分别以1×106个/孔的密度种植到0.4μm的inserts(适合24孔板)上,然后将inserts放入到特制的培养板中,加入培养基后37℃二氧化碳培养箱培养7天直到细胞达到100%融合。使用Millicell-ERS-2系统检测各组细胞的膜电阻,其中TEER的值按如下公式换算:
TEER(Ωcm2)=(Rtotal-Rinsert w/o Matrigel)×A
Rtotal:总电阻(Ω);
Rinsert w/o Matrigel(Ω):未种植细胞的inserts,经过1v/v%Matrigel处理或不经过1v/v%Matrigel处理的电阻值(Ω);
A:inserts膜面积(cm2)。
POS吞噬功能检测方法如下:
从动物屠宰场购买新鲜的猪眼球,按照发表的文献方法进行光感受器外节段(POS)分离和FITC标记(Stem Cells Transl.Med.2012,1,96~109)。group-A组和group-B组的RPE细胞在P2代分别以1×106个/孔的密度种植到细胞培养板中,将其转移到37℃二氧化碳培养箱培养7天直到细胞达到100%融合。直接上清中加入一定量的FITC-POS在37℃二氧化碳培养箱孵育处理2小时。然后PBS洗涤细胞3遍,加入4%多聚甲醛室温下固定15分钟。接着细胞PBS洗涤3次,分别加入含有0.1%TritonX-100PBS溶液进行膜渗透处理15分钟和含3w/v%BSA的PBS溶液处理1小时。然后加入鼠单克隆ZO-1(1∶500)抗体4℃孵育过夜,并PBS洗涤3遍,每遍5分钟。然后加入Cy3标记的抗鼠二抗(1∶1000)常温下孵育1小时,并PBS洗涤3遍,每遍5分钟。最后倒置荧光显微镜下拍照观察。
Z-stack共聚焦膜极性检测方法如下:
Z-stack共聚焦检测被用来观察RPE细胞的膜极性按照已经发表的文献方法进行操作(Invest Ophthalmol.Vis.Sci.2008,49,788~799)。group-A组和group-B组的RPE在P2代分别以1×106个/孔的密度种植到细胞培养板中,将其转移到37℃二氧化碳培养箱培养7天直到细胞达到100%融合。然后细胞进行如上的ZO-1免疫荧光处理,并利用共聚焦显微镜进行三维拍照观察。
倒置显微镜下观察Matrigel和Activin A(MA)处理对培养RPE细胞形态变化的影响的情况如下:
group-A组和group-B组的RPE细胞在P0代都能展示紧密的细胞与细胞连接的上皮样细胞形态。但是,从P2到P10代,group-A组细胞形态呈梭形形态(参见图1A),而group-B则能很好的维持紧密的细胞与细胞结合的上皮铺路石样的形态(参见图1B)。当对体外培养的RPE细胞在P4代进行单独的培养板孵育Matrigel或外加Activin A处理培养,细胞则出现上皮样和梭形混合形态生长,只有联合培养板孵育Matrigel和外加Activin A处理细胞才能维持很好的上皮样形态生长(参见图1C)。这些信息说明,只有经过Matrigel处理的RPE细胞才能很好的维持上皮样结构形态,MA处理可以很好的促进体外培养RPE细胞MET转变至少10代以上。
Matrigel和Activin A(MA)处理对RPE细胞紧密结合结构和屏障功能的影响情况如下:
免疫荧光结果显示,group-A组的RPE在P2代几乎不能表达紧密结合结构相关蛋白,而group-B组则能强烈在细胞膜部位表达紧密结合结构相关蛋白ZO-1,Occludin,Claudin-3和Claudin-1(参见图2A)。荧光素钠渗漏试验结果显示,group-A组的RPE在P2代的FLT值在4小时、12小时、24小时和36小时各个时间点都显著高于group-B组(*P<0.05,参见图2B)。同时,ZO-1免疫荧光处理后的三维共聚焦检测结果显示,group-B组的RPE在P2代能很好的展现细胞膜极性,而group-A组则由于阴性表达ZO-1则不能展现细胞膜极性(参见图2C)。这个RPE细胞极性观察效果与已经报道的文献结果吻合(Invest Ophthalmol.Vis.Sci.2008,49,788~799;Stem Cells Transl.Med.2013,2,341~354)。上皮细胞电阻模型(TEER)检测方法参见图2D。结果显示,达到完全融合状态下的group-B组的RPE的电阻值显著高于group-A组(*P<0.05),参见图2E。这些结果说明MA处理能有效的促进体外培养RPE细胞的紧密结构结构相关基因的表达,同时能够促进其屏障和膜极性功能的维持。
Matrigel和Activin A(MA)处理对RPE细胞的表型及吞噬功能的影响情况如下:
为了探索MA处理是否影响RPE细胞正常标志蛋白表达的影响,我们对P2代培养的group-A组和group-B组的RPE细胞进行免疫荧光检测。结果显示,经过MA处理的体外培养的RPE细胞能够正常的表达RPE细胞特异性标志蛋白,如:CRALBP,EMMPRIN,Mitf,Otx2,Tvrosinase和RPE-65(参见图3A)。同时,吞噬功能检测结果显示,group-B组的RPE细胞能正常吞噬FITC标记的猪的POS进入细胞质中,通过结合阳性的ZO-1的免疫荧光检测能很好的展示吞噬效果。而group-A组的RPE细胞由于阴性的ZO-1的免疫荧光检测不能很好的展示吞噬进入细胞质的效果(参见图3B)。同时,多孔酶标仪定量检测group-A组和group-B组的RPE细胞吞噬FITC-POS后的荧光值,group-B组要显著高于group-A组(*P<0.05),参见图3C。这些结果显示MA处理并不影响体外培养RPE细胞正常的表型和吞噬功能。
- 还没有人留言评论。精彩留言会获得点赞!
- 多功能转录调控因子CTCF的DNA结合位点CTCF_33的应用的制造方法与工艺
- 一种生物活性多肽SKHSSLDCVL及其制备方法和应用与制造工艺
- 一种生物活性多肽TIASGEPT及其制备方法和应用与制造工艺
- 一种猪流行性腹泻病毒及其应用的制造方法与工艺
- 一种结肠上皮间淋巴细胞的分离方法与制造工艺
- 一种新型羧基末端肽及长效白介素7的制造方法与工艺
- 一种水溶液中短链脂肪酸的分析方法及应用与制造工艺
- 氮芥衍生物N,N‑二(2‑氯乙基)‑N′‑十四酰基‑1,4‑苯二胺及其制备方法与制造工艺
- 氮芥衍生物N,N‑二(2‑氯乙基)‑N′‑十六酰基‑1,4‑苯二胺及其制备方法与制造工艺
- 芳胺氮芥衍生物N,N‑二(2‑氯乙基)‑N′‑乙酰基‑1,4‑苯二胺及其制备方法与制造工艺