一种玉米抗旱相关基因Zmhdz12及其应用的制作方法
本发明涉及的是基因工程技术领域,尤其涉及的是一种玉米抗旱相关基因zmhdz12及其应用。
背景技术:
我国是玉米种植和需求大国,玉米在粮食作物种植面积里占比第一,遍及西北、东北和中部大部分区域。近年,不断有报道我国大部分地区干旱少雨,加上灌溉不便和成本的提高,许多地方粮食减产甚至绝收,使得干旱严重影响到玉米的产收的高低和质量优良。因此,培育抗旱优质的品种成为玉米种质选育重要目标。然而,目前传统的育种技术由于育种年限长和种质资源匮乏,难以满足目前种质需求和生产目标。而基因工程技术快速发展,可以将基因工程技术和植物抗旱改良育种相结合,为植物抗旱育种开辟了一条高效快捷的途径,作物胁迫应答机制的研究和耐逆新品种的培育也成为粮食高质高产的决定性因素。目前,许多抗旱相关转录因子相继分离,并获得目标抗性的转育植株。但是,玉米中可用于抗旱遗传改良的基因很少,远远落后于水稻、拟南芥等其它物种,并且对玉米中已分离的抗旱基因的分子作用机制的研究也相对较少,严重制约着玉米种质的发展。因此,抗旱相关基因的挖掘和其功能的分析是作物抗旱遗传改良的基础。
植物的抗旱应答机制离不开转录因子的调控。有报道显示,植物的抗旱性能的体现并不是某一个转录因子单独调控的结果,是由多个转录因子协同表达共同影响决定的复杂生物学性状。转录因子的功能调控和植物抗旱机制的应答,为作物分子抗旱育种的开展提供了有力支持,为作物综合抗旱性能的提高和改良提供了理论依据。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供了一种玉米抗旱相关基因zmhdz12及其应用,以提供一种新的可用于玉米抗旱遗传改良的基因。
本发明是通过以下技术方案实现的:
本发明提供了一种玉米抗旱相关基因zmhdz12,其核苷酸序列如seqidno.1所示,全长735bp。
本发明还提供了上述玉米抗旱相关基因zmhdz12在降低或提高植物抗旱性中的应用。
本发明还提供了上述玉米抗旱相关基因zmhdz12的编码蛋白,其氨基酸序列如seqidno.2所示,具有244个氨基酸。
本发明还提供了一种植物过量表达载体,所述植物过量表达载体为pcambia1301载体,所述pcambia1301载体的多克隆位点区域依次连接有35s启动子、zmhdz12基因和终止子。
本发明还提供了一种遗传工程化的宿主细胞,所述宿主细胞含有所述植物过量表达载体,或其基因组中整合有外源的所述zmhdz12基因的正向或反向序列。
本发明还提供了一种提高植物抗旱性的方法,所述方法是将所述zmhdz12基因导入植物的细胞、组织或器官中,获得抗旱性强的转基因植株新品种。
进一步地,所述植物包括玉米、水稻、小麦、拟南芥。
本发明相比现有技术具有以下优点:本发明提供了一种玉米抗旱相关基因zmhdz12及其应用,该基因为一种新的植物抗旱相关基因,丰富了抗旱相关基因的资源,对玉米抗旱新品种的选育具有重要意义。
附图说明
图1为zmhdz12基因凝胶电泳检测结果图;
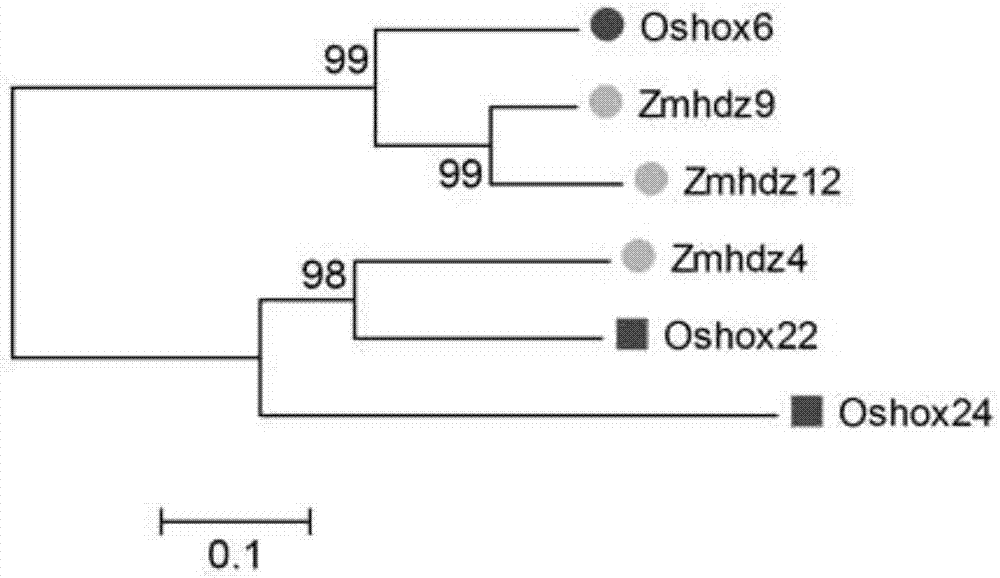
图2为zmhdz12蛋白与其它hd-zipi蛋白家族成员的系统进化树分析结果图;
图3为zmhdz12基因过表达载体图谱;
图4为模拟干旱处理下转基因拟南芥与野生型拟南芥相对含水量测定结果柱状图;
图5为模拟干旱处理下转基因拟南芥与野生型拟南芥丙二醛含量测定结果柱状图;
图6为模拟干旱处理下转基因拟南芥与野生型拟南芥相对电导率测定结果柱状图;
图7为模拟干旱处理下转基因拟南芥与野生型拟南芥体内脯氨酸含量测定结果柱状图;
图8为模拟干旱处理下转基因拟南芥与野生型拟南芥过氧化氢酶测定结果柱状图。
具体实施方式
实施例1
1、材料
本实施例所用方法如无特别说明均为本领域的技术人员所知晓的常规方法,所用的试剂等材料,如无特别说明,均为市售购买产品。
2、方法
2.1zmhdz12基因的克隆
选择玉米b73自交系为实验材料,提取三叶期玉米叶片组织rna,并反转录成cdna备用。
从玉米数据库检索获取zmhdz12的生物学信息,转录本id为grmzm2g034113_p01。以zmhdz12基因序列为模板设计特异性扩增引物,同时结合克隆载体的多克隆酶切位点,选择xbai和bamhi酶切位点引入zmhdz12序列两端,特异性扩增引物序列如下所示:
seqidno.3:zmhdz12-f:5’-gctctagaatggacggcgccgaggacga-3’
seqidno.4:zmhdz12-r:5’-ggatcctcactcgctgagggactcca-3’
以cdna为模板,zmhdz12-f和zmhdz12-r为引物,利用takara公司生产的高保真酶primerstarmaxpremix(2×)进行pcr扩增反应,pcr扩增反应体系如下:
pcr扩增程序为:98℃预变性10min,98℃变性10s,65℃退火5s,72℃延伸1min,共30个循环后,加入0.5μl的taq酶,以给3’端加上polya尾巴,最后,72℃下继续延伸10min完成反应,获得的pcr产物用质量比为1%的琼脂糖凝胶电泳检测拍照。
结果如图1所示,图中可以看出,目标基因条带清晰,且大小与预测结果一致,说明pcr结果良好。
进一步地,将目标基因用axygen公司的胶回收试剂盒进行切胶回收,与t1simple载体连接后转化到大肠杆菌trans5α感受态细胞中,用xbai和bamhi进行双酶切验证,筛选阳性克隆子,并送去华大基因公司测序。
2.2zmhdz12基因的生物信息学分析
测序结果经mega4.0软件与数据库中的序列比对后,与seqidno.1所示的核苷酸序列一致,说明成功克隆获得zmhdz12基因。经序列分析发现zmhdz12基因编码区全长735bp,共计编码244个氨基酸,pi为5.38,mw为26.79kd。对其蛋白序列进行分析,结果发现,zmhdz12基因编码蛋白含有两个突出的保守结构域,hd结构域及与其相连的zip结构域,并且zip结构域中含有6个重复的亮氨酸残基,预测zmhdz12基因属于hd-zipi家族转录因子。
选取玉米和水稻hd-zipi家族中功能得到报道验证的成员,并筛选与zmhdz12同源性较高的基因成员,分别对这些基因成员的蛋白序列进行分析比对并构建系统进化树,结果如图2所示,zmhdz12和筛选到的同源性较高的hd-zipi成员蛋白序列相似性较高,进化关系也比较近。其中部分基因已经报道其功能与植物的抗旱调控相关,如zmhdz4可提高过表达株系的耐旱性,这一发现为后续的功能验证奠定基础。
2.3zmhdz12基因过表达载体的构建
以pcambia1301为原始载体,在其多克隆位点的ecori和sali酶切位点之间连接一个35s启动子,并在sphi和hindiii酶切位点之间加上一段终止子,获得改造的载体pcambia1301a。
根据pcambia1301a上的多克隆位点及目的基因的序列特征,选择在zmhdz12基因基因两端添加kpni(5'端)和sali(3'端)酶切位点,以seqidno.5、seqidno.6为引物,以步骤2.1克隆获得的阳性质粒为模板,进行pcr扩增,获得扩增片段。
seqidno.5:zmhdz12-f’:5'-ggggtaccatggacggcgccgaggacga-3'
seqidno.6:zmhdz12-r’:5'-gcgtcgactcactcgctgagggactcca-3'
将扩增片段连接至t1simple中并转化大肠杆菌trans5α感受态细胞,摇菌测序并保存,提取质粒,用kpni、sali双酶切质粒得到小的目的片段,同时用kpni、sali双酶切p1301a得到大片段。
连接反应体系为:
连接反应在16℃下进行3h后,转化至大肠杆菌感受态细胞中,挑斑、摇菌、提质粒,并通过双酶切验证,获得如图3所示的zmhdz12基因过表达载体p1301a-zmhdz12。
2.4zmhdz12基因的拟南芥遗传转化
2.4.1拟南芥种子的清洗:
先取12ml次氯酸钠溶液于88ml水中,配置成配置12%的次氯酸钠溶液。取待清洗种子于无菌离心管中,每管加入1ml的12%的次氯酸钠溶液,浸泡清洗15min,期间间隔摇晃;再用无菌水漂洗5次,期间摇晃混匀,以洗净种子表面次氯酸钠溶液和杂质;将清洗杀菌之后的哥伦比亚野生型拟南芥种子在4℃冰箱处理2天,备用。
2.4.2拟南芥的培养
取出清洗之后种子,借助移液枪均匀铺散在ms固体培养基的方形培养皿上,拟南芥培养室培养;将培养基上生长10天左右的幼苗移入混合后的营养土中生长,营养黑土和蛭石体积比为1:3,继续温室培养;需要注意的是,刚刚移栽的幼苗需保持水分,采用透光塑料膜覆盖法,2-3天后揭开。
2.4.3农杆菌介导转化拟南芥
将构建的过表达载体p1301a-zmhdz12导入农杆菌eha105感受态细胞中,获得侵染菌。待移栽的拟南芥大部分准备第一次开花时,即为拟南芥侵染最佳时期。为了促进拟南芥有花枝的增生,可修剪提前开花的花苞;同时将已经有的角果剪去,提高转基因种子的阳性率。转化方法如下:将侵染菌进行扩大培养至od600值为0.8。同时配置转化buffer溶液(处理液):1l的buffer溶液需要2.3g的ms,50g蔗糖,0.5g的mes,用naoh调节ph值到5.8。处理液使用前还需加入表面活性剂。取搅拌后的混合buffer溶液悬浮离心得到的菌块,即得到侵染溶液。
浸染拟南芥花序:拟南芥抽薹约10厘米高时,用农杆菌浸染液浸湿拟南芥花序,重复2-3次,用保鲜膜包裹住植株地上部分,在黑暗下培养2-3天。一个礼拜后,再次重复浸染。约两个月,收获成熟拟南芥的种子(t0代),干燥后置于4℃下保存。
2.4.5转基因拟南芥的筛选
将上述收获的拟南芥种子(t0代)经消毒(用12%的次氯酸钠溶液漂洗9min,然后用灭菌的蒸馏水冲洗5次,每次清洗时间约1分钟),4℃春2天(注意避光),种子均匀洒在含潮霉素的ms培养基平板上,同时以野生型拟南芥种子作为对照。如果野生型拟南芥种子在不含抗性的ms平板上能够正常萌发生长,在含抗性的平板上均不能正常萌发生长,而转基因拟南芥中却有种子在含抗性的平板上能够正常萌发生长,则认为筛选阳性拟南芥植株是有效的。
以zmhdz12基因为目的基因,对筛选的阳性植株进行pcr分子检测,初步鉴定转基因拟南芥是否转化成功。
2.4.6转基因拟南芥后代的获得
按照步骤2.4.5的方法,将初步鉴定为转基因拟南芥植株的种子(t1代)用含潮霉素的ms培养基平板进行筛选,获得t1代植株,待t1代植株果荚成熟时,收获转基因t2代种子,以此类推,最终获得了三组稳定遗传的转基因拟南芥t2代株系,分别为l3、l5、l21。
2.5zmhdz12转基因拟南芥的耐旱性分析
将拟南芥l3、l5、l21和野生型wt株系种子在消毒后,均匀铺在含潮霉素的ms固体培养基上,野生型种子铺在ms固体培养基上,并置于4℃冰箱里春化2天(便于同步发芽)。将春化后的种子置于条件为22℃,16/8h光/暗培养的拟南芥专用培养温室里培养。萌发10天左右,选取大小一致的转基因株系和野生型幼苗移入营养土和蛭石体积比为1:3混合的营养土中生长。待幼苗有活力时,采用质量比为20%的peg-6000模拟干旱处理幼苗14天左右,对比观察、拍照,测定其生理生化指标。
2.5.1处理前后植株表型的观察
处理前,转基因株系与野生型株系生长无显著差别,模拟干旱处理后,野生型植株叶片较转基因植株叶片受到发紫发黄面积大,卷曲严重。
2.5.2叶片相对含水量(rwc)测定
(1)分别取20%peg-6000处理前、后的转基因植株和野生型植株相同部位叶片。
(2)用ddh2o冲洗两次,除去叶面上的土壤和杂质,再用滤纸吸尽表面水分,称鲜重w0;
(3)取称重后叶片浸泡在去离子水中5-6h,直至吸水饱和重量不变时,称鲜重w1;
(4)将(3)中称重的叶片用锡箔纸包好,放入180℃的烘箱,烘干水分,称干重w2;
(5)相对含水量的计算公式:
结果如图4所示,图中可以看出,处理前后,转基因株系和野生型植株叶片相对含水量发生了显著变化,处理前的含水量一致,处理后两者含水量都有下降,但野生型植株下降量明显高于转基因株系,说明野生型株系的叶片没有zmhd12过表达株系叶片保水性好。
2.5.3丙二醛(mda)含量测定
(1)称取实验组和对照组同等重量的组织,加入置于4℃贮存的0.05mol/l缓冲液并借助于石英砂,研磨成组织匀浆;
(2)取匀浆于离心管中,离心15min,,观察匀浆是否分层;
(3)取分层的匀浆上清液于新的试管中,先加入3ml的0.5%硫代巴比妥酸混匀,再加入5%三氯乙酸溶液,摇晃混匀,水浴锅(100℃)10min,并用清水冲洗试管以快速降温,然后离心,以去离子水为对照,测量离心上清在532nm、600nm波长下吸光值a532、a600。
(4)数据的处理按照下面运算公式:
式中,a为吸光度,v1为反应液总量,v为提取液总量,v2为反应液中的提取液量,w为植物样品的重量,1.55×10-1为丙二醛的微摩尔吸光系数。
结果如图5所示,图中可以看出,处理后转基因株系和野生型植株的丙二醛含量都有得到增加,但在上升幅度上,野生型植株高于转基因植株,图标中可以清晰看出,这种变化是极显著的,说明转基因植株中积累的丙二醛含量较少,细胞受伤程度较轻。
2.5.4相对电导率(rel)的测定
(1)取处理前后的实验组和野生型wt各株系同位置叶片,用ddh2o冲洗两次,打孔叶片10-15个圆片;
(2)各组叶片分别放入试管中,同时选用纱布和透气封口胶带将试管罩住并固定,抽取试管中空气,30min;
(3)试管放于摇床内1h,校准完成的电导仪测量初电导值k1;
(4)再将包含样品试管于水浴锅(100℃)煮沸16min,。沸水浴后用自来冷冲洗试管至室温,室温下静置10min后,摇匀后测其终电导值k2;
(5)以ddh2o作为对照,电导仪测量值为空白电导值k0;
(6)相对电导率的计算可按照下面公式计算:
结果如图6所示,图中可以看出,处理前各组植株相对电导率的是无明显差异的,但在处理后都发生了的变化,转基因株系的相对电导率在干旱处理后低于野生型植株,在这种现象显著差异分析后,是极显著的,说明转基因拟南芥比野生型拟南芥的叶细胞间的电解质含量少,膜受损情况较轻。
2.5.5植物体内脯氨酸含量的测定方法
(1)按下表1分别加入各试剂于七个洁净试管中,水浴锅(100℃)40min;
(2)吸取5ml甲苯加入冷却后的七个试管中,并混匀。测量520nm各试管吸光值,以0号试管校0;
(3)记录所测数值,并绘制脯氨酸标准曲线,脯氨酸含量为横坐标,吸光值为纵坐标,求得线性回归方程;
(4)取实验组和对照组叶片0.5g,剪刀剪碎至小片,加入5ml3%(质量)磺基水杨酸后,水浴锅(100℃)中10min,;
(5)取水浴后上清(已到室温),加入提前配置好的酸性茚三酮显色液和冰乙酸溶液,水浴锅(100℃),下面方法同(1)(2);
(6)数据的处理:
式中,c为提取液中脯氨酸浓度(μg),由标准曲线求得;v为提取液总体积(ml);a为测定时所吸取的体积(ml);w为样品重量(g)。
结果如图7所示,图中可以看出,在正常生长条件下,转基因株系和野生型植拟南芥的脯氨酸含量的几乎一致,但转基因植株的脯氨酸含量在处理后却大大提升,并分析得到该差异是极显著的。
2.5.6过氧化氢酶(cat)测定
cat测定采用南京建成生物研究所购买的过氧化氢酶(cat)测定试剂盒(可见光法)和总蛋白(tp)测定试剂盒(考马斯亮蓝法)进行测定,具体方法参照试剂盒说明书进行,具体为:
分别取20%peg处理前l3、l5、l21和野生型wt各实验组株系同一叶位的莲座叶,用ddh2o冲洗两次,除去叶面上的土壤和杂质。
(1)组织样本的检测
a.液氮预冷研钵和研磨棒,加入样品研磨至粉末状,称取1g粉末,并加入9倍体积的生理盐水,由此得到的组织匀浆,并于离心机2500rpm离心10分钟,取上清。
b.取5ml离心管按下面体积加入相应的试剂,其中,测定管添加组织原浆,对照管以水代替:
混匀,水浴锅中37℃温浴1min,再按下表加入相应体积的试剂三、试剂四:
c.摇匀各试剂的混样,波长405nm,测定各管吸光度值,双蒸水调零。
(2)蛋白定量测试
a.取(1)中a.步上清,取上清液用生理盐水按1:9比例稀释成1%浓度组织匀浆,待测;
b.将待测组织匀浆加入5ml离心管中,并按下表体积加入相应体积的试剂。其中,考马斯亮蓝显色液需要现配现用,配置方法:将考马斯亮蓝贮备液和双蒸水按1:4的比例混匀。注意:0.563/l蛋白标准品(ml)需放-20℃保存,可保存6个月。
混匀各试剂成分,室温放置10min,测量前双蒸水调零,测量各试管样品在调波长595nm的吸光值。
c.实验组样本蛋白浓度计算公式如:
本实施例中,标准品浓度为0.563g/l。
(3)组织中cat活力的计算:
为了准确分析各组数据,我们选用spss10.0软件完成本部分数据的处理和统计分析。差异显著性t检验是基于p<0.01(**)和p<0.05(*)两个水平上进行。
在逆境条件下,植株会产生过多的活性氧如过氧化氢(h2o2),影响植株的生长发育,但是植株体内的过氧化氢酶能消除体内过多的过氧化氢,保护细胞免受过氧化氢的毒害。本发明对转基因株系和野生型植株叶片中的氧化氢酶活力进行测定,结果如图8所示,图中可以看出,处理前转基因株系与野生型株系的过氧化氢酶活性基本一致,处理后,转基因株系的过氧化氢酶活力较野生型植株显著升高。
3、结论
通过对zmhdz12转基因植株的耐旱性试验,对丙二醛、游离脯氨酸和过氧化氢酶活力等生理生化指标测定,结果发现干旱胁迫下,zmhdz12转基因植株抗氧化能力较高,所受胁迫伤害较小,进一步验证了zmhdz12基因与植物的抗旱调控相关,过量表达该zmhdz12基因可以提高转基因植株的耐旱性,从而为玉米品种的基因工程改良提供了新的遗传资源。
以上为本发明一种详细的实施方式和具体的操作过程,是以本发明技术方案为前提下进行实施,但本发明的保护范围不限于上述的实施例。
sequencelisting
<110>安徽农业大学
<120>一种玉米抗旱相关基因zmhdz12及其应用
<130>/
<160>6
<170>patentinversion3.3
<210>1
<211>735
<212>dna
<213>zeamays
<400>1
atggacggcgccgaggacgacgggacggagtggatgatgcatggtgccggagggaaggga60
aaaggcggcggcgcgctcgacaagaacaagaagcgcttcagcgacgagcagaccaagtcg120
ctggagtccatgttcgcgacgcaggccaagctggagccgcgccagaagctgcagctggcg180
cgggagctcggcctgcagccgcgccaggtcgccatctggttccagaacaagcgcgcgcgc240
tggaagtccaagcagctggagcgcgagtactcggcgctgcgcgacgactaccacgcgctc300
ctctgcagctacgagtccctcaaggacgagaagcgcgcgctcctcaagcagctggagaag360
ctggccgagatgctgcacgagccgccgcagggcaagtactacggcggcaatgcggacgac420
gtgcgctcgggcggcgtcggcggcacgaaggaggaggaggagtccacagacgcctgcgcc480
ggggccgcgctctactcgtccgagtgcgctggcggtggcaggttcatcgcgcacttcttg540
gcggacgacgacgtgggagcagccctcttccggccgccgtcgtctccgcagccgaccgct600
ggcttactcacgtcgtcggggccgccggagcaccagccgttccagttccactccggctgc660
tgctggccgtcgtcgtcggcggagcagacctgcagcggctcgcaatggtgggagttggag720
tccctcagcgagtga735
<210>2
<211>244
<212>prt
<213>zeamays
<400>2
metaspglyalagluaspaspglythrglutrpmetmethisglyala
151015
glyglylysglylysglyglyglyalaleuasplysasnlyslysarg
202530
pheseraspgluglnthrlysserleuglusermetphealathrgln
354045
alalysleugluproargglnlysleuglnleualaarggluleugly
505560
leuglnproargglnvalalailetrppheglnasnlysargalaarg
65707580
trplysserlysglnleugluargglutyrseralaleuargaspasp
859095
tyrhisalaleuleucyssertyrgluserleulysaspglulysarg
100105110
alaleuleulysglnleuglulysleualaglumetleuhisglupro
115120125
proglnglylystyrtyrglyglyasnalaaspaspvalargsergly
130135140
glyvalglyglythrlysglugluglugluserthraspalacysala
145150155160
glyalaalaleutyrserserglucysalaglyglyglyargpheile
165170175
alahispheleualaaspaspaspvalglyalaalaleupheargpro
180185190
proserserproglnprothralaglyleuleuthrserserglypro
195200205
progluhisglnpropheglnphehisserglycyscystrpproser
210215220
serseralagluglnthrcysserglyserglntrptrpgluleuglu
225230235240
serleuserglu
<210>3
<211>28
<212>dna
<213>人工序列
<400>3
gctctagaatggacggcgccgaggacga28
<210>4
<211>25
<212>dna
<213>人工序列
<400>4
ggatcctcactcgctgagggactcca26
<210>5
<211>28
<212>dna
<213>人工序列
<400>5
ggggtaccatggacggcgccgaggacga28
<210>6
<211>28
<212>dna
<213>人工序列
<400>6
gcgtcgactcactcgctgagggactcca28
- 还没有人留言评论。精彩留言会获得点赞!