苄基鸟嘌呤衍生物及其有机盐类化合物和药物组合物及其应用的制作方法
本发明涉及抗肿瘤药物领域,且特别涉及一种苄基鸟嘌呤衍生物及其有机盐类化合物和药物组合物及其应用。
背景技术:
研究表明,microrna(mirna)在肝癌组织中转录异常,与肝癌的发生发展密切相关。其中转运蛋白exportin-5(xpo5)是在细胞核与细胞质之间穿梭的核转运蛋白,在mirna生物合成过程中发挥重要作用,与成熟mirna的水平息息相关。研究表明,肝癌中xpo5被丝/苏氨酸蛋白激酶erk磷酸化。磷酸化xpo5受肽脯氨酰顺反异构酶pin1(peptidyl-prolylcis/transisomerase,nima-interacting1)调控并发生构型改变,滞留在细胞核内,不能有效转运pre-mirna到细胞质,导致成熟mirna生物合成降低。以在正常肝脏组织中高转录而在肝癌组织中低转录的抑癌基因mir-122为例,erk对xpo5的磷酸化作用导致肝癌中mir-122生物合成量显著降低,促进肿瘤生长并使肿瘤对抗癌药物产生抗性。磷酸化xpo5的构型改变需在异构酶pin1的介导下完成。因此,pin1可作为全新的药物靶点,有机会实现对mirna生物合成的调控以及肝癌的治疗。然而,由于细胞膜渗透性差、pin1亲和力不高等问题,至今未见特异性的pin1抑制剂进入临床研究的报道。因此,目前迫切需要寻找新型抗肿瘤pin1抑制剂,为肝癌的临床治疗提供新的策略。
技术实现要素:
本发明的目的在于提供一种苄基鸟嘌呤衍生物,该苄基鸟嘌呤衍生物易于制备、成药性好,可抑制pin1蛋白的酶催化活性,能在细胞和动物水平上促进成熟microrna生物合成。
本发明的另一目的在于提供一种有机盐类化合物,该盐类能够抑制磷酸化xpo5的构型发生改变,避免磷酸化xpo5在细胞内滞留,促进成熟microrna生物合成
本发明的另一目的在于提供一种药物组合物,该组合物能够促进成熟microrna生物合成,可用于治疗癌症。
本发明的另一目的在于提供一种苄基鸟嘌呤衍生物在制备抗肿瘤药物中的用途,以完善现有抗肿瘤药物的种类。
本发明的另一目的在于提供一种有机盐类化合物在制备抗肿瘤药物中的用途,扩大了有机盐类化合物的使用范围。
本发明的另一目的在于提供一种药物组合物在制备抗肿瘤药物中的用途,增加了治疗抗肿瘤药物的种类。
本发明解决其技术问题是采用以下技术方案来实现的:
本发明提供一种苄基鸟嘌呤衍生物,其结构通式为:
其中,ar为芳香环取代基。
本发明还提供一种有机盐类化合物,其包括上述的苄基鸟嘌呤衍生物。
本发明还提供一种药物组合物,其包括上述的有机盐类化合物或者苄基鸟嘌呤衍生物。
本发明还提供一种苄基鸟嘌呤衍生物在制备抗肿瘤药物中的用途。
本发明还提供一种有机盐类化合物在制备抗肿瘤药物中的用途。
本发明还提供一种药物组合物在制备抗肿瘤药物中的用途。
本发明苄基鸟嘌呤衍生物及其制备方法的有益效果是:与现有技术相比,本发明提供的一系列新的苄基鸟嘌呤衍生物易于制备、成药性好,可抑制pin1蛋白的酶催化活性,能在细胞和动物水平上促进成熟microrna生物合成,抑制肝癌增殖。其可作为pin1靶向抑制剂,进而可作为肝癌治疗药物。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例中所需要使用的附图作简单地介绍。
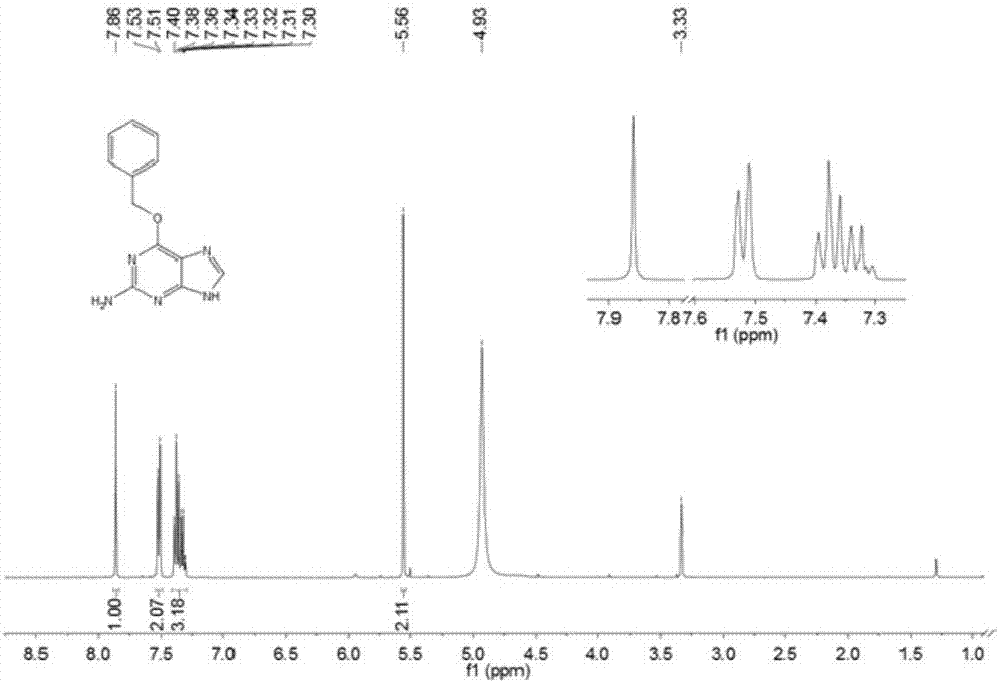
图1为本发明实施例1制备得到的苄基鸟嘌呤衍生物的核磁共振氢谱图;
图2为本发明实施例1制备得到的苄基鸟嘌呤衍生物的核磁共振碳谱图;
图3为本发明实施例1制备得到的苄基鸟嘌呤衍生物的质谱图;
图4为本发明实施例2制备得到的苄基鸟嘌呤衍生物的核磁共振氢谱图;
图5为本发明实施例2制备得到的苄基鸟嘌呤衍生物的核磁共振碳谱图;
图6为本发明实施例2制备得到的苄基鸟嘌呤衍生物的质谱图;
图7本发明实施例3制备得到的苄基鸟嘌呤衍生物的核磁共振氢谱图;
图8为本发明实施例3制备得到的苄基鸟嘌呤衍生物的核磁共振碳谱图;
图9为本发明实施例3制备得到的苄基鸟嘌呤衍生物的质谱图;
图10为实验例2对肝癌细胞抗增殖试验的结果图;
图11为实验例3对小鼠肿瘤生长抑制试验的结果图;
图12为实验例3中化合物4对小鼠肿瘤生长抑制试验的结果图;
图13为实验例4中化合物4与pin1蛋白的热转移试验结果图;
图14为实验例5中化合物4促进成熟microrna生物合成的qpcr试验结果图;
图15为实验例6中化合物4恢复肝癌细胞内xpo5的核质穿梭的共聚焦显微镜试验结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
在本发明的描述中,需要说明的是,术语“第一”、“第二”等仅用于区分描述,而不能理解为指示或暗示相对重要性。
下面对本发明实施例的苄基鸟嘌呤衍生物及有机盐类化合物和药物组合物及其应用进行具体说明。
本发明实施例提供的一种苄基鸟嘌呤衍生物,其结构通式为:
其中,ar为芳香环取代基。
进一步地,本发明实施例中芳香取代基选自苯基、萘基、吡啶基、喹啉基、吡咯基、吡唑基、咪唑基、呋喃基、噻吩基、恶唑基和噻唑基中的任意一种。进一步优选地,苯基、萘基、吡啶基、喹啉基、吡咯基、吡唑基、咪唑基、呋喃基、噻吩基、恶唑基和噻唑基均不含取代基或均包括至少一个取代基。再进一步优选地,取代基选自芳基、酰基、酰胺基、羧基、羧酸酯基、磺酸基、磺酸胺基、磺酸酯基、亚磺酸基、亚磺酸胺基、亚磺酸酯基、腈基、环烷基、烷基、烯基、炔基、卤素、烷氧基、氨基、胺基、硫醚基、硝基、硅基、膦酸基、膦酸酯基中一种或多种。
本发明还提供上述苄基鸟嘌呤衍生物在制备抗肿瘤药物中的用途。进一步优选地,该肿瘤药物为pin1靶向抑制剂类药物。再进一步优选地,该肿瘤药物为治疗肝癌的药物。
本发明实施例提供的苄基鸟嘌呤衍生物通过作用于pin1,抑制pin1蛋白的酶的催化活性,降低pin1对磷酸化xpo5的作用,减少细胞内磷酸化xpo5的积蓄,能够有效转运pre-mirna到细胞质,促进成熟mirna生物合成,进而实现该药物的靶向性治疗,有效抑制肿瘤的生长。因此,苄基鸟嘌呤衍生物可作为抗肿瘤药物应用,进一步地作为pin1靶向抑制剂类药物一级治疗肝癌的药物。
本发明实施例提供的苄基鸟嘌呤衍生物、机盐类化合物和药物组合物可制成医学和药学上课接受的剂型,例如片剂、胶囊剂、水性或油性溶液剂、混悬剂、乳剂、乳膏剂、软膏剂、凝胶剂、喷鼻剂、栓剂、用于吸入的细小分散的粉剂或气雾剂或喷雾剂、用于胃肠道外(包括静脉内、肌内或输注)的无菌水性或油性溶液或混悬液或无菌乳剂。
本发明还提供一种有机盐类化合物及其用途,该有机盐类化合物包括上述的苄基鸟嘌呤衍生物。由于苄基鸟嘌呤衍生物能够抑制pin1蛋白酶的活性,进而包括该苄基鸟嘌呤衍生物的有机盐类化合物也具有一定的抑制效果,可用于制备抗肿瘤药物。
本发明还提供一种药物组合物及其用途,该药物组合物包括上述的有机盐类化合物或者苄基鸟嘌呤衍生物。由于苄基鸟嘌呤衍生物能够抑制pin1蛋白酶的活性,进而包括该苄基鸟嘌呤衍生物或其有机盐类化合物的药物组合物也可用于制备抗肿瘤药物。
药物组合物可为单位剂量形式。在这些形式中,将所述组合物分成含适量活性组分的单位剂量。该单位剂量形式可为包装制剂,包装中包含分隔量的制剂,例如盒装片剂、胶囊剂和在管形瓶中的粉剂。单位剂量形式还可以为胶囊剂、扁囊剂或片剂或其可为适当数量的任何这些包装形式。
在治疗肿瘤的过程中,可采用本发明的药物组合物与其它抗肿瘤药物进行联合治疗。例如,与用于医学肿瘤学的抗增殖/抗肿瘤药、细胞生长抑制剂、抗入侵药物、生长因子功能抑制剂、抗血管生成剂、血管损伤剂等联用。
在治疗肿瘤时,可通过同时、序贯或单独给予各种治疗成分可实现这种联合治疗。此类组合产品应用有效剂量范围内的本发明化合物和准许剂量范围内的其它药学活性剂。
本发明实施例还提供一种苄基鸟嘌呤衍生物的制备方法:
具体的反应式为:
具体的合成包括以下步骤:
s1、化合物b的合成;
将化合物a(6-氯-2-胺基-9h-嘌呤)于30-50摄氏度溶解在dmf中,冷却至室温,加入1-甲基吡咯烷,搅拌反应10-30小时,加入丙酮使产物沉淀,过滤,滤饼用乙醚清洗两次,真空干燥后得产品即化合物b。其中,化合物a与1-甲基吡咯烷摩尔比为1:1.8-2.2。
s2、化合物c的合成;
将苄醇衍生物和氢化钠在惰性气体保护下溶解在无水dmf中,加入化合物b,室温搅拌反应2-5小时,旋蒸除去溶剂,粗产品经柱色谱纯化(甲醇/二氯甲烷为流动相)得纯品。其中,苄醇衍生物:氢化钠:化合物b的摩尔比为1:1.8-2.2:1。
本发明实施例制备得到的苄基鸟嘌呤衍生物的结构通过1hnmr、13cnmr和hr-esims进行分析测定。
本发明实施例提供的一系列新的苄基鸟嘌呤衍生物相对于普通硒醚衍生物有多环的存在,其结构更加复杂多样。并且,本发明实施例提供的制备方法简便、高效、绿色环保,给多环芳硒醚衍生物的工业化生产提供了一条很有价值的途径。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供的一种苄基鸟嘌呤衍生物(化合物1),其结构式如下所示。
本发明实施例制备得到的苄基鸟嘌呤衍生物的结构通过1hnmr、13cnmr和hr-esims进行分析测定。具体图谱见图1、图2和图3。白色固体。1hnmr(400mhz,methanol-d4)δ7.86(s,1h),7.52(d,j=7.2hz,3h),7.42-7.29(m,4h),5.56(s,2h).13cnmr(100mhz,methanol-d4)δ160.32,160.05,153.83,138.65,136.54,128.07,128.01,127.74,118.32,67.58.hr-esims:242.1041[m+h]+(calc.forc12h12n5o,242.1037)。
实施例2
本实施例提供的一种苄基鸟嘌呤衍生物(化合物2),其结构式如下所示。
本发明实施例制备得到的苄基鸟嘌呤衍生物的结构通过1hnmr、13cnmr和hr-esims进行分析测定。具体图谱见图4、图5和图6。白色固体。1hnmr(400mhz,dmso-d6)δ12.49(s,1h),7.86(s,1h),7.74-7.61(m,1h),7.59-7.51(m,1h),7.49-7.35(m,2h),6.34(s,2h),5.57(s,2h).13cnmr(100mhz,dmso-d6)δ162.22,160.11,156.54,138.40,134.67,133.19,130.88,130.42,129.82,127.85,114.46,64.63.hr-esims:267.0650[m+h]+(calc.forc12h11cln5o,267.0647)。
实施例3
本实施例提供的一种苄基鸟嘌呤衍生物(化合物3),其结构式如下所示。
本发明实施例制备得到的苄基鸟嘌呤衍生物的结构通过1hnmr、13cnmr和hr-esims进行分析测定。具体图谱见图7、图8和图9。白色固体。1hnmr(400mhz,dmso-d6)δ12.53(s,1h),7.87(s,1h),7.46(d,j=8.1hz,2h),7.28(d,j=8.1hz,2h),6.34(s,2h),5.45(s,2h),2.47(s,3h).13cnmr(100mhz,dmso-d6)δ161.43,160.10,156.54,138.83,138.53,133.70,129.78,126.25,120.05,66.85,15.13.hr-esims:268.0909[m+h]+(calc.forc13h14n5os,268.0913)。
实施例4
本实施例提供的一种苄基鸟嘌呤衍生物(化合物4),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ12.42(s,1h),10.01(s,1h),7.81(s,1h),7.40(m,4h),6.29(s,2h),5.46(s,2h),4.40(d,j=4.9hz,2h).13cnmr(100mhz,dmso-d6)δ161.43,160.63,160.49,160.38,160.12,159.86,156.54,138.40,137.04,133.91,128.84,127.71,120.05,118.75,116.60,114.46,112.32,66.72,51.10,51.09,51.07.hr-esims:367.1127[m+h]+(calc.forc15h14f3n6o2,367.1125)。
实施例5
本实施例提供的一种苄基鸟嘌呤衍生物(化合物5),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,methanol-d4)δ7.86(s,1h),7.23(s,1h),7.14-6.98(m,2h),5.51(d,j=2.7hz,2h),5.18(d,j=1.4hz,2h),3.88(d,j=2.0hz,3h),3.49(d,j=1.4hz,3h).13cnmr(100mhz,methanol-d4)δ160.35,160.12,155.62,150.12,146.17,138.24,131.37,121.81,117.14,113.97,113.82,95.31,67.29,56.13,56.04.hr-esims:332.1353[m+h]+(calc.forc15h18n5o4,332.1354)。
实施例6
本实施例提供的一种苄基鸟嘌呤衍生物(化合物6),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.41(s,1h),7.85(t,j=1.5hz,1h),7.75(dd,j=7.6,1.5hz,1h),7.70(dd,j=7.6,1.4hz,1h),7.55(dd,j=7.5,1.6hz,1h),7.14(dd,j=7.5,1.6hz,1h),7.06(t,j=1.7hz,1h),5.53(s,2h),4.93(s,1h),1.93(s,2h).13cnmr(100mhz,dmso-d6)δ162.08,160.49,156.54,155.69,138.40,135.06,133.89,130.10,129.19,128.92,126.98,124.64,120.05,116.09,109.84,68.14.hr-esims:308.1144[m+h]+(calc.forc15h18n5o4,308.1142)。
实施例7
本实施例提供的一种苄基鸟嘌呤衍生物(化合物7),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ9.06(d,j=1.6hz,1h),8.43(d,j=10.3hz,2h),8.11(dd,j=7.5,1.5hz,1h),7.80-7.32(m,3h),5.12(s,2h),1.91(s,2h).13cnmr(100mhz,dmso-d6)δ162.08,160.49,156.54,148.66,146.94,138.40,132.03,129.57,129.31,129.18,129.09,128.34,127.08,120.05,67.59.hr-esims:293.1149[m+h]+(calc.forc15h13n6o,293.1146)。
实施例8
本实施例提供的一种苄基鸟嘌呤衍生物(化合物8),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.55-8.46(m,2h),8.42(s,1h),7.72(dt,j=7.9,1.4hz,1h),7.47(dd,j=8.0,4.9hz,1h),5.12(s,2h),1.89(s,2h).13cnmr(100mhz,dmso-d6)δ162.08,160.49,156.54,148.19,147.50,138.40,135.57,134.11,124.47,120.05,67.39.hr-esims:243.0986[m+h]+(calc.forc11h11n6o,243.0989)。
实施例9
本实施例提供的一种苄基鸟嘌呤衍生物(化合物9),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.44(s,1h),6.39(dd,j=6.9,2.1hz,1h),6.11-6.02(m,2h),5.29(s,2h),3.59(s,3h),1.82(s,2h).13cnmr(100mhz,dmso-d6)δ162.22,160.49,156.54,138.40,128.57,123.29,114.46,107.82,107.31,59.61,33.91.hr-esims:245.1148[m+h]+(calc.forc11h13n6o,245.1146)。
实施例10
本实施例提供的一种苄基鸟嘌呤衍生物(化合物10),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.43(s,1h),7.18(d,j=7.5hz,1h),6.77(d,j=7.5hz,1h),5.05(s,2h),3.90(s,3h),1.86(s,2h).13cnmr(100mhz,dmso-d6)δ162.66,162.22,160.49,156.54,152.28,143.88,138.40,117.48,114.46,109.68,60.78,52.21.hr-esims:290.0887[m+h]+(calc.forc12h12n5o4,290.0884)。
实施例11
本实施例提供的一种苄基鸟嘌呤衍生物(化合物11),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.43(s,1h),7.23(dd,j=7.3,1.7hz,1h),7.08(dd,j=7.5,1.7hz,1h),7.01(t,j=7.4hz,1h),5.47(s,2h),1.85(s,2h).13cnmr(100mhz,dmso-d6)δ160.49,159.92,156.54,139.67,138.40,127.93,126.95,120.05,65.42.hr-esims:248.0602[m+h]+(calc.forc10h10n5os,248.0601)。
实施例12
本实施例提供的一种苄基鸟嘌呤衍生物(化合物12),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.42(s,1h),7.79(d,j=2.2hz,1h),7.09(d,j=2.2hz,1h),5.25(s,2h),1.92(s,2h).13cnmr(100mhz,dmso-d6)δ162.22,160.49,156.54,138.40,133.61,133.18,118.99,114.46,60.51.hr-esims:232.0938[m+h]+(calc.forc9h10n7o,232.0942)。
实施例13
本实施例提供的一种苄基鸟嘌呤衍生物(化合物13),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.43(s,1h),7.61(d,j=7.5hz,1h),7.53(s,1h),7.43(d,j=7.5hz,1h),7.28(dd,j=7.5,1.5hz,1h),6.70(dd,j=7.5,1.5hz,1h),5.42(s,2h),1.86(s,2h).13cnmr(100mhz,dmso-d6)δ162.08,160.49,156.54,156.10,145.65,138.40,134.66,125.19,123.44,121.73,120.05,111.16,106.08,68.33.hr-esims:282.0982[m+h]+(calc.forc14h12n5o2,282.0986)。
实施例14
本实施例提供的一种苄基鸟嘌呤衍生物(化合物14),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.43(s,1h),8.23(s,1h),7.67(t,j=1.6hz,1h),7.38(d,j=7.5hz,1h),7.21-7.15(m,2h),6.63(dd,j=7.5,1.6hz,1h),5.42(s,2h),1.92(s,2h).13cnmr(100mhz,dmso-d6)δ162.08,160.49,156.54,138.40,136.56,134.51,127.91,125.31,123.88,120.27,120.05,111.84,102.16,68.33.hr-esims:281.1148[m+h]+(calc.forc14h13n6o,281.1146)。
实施例15
本实施例提供的一种苄基鸟嘌呤衍生物(化合物15),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.43(s,1h),7.50(s,1h),5.20(s,2h),1.83(s,2h).13cnmr(100mhz,dmso-d6)δ164.41,162.22,160.49,156.54,138.40,122.11,119.56,114.46,56.09.hr-esims:267.0395[m+h]+(calc.forc9h8cln6o2,267.0392)。
实施例16
本实施例提供的一种苄基鸟嘌呤衍生物(化合物16),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.43(s,1h),7.86(s,1h),5.20(s,2h),2.81(s,3h),1.86(s,2h).13cnmr(100mhz,dmso-d6)δ168.16,160.49,159.92,156.54,138.98,138.40,138.07,120.05,64.29,19.23.hr-esims:263.0708[m+h]+(calc.forc10h11n6os,263.0710)。
实施例17
本实施例提供的一种苄基鸟嘌呤衍生物(化合物17),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.42(s,1h),7.79(d,j=2.2hz,1h),7.09(d,j=2.2hz,1h),5.25(s,2h),1.92(s,2h).13cnmr(100mhz,dmso-d6)δ162.22,160.49,156.54,138.40,133.61,133.18,118.99,114.46,60.51.hr-esims:232.0949[m+h]+(calc.forc9h10n7o,232.0942)。
实施例18
本实施例提供的一种苄基鸟嘌呤衍生物(化合物18),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.42(s,1h),7.36-7.29(m,2h),7.30-7.20(m,2h),5.12(d,j=0.9hz,2h),3.45(hd,j=6.8,1.0hz,1h),1.91(s,2h),1.36(d,j=6.8hz,6h).13cnmr(100mhz,dmso-d6)δ162.22,160.49,156.54,146.79,138.40,134.08,129.70,127.68,127.48,126.98,114.46,65.23,28.97,23.90.hr-esims:284.1509[m+h]+(calc.forc15h18n5o,284.1506)。
实施例19
本实施例提供的一种苄基鸟嘌呤衍生物(化合物19),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ8.41(s,1h),7.72(dt,j=7.5,2.0hz,1h),7.44(dtt,j=6.1,2.0,1.1hz,1h),7.40-7.33(m,2h),5.42(d,j=1.2hz,2h),1.97(s,2h),1.55(s,2h).13cnmr(100mhz,dmso-d6)δ162.08,160.49,156.54,138.40,138.10,137.14,133.37,130.16,127.87,125.42,120.05,68.33.hr-esims:286.1102[m+h]+(calc.forc12h13bn5o3,286.1106)。
实施例20
本实施例提供的一种苄基鸟嘌呤衍生物(化合物20),其结构式如下所示。
其结构分析结果如下:白色固体。1hnmr(400mhz,dmso-d6)δ7.44-7.33(m,9h),7.35-7.27(m,2h),6.79(dd,j=2.0,1.1hz,2h),6.56(t,j=2.0hz,1h),5.42(d,j=1.3hz,1h),5.05(d,j=1.3hz,4h),1.90(s,2h).13cnmr(100mhz,dmso-d6)δ162.08,160.49,160.09,156.54,140.68,138.40,136.61,128.32,127.97,127.87,120.05,107.09,100.70,69.91,68.47.hr-esims:454.1874[m+h]+(calc.forc26h24n5o3,454.1874)。
实验例1
将实施例1-实施例20制备得到的化合物1-化合物20对靶蛋白pin1进行酶活性抑制试验。其中,以胡桃醌为阳性对照药。
将gst-pin1、α-糜蛋白酶和待测化合物,于hepes中4℃充分混合10分钟,反应前加入suc-aepf-pna,总体积150μl,反应体系配制详情见表1。用紫外分光光度计记录390nm的信号以检测反应进程,持续180秒,每个反应重复3次,取其平均值。其中,添加胡桃醌的测试组为对照组,未添加药物的测试组为空白组。而后根据公式:
抑制率(%)=(对照组平均吸光值-加药组平均吸光值)/(对照组平均吸光值-空白组平均吸光值)x100%
根据抑制率计算得到半抑制浓度即ic50。具体的结果见表2。
表1各原料使用量
表2化合物抑制pin1蛋白活性
从表2所示的结果可知,化合物1-化合物20对pin1蛋白的酶活性具有显著的抑制作用,其中,化合物1~2,4,7,10-13和20的ic50值达到纳摩尔水平。
实验例2
化合物1-化合物20对肝癌细胞的抗增殖进行试验。其中,以胡桃醌为阳性对照药。
实验方法:分别取对数生长期的人肝癌细胞(sk-hep-1),接种于96孔培养板中(密度为2×104个/ml),培养24小时后,分别加入化合物1-化合物20(小分子初始浓度5mmol/l,溶剂dmso,每孔加药2μl,终浓度50μmol/l),以胡桃醌(终浓度50μmol/l)为阳性对照。在5%co2培养箱中于37℃培养72小时后,用mtt方法测定490nm波长处吸收值,从而确定表征小分子药物的抗增殖活性。具体检测结果见表3和图10。
表3化合物抑制肝癌细胞增殖活性
通过表3可知,化合物1-化合物20都能显著抑制肝癌细胞增殖,其中,化合物4,7和12达到纳摩尔水平。通过图10可知,化合物1-化合物20在50μmol/l的浓度下,对sk-hep-1肝癌细胞具有良好的抗增殖作用。
实验例3
将化合物1-化合物20对小鼠肿瘤生长抑制进行试验。
操作方法:将肝癌细胞株(sk-hep-1)接种到免疫缺陷性的裸鼠皮下(每组10只裸鼠),共21组,建立皮下移植瘤模型,设置加药组和对照组,每周两次静脉注射加药,每次注射药品的量为5mg/kg,接种26天后收集肿瘤组织,观察肿瘤生长情况。具体实验结果见图11和图12。
图11为化合物1-20在5mg/kg的剂量下,对小鼠肿瘤生长的影响。结果表明化合物1-20都能显著抑制小鼠肿瘤生长。图12为使用化合物4后解剖后的肿瘤的照片。可知,使用后肿瘤大小明显减小,进一步说明苄基鸟嘌呤衍生物能够抑制肿瘤生长。
实验例4
对化合物4与靶蛋白pin1的相互作用进行实验。
在e.coli中表达纯化人源pin1蛋白,以纯化的pin1蛋白和化合物4为实验材料,运用热转移(tsa)技术,表征蛋白质-小分子相互作用,试验结果如图13所示。
热转移实验方法:将pin1蛋白用pbs缓冲液稀释(蛋白终浓度25μg/ml),制成两份,每份297μl,一份用化合物4处理(加药组,化合物初始浓度5mmol/l,溶剂dmso,加药3μl,终浓度50μmol/l),另一份用dmso(对照组,3μl)处理。室温下孵育20分钟之后,加药组和对照组再在分别制成6小份,每小份40μl。加药组和对照组各取一小份在不同温度下(50、52、54、56、58和60摄氏度)分别加热3分钟,再冷却3分钟,于4摄氏度离心(20000xg)20分钟,上清液转移至新的微管中,用sds-page电泳,再用考马斯亮蓝染色读出结果。
图13试验结果表明,化合物4处理pin1蛋白后,pin1蛋白的热稳定性较对照组显著增强,表明化合物4可与靶蛋白pin1发生直接的相互作用。
实验例5
对化合物4调控成熟microrna生物合成进行实验。
操作方法:将人肝癌sk-hep-1细胞(密度为2×105个/ml)接种于6孔板中,24小时后加入化合物4(化合物初始浓度50mmol/l,溶剂dmso,加药1μl,终浓度25μmol/l),设置对照组(dmso,1μl)。72小时后用trizol提取细胞的总rna,利用qpcr,表征化合物-4对成熟mirna生物合成的影响,试验结果如图14所示。
图14试验结果显示,化合物4可以显著促进成熟抑癌microrna(mir-122和mir-29b)的生物合成,表明化合物4是通过调控成熟microrna生物合成的方式发挥抗肝癌作用。
实验例6
对化合物4对肝癌细胞内xpo5核质分布进行实验。
通过共聚焦显微镜,表征了转运蛋白xpo5在细胞核及细胞质中的分布情况,实验结果如图15所示。具体操作方法:于12孔板中用lipofectamine2000对sk-hep-1细胞转染erk2-mek1-la质粒活化xpo5,设置加药组(化合物初始浓度50mmol/l,溶剂dmso,加药0.5μl,终浓度25μmol/l)和对照组(dmso,0.5μl),用dapi和anti-xpo5抗体进行细胞核和xpo5蛋白的染色,共聚焦显微镜观察xpo5在细胞核与细胞质中的分布情况。
根据图15可知,肝癌细胞内xpo5集中分布于细胞核中,而用化合物-4处理肝癌细胞后,xpo5在细胞质的含量明显增多,证明化合物-4能恢复肝癌细胞内xpo5蛋白的核质穿梭。
综上,本发明实施例1-20提供的一系列新的苄基鸟嘌呤衍生物易于制备、成药性好,可抑制pin1蛋白的酶催化活性,能在细胞和动物水平上促进成熟microrna生物合成,抑制肝癌增殖。其可作为pin1靶向抑制剂,进而可作为肝癌治疗药物。而其药学上可接受的盐类化合物以及其形成的组合物也可作为pin1靶向抑制剂,进而可作为癌症治疗药物。提供了一种新型的pin1靶向抑制剂,为肝癌的临床治疗提供新的策略。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!