一种检测HIV相关基因的SPR传感器及其制备与应用的制作方法
本发明涉及核酸检测及表面等离子共振传感领域,特别是涉及一种检测hiv(人类免疫缺陷病毒)相关基因的spr(表面等离子共振)传感器及其制备与应用。
背景技术:
自1985年中国大陆发现第1例hiv感染者至今,艾滋病(aids)在全球的流行日益严重,形势严峻。据联合国艾滋病规划署数据,2015年全球共110万人死于aids,该年新增艾滋病毒感染病例210万。aids的流行给人类健康和社会经济带来了极大的损害。人类免疫缺陷病毒(hiv)检测的主要目的是诊断hiv病原体、指导临床用药以及检出hiv携带者,早期的发现及干预有助于控制病情并及时阻断传播途径。目前我国hiv感染的诊断大多是依赖血清学检测,多采用酶联免疫吸附试验(elisa)联合免疫印迹法(wb)检测hiv抗体。虽然血清学检测特异性好,适合于临床及血液筛查等大样本量的检测,但其需要相应的仪器设备及接受过特殊培训的技术人员。且由于技术原因,不能完全排除相互干扰的可能性,其灵敏度较差。另外,血清学检测本身存在弊端:在“窗口期”病毒侵入但抗体还没有产生,免疫学方法不能检出,即使第四代elisa检测,仍有2-3周的窗口期,不能满足早期诊断的需求。
因而,需要更早期的标志物用于hiv感染的诊断。在抗体产生之前,感染者体内最早可被检测到的是病毒核酸,且呈一过性高水平,此后有所下降。核酸检测不依赖抗体的产生,可明显缩短窗口期。核酸检测具有以下特点:①能够用于常规不能培养和分离的病毒的检测(如hbv、hcv、hiv等);②样品用量少,并可检测低丰度含量样品;③不依赖抗体的产生,在病毒感染的急性期抗体尚未出现之前即可检测,适用于早期诊断;④可对病毒基因进行基因分型,比血清分型更有价值;⑤通过对病毒耐药基因的检测,可预测或发现病毒的耐药性;⑥可用于先天性或围产期获得性病毒感染的诊断;⑦灵敏度高(可达ng甚至fg水平,理论上能检出单个病毒基因),特异性好,快速、简捷。
目前,核酸检测主要是通过荧光定量pcr法,它是通过荧光染料或荧光标记的特异性的探针,对pcr产物进行标记跟踪,在线监控反应过程,从而实现待检核酸的实时定量检测。将其运用于hiv病毒核酸检测可以很好地解决“窗口期”漏诊问题,只要病毒侵入就可以检出,且特异性强、自动化程度高。但是该方法仍存在过程繁琐,检测时间长等不足之处。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种检测hiv相关基因的spr传感器及其制备与应用,用于解决现有技术中对hiv的检测特异性差、过程繁琐、检测时间长等问题。
为实现上述目的及其他相关目的,本发明本发明第一方面提供一种检测hiv相关基因的spr传感器的制备方法,包括制备熵驱动的链置换循环放大体系,具体包括如下步骤:
(a)探针准备:将dna单链p、r、q溶解,混合,变性,制得三链复合产物prq,备用;
(b)取步骤(a)所得三链复合产物prq,将杂交液、三链复合产物prq与单链f、靶序列t混合,得混合液,孵育,反应,得反应产物;
(c)将步骤(b)所得的反应产物进样至固定有捕获探针的工作芯片表面,制得所述熵驱动的链置换循环放大体系。
进一步地,步骤(a)中,所述单链p含有的核苷酸序列为:
5'-ttttttttttttttttccctactgctagagatttt-3'(seqidno.2)。
进一步地,步骤(a)中,所述单链r的核苷酸序列为:
5'-cctacgtctccaactaacttacgg-3'(seqidno.3)。
进一步地,步骤(a)中,所述单链q上至少有3个碱基与捕获探针互补配对。
进一步地,步骤(a)中,所述单链q上至少有4个碱基与捕获探针互补配对。
进一步地,步骤(a)中,所述单链q上有4-8个碱基与捕获探针互补配对。
进一步地,步骤(a)中,所述单链q上有6个碱基与捕获探针互补配对。
进一步地,步骤(a)中,所述单链q上有6个碱基与捕获探针互补配对时,所述单链q的核苷酸序列为q6:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。
进一步地,步骤(a)中,所述单链q上有4个碱基与捕获探针互补配对时,所述单链q的核苷酸序列为q4:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggat-3'(seqidno.5)。
进一步地,步骤(a)中,所述单链q上有5个碱基与捕获探针互补配对时,所述单链q的核苷酸序列为q5:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatc-3'(seqidno.6)。
进一步地,步骤(a)中,所述单链q上有7个碱基与捕获探针互补配对时,所述单链q的核苷酸序列为q7:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcct-3'(seqidno.7)。
进一步地,步骤(a)中,所述单链q上有8个碱基与捕获探针互补配对时,所述单链q的核苷酸序列为q8:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatccta-3'(seqidno.8)。
进一步地,步骤(a)中,混合液中单链p、r、q的摩尔比为1.2:1.2:1。
进一步地,步骤(a)中,先将dna单链p、r、q分别溶解于tebuffer中,再进行混合。
进一步地,步骤(a)中,tebuffer包含10mmtrishcl、1mmedta,ph8.0。
进一步地,步骤(b)中,所述单链f的核苷酸序列为:
5'-aactgactcctacgtctccaactaacttacggccctactgctagagattttatcagagtggcttc-3'(seqidno.9)。
进一步地,步骤(b)中,所述靶序列t含有如下核苷酸序列:
5'-actgctagagattttccacat-3'(seqidno.10)。
进一步地,步骤(b)中,混合液中靶序列t的浓度≥50fm。
进一步地,步骤(b)中,混合液中靶序列t的浓度≥1.5pm。
进一步地,步骤(b)中,孵育时间≥15min;
进一步地,步骤(b)中,孵育时间为15-75min;
进一步地,步骤(b)中,孵育温度≥4℃;
进一步地,步骤(b)中,孵育温度为4-48℃;
进一步地,步骤(b)中,先将dna单链f、靶序列t分别溶解于tebuffer,再将杂交液与分别含有三链复合产物prq、单链f、靶序列t的tebuffer混合,得到熵驱动的链置换循环放大体系。
进一步地,步骤(b)中,tebuffer包含10mmtrishcl、1mmedta,ph8.0。
进一步地,步骤(b)中,所述杂交液包括10mmtris、480mmnacl、5mmmgcl2,ph为7.0。
进一步地,步骤(b)中,混合液中三链复合物prq的终浓度为10nm。
进一步地,步骤(b)中,混合液中单链f的终浓度为10nm。
进一步地,步骤(b)中,靶序列t的加入体积为混合液总体积的2.5%。
进一步地,步骤(c)中,所述工作芯片上固定的捕获探针序列如seqidno.1所示。
需要说明的是,捕获探针的序列并不限于seqidno.1所示的序列,可以根据不同的靶序列t而进行适应性设计。
进一步地,步骤(c)中,所述捕获探针为双巯基修饰的捕获探针,其序列如下:
5'-hs-(ch2)6-ggctgttttttaggatccgagtcagttttttttcagcc-(ch2)6-sh-3'。
双巯基修饰可使芯片具有更好的抗干扰性,与传统探针制备方法相比,不需要后续mch封闭过程。
进一步地,步骤(c)中,将捕获探针与固定液混合,将混合液进样至工作芯片表面,制得固定有捕获探针的工作芯片,捕获探针在混合液中的摩尔浓度为500nm~2000nm。
进一步地,步骤(c)中,固定捕获探针时,固定液选自kh2po4水溶液。
进一步地,步骤(c)中,进样体积≥10μl。
进一步地,步骤(c)中,进样体积为10-50μl,包括边界值。
进一步地,步骤(c)中,将工作芯片置入表面等离子共振仪中,以含450mmnacl、30mmna3po4·12h2o、3mmedta-2na、0.25%tritonx-100的缓冲液为运行液。
进一步地,步骤(c)中,在工作芯片上固定捕获探针的方法包括:
(1)表面处理:对工作芯片进行表面处理,使其表面光洁;
(2)固定捕获探针:将工作芯片置于表面等离子共振仪内,将捕获探针溶解于固定液之后,进样捕获探针,使得捕获探针固定在工作芯片的表面,得到固定有捕获探针的工作芯片。
进一步地,步骤(2)中,捕获探针的摩尔浓度为500nm~2000nm。
进一步地,步骤(2)中,捕获探针的摩尔浓度为1000nm。
上述捕获探针的摩尔浓度是指捕获探针溶解于固定液之后,捕获探针在混合液中的终浓度。
进一步地,步骤(2)中,固定液选自kh2po4水溶液。
进一步地,步骤(2)中,固定液为ph=3.8、摩尔浓度为1m的kh2po4水溶液。
进一步地,还包括制备dna四面体纳米分子的方法,包括至少制备一层dna四面体,并将杂交液、dna四面体混合反应,将得到的反应液进样至固定有捕获探针的工作芯片表面,得到dna四面体纳米分子放大检测体系。
进一步地,所述杂交液包括20mmtris、50mmmgcl2。
进一步地,第一层dna四面体纳米分子(t0)的制备方法具体包括:将dna单链a0、b0、c0、d0混合,变性,得到第一层dna四面体纳米分子(t0)。
优选地,所述单链a0的核苷酸序列为:
5'-gaagccactctgatacattcctaagtctgaaacattacagcttgctacacgagaagagccgccatagta-3'(seqidno.11)。
优选地,所述单链b0的核苷酸序列为:
5'-ctgtcatcggtcactatcaccaggcagttgacagtgtagcaagctgtaatagatgcgagggtccaatac-3'(seqidno.12)。
优选地,所述单链c0的核苷酸序列为:
5'-ctgtcatcggtcactcaactgcctggtgataaaacgacactacgtgggaatctactatggcggctcttc-3'(seqidno.13)。
优选地,所述单链d0的核苷酸序列为:
5'-ctgtcatcggtcacttcagacttaggaatgtgcttcccacgtagtgtcgtttgtattggaccctcgcat-3'(seqidno.14)。
进一步地,所述单链dnaa0、b0、c0、d0等摩尔混合。
进一步地,先将dna单链a0、b0、c0、d0分别溶解于tebuffer,再将四种单链的tebuffer溶液混合,进行后续的变性处理。
进一步地,还包括第二层dna四面体纳米分子(t1)的制备,具体包括:将单链dnaa1、b1、c1、d1等摩尔浓度混合,变性,快速降温;再将第一层dna四面体纳米分子(t0)与第二层dna四面体纳米分子(t1)混合,孵育得到含有双层dna四面体纳米分子的混合液,将该混合液加到工作芯片表面,得到双层dna四面体纳米分子放大检测体系。
进一步地,所述单链a1的核苷酸序列为:
5'-gtgaccgatgacagacattcctaagtctgaaacattacagcttgctacacgagaagagccgccatagta-3'(seqidno.15)。
进一步地,四个单链包括单链b1,所述单链b1的核苷酸序列为:
5'-tatcaccaggcagttgacagtgtagcaagctgtaatagatgcgagggtccaatac-3'(seqidno.16)。
进一步地,四个单链包括单链c1,所述单链c1的核苷酸序列为:
5'-tcaactgcctggtgataaaacgacactacgtgggaatctactatggcggctcttc-3'(seqidno.17)。
进一步地,四个单链包括单链d1,所述单链d1的核苷酸序列为:
5'-ttcagacttaggaatgtgcttcccacgtagtgtcgtttgtattggaccctcgcat-3'(seqidno.18)。
进一步地,所述单链dnaa1、b1、c1、d1等摩尔混合。
进一步地,先将单链dnaa1、b1、c1、d1分别溶解于tebuffer,再将四种单链的tebuffer溶液混合,进行后续的变性处理。
进一步地,第一层dna四面体纳米分子(t0)与第二层dna四面体纳米分子(t1)以1:3的摩尔比混合。
进一步地,所述混合液中双层dna四面体纳米分子的浓度为1μm;
进一步地,所述混合液的进样体积≥10μl;
进一步地,所述混合液的进样体积为10-50μl,包括边界值。
进一步地,进样流速为2μl·min-1。
本发明第二方面提供上述方法制得的spr传感器。
本发明第三方面提供上述spr传感器在检测hiv相关基因中的用途。
如上所述,本发明的一种检测hiv相关基因的spr传感器及其制备与应用,具有以下有益效果:本发明成功构建了可用于hiv相关基因的表面等离子共振传感器及检测体系,应用本发明的传感器,对hiv相关基因的测定显示了灵敏度高、稳定、重现性好的能力。与现有技术比较,本发明的传感器无酶、可实时监测,并且成本低,操作简单方便,检测周期短,灵敏度高,特异性好,有望成为具有实际应用价值的传感器。
附图说明
图1为本发明的典型spr流程传感图,分别为进样熵驱动的链置换循环放大体系、进样双层dna四面体纳米分子和再生液(naoh)。
图2为空白、不加prq复合物、不加f链、不加dna四面体纳米分子、仅加单层dna四面体纳米分子和加双层dna四面体纳米分子的spr传感信号对比图。
图3为单层dna四面体t0,t1能够形成双层dna四面体纳米分子的电泳验证图。
图4为不同碱基数目结合位点的q链所构建的表面等离子共振hiv相关基因传感器响应信号结果图。
图5为不同反应时间下熵驱动的链置换循环放大体系所构建的表面等离子共振hiv相关基因传感器响应信号结果图。
图6为不同反应温度下熵驱动的链置换循环放大体系所构建的表面等离子共振hiv相关基因传感器响应信号结果图。
图7为不同进样量的双层dna四面体纳米分子所构建的表面等离子共振hiv相关基因传感器响应信号结果图。
图8-a为本发明实施例的检测6个不同浓度(150nm,15nm,1.5nm,150pm,15pm,1.5pm)hiv相关基因标准品溶液所得spr响应信号图。
图8-b为本发明实施例的四参数拟合校准s曲线图。
图9为本发明实施例制备的表面等离子共振hiv相关基因检测传感器的特异性分析结果图。
图10为本发明的原理图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
须知,下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置;所有压力值和范围都是指绝对压力。
此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
实施例1制备表面等离子共振hiv相关基因检测传感器
1.材料与方法
1.1材料
hplc纯化的dna序列由上海生工生物工程有限公司合成。tebuffer(10mmtrishcl,1mmedta,ph8.0)购自上海生工生物工程有限公司,dnamarker购自大连takara公司,kh2po4、nacl、mgcl2、na3po4·12h2o、edta-2na等其他试剂均购自重庆茂业化学试剂有限公司。
1.2检测仪器
biocorex型表面等离子共振仪为瑞典biocoreab公司产品。
1.3检测原理
如图10所示,在均相反应体系中,靶序列t通过位于q链的立足点触发熵驱动的链置换循环放大反应,游离出三链复合物prq中的p单链,形成trq三链复合物,同时暴露出位于q链中间的新的立足点。当f链存在时,与新的立足点结合,生成双链产物f-q,同时释放出r单链及靶序列t,靶序列t可进入下一轮循环反应,进行信号放大。所述双链产物f-q中,f链和q链上分别存在一段单链dna片段,可与芯片表面固定的茎环型捕获探针(captureprobe)通过碱基互补配对结合。将上述均相反应体系进样至表面等离子共振仪中后,f-q与捕获探针(captureprobe)特异性结合,同时暴露出位于f链上的双层dna四面体纳米分子的结合位点。将预先制备好的双层dna四面体纳米分子进样至表面等离子共振仪中后,其可与f链特异性结合,从而产生明显放大的spr信号响应。根据标准hiv相关基因反应产生的spr响应信号绘制校准曲线并得到实测样品中hiv相关基因的水平。
2.工作芯片的制备
(1)裸金芯片表面处理:以金膜厚度为50nm的裸金芯片作为工作芯片,将裸金芯片表面用食人鱼溶液(95%~98%浓硫酸与30%h2o2水溶液的体积比为3:1)处理3次,每次3min,去离子水冲洗干净后室温晾干。
(2)固定捕获探针:将工作芯片置于表面等离子共振仪内,进样捕获探针,捕获探针通过通道流过工作芯片表面,通过金-硫键固定于芯片表面,即得含有捕获探针的工作芯片。在使用之前,于4℃低温保存,该工作芯片可重复多次使用。
工作芯片上捕获探针的摩尔浓度可以为500nm~2000nm,本实施例为1000nm。将捕获探针与固定液混合后,再进样,固定液为ph3.8、摩尔浓度为1m的kh2po4水溶液。
捕获探针的摩尔浓度是指:捕获探针与固定液混合后,捕获探针在混合液中的终浓度。
3.表面等离子共振hiv相关基因检测传感器的使用
(1)将工作芯片置入表面等离子共振仪中,以含450mmnacl、30mmna3po4·12h2o、3mmedta-2na、0.25%tritonx-100,ph=7.4的缓冲液为运行液,设置流速为5μl/min,待基线稳定。
(2)将dna单链p、r、q分别溶解于tebuffer,以单链p、r、q的摩尔比为1.2:1.2:1进行混合,变性,恢复至室温待用;将dna单链f、t分别溶解于tebuffer待用。本步骤的tebuffer包含10mmtris-hcl、1mmedta,ph8.0。
以含10mmtris、480mmnacl、5mmmgcl2,ph=7.0的缓冲液为杂交液,构建熵驱动的链置换循环放大体系,混合液的组成如下:
将所述熵驱动的链置换循环放大体系在37℃下反应30min后,进样至表面等离子共振仪内(通过进样通道进样至工作芯片表面),进样量为30μl,流速为2μl/min。
本实验采用的靶序列t为人工合成,具体序列为5'-actgctagagattttccacat-3'(seqidno.10)。
(3)将dna单链a0、b0、c0、d0分别溶解于tebuffer,得到四份溶液,各溶液中单链的摩尔浓度相等,将前述四份单链溶液等体积混合,使得四种单链等摩尔混合,混合后,变性,快速降温(在1min内使溶液从95℃降温至4℃),制得第一层dna四面体纳米分子(t0);将dna单链a1、b1、c1、d1分别溶解于tebuffer,以同样的方式使四种单链等摩尔混合,变性,快速降温(在1min内使溶液从95℃降温至4℃),制得第二层dna四面体纳米分子(t1);将制备好的第一层dna四面体纳米分子(t0)、第二层dna四面体纳米分子(t1)以1:3的摩尔比混合,加入杂交液,37℃下反应60min,制得双层dna四面体纳米分子,备用。本步骤的杂交液包含20mmtris、50mmmgcl2,ph8.0。单链a0的序列如seqidno.11所示,单链b0的序列如seqidno.12所示,单链c0的序列如seqidno.13所示,单链d0的序列如seqidno.14所示,单链a1的序列如seqidno.15所示,单链b1的序列如seqidno.16所示,单链c1的序列如seqidno.17所示,单链d1的序列如seqidno.18所示。
(4)将制备好的双层dna四面体纳米分子进样至表面等离子共振仪内(通过进样通道进样至工作芯片表面),进样量为30μl,流速为2μl/min。
(5)用50mm的naoh水溶液作为再生液,进样5μl,流速为2μl/min。
(6)以两次进样的spr响应信号总和作为对应样品的响应信号。
(7)工作芯片可重复多次使用,因而可重复操作(1)~(5)进行多个样品检测。
实施例2验证表面等离子共振hiv相关基因检测传感器的可行性
1.先后加入熵驱动的链置换循环放大体系、双层dna四面体纳米分子和再生液naoh的表征。
捕获探针的进样量为100μl,摩尔浓度为1μm。
q/c碱基互补配对个数为6,q链序列为q6:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。杂交液、三链复合物prq、单链f、靶序列t混合得到混合液后,混合液中三链复合物prq、单链f的浓度均为250nm,靶序列t的浓度为100nm,熵驱动的链置换循环放大反应温度为37℃,反应时间为30min,进样量为30μl。双层dna四面体纳米分子的浓度为1μm,进样量为30μl。再生液naoh水溶液的浓度为50mm,进样量为5μl。流速均为2μl·min-1。其他操作与实施例1相同。
如图1所示为每一步(包括加入熵驱动的链置换循环放大体系、加入双层dna四面体纳米分子、加入再生液naoh)的spr响应信号:
△ru1为熵驱动的链置换循环放大体系的spr响应信号水平。
△ru2为双层dna四面体纳米分子的spr响应信号水平。
并可见再生液naoh能够把结合上的物质完全再生下来。
2.两步放大检测体系可行性分析。
捕获探针的进样量为100μl,浓度为1μm。
q/c碱基互补配对个数为6,q链序列为q6:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。混合液中复合物prq、单链f的浓度为250nm,靶序列t的浓度为100nm。熵驱动的链置换循环放大反应温度为37℃,反应时间为30min,进样量为30μl。单层dna四面体纳米分子的浓度为1μm,进样量为30μl。双层dna四面体纳米分子的浓度为1μm,进样量为30μl。再生液naoh水溶液的浓度为50mm,进样量为5μl。流速均为2μl·min-1。其他操作与实施例1相同。
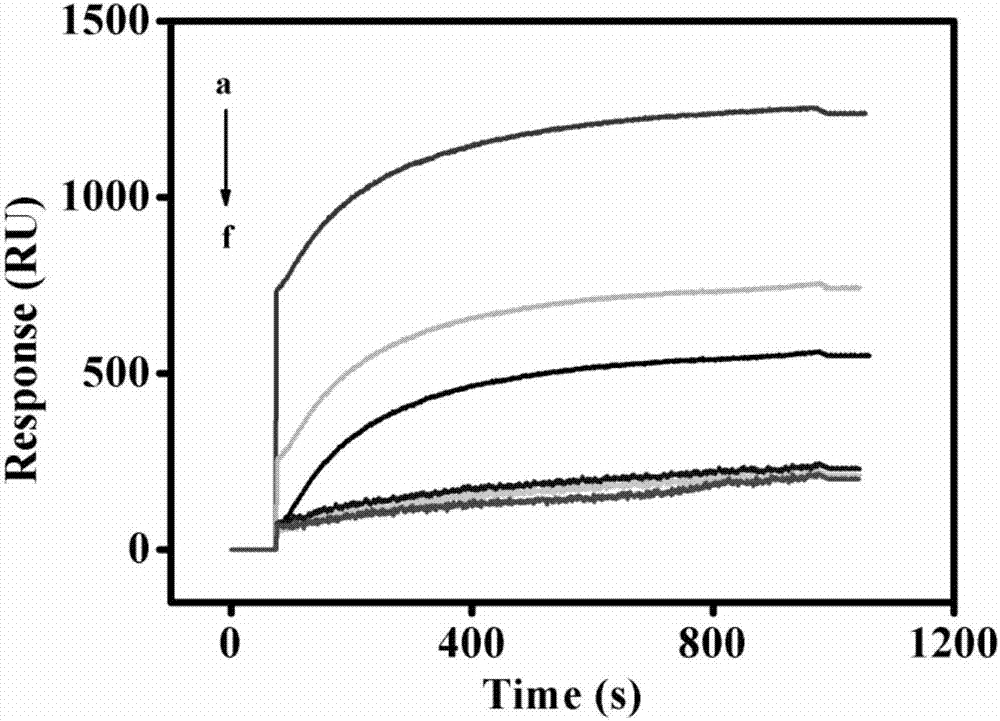
如图2所示,从上向下依次为a-f曲线:
a为加双层dna四面体纳米分子时获得的spr响应信号;
b为仅加单层dna四面体纳米分子t0时获得的spr响应信号;
c为不加dna四面体纳米分子时获得的spr响应信号;
d为不加f链时获得的spr响应信号;
e为不加prq复合物时获得的spr响应信号;
f为空白组(加有除靶序列t以外的两步放大体系)的spr响应信号;
实验结果表明两步放大检测体系是可行的。
3.对双层dna四面体纳米分子的验证
对实施例1中所得的dna四面体纳米分子用page电泳进行验证。
如图3:
条带1为500bp的marker;
条带2为1μm单链a0;
条带3为1μm单链a0+b0;
条带4为1μm单链c0+d0;
条带5为1μm单链a0+b0+c0;
条带6为1μm单链b0+c0+d0;
条带7为1μmt0;
条带8为1μmt0+t1;
条带9为1000bp的marker。
电泳结果说明双层dna四面体纳米分子组装成功。
图3中,条带2-7中样品为相应浓度的各个序列,混合,变性,快速降温(从95℃于1min内降温至4℃)制得,条带8中样品为t0与t1以1:3的摩尔比混合,37℃下孵育1h制得。
实施例3表面等离子共振hiv相关基因检测传感器及其使用条件影响实验
我们还对本发明中几个重要的条件(即q/c碱基互补配对个数、熵驱动的链置换循环放大反应时间、反应温度、双层dna四面体纳米分子进样量这四个测定条件)对检测结果的影响进行了进一步的实验。对每一个条件都由低浓度到高浓度分别选取五个点进行一系列实验。
1.为考察q/c碱基互补配对个数对表面等离子共振hiv相关基因检测传感器的影响,本实验采用了不同的碱基配对个数构建表面等离子共振传感器。如图4可见,信噪比随着碱基配对个数的不同而不同,当q/c碱基配对个数为6时,信噪比为最大值,说明这个碱基配对个数为最佳。
图4中,捕获探针的进样量为100μl,浓度为1μm。混合液中复合物prq、单链f的浓度均为250nm,靶序列t的浓度为100nm。熵驱动的链置换循环放大反应温度为37℃,反应时间为60min,进样量为30μl。双层dna四面体纳米分子的浓度为1μm,进样量为60μl。再生液naoh水溶液的浓度为50mm,进样量为5μl。流速均为2μl·min-1。其他操作与实施例1相同。
当q/c碱基配对个数为6时,q链的核苷酸序列为:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。
当q/c碱基配对个数为4时,q链的核苷酸序列为:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggat-3'(seqidno.5)。
当q/c碱基配对个数为5时,q链的核苷酸序列为:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatc-3'(seqidno.6)。
当q/c碱基配对个数为7时,q链的核苷酸序列为:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcct-3'(seqidno.7)。
当q/c碱基配对个数为8时,q链的核苷酸序列为:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatccta-3'(seqidno.8)。
空白对照组是指加有除靶序列t以外的两步放大体系的spr响应信号值。
当q/c碱基配对个数为3时,也能得到较好的检测结果,此处不再赘述。
2.为考察熵驱动的链置换循环放大反应时间对表面等离子共振hiv相关基因检测传感器的影响,本实验采用了含不同反应时间(15,30,45,60,75min)的反应体系,然后进行表面等离子共振检测,如图5可见,聚合延伸体系的最佳反应时间为30min。
图5中,捕获探针的进样量为100μl,浓度为1μm。
q/c碱基互补配对个数为6,q链序列为q6:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。
混合液中复合物prq、单链f的浓度均为250nm,靶序列t的浓度为100nm。熵驱动的链置换循环放大反应温度为37℃,进样量为30μl。双层dna四面体纳米分子的浓度为1μm,进样量为60μl。再生液naoh的浓度为50mm,进样量为5μl。流速均为2μl·min-1。其他操作与实施例1相同。
空白对照组是指加有除靶序列t以外的两步放大体系的spr响应信号值。
3.同理,为考察熵驱动的链置换循环放大反应温度对表面等离子共振hiv相关基因检测传感器的影响,本实验采用了不同的反应温度(4℃,25℃,37℃,42℃,48℃),然后进行表面等离子共振检测。如图6可见,信噪比最佳的杂交温度为37℃。
图6中,捕获探针的进样量为100μl,浓度为1μm。q/c碱基互补配对个数为6,q链序列为q6:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。混合液中复合物prq、单链f的浓度均为250nm,靶序列t的浓度为100nm。熵驱动的链置换循环放大反应时间为30min,进样量为30μl。双层dna四面体纳米分子的浓度为1μm,进样量为60μl。再生液naoh的浓度为50mm,进样量为5μl。流速均为2μl·min-1。其他操作与实施例1相同。
空白对照组是指加有除靶序列t以外的两步放大体系的spr响应信号值。
4.同理,为考察双层dna四面体纳米分子进样量对表面等离子共振hiv相关基因检测传感器的影响,本实验采用了不同的进样体积(10,20,30,40,50μl),然后进行表面等离子共振检测。如图7可见,信噪比最佳的进样体积为30μl。
图7中,捕获探针的进样量为100μl,浓度为1μm。q/c碱基互补配对个数为6,q链序列为q6:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。混合液中复合物prq、单链f的浓度均为250nm,靶序列t的浓度为100nm。熵驱动的链置换循环放大反应温度为37℃,反应时间为30min,进样量为30μl。双层dna四面体纳米分子的浓度为1μm。再生液naoh的浓度为50mm,进样量为5μl。流速均为2μl·min-1。其他操作与实施例1相同。
空白对照组数据是指加有除靶序列t以外的两步放大体系的spr响应信号值。
图4-图7中,信噪比是指实验组与对照组在同一横坐标条件下的spr响应信号值之比。
实施例4制备的表面等离子共振hiv相关基因检测传感器的性能分析
为了评估表面等离子共振hiv相关基因检测传感器的性能,在最优实验条件下,对以杂交液(ph7.0)配制的不同浓度的hiv相关基因标准品进行分析。
捕获探针的进样量为100μl,浓度为1μm。q/c碱基互补配对个数为6,q链序列为q6:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。混合液中复合物prq、单链f的浓度均为250nm,靶序列t的浓度a-g依次为150nm、15nm、1.5nm、150pm、15pm、1.5pm、0。熵驱动的链置换循环放大反应温度为37℃,反应时间为30min,进样量为30μl。双层dna四面体纳米分子的浓度为1μm,进样量为30μl。再生液naoh的浓度为50mm,进样量为5μl。流速均为2μl·min-1。其他操作与实施例1相同。
具体的,用杂交液(ph7.0)稀释hiv相关基因到6个不同浓度(150nm,15nm,1.5nm,150pm,15pm,1.5pm),进样30μl,用四参数(四参数包括q/c碱基配对个数、熵驱动的链置换循环放大反应时间、熵驱动的链置换循环放大反应温度、双层dna四面体纳米分子进样量)拟合绘制校准s形曲线,校准曲线检测范围为1pm-150nm,回归方程为y(δru)=152.55×lgc(nm)+863.36,相关系数为0.9906。将未添加hiv相关基因的杂交液作为空白对照,并重复检测3次,计算平均值和标准差,根据空白信号平均值加上3倍标准差所对应的值估计最低检出限,计算得50fm,检测结果如图8-a所示,标准曲线如图8-b所示。
实施例5制备的表面等离子共振hiv相关基因检测传感器的特异性分析
表面等离子共振hiv相关基因检测传感器的特异性,在分析不分离的生物样本中的基因序列时具有重要的作用,主要取决于识别体系的特异性。为了评价本表面等离子共振hiv相关基因检测传感器的特异性,我们对与hiv相关基因相比的单碱基突变、双碱基突变、完全不互补序列分别采用实施例4所构建的表面等离子共振hiv相关基因检测传感器进行测定。序列分别为:
单碱基错配:5'-actgctagagattttccactt-3'(seqidno.19)。
双碱基错配:5'-actgctagagattttacactt-3'(seqidno.20)。
完全不互补:5'-tagcttatcagactgatgttga-3'(seqidno.21)。
捕获探针的进样量为100μl,浓度为1μm。q/c碱基互补配对个数为6,q链序列为q6:
5'-atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc-3'(seqidno.4)。混合液中复合物prq、单链f的浓度均为250nm,各错配序列的浓度为100nm。熵驱动的链置换循环放大反应温度为37℃,反应时间为30min,进样量为30μl。双层dna四面体纳米分子的浓度为1μm,进样量为30μl。再生液naoh的浓度为50mm,进样量为5μl。流速均为2μl·min-1。
结果如图9所示,相比同浓度的hiv相关基因,单碱基和双碱基突变序列的spr响应信号都有明显降低,完全不互补序列接近空白所对应的spr响应信号。这些结果说明制备的表面等离子共振hiv相关基因检测传感器具有良好的特异性。
图9中,target、sm、dm、nc、blank依次表示实施例1中的靶序列t、本实施例中的单碱基错配序列、双碱基错配序列、完全不互补序列以及空白对照组(空白对照组是指加有除靶序列t以外的两步放大体系)的spr响应信号值。
实施例6制备的表面等离子共振hiv相关基因检测传感器的稳定性和重现性分析
工作芯片固定一次捕获探针,采用实施例4所构建的表面等离子共振hiv相关基因检测传感器进行测定,以100nm靶序列t为样品,检测样品30次,spr响应信号降低﹤10%,表明工作芯片重复多次使用也能保持良好的性能。用工作芯片在最优实验条件下(即采用实施例4所构建的spr传感器)对1nm靶序列t进行检测,重复进行三次平行实验,变异系数为6.5%,表明本发明制备的表面等离子共振hiv相关基因检测传感器具有良好的稳定性和重现性。
综上所述,本发明具有如下有益效果:(1)本发明研制了一种基于熵驱动的链置换循环放大体系和双层dna四面体纳米分子双重信号放大的表面等离子共振传感器,可以用于灵敏、快速、特异地检测hiv相关基因。首先设计双巯基标记的茎环型捕获探针,该探针可与熵驱动的链置换循环放大体系输出的双链dna产物结合。通过设计,双链dna产物的另一端可与双层dna四面体纳米分子结合。若样品中不存在hiv相关基因时,不能触发熵驱动的链置换循环放大反应,不能输出双链dna产物,进而不能与捕获探针结合;当样品中存在hiv相关基因时,熵驱动的链置换循环放大反应被触发,输出双链dna产物,并游离出靶序列t进行第一次信号放大。结合到芯片表面的双链dna产物可进一步结合双层dna四面体纳米分子,形成第二次信号放大。表面等离子共振传感器对hiv相关基因进行检测,校准曲线做四参数拟合,回归方程为y(δru)=152.55×lgc(nm)+863.36,检测范围为1pm-150nm,相关系数为0.9906,最低检测限为50fm。当然,根据实验结果,仅基于熵驱动的链置换循环放大体系也能对hiv相关基因进行检测,在此基础上,再加入单层或双层dna四面体纳米分子放大体系,能够取得更好的检测效果。
(2)特异性好:本发明首先制得双巯基标记的茎环型捕获探针,该探针与双链dna复合物f-q互补结合,f-q上的结合位点在f链和q链上各有一段,该设计大大提高了识别的特异性。靶序列通过立足点触发熵驱动的链置换反应,整个过程严格遵守碱基互补配对原则,特异性好。双链dna复合物f-q通过单链dna末端结合dna四面体纳米分子,整个过程严格遵守碱基互补配对原则,降低了大分子颗粒吸附作用对结果的影响,大大提高了对靶序列检测的特异性。
(3)检测速度快:本发明利用熵驱动的链置换反应和预先制备好的双层dna四面体纳米分子进行hiv相关基因的表面等离子共振检测,整个过程仅需1h,相比其他方法大大缩短了检测时间,检测速度快。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
sequencelisting
<110>重庆医科大学
<120>一种检测hiv相关基因的spr传感器及其制备与应用
<130>pcqyk172364
<160>21
<170>patentinversion3.5
<210>1
<211>38
<212>dna
<213>artificial
<220>
<223>捕获探针
<400>1
ggctgttttttaggatccgagtcagttttttttcagcc38
<210>2
<211>35
<212>dna
<213>artificial
<220>
<223>单链p
<400>2
ttttttttttttttttccctactgctagagatttt35
<210>3
<211>24
<212>dna
<213>artificial
<220>
<223>单链r
<400>3
cctacgtctccaactaacttacgg24
<210>4
<211>56
<212>dna
<213>artificial
<220>
<223>单链q6
<400>4
atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcc56
<210>5
<211>54
<212>dna
<213>artificial
<220>
<223>单链q4
<400>5
atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggat54
<210>6
<211>55
<212>dna
<213>artificial
<220>
<223>单链q5
<400>6
atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatc55
<210>7
<211>57
<212>dna
<213>artificial
<220>
<223>单链q7
<400>7
atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatcct57
<210>8
<211>58
<212>dna
<213>artificial
<220>
<223>单链q8
<400>8
atgtggaaaatctctagcagtagggccgtaagttagttggagacgtaggcggatccta58
<210>9
<211>65
<212>dna
<213>artificial
<220>
<223>单链f
<400>9
aactgactcctacgtctccaactaacttacggccctactgctagagattttatcagagtg60
gcttc65
<210>10
<211>21
<212>dna
<213>artificial
<220>
<223>靶序列t
<400>10
actgctagagattttccacat21
<210>11
<211>69
<212>dna
<213>artificial
<220>
<223>单链a0
<400>11
gaagccactctgatacattcctaagtctgaaacattacagcttgctacacgagaagagcc60
gccatagta69
<210>12
<211>69
<212>dna
<213>artificial
<220>
<223>单链b0
<400>12
ctgtcatcggtcactatcaccaggcagttgacagtgtagcaagctgtaatagatgcgagg60
gtccaatac69
<210>13
<211>69
<212>dna
<213>artificial
<220>
<223>单链c0
<400>13
ctgtcatcggtcactcaactgcctggtgataaaacgacactacgtgggaatctactatgg60
cggctcttc69
<210>14
<211>69
<212>dna
<213>artificial
<220>
<223>单链d0
<400>14
ctgtcatcggtcacttcagacttaggaatgtgcttcccacgtagtgtcgtttgtattgga60
ccctcgcat69
<210>15
<211>69
<212>dna
<213>artificial
<220>
<223>单链a1
<400>15
gtgaccgatgacagacattcctaagtctgaaacattacagcttgctacacgagaagagcc60
gccatagta69
<210>16
<211>55
<212>dna
<213>artificial
<220>
<223>单链b1
<400>16
tatcaccaggcagttgacagtgtagcaagctgtaatagatgcgagggtccaatac55
<210>17
<211>55
<212>dna
<213>artificial
<220>
<223>单链c1
<400>17
tcaactgcctggtgataaaacgacactacgtgggaatctactatggcggctcttc55
<210>18
<211>55
<212>dna
<213>artificial
<220>
<223>单链d1
<400>18
ttcagacttaggaatgtgcttcccacgtagtgtcgtttgtattggaccctcgcat55
<210>19
<211>21
<212>dna
<213>artificial
<220>
<223>单碱基错配序列
<400>19
actgctagagattttccactt21
<210>20
<211>21
<212>dna
<213>artificial
<220>
<223>双碱基错配序列
<400>20
actgctagagattttacactt21
<210>21
<211>22
<212>dna
<213>artificial
<220>
<223>完全不互补序列
<400>21
tagcttatcagactgatgttga22
- 还没有人留言评论。精彩留言会获得点赞!