PFKFB3蛋白的第194位酪氨酸的磷酸化及其应用的制作方法
本发明涉及pfkfb3蛋白酪氨酸第194位的磷酸化,尤其是涉及人和鼠的pfkfb3蛋白的第194位酪氨酸的磷酸化及其应用。
背景技术:
癌症是威胁人类健康的重大疾病,根据who的报告,2000年全球癌症死亡已经突破700万,占全部死亡人数的12%。2015年我国恶性肿瘤发病人数为429.2万,死亡281.4万,癌症成为威胁人民生命财产安全的最严重的疾病之一[1]。因此,鉴定新型的肿瘤筛选及诊断标记、发现新的肿瘤治疗靶点对提高癌症的防治手段、降低癌症死亡率至关重要。
c-src基因作为在动物中发现的第一个原癌基因,它编码一个分子量为60kda的酪氨酸激酶c-src,是一个重要的非受体酪氨酸激酶。c-src是胞内非受体酪氨酸激酶家族(src激酶家族)的一个成员,该家族包括c-src、fyn、yes,blk,yrk,fgr,hck,lck和lyn共9个成员[2]。c-src激酶由一个催化结构域,三个src同源结构域(sh2、sh3、sh4)和一个位于c端的负调控结构域构成[3]。正常情况下c-src羧基末端的第530位酪氨酸会被磷酸化,与其自身的sh2结构域结合形成分子内结构,从而抑制了其本身的激酶活性。细胞因子受体、粘附受体、酪氨酸激酶受体等跨膜蛋白能激活磷酸酶使c-src的第530位酪氨酸去磷酸化,从而解除分子内抑制,激活c-src的激酶活性[4],激活的c-src能通过磷酸化一系列底物蛋白激活细胞生长、血管生成、细胞增殖和细胞迁移等信号途径,在肿瘤诱发、恶化和转移中起重要作用[5]。研究表明,在大约50%的结肠癌、肝癌、肺癌、乳腺癌和胰腺癌组织中都存在c-src通路的过度激活。在小鼠模型中vegf、akt和erk信号通路可激活c-src,导致前列腺癌、卵巢癌和结肠癌的形成与转移[6,7]。
由于c-src的高表达或激活与多种肿瘤的发生和发展密切相关,而warburg效应是恶性肿瘤的基本特征之一,且以前没有关于c-src调节warburg效应的报道,因此,在前期工作中研究了c-src与糖酵解及warburg效应的关系。
糖酵解是发生在细胞质的无氧代谢过程,一分子葡萄糖经过十步酶促反应生成两分子丙酮酸和2个atp。整个糖酵解通路有两个限速酶,第一个是己糖激酶(hk),催化糖酵解的第一步反应,将葡萄糖磷酸化生成6-磷酸葡萄糖(glucose-6-p,g-6-p),6-磷酸葡萄糖可进入后续的糖酵解和磷酸戊糖途径。第二个是磷酸果糖激酶1(pfk1),催化6-磷酸果糖生成果糖1,6-二磷酸(fructose1,6-bisphosphate,f-1,6-bp)。已知f-2,6-bp是pfk1的最强的变构激活剂,而磷酸果糖激酶-2(pfk2)能催化f-2-p生成f-2,6-bp。哺乳动物中,pfk-2有4种不同的同工酶,即pfkfb1、pfkfb2、pfkfb3和pfkfb4。其中pfkfb3是分布最广泛,且在所有同工酶中其激酶活性最强,对糖酵解的激活作用也最强[8,9]。另外,pfkfb3在肿瘤中高表达,与肿瘤的发生和发展密切相关[10,11]。
参考文献:
1.孙燕.中国肿瘤防治工作进入新时期[j].科技导报,2016,34(20):14-17.
2.oppermannh,levinsonad,varmushe,levintowl,bishopjm."uninfectedvertebratecellscontainaproteinthatiscloselyrelatedtotheproductoftheaviansarcomavirustransforminggene(src)".proc.natl.acad.sci.u.s.a.1979;76(4):1804-1808
3.brownmt.cooperja.regulation,substratesandfunctionsofsrc.biochembiophysacta1996;1287(2-3):121–149.
4.brickellp.m.thep60c-srcfamilyofprotein-tyrosinekinases:structure,regulation,andfunction.critrevoncogenesis1992;3(4):401-446
5.matsumotot,jiangj,kiguchik,ruffinol,carbajals,beltránl,boldk,rosenbergmp,digiovannij.targetedexpressionofc-srcinepidermalbasalcellsleadstoenhancedskintumorpromotion,malignantprogression,andmetastasis.cancerres2003;63(16):4819-4828.
6.weiss,cuij,barnesl,chereshd.endothelialbarrierdisruptionbyvegf-mediatedsrcactivitypotentiatestumorcellextravasationandmetastasis.jcellbiol2004;167(2):223-229.
7.wienerjr,nakanok,kruzelockrp,bucanacd,bastrcjr,gallickge.decreasedsrctyrosinekinaseactivityinhibitsmalignanthumanovariancancertumorgrowthinanudemousemodel.clincancerres1999;5(8):2164-2170.
8.navarro-sabatéa,manzanoa,rieral,rosajl,venturaf,bartronsr.thehumanubiquitous6-phosphofructo-2-kinase/fructose-2,6-bisphosphatasegene(pfkfb3):promotercharacterizationandgenomicstructure.gene.2001feb7;264(1):131-138.
9.yalcina,telangs,clemb,chesneyj.regulationofglucosemetabolismby6-phosphofructo-2-kinase/fructose-2,6-bisphosphatasesincancer.expmolpathol.2009jun;86(3):174-179.
10.atsumit,chesneyj,metzc,lengl,donnellys,makitaz,mitchellr,bucalar.highexpressionofinducible6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase(ipfk-2;pfkfb3)inhumancancers.cancerres.2002oct15;62(20):5881-5887.
11.cantelmoar,conradilc,brajicaetal.inhibitionoftheglycolyticactivatorpfkfb3inendotheliuminducestumorvesselnormalization,impairsmetastasis,andimproveschemotherapy.cancercell.2016dec12;30(6):968-985.
技术实现要素:
本发明的第一目的在于提供pfkfb3蛋白的第194位酪氨酸的磷酸化。
本发明的第二目的在于提供pfkfb3蛋白第194位酪氨酸磷酸化的抗体。
本发明的第三目的在于提供pfkfb3蛋白第194位酪氨酸磷酸化的抗体的制备方法。
本发明的第四目的在于提供pfkfb3蛋白第194位酪氨酸磷酸化在临床肿瘤中的检测。
本发明的第五目的在于提供pfkfb3蛋白第194位酪氨酸磷酸化在临床抗肿瘤药物的应用。
所述pfkfb3蛋白的第194位酪氨酸的磷酸化,c-src蛋白能与pfkfb3蛋白相互作用,磷酸化pfkfb3蛋白的酪氨酸194位点,磷酸化位点的磷素化决定了pfkfb3蛋白的酶活性,即转化果糖-6-磷酸(f-6-p)为果糖-2,6-二磷酸(f-2,6-bp),所述转化增强了糖酵解的速率,进而促进了肿瘤的发生、发展和转移;相反的,所述磷酸化位点的酪氨酸突变为苯丙胺酸(pfkfb3-y194f)时,c-src失去了对糖代谢的调控能力,因而失去了促进肿瘤发生、发展和转移的能力。
所述pfkfb3蛋白第194位酪氨酸磷酸化的抗体,为单克隆抗体或多克隆抗体;所述多克隆抗体的制备方法包括以下步骤:
1)多肽合成;
2)动物免疫;选用健康家兔2只,经过2mg/只、5次免疫后,收集血清50~70ml/只;
3)免疫血清的鉴定:利用10g/ml抗原包被,elisa的方法鉴定血清的效价及特异性。
所述pfkfb3蛋白第194位酪氨酸磷酸化的抗体在检测第pfkfb3蛋白194位酪氨酸的磷酸化的应用。
当c-src蛋白被激活时,pfkfb3蛋白第194位酪氨酸被磷酸化,pfkfb3蛋白的酶活性极大增强,对糖酵解的正向调控能力上调,从而促进c-src对糖酵解的调控能力和促进肿瘤细胞的增殖、迁移、侵袭和转移的能力。
所述pfkfb3蛋白第194位酪氨酸磷酸化在临床肿瘤中的检测,包括在结肠癌、肝癌和乳腺癌等各种肿瘤中作为检测靶点;用于评估c-src、pfkfb3及糖酵解的激活情况;用于肿瘤的分期、分级及预后评估;用于指导临床抗肿瘤药物的选择;用于指导开发能抑制pfkfb3磷酸化的抗肿瘤药物。
所述pfkfb3蛋白第194位酪氨酸磷酸化在临床抗肿瘤药物的应用,包括抗体在检测临床标本中pfkfb3蛋白的磷酸化水平,确定包括结肠癌、肝癌、乳腺癌和肠癌等各种c-src激活的肿瘤标本中pfkfb3的磷酸化与c-src的磷酸化之间的相关性,pfkfb3蛋白的磷酸化与肿瘤的分级、分期及预后的关系等的应用,及评估c-src、pfkfb3及糖酵解的激活情况,用于指导临床抗肿瘤药物的选择和用于指导开发能抑制pfkfb3磷酸化的抗肿瘤药物。
pfkfb3蛋白的第194位酪氨酸残基是一个新的磷酸化位点,此位点的磷酸化决定了pfkfb3作为糖酵解的正向调控酶对糖代谢的调控,当该位点的酪氨酸残基突变为苯丙胺酸时,pfkfb3蛋白失去对糖酵解的调控作用,进而失去促进肿瘤细胞增殖、侵袭、迁移和转移的能力。本发明根据以上对pfkfb3新的磷酸化位点的研究成果,制备了针对此位点的多克隆特异性磷酸化抗体,此抗体能够特异识别pfkfb3的磷酸化状态。
当pfkfb3蛋白194位酪氨酸发生磷酸化时,pfkfb3蛋白的酶活性增强,糖酵解增强。因而,该位点的磷酸化可用来指示pfkfb3的酶活性及细胞的糖酵解水平。所述的应用包括,pfkfb3蛋白第194位点的磷酸化水平,可指示c-src(geneid:6714)及其家族其他激酶的活性水平。通过各种基于抗原-抗体的方法(如elisa、wb、ip、if、ihc等)检测细胞或组织中pfkfb3-y194位点的磷酸化水平;开发能抑制pfkfb3-y94位点磷酸化的药物,制备针对该位点磷酸化的单克隆抗体或多克隆抗体。所述的应用包括,该磷酸化位点在包括结肠癌,肝癌,乳腺癌和肠癌等各种肿瘤标本中,作为检测靶点,应用于评估c-src、pfkfb3及糖酵解的激活情况;应用于肿瘤的分期、分级及预后评估;应用于指导临床抗肿瘤药物的选择;应用于指导开发能抑制pfkfb3磷酸化的抗肿瘤药物。
本发明检测了c-src与pfkfb3的相互作用,发现c-src与pfkfb3有很强的相互作用,且能高度磷酸化pfkfb3上的酪氨酸位点,进而促进糖酵解的速率和乳酸的生成。在本发明中,发现了pfkfb3的磷酸化激活模式,即c-src及其家族激酶能通过磷酸化pfkfb3酪氨酸194位点而增强其酶活性,增强糖酵解速率,促进肿瘤的发生、发展和转移。
附图说明
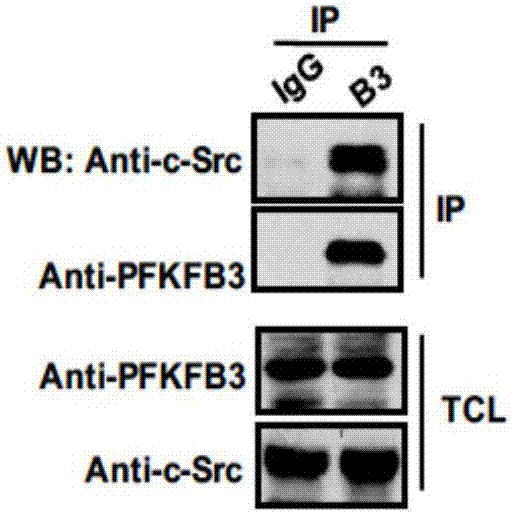
图1为免疫共沉淀证明内源性pfkfb3和c-src蛋白具有相互作用。
图2为c-src能够磷酸化pfkfb3,磷酸化的强度与c-src的活性呈正相关。
图3为确定pfkfb3上c-src的磷酸化位点为酪氨酸194位点,且自制的抗pfkfb3-y194的抗体有很好的特异性。
图4为pfkfb3y194位点的磷酸化能激活其激酶活性。
图5为c-src通过磷酸化pfkfb3促进糖酵解。
图6为c-src通过磷酸化pfkfb3促进细胞增殖。
图7为c-src通过磷酸化pfkfb3促进肿瘤发生。
图8为肿瘤组织中c-src的磷酸化水平和pfkfb3-y194的磷酸化ihc染色结果图。
图9为肿瘤组织中c-src的磷酸化水平和pfkfb3-y194的磷酸化统计学图。
图10为c-src通过磷酸化pfkfb3促进肿瘤细胞的迁移能力。
图11为c-src通过磷酸化pfkfb3促进肿瘤细胞的侵袭能力。
图12为c-src通过磷酸化pfkfb3促进肿瘤细胞转移能力的he染色结果图。
图13为c-src通过磷酸化pfkfb3促进肿瘤细胞转移能力的统计学图。
具体实施方式
图1为本发明通过免疫共沉淀实验发现c-src能与pfkfb3相互作用。在结肠癌hct116细胞中免疫沉淀了内源性的pfkfb3,在沉淀中能检测到c-src,说明二者在内源水平有很强的相互作用。
图2给出c-src能够磷酸化pfkfb3,磷酸化的强度与c-src的活性呈正相关。由于c-src是一个酪氨酸激酶,它对下游蛋白的调节作用主要是通过磷酸化作用实现的,因此在293t细胞中共表达了ha-pfkfb3和flag标签的c-src、c-src的激酶失活突变体(c-src-kd)、c-src的持续性激活突变体(c-src-ca),免疫沉淀ha-pfkfb3,用抗磷酸化酪氨酸的抗体(anti-ptyr)检测pfkfb3,发现c-src能强烈地磷酸化pfkfb3,c-src-ca的磷酸化作用更强,而c-src-kd没有作用,说明c-src的确是pfkfb3的上游激酶。
图3进一步确定pfkfb3上c-src的磷酸化位点为酪氨酸194位点,且自制的抗pfkfb3-y194的抗体有很好的特异性。为了确定pfkfb3上最主要的磷酸化位点,质谱鉴定到并构建了pfkfb3-y194f和pfkfb3-y315f两个突变体,发现c-src不能使pfkfb3-y194f磷酸化,说明pfkfb3-y194是c-src的主要磷酸化位点(图3a)。随后合成了y194磷酸化的pfkfb3的多肽,注射兔子,制备了能特异性识别y194位点磷酸化的pfkfb3的多抗(命名为anti-p-y194)(图3b)。
图4为pfkfb3y194位点的磷酸化能激活其激酶活性。随后研究了y194位点的磷酸化对pfkfb3的酶活性的影响,通过在pfkfb3ko细胞中的补救实验(回补的表达载体前用前缀“r”标记,如rflag-pfkfb3)发现c-src能通过磷酸化y194强烈地激活pfkfb3的酶活性(图4)。
图5为c-src通过磷酸化pfkfb3促进糖酵解。通过在pfkfb3敲除的mhcc97h和hct116细胞中补救表达野生型pfkfb3和不能被c-src磷酸化的pfkfb3-y194f,检测细胞对2-nbdg(一种荧光标记的葡萄糖类似物)的摄入(图5a)及乳酸的产生(图5b),结果表明c-src能通过磷酸化pfkfb3-y194f促进糖酵解的速率和乳酸的生成。
图6为c-src通过磷酸化pfkfb3促进细胞增殖。在发现了c-src能通过磷酸化pfkfb3-y194而激活糖酵解后,想知道该调节作用在细胞增殖及肿瘤发生中的作用。从绘制的细胞生长曲线可知,敲除pfkfb3能显著削弱hct116细胞的增殖,该作用能被重新表达野生型pfkfb3补救,而不能被pfkfb3-y194f补救,说明c-src能通过磷酸化pfkfb3-y194促进细胞的增殖(图6)。
图7为c-src通过磷酸化pfkfb3促进肿瘤发生。研究了该磷酸化对小鼠移植瘤生长的影响。在pfkfb3kohct116细胞中稳定表达了pfkfb3-y194f,然后进行了裸鼠皮下移植瘤实验,同时与表达野生型pfkfb3的细胞及相应的ko细胞进行对比,发现c-src通过磷酸化pfkfb3-y194能促进肿瘤的发生。
图8和9给出肿瘤组织中c-src的磷酸化水平和pfkfb3-y194的磷酸化有很强的相关性。结肠癌组织芯片ihc染色可以看到肿瘤组织相较于癌旁组织,pfkfb3y194的磷酸化水平有显著的上调,并且和c-src的活性水平也有很好的相关性。
图10为c-src通过磷酸化pfkfb3促进肿瘤细胞的能力。表明,敲除pfkfb3能显著削弱hct116细胞的迁移能力,该作用能被重新表达野生型pfkfb3补救,而不能被pfkfb3-y194f补救,说明c-src能通过磷酸化pfkfb3-y194促进细胞的迁移。
图11为c-src通过磷酸化pfkfb3促进肿瘤细胞的侵袭能力。表明,敲除pfkfb3能显著削弱hct116细胞的侵袭能力,该作用能被重新表达野生型pfkfb3补救,而不能被pfkfb3-y194f补救,说明c-src能通过磷酸化pfkfb3-y194促进细胞的侵袭。
图12和13为c-src通过磷酸化pfkfb3促进肿瘤细胞的转移能力。随后研究了该磷酸化对肿瘤转移能力的影响。在pfkfb3kdb16f10细胞中稳定表达了pfkfb3-y194f,然后进行了裸鼠尾静脉注射实验,同时与表达野生型pfkfb3的细胞及相应的kd细胞进行对比,发现c-src通过磷酸化pfkfb3-y194能促进肿瘤的转移。
本发明给出pffkb3蛋白酪氨酸第194位的磷酸化,提出了该位点的磷酸化对糖酵解的促进作用等,并制备了抗pfkfb3-y194磷酸化的多克隆抗体,该抗体能用于检测结肠癌、肝癌等各种c-src被激活的肿瘤等分级、分期,转移及预后评估,有重要的应用价值,同时可用于评估c-src的激活程度,进一步考虑用c-src的抑制剂来治疗肿瘤。研究结果对临床化疗药物的选择也有一定的指导意义,对c-src和pfkfb3高度激活的肿瘤,考虑用c-src的抑制剂。并且研究结果还可用于指导开发能抑制pfkfb3磷酸化的抗肿瘤药物。
材料与方法如下:
1、常用药品和试剂:
本说明使用的大部分药品与试剂分别购自美国sigma公司、上海生工(sangon)生物工程公司和newenglandbiolab(neb)公司。此外,限制性内切酶、核酸外切酶ⅲ(exoⅲ)和dna标准分子量marker购自大连宝生(takara)生物工程公司或transgene公司;碱性磷酸酶(cip)购自美国promega公司;t4dna连接酶(t4ligase)购自美国invitrogen公司;pvdf膜购自millipore公司;用于免疫共沉淀和westernblot分析的抗体购自美国santacruz,cellsignaling。此外,pfkfb3的抗体是用与gst融合的pfkfb3(aa440-520)蛋白免疫新西兰兔子,纯化血清获得;pfkfb3磷酸化的抗体是合成磷酸化的多肽{ptyr}easyqpldpdkc免疫新西兰兔子,通过cnbrbeads纯化血清获得。phos-tag是购买的wako公司的。
2、免疫共沉淀(co-ip):
对于过量表达免疫共沉淀实验,以35mm的细胞培养皿为例。转染24~36h后收集细胞。将培养皿置于冰上,接下来的所有操作皆在冰上进行。用真空泵将35mm细胞培养皿中的培养液彻底吸干净,加入400μl细胞裂解液,用细胞刮将细胞从培养皿内刮下,将细胞裂解液收集在1.5mleppendorf管中。随后用手持式超声破碎仪30%的功率超声12次,每次1s。随后将细胞裂解液4℃13,500rpm离心15min。取30μl上清转移到新管,加入2×sds样品缓冲液制备成tcl(totalcelllysis),置沸水中煮5min,放于-20℃备用于westernblot分析。剩余上清中取出350μl用于免疫共沉淀分析。以每个样品用量5μlproteina/g琼脂糖珠(santacruz)(使用前用适量裂解缓冲液洗3次,每次3,000rpm离心1min)与1μg抗体或者m2beads(直接带有flag的标签抗体)。将beads和350μl细胞裂解液混合,在4℃的垂直混合仪缓慢颠倒混匀3h,使目的蛋白从细胞裂解液中被特异性抗体免疫沉淀下来。随后4℃以3,000rpm速度离心2min,将beads离心至管底,弃上清,分别用500μllysisbuffer洗beads三次,去除一些非特异的结合。最后向beads中加入50μl1.2×sds样品缓冲液,沸水煮5min,为ip(co-ip)的样品,存于-20℃用于westernblot分析。
3、溶液配方:
lysisbuffer:20mmtris-hcl(ph7.5),150mmnacl,1mmedta,1mmegta,1%triton-x100,2.5mmsodiumpyrovate,1mmβ-glycerolphosphate,1mmsodiumorthovanadate,1mmdtt,1μg/mlleupeptin,1mmpmsf。
2×sdssamplebuffer(10ml):2mlglycerol,4ml10%sds,2ml4×stackinggelbuffer,1mlβ-mercaptoethanol,0.002gbromophenolblue
1.2×sdssamplebuffer:将2×sdssamplebuffer用1×lysisbuffer稀释即可。
5×sdssamplebuffer(50ml):5ml3mtris-hcl(ph6.8),5gsds,25mlglycerol,12.5mlβ-mercaptoethanol,25mgbromophenolblue,ddw7.3ml
4、mttassay:
mtt比色法检测细胞生长速率的原理是四唑盐(mtt)能够被细胞中脱氢酶还原成不溶于水的蓝色物质,并沉淀在细胞中,用dmso能够将这种蓝色物质溶解,溶液的颜色在570nm处有最大吸收峰,用酶标仪测的吸光度表示细胞量的多少。
将细胞培养在96孔板中,分5d的计数量,细胞密度起始都是1×103。24h之后,测第一次增殖量,每个孔加入20μlmtt溶液(5mg/ml),继续培养4h。将培养基吸干净,用150μldmso溶解甲瓒,测吸光度。连续测5d,将测得的吸光度为纵坐标,时间为横坐标绘制细胞生长曲线。
5、测定glucoseuptake:
细胞种植于6孔板中,密度60%左右用lowglucosedmem处理细胞4h后,pbs缓冲液清洗一次,随后用noglucosedmem加0.1mm2-nbdg孵育细胞30min,随后收集细胞,pbs漂洗3次后重悬细胞于1ml的pbs缓冲液中,上流式细胞仪分析活细胞内2-nbdg水平。
6、pfk酶活测定:
pfk催化果糖-6-磷酸和atp生成果糖-1,6-二磷酸和adp,丙酮酸激酶和乳酸脱氢酶进一步依次催化nadh氧化生成nad+,在340nm下测定nadh下降速率,即可反映pfk活性。
7、乳酸检测:
乳酸使用北京华宇亿康乳酸检测试剂盒检测。
8、裸鼠肿瘤移植实验:
利用pbobi载体或者plko.1载体构建慢病毒,感染细胞,建立稳定表达的细胞系,将细胞扩增起来。裸鼠的年龄大概为6周。每只小鼠注射1×107个细胞于裸鼠的后侧大腿与背部相邻的皮下位置。注射3周后,肿瘤长至合适大小,断颈法处死小鼠,拍照并解剖取得肿瘤称重。
9、裸鼠尾静脉注射实验:
利用pbobi载体或者plko.1载体构建慢病毒,感染细胞,建立稳定表达的细胞系,将细胞扩增起来。裸鼠的年龄大概为6周。每只小鼠注射2×106个细胞于裸鼠的尾静脉。注射2周后,断颈法处死小鼠,拍照并解剖取得小鼠肺,福尔马林固定后脱水、包埋、切片以及ihc染色。
本发明涉及pfkfb3蛋白的第194位酪氨酸的磷酸化(pfkfb3-p-y194)及针对该磷酸化位点的应用。应用包括:通过各种基于抗原-抗体的方法(如elisa、wb、ip、if、ihc等)检测细胞或组织中pfkfb3-y194位点的磷酸化水平;开发能抑制pfkfb3-y94位点磷酸化的药物,制备针对该位点磷酸化的单克隆抗体或多克隆抗体。当pfkfb3-y194位点被酪氨酸激酶(如c-src家族的蛋白激酶)磷酸化后,pfkfb3的酶活性上调,糖酵解增强,氧化性戊糖磷酸途径减弱,而非氧化性戊糖磷酸途径增强,从而促进了肿瘤的发生、发展和转移。本发明还涉及针对该位点的应用。pfkfb3-y194的磷酸化水平不仅能用于指标pfkfb3及其上游蛋白激酶(如c-src家族)的活性,而且能用于评估肿瘤细胞的增殖、迁移和转移能力,也能用于指导临床抗肿瘤药物的选择,及开发能抑制pfkfb3-y194位磷酸化的药物。
以下给出有关缩写:
1、pfkfb3-y194:pfkfb3蛋白的第194位酪氨酸;
2、pfkfb3-p-y194:pfkfb3蛋白的第194位酪氨酸被磷酸化;
3、anti-p-y194:抗pfkfb3蛋白的第194位酪氨酸磷酸化的抗体。
- 还没有人留言评论。精彩留言会获得点赞!