一种分离和纯化不同外泌体亚群的方法与流程
本发明属于生物检测技术领域。更具体地,涉及一种分离和纯化不同外泌体亚群的方法。
背景技术:
外泌体(exosomes)是一种具有双层质膜结构的微囊泡,直径约为30-150nm,由细胞通过胞吐作用释放至细胞间隙或体液中,其内含有多种来源细胞所特有的蛋白质、脂质和核酸等活性生物分子。
外泌体在癌症的发病机制、癌细胞的转移和一些退行性疾病中发挥一定的作用。它们在血液循环中的丰度随着包括癌症在内的疾病的增加而增加。例如,阶段ii到iv卵巢癌患者分泌外泌体的水平明显高于正常对照组与早期阶段的癌症病人。大肠癌患者和肺癌患者也比对照健康人产生较高数量的外泌体。乳腺癌细胞相对正常乳腺上皮细胞也产生更多的外泌体。基于肿瘤细胞产生较高水平的外泌体,并且其内含有多种来源细胞所特有的蛋白质、脂质和核酸等活性生物分子,外泌体极有潜力成为一种非侵入性的癌症诊断方法。
开发从细胞培养液或生物流体分离外泌体的有效的方法可以让研究者更好地了解微囊泡的成分。虽然高速离心一直是实验室中的“经典”的分离外泌体的方法,但它是一项费时费力的工作。市场上也有一些提取试剂盒,采用简单的低速离心沉淀,然而,这样提取的外泌体,包含很多杂蛋白,因此,只可以作为一种快速富集外泌体的工具。最近的报告表明,从生物合成、包含物和生物特性来看,外泌体是高度异质性的。目前在鉴定外泌体为基础的生物标志物的研究中都是用总量的外泌体来进行的。尝试分离不同子类的外泌体也只有两种方法,一种方法是基于密度梯度超速离心法,这是一个漫长、艰苦而且产量较低的程序;另外一种方法是免疫沉淀,它只能选择特定子类的外泌体,并且需要预先知道其表面蛋白和脂类的类型,采用严厉处理释放抗体结合体,整个方法是费时且昂贵的。
技术实现要素:
本发明要解决的技术问题是克服现有外泌体分离技术的缺陷和不足,提供一种用差别亲和力羟基磷灰石分离外泌体亚群的新方法,该方法还可以用于特异性富集癌细胞分泌的外泌体。该方法能够从细胞培养基或生物体液中简单而快速的分离无杂蛋白的外泌体,且获得的不同外泌体子类中所包含的蛋白、mirna和dnas分子等分布情况几乎没有重叠。
本发明的目的是提供一种基于羟基磷灰石的分离和纯化不同外泌体亚群的方法。
本发明另一目的是提供所述方法在分离纯化外泌体、分离纯化外泌体亚群以及在特异性富集癌细胞分泌的外泌体方面的应用。
本发明上述目的通过以下技术方案实现:
一种基于羟基磷灰石的分离和纯化不同外泌体亚群的方法,也是一种特异性富集癌细胞分泌的外泌体的方法,包括如下步骤:
s1.从细胞培养液或生物体液中分离纯化获得总外泌体悬液;
s2.利用羟基磷灰石通过色谱分离获得不同外泌体亚群。
具体优选地,步骤s2的具体方法是:
s21.将步骤s1获得的总外泌体悬液与羟基磷灰石混合,摇动条件下孵育后,转移至亲和层析柱,用3~5mm磷酸钠溶液(优选为5mm)洗涤;
s22.然后利用由低到高不同浓度的磷酸钠溶液依次洗脱,得到的各洗脱液再经过除杂得到各不同的外泌体亚群。具体地,所述除杂是超滤或透析去除外泌体亚群洗脱液中的磷酸钠。
其中,优选地,步骤s21所述总外泌体悬液与羟基磷灰石的用量比为1~5:1。
更优选地,步骤s21所述总外泌体悬液与羟基磷灰石的用量比为2~3:1。
优选地,步骤s21所述所述摇动的转速为50~180rpm。
更优选地,步骤s21所述摇动的转速为100~120rpm。
优选地,步骤s21所述所述孵育的时间为30~60min。
更优选地,步骤s21所述孵育的时间为35~45min。
优选地,步骤s21所述3~5mm磷酸钠溶液洗涤是在300g离心1分钟,洗涤一次。
优选地,步骤s22所述所述磷酸钠溶液的浓度不低于10mm。
另外,优选地,步骤s1所述样品可以为细胞培养液或生物体液。
优选地,步骤s1的具体方法如下:
(1)从细胞培养液中分离纯化获得总外泌体悬液:细胞培养液在低温、200~800g下离心2~8min去除悬浮细胞,上清液再在低温、2000~3000g下离心10~20min去除细胞碎片,然后0.22微米孔径滤膜过滤去除较大的微泡,采用超滤离心过滤管ultravel-100膜浓缩上清液,这一步不仅浓缩外泌体,也同时消除了很大一部分分子量小于100kda的杂蛋白;浓缩液经尺寸排阻色谱法去除蛋白质而获得总外泌体悬液。
(2)从生物体液中分离纯化获得总外泌体悬液:生物体液样品在低温、14000~17000g下离心30min,清除变性的蛋白质和微泡,上清液经尺寸排阻色谱法除蛋白质而获得总外泌体悬液。
其中,优选地,(1)中,细胞培养液在4℃500g下离心5min去除悬浮细胞,上清液再在4℃2500g下离心15min去除细胞碎片。
更优选地,(2)所述生物体液可以是血浆、肺积水、腹水或唾液等。如果是冷冻的样品需先在室温下解冻。
优选地,(2)中离心的条件为4℃14000~17000g离心30min。
优选地,(1)和(2)中所述尺寸排阻色谱法具体是上清液经琼脂糖凝胶填充柱纯化,具体步骤为:将上清液转移到一个琼脂糖凝胶填充柱,用5mm磷酸钠(ph值为7)重复循环洗脱8次,第2~8次的洗脱液合并即为总外泌体悬液。
另外,本发明上述方法在分离和纯化外泌体方面的应用,在分离和纯化外泌体亚群方面的应用,以及在特异性富集癌细胞分泌的外泌体方面的应用,均应在本发明的保护范围之内。
本发明的方法中外泌体亚群的分离可以通过色谱分离来完成的理论基础为:由于膜表面存在不同类别的蛋白质、核酸、脂类和糖类,外泌体具有不同的膜表面特性。利用膜表面生物分子之间的物理和化学性质的差异,外泌体亚群的分离可以通过色谱分离来完成。我们发现,几乎所有出现在血浆中、肺癌胸腔积液、腹水和细胞培养基中的外泌体都能够结合经5mm磷酸钠洗脱过的陶瓷羟基磷灰石。
本发明的方法分离、纯化的外泌体亚群已被证明包含有不同的蛋白质、rna和dna。对不同来源的外泌体,羟基磷灰石色谱法为基础的分析具有其独特性。例如,用这一技术获得的癌症(乳腺癌和肺癌)患者和普通健康人的外泌体,其亚群分布被认为是不同的:癌症样本检测到的某些外泌体亚群在对照样品中没有出现。因此,一种基于这种技术的新方法,在这里称为“差异分析”,可以提供一种方式来分离(或富集)疾病特异的外泌体亚群。这可以为更敏感和可靠的检测已知和批准的生物标志物铺平道路,并发现各种疾病的新的生物标志物。
另外,本发明的实验结果还显示了,从卵巢癌细胞系(igrov1和ovcar3细胞系)分泌的外泌体比正常细胞系(人角质细胞细胞株,hacat)分泌的外泌体具有更高的异质性。更加特别的是,癌细胞比正常细胞分泌的外泌体对羟基磷灰石具有更强的亲和力。乳腺癌和肺癌患者血浆、腹水和肺胸腔积液释放的外泌体比正常健康人血浆分泌的外泌体表现出更多的异质性(图10-12),癌细胞分泌的外泌体可能比正常细胞释放的外泌体对羟基磷灰石具有更强的亲和力;因此该方法可以分离并富集癌细胞特异分泌的外泌体,从而提高检测的灵敏度。在所获得的外泌体亚群中检测到肿瘤特有的dna突变。目前研究人员采用血液样本检测癌症利用的是循环肿瘤细胞(ctc),它们的富集可能为发现生物标志物从而为预测治疗反应和疾病进展提供依据。外泌体可能为此目的提供了另外一种选择。我们在肺肿瘤病人胸膜肺积液标本的外泌体中成功检测到肺肿瘤特异的egfrl858r突变dna。
本发明具有以下有益效果:
本发明提供了一种基于羟基磷灰石的分离纯化不同外泌体亚群的方法,获得外泌体无杂蛋白,且不同外泌体亚群的dna、rna及蛋白质几乎没有重叠;而且该方法不需要昂贵且精密的实验仪器(如超速离心机、荧光显微镜和抗体等),操作简单、快速,可以简单地通过加大羟基磷灰石层析柱体积的方式,进行较大量地外泌体亚群的提取。
本发明方法中外泌体解吸过程是非常温和的,从而获得的外泌体可以进一步应用,如用作功能分析材料(如对靶细胞和组织的影响)和治疗药物等。
由于生物体液中的外泌体是来自于正常细胞和癌细胞的混合体,其中只有极少部分来自于癌细胞,我们发现癌细胞分泌的外泌体比正常细胞释放的外泌体对羟基磷灰石具有更强的亲和力,从而可以分离并富集癌细胞特异分泌的外泌体,提高检测的灵敏度。因此,本发明的方法还可以用来特异性富集癌细胞分泌的外泌体,
另外,由于羟基磷灰石已被广泛用于纯化用于人类的治疗性单克隆抗体,因此本发明的技术可以适用于临床使用,具有很大的应用前景。
附图说明
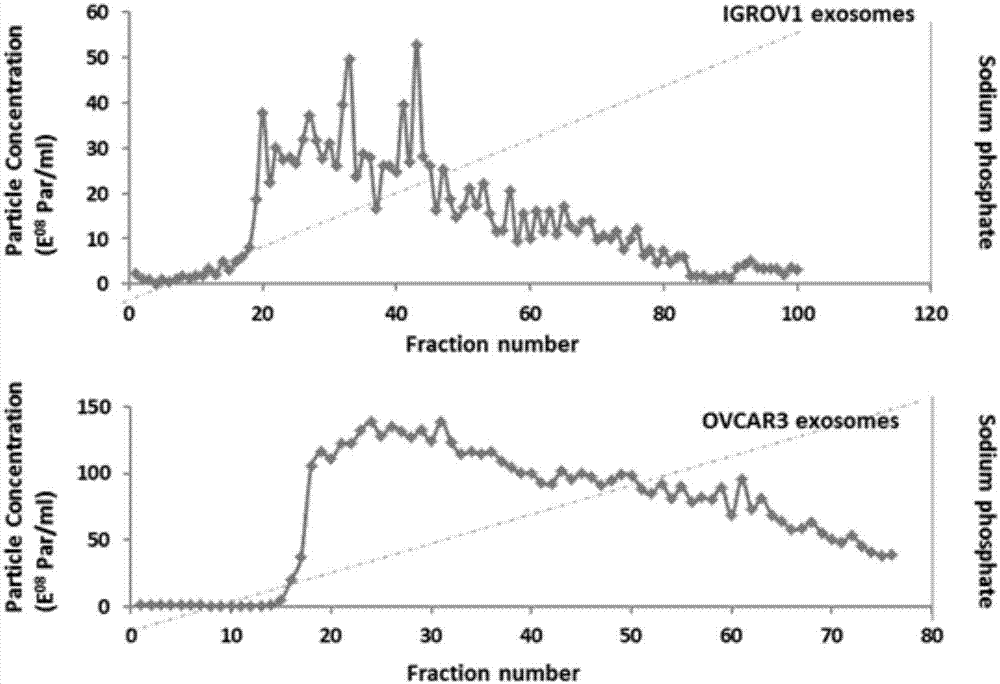
图1为不同的卵巢癌细胞系释放的外泌体经线性梯度洗脱后显示具有不同的亚群分布。
图2为igrov1外泌体亚群的蛋白质表达谱。
图3为不同的igrov1外泌体亚群含有不同的rna。
图4为只有一部分ovcar3外泌体亚群包含有双链dna。
图5为质谱分析显示不同的ovcar3外泌体亚群包含不同的蛋白质组。
图6为阶梯洗脱式分离和分析igrov1、ovcar3和hacat细胞分泌的外泌体亚群。
图7为质谱分析显示不同的阶梯洗脱式分离的ovcar3外泌体亚群包含不同的蛋白质组。
图8为ovcar3和hacat细胞分泌的外泌体亚群的western印迹比较。
图9为ovcar3细胞分泌的外泌体亚群的mirna表达分析。
图10为乳腺癌患者和对照健康人血浆外泌体的亚群分布。
图11为肺癌患者和对照健康人血浆外泌体的亚群分布。
图12为人腹水、肺癌胸腔积液的外泌体的亚群分布。
图13为从肺癌胸腔积液中富集包含dicer和ago2蛋白的外泌体。
图14为胸腔积液外泌体亚群中egfr突变dna的检测。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均可从商业途径得到。
实施例1分离和纯化不同外泌体亚群的方法
1、本发明构建了一种分离和纯化不同外泌体亚群的方法,也可以用来特异性富集癌细胞分泌的外泌体,包括如下具体步骤:
(1)一种从培养基(细胞培养液)中分离纯化总的外泌体的方法:
100~500ml细胞培养液在4℃500g下离心5分钟去除悬浮细胞,上清液再在4℃2500g离心15分钟去除细胞碎片,然后通过0.22微米孔径滤膜过滤去除较大的微泡;上清液采用超滤离心过滤管ultravel-100膜浓缩。这一步不仅浓缩外泌体,也同时消除了很大一部分分子量小于100kda的杂蛋白。浓缩后的上清液经尺寸排阻色谱法去除蛋白质而获得外泌体悬液。
其中,所述经尺寸排阻色谱法去除蛋白质的具体方法是:浓缩后的上清液转移到一个10~40ml的琼脂糖凝胶填充柱,用5mm磷酸钠重复循环洗脱20次(5mm磷酸钠的ph值为7,经100kd分子量的膜过滤除去溶液中的外泌体,在此命名为缓冲液a)。收集20组0.5~2.0ml洗脱液,依次编号为1~20。
蛋白浓度使用nanodrop装置在280nm处的吸光度来测定,外泌体的数量和粒径分布用纳米颗粒跟踪分析仪来检测。
结果显示,大多数外泌体出现在编号2~8的洗脱液里,而95%以上的蛋白质出现在编号10以后的洗脱液里。因此,我们把编号2~8的洗脱液混合作为纯化的总外泌体悬液。
(2)一种从生物体液中分离纯化总的外泌体的方法:
冷冻的血浆样品(购自asterand或min-hantan博士赠送)在室温下解冻,在4℃14000~17000g离心30分钟清除变性的蛋白质和微泡。上清液经尺寸排阻色谱法除蛋白质而获得外泌体悬液(上清液经琼脂糖凝胶柱纯化,方法同上,其中血浆和琼脂糖凝胶的体积比为1ml:10~20ml)。
(3)基于羟基磷灰石通过色谱分离外泌体亚群:
上述(1)或(2)纯化的外泌体与pbs清洗后的羟基磷灰石(cht陶瓷羟磷灰石i型树脂,20µm)0.5ml混合,在水平摇床上缓慢摇动条件下孵育35~45分钟后,将悬浮液转移至一个单一的亲和层析柱(碧云天fcl03)。
未结合物质的洗脱是:将亲和层析柱放入15毫升的离心管,在300g离心1分钟,3毫升缓冲液a洗涤一次,洗脱未结合物质。
外泌体的分离是由洗脱羟基磷灰石结合的物质来进行的,具体是:利用由低到高不同浓度的磷酸钠溶液依次洗脱,得到的各洗脱液再经过除杂得到各不同的外泌体亚群。具体地,所述除杂是超滤或透析去除外泌体亚群洗脱液中的磷酸钠。
其中,洗脱液中磷酸钠浓度分线性梯度式或渐进式增加两种,其中线性梯度式洗脱液中磷酸钠的浓度从10mm线性缓慢地升到1000mm,收集75-100个样品,每个样品0.3ml;渐进式洗脱液中磷酸钠的浓度分别是10、20、40、80、120、160、200、400,600、800,和1000mm,洗脱液的体积为0.5ml,每个磷酸钠的浓度重复洗脱5次;或者洗脱液的体积增大到2.5ml,洗脱1次。收集的洗脱液按磷酸钠的浓度顺序分别标记为洗脱液1,2,3,直到11。
外泌体亚群洗脱液中的磷酸钠可以由超滤或透析去除。
最后,该柱用0.1mnaoh处理,以除去强结合的材料而回收再利用羟基磷灰石。
实施例2分离和纯化的外泌体亚群的分析
1、实施例1中分离、纯化的外泌体亚群的蛋白浓度使用nanodrop装置在280nm处的吸光度来测定,外泌体的数量和粒径分布用纳米颗粒跟踪分析仪来检测。westernblot和dotblot分析被用来分析所获得的外泌体亚群包含的特定蛋白。
另外,提取各外泌体亚群的总rna和dna,并用安捷伦2100生物分析仪(bioanalyser)进行rna和dna评估。外泌体亚群的蛋白质组学分析参照文献报导的方法(shevchenko,a等2006,natureprotocols1,2856-2860)和新加坡实验医疗学中心(experimentaltherapeuticscentre)蛋白质组学分析样品制备手册进行。
2、我们观察到,外泌体在不同的磷酸盐浓度都能被洗脱,且两个不同的卵巢癌细胞系igrov1和ovcar3经线性梯度磷酸盐缓冲液洗脱释放的外泌体洗脱曲线显然是不同的(图1)。
为了说明不同磷酸梯度洗脱的外泌体的异质性,我们提取了外泌体的蛋白,对几种外泌体标签用斑点杂交法进行了分析。我们观察到,分别包含有cd81和alix、cd9、epcam和tsg101的外泌体富集在不同的亚群(图2)。有趣的是,包含有cd63的外泌体可以分成不同的类别,可以与包含有cd81、alix和cd9的外泌体同在一类亚群,但不存在于包含有epcam和tsg101的外泌体亚群(图2)。
此外,有些外泌体的亚群已被证明含有不同类别的rna,而有些亚群不包含rna(图3)。
外泌体亚群的dna含量分析显示,只有中间一些亚群含有dna,而其它亚群不含有dna(图4),这些证据进一步表明,陶瓷羟基磷灰石分离的外泌体其内含物是不相同的。
外泌体亚群的蛋白质组学分析(lc-ms/ms)也得到相同的结论:将洗脱液每5份合并为1组,75份共合并为15组,也即15个亚群。将外泌体悬液提取的蛋白质在1.5ml离心管中用胰蛋白酶消化一夜,提取的蛋白肽由安捷伦uhdqtof6538进行分析。质谱数据搜索使用uniprot蛋白数据库,结果在15个外泌体亚群中鉴定出了70个蛋白质,外泌体富含的蛋白质在不同的亚群间几乎没有重叠(图5)。
3、羟基磷灰石高效液相色谱法的分离效率是令人满意的。然而,高效液相色谱法不适合快速和高通量的分析。因此,我们把羟基磷灰石装进小的分离柱(0.5毫升),外泌体的分离是由洗脱羟基磷灰石结合的物质来进行的,洗脱液中磷酸钠浓度采用渐进式的提高,分别是10、20、40、80、120、160、200、400,600、800,和1000mm,洗脱液的体积为0.5ml,每个磷酸钠的浓度重复洗脱5次;或者洗脱液的体积增大到2.5ml,洗脱1次。收集的洗脱液按磷酸钠的浓度顺序分别标记为洗脱液1,2,3,直到11。最后,该柱用0.1mnaoh处理,以除去强结合的材料而回收再利用羟基磷灰石。11个级分的外泌体图谱表明,卵巢癌细胞(igrov1和ovcar3细胞系)分泌的外泌体比正常细胞(人角质细胞细胞株humankeratinocytecellline,hacat)分泌的外泌体具有更高的异质性。更加特别的是,癌细胞比正常细胞分泌的外泌体对羟基磷灰石具有更强的亲和力(图6)。我们进一步对获得的外泌体亚群的蛋白进行了免疫印迹法分析。不同的亚群包含有不同的蛋白标签,根据蛋白标签的异同,可以把igrov1细胞分泌的外泌体分离成6到8个亚型,洗脱液5包含所有的5个蛋白标记,而洗脱液1和11只包含一个蛋白标记(图6)。
该方法可以简单地加大羟基磷灰石层析柱的体积,进行较大量地外泌体亚群的提取。该方法采用的外泌体解吸过程是非常温和的,从而获得的外泌体可以进一步应用,如用作功能分析材料(如对靶细胞和组织的影响)和治疗药物等。
4、为了寻找更多的指定肿瘤来源的外泌体亚群的蛋白质标记,我们用卵巢癌细胞株ovcar3作为外泌体的蛋白质来源。利用4-20%的sds-page凝胶分离蛋白质,然后将每条凝胶切成8小块。在1.5ml离心管中用胰蛋白酶消化一夜,提取的蛋白肽由安捷伦uhdqtof6538进行分析。质谱数据搜索使用uniprot蛋白数据库,结果在11个外泌体亚群中鉴定出了188个蛋白质,其中5号洗脱液鉴定出最多条蛋白,即97条蛋白质;2号洗脱液鉴定出最少条蛋白,即17条蛋白质。常见的外泌体标记物cd9、cd81、tetraspanin-14和syntenin-1出现在几乎所有的洗脱液里。而alix、cofilin-1、整合素alpha-v、和磷脂酶d3只存在于9号洗脱液里,整合素alpha-3仅呈现在9和10号洗脱液里,值得注意的是9和10号洗脱液里的外泌体相比“正常”的外泌体表现出较强的亲和吸附性(图7)。将这188种鉴定的蛋白质,进行细胞组分、生物过程和分子功能分类。鉴定的外泌体蛋白质的细胞组分包括胞外区(20条蛋白,p值1.01e-02)、细胞外基质(11条蛋白,p值1.34e-04)和核染色体(11条蛋白质,p值1.39e-06)。鉴定的外泌体蛋白主要参与的生物过程包括细胞组成的组织或合成(55条蛋白,由h4,h2a1b,h2aw,h2ax,h2a2c,h2ay,h2b1j,h2az,h32和top1,p值2.53e-13),细胞粘附蛋白(20条蛋白,由laminin和整合素β1,;p值1.31e-05),细胞的过程(114条蛋白质,伴侣和囊泡的外壳蛋白;p值7.96e-05)。关于这些蛋白的分子功能,卵巢癌来源的外泌体蛋白具有丰富的结构分子活性(22条蛋白质,p值1.65e-02)、酶活性(3条蛋白质,p值3.05e-02),与特异序列的dna结合的转录因子活性(1条蛋白质,p值3.92e-03)。
5、我们采用westernblot方法验证上述蛋白质组分析鉴定的卵巢癌细胞株ovcar3外泌体亚群的蛋白质标记。我们选择了常见的几乎在所有的洗脱液中都出现的外泌体标记cd9、cd81和一些仅出现在9号洗脱液的蛋白标志物,如整合素alpha-v和磷脂酶d3。western印迹表明,常见的外泌体标记cd9出现在几乎所有的洗脱液中,cd81标记出现在大多数的洗脱液中。整合素alpha-v不仅存在于9号洗脱液,也出现在3-7号洗脱液中。磷脂酶d3不仅存在于9和10号洗脱液中,也出现在4和5号洗脱液中(图8)。
我们进一步用westernblot分析研究了以上4个标志蛋白在人角质细胞细胞株(hacat)外泌体亚群中的表达。结果表明,常见的外泌体标记cd9出现在4、6和9号洗脱液中,而cd81出现在3到10号洗脱液中。整合素alpha-v只在4和5号洗脱液中有很弱的表达。pld3只存在于3和4号洗脱液中(图8)。westernblot分析显示,癌细胞分泌的外泌体比正常细胞分泌的外泌体具有更高的异质性,特别有趣地是,癌细胞分泌的外泌体含有更多的蛋白质标记物,也有较强的羟基磷灰石亲和性。
6、近期外泌体mirna分析被广泛应用在癌症诊断的研究。因此,我们一直对用我们的技术获得的外泌体亚群的mirna含量分析感兴趣。对从ovcar细胞或者hacat细胞分离得到的外泌体亚群和未分离的总样本的外泌体进行了利用affymetrix4.0阵列的mirna含量分析。总的来说,我们在外泌体亚群检测到几千个mirnas。不同的外泌体亚群包含不同数量的mirnas,一些mirnas在所有的亚群中出现,而有些mirnas仅在某些亚群中富集(图9)。与hacat细胞分泌的外泌体相比,ovcar3细胞分泌的外泌体表达的mirnas,有385个上调和11个下调。有趣的是,当我们对单个相对应的外泌体亚群mirna表达谱进行比较时,ovcar3细胞表达的mirnas有更多个上调或下调。例如:在9、10或11号ovcar3细胞外泌体洗脱液中分别有354、240或106的上调的mirnas和14,10或22个下调的mirnas(图9)。这些在9-11号ovcar3细胞外泌体洗脱液中特异性表达的mirnas将可用于癌症的生物标志物。
7、我们进一步对鉴定的外泌体mirnas作表达途径分析。关于这些mirnas的分子和细胞功能,外泌体包含的所有mirnas都参与细胞发育、细胞的生长和增殖。ovcar3分泌的总外泌体mirnas的靶点与hacat分泌的总外泌体mirnas的靶点相比较,我们检测到254个不同通路。当我们对单个相对应的外泌体亚群mirnas的靶点进行比较时,我们检测到更多的不同通路,9、10或11号洗脱液中ovcar3细胞外泌体mirna的靶点分别有321、309或38条不同通路。在9或10号洗脱液中分别包括12或9条特有通路(图9)。这12条通路是erbb4介导的信号转导、急性髓系白血病的信号、肌动蛋白细胞骨架信号、脂肪生成途径、昼夜节律信号、ampk信号通路、tob在t细胞信号转导的抗增殖作用、b细胞受体信号、基底细胞癌信号、bmp信号通路(tgf-β信号)、降解甘油i(3-磷酸甘油穿梭,pparα/rxrα激活)和成骨细胞作用(在类风湿性关节炎中的破骨细胞和软骨细胞)。而9条通路如下:肌动蛋白细胞骨架信号(b细胞受体信号)、生长抑素受体2的抗增殖作用、轴突导向信号(b细胞受体信号)、芳香烃受体信号、轴突导向信号(人类胚胎干细胞多能性)、通过调节stathmin1乳腺癌(camp介导的信号)、通过药物外排癌耐药性、硫酸软骨素降解(后生动物)和黑色素细胞的生长和色素沉着的信号(黑色素瘤信号和在破骨细胞的rank信号)(图9)。而9和10号洗脱液中共同存在58条通路,比如抗氧化剂维生素c介导的信号通路、脂肪细胞ampk信号通路、醛甾酮介导的信号转导、上皮细胞中的磷酸肌醇信号、生物合成、降解、ampk信号等(图9)。所有的存在于9和10号洗脱液外泌体中的信号通路都可能是癌细胞所特有的。
8、考虑到我们的技术用于诊断目的的潜在效用,重要的是要测试临床样本,癌症患者的生物体液,如血浆、腹水和肺胸腔积液。在所有的情况下,我们发现,该技术获得的“正常”和癌症样本的外泌体亚群分布是不同的。这些样品的外泌体亚群分布如图10~14所示。
这表明,乳腺癌和肺癌患者血浆、腹水和肺胸腔积液释放的外泌体比正常健康人血浆分泌的外泌体表现出更多的异质性(图10~12)。癌细胞分泌的外泌体可能比正常细胞释放的外泌体对羟基磷灰石具有更强的亲和力。在这里应该说明的是由于生物体液中的外泌体是来自于正常细胞和癌细胞的混合体,其中只有极少部分来自于癌细胞,因此对羟基磷灰石具有更强的亲和力的外泌体的比例没有癌细胞系的高。
9、生物体液中发现的外泌体来自于正常细胞和癌细胞的混合体。分离并富集癌细胞特异分泌的外泌体进行分析,可以提高检测的灵敏度。近年来的研究发现,癌细胞而不是正常细胞含有dicer和ago2酶,参与生物合成mirna(melosa,2014)。我们发现,我们的技术允许在很短的时间内在肺癌胸腔积液中显著富集包含dicer和ago2酶的外泌体(图13)。
10、我们的技术的另一个潜在的应用就是在外泌体亚群中检测肿瘤特有的dna突变。目前研究人员采用血液样本检测癌症利用的是循环肿瘤细胞(ctc)。它们的富集可能为发现生物标志物,从而为预测治疗反应和疾病进展提供依据。外泌体可能为此目的提供了另外一种选择。我们和合作者(minhantan博士),在肺肿瘤病人胸膜肺积液标本的外泌体中成功检测到肺肿瘤特异的egfrl858r突变dna(图14)。
- 还没有人留言评论。精彩留言会获得点赞!