靶向AKAP3的亲和肽P296的制作方法
本发明涉及生物领域,尤其涉及一种多肽。
背景技术:
a型激酶锚定蛋白(a-kinaseanchorproteins,akaps)是结合蛋白激酶a(pka)亚基的一组结构不同的蛋白质。大量的证据表明akaps在camp介导的信号传导中起着重要的作用。akap3是一个癌睾抗原。研究表明,akap3是精子特有的基因,主要在精子形成过程中减数分裂后表达,在精子前体细胞的形态变化和调节精子功能中起重要作用。在正常组织中,akap3表达仅存在于睾丸中。akap3的mrna在各种肿瘤细胞系中广泛表达。研究发现,akap3在卵巢癌中高表达,并且akap3的表达和肿瘤的组织学分级有关,也与肿瘤的临床分期有关。
技术实现要素:
本发明克服了现有技术的不足,提供了一种靶向akap3的亲和肽或akap3来源的抗肿瘤ctl表位肽p296及其应用。
一方面,本发明提供了一种多肽,其氨基酸序列如seqidno.1所示。
另一方面,本发明提供了所述多肽的制备方法,该多肽可通过固相合成制得,如采用标准fmoc方案制备。
另一方面,本发明提供了含所述多肽的食物、保健品或药物组合物,药物组合物可包括多肽及其药学上可接受的载体或赋形剂,其形式可为疫苗。
再一方面,本发明提供了所述多肽用于制备akap3表达阳性肿瘤的预防性或治疗性多肽疫苗的用途。
本发明的有益效果为:
本发明的多肽是akap3抗肿瘤ctl表位肽,较好地诱导特异性ctl应答,提升ifn-γ的表达量,从而增强肿瘤预防和治疗的效果,可制为一种新型的肿瘤治疗性疫苗甚至食物、保健品。
附图说明
图1表征elispot法检测表位肽体外特异性ctl分泌ifn-γ的能力;
图2表征ldh法检测表位肽体外特异性ctl细胞毒性;
图3表征elispot法检测表位肽体内特异性ctl分泌ifn-γ的能力;
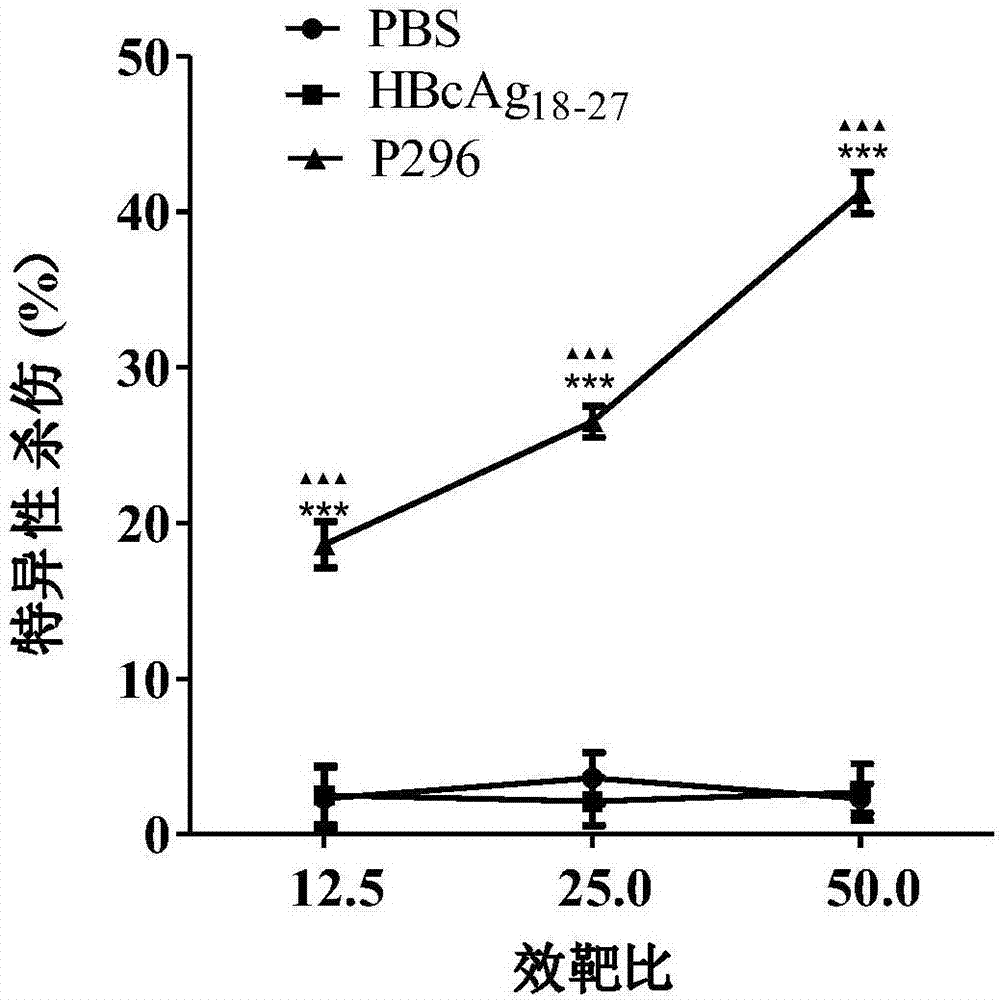
图4表征ldh法检测表位肽体内特异性ctl细胞毒性;
图5表征elisa法检测小鼠血清中ifn-γ的分泌量;
图6为转基因小鼠体重变化图。
各图中所涉*p<0.05,**p<0.01,***p<0.001分别代表实验组与pbs组的显著性差异;▲p<0.05,▲▲p<0.01和▲▲▲p<0.001分别代表实验组与hbcag18–27或者th表位组的显著性差异。
具体实施方式
本发明的候选肽p296,其序列为mmvsimktl(met-met-val-ser-ile-met-lys-thr-leu),如seqidno.1所示,采用标准fmoc方案进行固相合成,经质谱检测其分子量为:1053.6[m+h],基本同理论值1053.4。下面鉴定该候选肽(有时亦称表位肽)的活性,所用实验方法、试剂均为常规选择,参见文献:shirr,liuj,zouz,qiym,zhaimx,zhaiwj,gaoyf:theimmunogenicityofanovelcytotoxictlymphocyteepitopefromtumorantigenpl2l60couldbeenhancedby4-chlorophenylalaninesubstitutionatposition1.cancerimmunology,immunotherapy:cii2013,62(11):1723-1732。如无特别说明,所涉名词、缩写均为本领域常规含义。
1.t2a2细胞亲和力实验
①收集t2a2细胞,用无血清imdm洗3次,调整细胞浓度至1×106/ml,铺于24孔板中,1ml/孔。实验组加入2.5μg/ml的β2微球蛋白,50μm的候选肽p296;设置阳性组、阴性组、背景对照组。于37℃、5%co2培养箱中共孵育18h。
②收集孵育后的细胞,用冰pba洗3次,加入0.5ml1:100稀释的单克隆抗体bb7.2,4℃避光孵育30min。
③冷pba洗3次,加入50μl稀释度为1:50的fitc-羊抗鼠igg溶液,4℃避光孵育40min。冷pba洗涤1次,1mlpba重悬,上流式细胞仪进行检测。同时,设置已被鉴定的hbcag18-27作为结合力和稳定性实验的阳性肽,pbs作为阴性对照,未加肽刺激的单纯t2a2细胞作为背景对照。
结果用荧光系数(fi)表示:荧光系数(fi)=(表位肽平均荧光强度-背景平均荧光强度)/背景平均荧光强度。结果分析:如果fi>1.5:候选肽与hla-a*0201具有强亲合力;1.5>fi>0.5:中等亲合力;fi<0.5:弱亲合力。经分析,本肽的fi=1.64。
2.肽/mhc复合物稳定性分析
收集t2a2细胞,用无血清imdm洗3次,调整细胞浓度至1×106/ml,铺于24孔板中,1ml/孔。分别加入50μm的候选肽,设置阳性组、阴性组、背景组和调零组,每孔加入2.5μg/ml的β2微球蛋白,于37℃、5%co2培养箱中共孵育18h。
孵育完成后,以冷pba洗涤3次以洗净未结合的肽,加入10μg/mlbrefeldina(布雷菲德菌素a)孵育1h。以0h、2h、4h、6h为时间点,37℃、5%co2共孵育。冷pba洗涤2次,加500μl稀释度为1:100的单克隆抗体bb7.2,4℃避光孵育30min。冷pba洗涤2次,加50μl稀释度为1:50的fitc-羊抗鼠igg,4℃避光孵育40min。冷pba洗涤后,pba重悬细胞,于流式细胞仪检测,结果以dc50表示。
经检测,dc50>4h。
3.体外免疫活性检测
细胞毒t淋巴细胞体外诱导
①40ml离心管中加入适量肝素钠溶液,抽取hla-a2阳性健康志愿者外周血20ml,无菌ph=7.2的pbs将抗凝血进行稀释。
②将4ml的淋巴细胞分裂液贴壁缓缓加入无菌的离心管,随后加入经pbs稀释过的抗凝血,注意不要打破界面。2000rpm,离心20min。
③离心结束后,离心管中细胞从上至下分为四层;弃去第一层血浆层,吸取第二层环状乳白色的淋巴细胞层,置于另一无菌离心管中,随后加入5倍体积的pbs洗涤,2000rpm,15min。
④弃上清,收集沉淀。用含10%胎牛血清的imdm培养基调整细胞浓度为1×106/ml,置于24孔板中培养。
⑤设定pbs组、hbv组、实验组,第2天hbv组、实验组分别加入相对应的多肽和β2-m(两者终浓度均设为10μg/ml),pbs组加入相对应的pbs,第3天加入50u/ml的重组人源il-2(rhil-2),观察培养液状态,进行半量换液,补加rhil-2。每7天进行一轮重复刺激,刺激过程:24孔板进行1000rpm,10min离心,去除上清,加入新鲜的含10%胎牛血清的imdm培养基,同时补加上述量相对应的多肽、rhil-2和β2-m,第2轮刺激的第3天加入cd3抗体。
⑥完成3轮刺激后,继续培养2-3天,收集细胞即作为效应ctl。
免疫活性检测:
1)elispot(enzyme-linkedimmunospotassay酶联免疫斑点实验)法检测分泌ifn-γ的t细胞数
a.首先进行预包被板的活化:
取出所需elispot板条,每孔加200μl无血清的imdm培养基进行封闭,静置10min后将培养基弃去;
b.细胞铺板:
诱导的ctl作为效应细胞,荷肽的t2a2作为刺激细胞,细胞浓度均调整为2×106个/ml;实验孔每孔加50μl效应细胞和50μl刺激细胞;
阴性对照孔每孔加100μl无血清的imdm培养基;
阳性对照孔每孔加50μl的效应细胞和10μlpha再补加40μl无血清的imdm培养基培养。
铺板完毕放于培养箱中,37℃、5%co2孵育18h;
c.细胞裂解:
孵育结束后,倾尽孔中培养基,每孔加入200μl无菌的去离子水,4℃裂解细胞10min;倾尽孔内液体,加入200μl1×washingbuffer进行洗涤,洗涤6次,每次停留60s,洗涤完毕后,在吸水纸上拍干;
d.加入检测抗体孵育:
加入100μl生物素标记的抗体,37℃孵育1h;孵育完成后,倾尽孔内液体,加入200μl1×washingbuffer进行洗涤,洗涤6次,每次停留60s,洗涤完毕后,在吸水纸上拍干;
e.加入酶联亲和素孵育:
加入100μl酶联亲和素,37℃孵育1h;孵育完成后,倾尽孔内液体,每孔加入200μl1×washingbuffer进行洗涤,洗涤6次,每次停留60s,洗涤完毕后,在吸水纸上拍干;
f.显色:
加入100μl现配的aec显色液,室温25℃避光静置30min,进行显色;显色完成后,倾尽孔内液体并打开孔板底座,去离子水洗涤,终止显色。置于通风处,室温静置干燥;用elispot图像分析仪计数96孔板中每孔的斑点数,结果比较如图1所示。
2)ldh(lactatedehydrogenase乳酸盐脱氢酶)法检测细胞毒性实验
①靶细胞、效应细胞的准备
本实验中将sw620作为靶细胞,调整细胞浓度为1×105个/ml,每孔加入5000个/50μl,加入不同数量和体积的效应细胞(前面体外诱导制备),使实验组形成不同的效靶比(分别为12.5:1、25:1、50:1),并补加无血清的imdm培养基至总体积100μl,每组设置3个复孔。
同时设立以下对照:
靶细胞自发释放组
靶细胞最大释放组
效应细胞自发释放组
背景对照组
总体积校正对照组,各对照组也设3个复孔,每孔总体积100μl。
②ldh实验步骤:
细胞培养板96孔板置于37℃,5%co2培养箱中培养4h。孵育结束前45min,加入10μl10×裂解液添加在靶细胞最大释放孔和体积校正孔中。培养结束后,离心培养板1000rpm,10min;取出96孔板,每孔轻轻吸取50μl上清置于另一96孔板对应的孔中,全部转移结束后,每孔迅速加入50μl乳酸脱氢酶底物混合液,室温避光孵育30min;孵育结束后,每孔添加50μl终止液;酶标仪上以490nm检测吸收od值,计算杀伤率。
杀伤率=(实验组释放-效应细胞自发释放-靶细胞自发释放)/(靶细胞最大释放-靶细胞自发释)×100%。
结果比较如图2所示。
4.akap3的hla-a2.1/kb转基因小鼠体内免疫活性检测
效应ctl(细胞毒性t淋巴细胞)的体内诱导
随机选取6~8周龄hla-a2.1/kb转基因小鼠,每组5只,雌雄随机分配。
实验共设置pbs组、th表位组、实验组。每组注射小鼠体内的剂量如下:
pbs组:pbs:弗氏不完全佐剂(ifa)=1:1
th组:pbs:th表位:弗氏不完全佐剂(ifa)=1:1:2
实验组:实验组:th表位:弗氏不完全佐剂(ifa)=1:1:2
第1次免疫注射记为第0天,按照上面所给各个组分进行皮下免疫注射,在第5d、第10d时进行第2次和第3次加强免疫;同时每次免疫注射前,对hla-a2.1/kb转基因小鼠进行观察,记录体重,结果如图6所示。
制备效应细胞:
①将免疫注射后的hla-a2.1/kb转基因小鼠于第11d脱颈处死,置于75%酒精中,浸泡处理10min消毒后,无菌开腹腔取出脾脏,去除脂肪和结缔组织放于200目不锈钢网筛中;
②培养皿中加入少量ph=7.2的pbs,并将200目钢网置于其上,用20ml医用注射器内芯进行研磨,尽量研磨干净。pbs冲洗,移去筛网,培养皿中得脾细胞悬液(约10ml),转移至无菌离心管中;
③1000rpm、10min水平离心,弃上清,收集细胞;每管加入5ml红细胞裂解液,轻轻吹打重悬细胞,4℃孵育15min裂解红细胞;1000rpm、10min水平离心弃上清,收集细胞。pbs洗涤2次;
④将脾细胞重悬于10ml含10%胎牛血清的rpmi1640培养基中。计数后的脾细胞悬液置于6孔板中培养,每孔5ml细胞悬液;次日每孔加入250u重组鼠源il-2、β2-m以及与相对应的多肽;在37℃、5%co2培养箱中培养5d,收获后作为效应细胞,进行elispot和ldh检测。elispot和ldh检测方法同前面体外免疫实验所用方法,elispot法检测结果如图3所示,ldh法检测结果如图4所示。
hla-a2.1/kb转基因小鼠血清中ifn-γ酶联免疫分析(elisa)
在转基因小鼠脱颈处死之前,用眼球取血的方法取各组免疫小鼠静脉血,室温静置2-4h后,3000rpm离心10分钟取上层血清,标记好后-80℃保存。elisa法检测小鼠血清中ifn-γ抗体水平,结果比较如图5所示。
序列表
<110>漯河医学高等专科学校
<120>靶向akap3的亲和肽p296
<160>1
<210>1
<211>9
<212>prt
<213>人工合成
<400>1
metmetvalserilemetlysthrleu
15
- 还没有人留言评论。精彩留言会获得点赞!