一种猪血的酶解方法与流程
1、技术领域
本发明属于猪血的加工、利用领域,具体涉及一种猪血的酶解方法。
2、
背景技术:
我国是一个畜牧业大国,随着畜禽养殖的迅猛发展,副产物随之大量增加,这些副产物的深加工必须跟上养殖业的发展步伐,才能提高畜禽养殖的经济效益,减少资源浪费,促进畜牧产业持续、快速、健康、稳定地发展。因此,加强畜禽副产物的开发利用具有十分重要的意义。畜禽副产物的开发利用主要包括对畜禽的血液、骨、内脏、皮毛、蹄等的综合加工利用。目前,利用畜禽的副产品进行生化制药,已发展成与现代生物科技紧密结合的一项高科技产业,如何发展更多高科技含量高、附加值高的畜禽副产品利用项目,已成为畜禽副产品研究、开发的重点。因饮食习惯等原因,猪肉是我国居民消费量最多的一类肉。而猪血是一个巨大的动物蛋白资源库,但目前猪血的利用率不高,许多猪血资源白白流失,这不仅是巨大的浪费,同时对环境也造成了一定的污染。如何更好地开发猪血资源,使其丰富的营养得到更充分的利用,同时最大限度地减少对环境的污染,是摆在我们面前的一个课题。因此利用现代高新技术,开发具有高附加值的猪血产品,进一步提高猪血的利用率,对动物血液制品的工业化和生态环境的保护都具有重要意义。
猪血富含蛋白质和氨基酸,以及适量的矿物质、维生素、激素、酶类和其它一些生物活性物,是一种高蛋白、低脂肪、低糖而微量元素含量丰富的食品工业副产品,素有“液态肉”之称。猪血作为猪肉消费量逐年增加的大宗副产物,是制备生物活性肽的良好经济来源;研究表明猪血血红蛋白肽具有提高免疫力、降血压血脂、调节胃肠和抗氧化等功能,在食品、饲料、医药等领域显示出良好的应用前景。
发明专利申请cn201110068741.x公开了一种猪血球蛋白酶解物的生产方法,包括以下步骤:(1)采集:取新鲜猪血加入猪血体积4.5‰-6.0‰的抗凝剂抗凝;(2)分离:将抗凝后的猪血用管式分离机进行分离,分离出血浆液和血球液;(3)溶血:将上述血球液加0.8-2.5倍水稀释得到血球溶解液,在低渗情况下使红细胞膜破裂释放出血红蛋白;(4)酶解:向上述血球溶解液中添加血球液重量2.0‰-6.0‰的动物蛋白水解酶进行酶解反应得到酶解液;(5)离心:分别使用三足离心机及管式固液分离机对上述酶解液进行离心,得到上清液,去掉残渣;(6)脱色:将上述上清液进行脱色,得到脱色液;(7)离心:分别使用三足离心机、管式固液分离机对上述脱色液进行离心,取除活性炭得到上,清液;(8)喷雾干燥:将离心得到的上清液进行喷雾干燥即得到最终的成品。该制备方法复杂,步骤长。
时亚文等.猪血红蛋白的酶解工艺研究.食品与药品,2013,15(6):390公开了猪血红蛋白的酶解工艺研究,公开了血红蛋白酶解液的制备方法:新鲜血细胞液进行溶血后酶解,然后酶灭活,再进行离心制得血红蛋白酶解液。用组合酶ⅰ(蛋白酶f与蛋白酶p)和组合酶ⅱ(蛋白酶f与蛋白酶n)同步酶解猪血红蛋白。研究表明,组合酶ⅰ的最佳酶解条件为:酶添加量0.2%,温度50℃,料水比1:1.25,ph7.5,水解时间20h;组合酶ⅱ的最佳酶解条件为:酶添加量0.24%,温度50℃,料水比1:1.75,ph8.0,酶解时间20h。该方法既没有公开使用何种蛋白酶,且酶解的时间长,长达20h。
3、
技术实现要素:
本发明提供了一种新的猪血的酶解方法,该方法在猪血红细胞破碎处理方式的基础上,用酶法制备猪血红蛋白酶解产物,该方法简单、易操作,制得的酶解产物抗氧化活性好。
为了达到上述目的,本发明采用以下技术方案:
本发明要求保护一种猪血的酶解方法,所述的酶解方法为:
(1)猪血红细胞的制备
取新鲜猪血并加入抗凝血剂,于4℃保存;然后冷冻离心,得血红球和血浆;去血浆收集血红球并加入抗凝血剂搅拌混匀,再冷冻离心,去上清液取沉淀,即得猪血红细胞,于-18℃冷冻保存备用;
(2)猪血红蛋白酶解物的制备
取猪血红细胞,按10%的细胞浓度加入碱性蛋白酶的磷酸缓冲液,冰浴中超声破碎处理,后水浴加热,然后加蛋白酶水解,灭酶,后将水解物于4000r/min冷冻离心10min,上清液即为猪血红蛋白酶解产物。
本发明所述的超声破碎处理时间为5min,超声功率为300w,工作5s、间隔5s。
本发明所述的蛋白酶为碱性蛋白酶、中性蛋白酶或菠萝蛋白酶,优选为碱性蛋白酶。
本发明所述的猪血红细胞的制备中:
所述的冷冻离心条件为4℃、4000r/min,离心时间为20min;
所述的新鲜猪血与抗凝血剂的重量比为19:0.5~2,优选为19:1;
所述的抗凝血剂为肝素钠、edta、草酸盐、氟化钠、柠檬酸、柠檬酸钠、磷酸二氢钠、六偏磷酸钠的一种或多种组成,优选为由柠檬酸、柠檬酸钠、磷酸二氢钠组成。
本发明所述的柠檬酸、柠檬酸钠、磷酸二氢钠的重量比为1:5~8:4~7,优选为1:7.5:5。
本发明所述猪血红蛋白酶解物的制备中:
所述的碱性蛋白酶的浓度为5%~7%,优选为6%;
所述的碱性蛋白酶的磷酸缓冲液的ph为7.0~8.5,优选为8.0;
所述的水浴加热温度为50℃~60℃,优选为55℃;
所述的碱性蛋白酶的水解时间为1h~6h,优选为1h。
本发明进一步要求保护一种猪血的酶解方法,所述的酶解方法为:
(1)猪血红细胞的制备:取新鲜猪血并按19∶1比例迅速加入5g/l浓度的抗凝血剂即柠檬酸:柠檬酸钠:磷酸二氢钠=1:7.5:5后,于4℃保存;然后在4℃、4000r/min条件下高速冷冻离心20min,得血红球和血浆;去血浆收集血红球并加入一倍体积的抗凝血剂,搅拌混匀,再于4℃、4000r/min条件下离心20min,去上清液取沉淀,即得血红细胞,于-18℃冷冻保存备用;
(2)猪血红蛋白酶解物的制备:称取一定量的血红蛋白,按10%的细胞浓度加入6%碱性蛋白酶的磷酸缓冲液,磷酸缓冲液的ph为8.0,冰浴中超声破碎5min,超声功率为300w,工作5s、间隔5s,后水浴加热至55℃,然后加蛋白酶水解1h,灭酶,后将水解物于4000r/min冷冻离心10min,上清液即为猪血红蛋白酶解产物。
本发明具有以下优点:
(1)本发明可以解决动物屠宰时动物血液对环境的污染,提高了蛋白质资源的利用率。
(2)可以利用本发明对猪血进一步开发和利用,提高产品的附加值,为开发具有功能性的活性肽、促进我国猪血资源的进一步开发和利用具有重要的理论和实践指导意义,同时也有利于提高肉类工业的行业利润,对实现猪血资源深加工的工业化开发和生产具有重要的意义。
(3)本发明采用了柠檬酸:柠檬酸钠:磷酸二氢钠(1:7.5:5)作为抗凝剂,抗凝效果好。
(4)本发明采用了冰浴超声破碎处理的方法,红细胞破碎效果好。
(5)本发明采用碱性蛋白酶对猪血红蛋白进行水解,抗氧化性活性效果较好,最大值达91.25%。
(5)本发明酶解方法简单、易操作,适合放大生产。
(6)本发明制得的酶解产物抗氧化活性好,对dpph(二苯基苦酰肼基自由基)清除率为96.94%。
4、附图说明
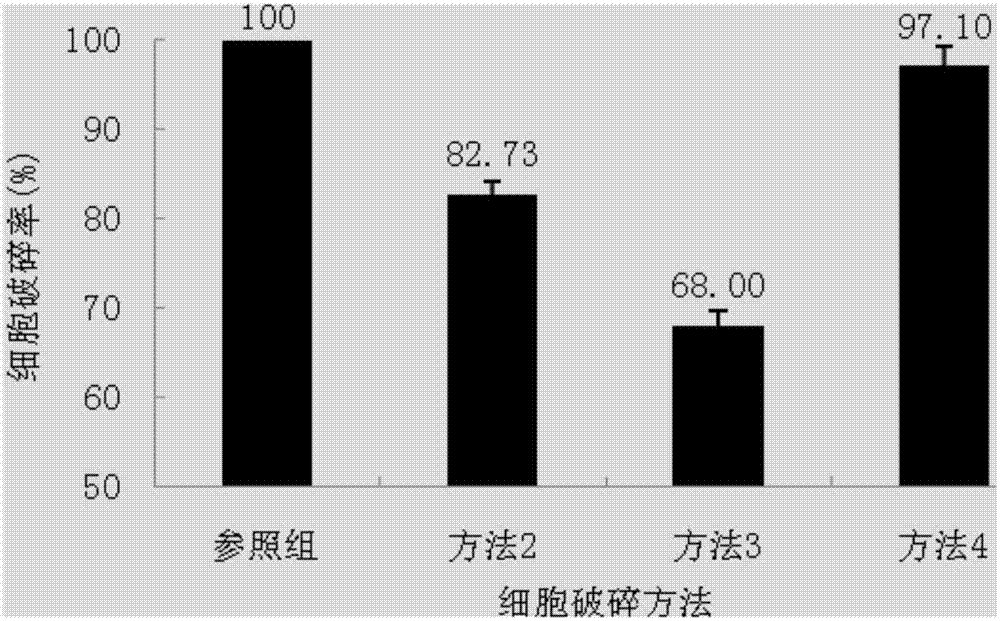
图1为不同破碎处理方法的细胞形态,图1a为破碎方法1,图1b为破碎方法2,图1c为破碎方法3,图1d为破碎方法4;
图2为不同处理方法的细胞破碎率;
图3为不同酶解物的dpph清除率;
图4为酶解温度对dpph清除率的影响;
图5为ph对dpph清除率的影响;
图6为酶用量对dpph清除率的影响。
5、具体实施方式
以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下实施例。
实施例1猪血红蛋白酶解产物的制备
1、猪血红细胞的制备
取新鲜猪血并按19∶1比例迅速加入5g/l浓度的抗凝血剂(柠檬酸:柠檬酸钠:磷酸二氢钠=1:7.5:5)后,于4℃保存;然后在4℃、4000r/min条件下高速冷冻离心20min,得血红球和血浆;去血浆收集血红球并加入约一倍体积的抗凝血剂,搅拌混匀,再于4℃、4000r/min条件下离心20min,去上清液取沉淀,即得血红细胞,于-18℃冷冻保存备用。
2、猪血红蛋白酶解物的制备
称取一定量的猪血红细胞,按10%(w/v,细胞浓度)加入6%碱性蛋白酶的磷酸缓冲液,磷酸缓冲液的ph为8.0,冰浴中超声破碎(300w)处理5min(工作5s、间隔5s),后水浴加热至55℃,然后加蛋白酶水解1h,灭酶,后将水解物于4000r/min冷冻离心10min,上清液即为猪血红蛋白酶解产物。
实施例2抗凝剂对猪血的抗凝效果
组合1:柠檬酸:柠檬酸钠:磷酸二氢钠=1:5:7;
组合2:柠檬酸:柠檬酸钠:磷酸二氢钠=1:8:7;
组合3:柠檬酸:柠檬酸钠:磷酸二氢钠=1:5:4;
组合4:柠檬酸:柠檬酸钠:磷酸二氢钠=1:8:4;
组合5:柠檬酸:柠檬酸钠:磷酸二氢钠=1:7.5:5;
将上述抗凝血剂分别与新鲜猪血(1:19)充分混合,于室温和4℃下保存24h和48h后观察抗凝效果。
实验结果表明,组合5在常温和冷藏条件下的抗凝效果均最佳,具体结果见下表1。
表1不同抗凝剂对猪血的凝固效果
实施例3不同破碎处理方法对猪血红细胞形态的影响
实验方法:
(1)方法1(参照组):取猪血红细胞,按10%(w/v,细胞浓度)将其加入生理盐水中混匀,取1ml生理盐水进行10倍梯度稀释;
(2)方法2:取猪血红细胞,按10%(w/v,细胞浓度)将其加入生理盐水中混匀,取80ml于-18℃冷冻2h,然后于40℃水浴保温超声解冻5min;
(3)方法3:取猪血红细胞,按10%(w/v,细胞浓度)将其加入生理盐水中混匀,取80ml用高速分散器10000r/min均质5min;
(4)方法4:取猪血红细胞,按10%(w/v,细胞浓度)将其加入生理盐水中混匀,取80ml冰浴中超声细胞破碎(300w)处理5min(工作5s、间隔5s)。
实验结果:图1a、图1b、图1c和图1d分别对应上述四种方法。图1a中可见完整的猪血红细胞呈圆形,计得细胞数1.85×109个/ml;图1b中的猪血红细胞呈近圆形或不规则,细胞破碎情况较严重,测得细胞数3.2×108个/ml,破碎率为82.73%;图1c中的猪血红细胞呈近圆形或不规则,部分细胞保持完整,测得细胞数为5.90×108个/ml,破碎率68.00%。图1d中的猪血红细胞形状不规则,红细胞破损严重,测得细胞数5.0×106个/ml,破碎率97.10%。
实施例4不同的蛋白酶对dpph(二苯基苦酰肼基自由基)清除率的影响
实验方法:
(1)猪血红蛋白酶解产物的制备:选用碱性蛋白酶(alkalineproteinase)、中性蛋白酶(neutralprotease)和菠萝蛋白酶(bromelain)进行猪血红蛋白的酶解:称取一定量的血红细胞,按10%(w/v,细胞浓度)加入蛋白酶对应的最适ph的磷酸缓冲液,冰浴中超声破碎(300w)处理5min(工作5s、间隔5s),后水浴加热至50℃,然后加蛋白酶水解1h,灭酶,后将水解物于4000r/min冷冻离心10min,上清液即为猪血红蛋白酶解产物。
(2)dpph自由基清除率的测定:取2ml的水解液,加入2ml新配置浓度为1×10-4mol/l的dpph溶液,摇匀,室温避光条件下反应30min,517nm处测定吸光值。空白试样不加入样品或dpph溶液,分别用等体积无水乙醇代替。
dpph清除率按下列公式计算:dpph清除率/%=100%[1-(a1-a2)/a3]
式中:a1为样品组,加入样品和dpph溶液时的吸光度;a2为空白组,加入样品,但不加入dpph溶液时的吸光度;a3为对照组,不加样品,加入dpph溶液时的吸光度。
实验结果:
不同蛋白酶水解蛋白质时的作用位点不同,其酶解物的抗氧化活性差异较大。图3表明,中性蛋白酶解物的dpph清除率呈先增大后缓慢下降的趋势,于酶解4h后达至75.86%的最强清除效果;而菠萝蛋白酶和碱性蛋白酶酶解物的dpph清除率随酶解时间延长呈逐渐上升趋势,且可能由于碱性蛋白酶水解过程中暴露的活性位点较多,对酶解猪血红蛋白抗氧化性活性效果较好,最大值达91.25%。
实施例5猪血红蛋白酶解方法
实验方法:见实施例4。
1、温度对猪血红蛋白酶解物的dpph清除效果影响
实验条件:碱性蛋白酶进行水解,细胞浓度10%,ph8.0,酶解时间6h,酶用量5%。
实验结果:温度对猪血红蛋白酶解效果的影响如图4所示。随温度升高,酶解物dpph清除率逐渐增大,于55℃达至最高,随后开始下降;这是由于温度升高使体系内能增大,分子运动加剧,酶与底物的接触更为充分,催化效率增强,使猪血红蛋白降解产生的具有dpph清除作用的分解物增多。但过高的温度易降低酶活,甚至完全失活。
2、ph对猪血红蛋白酶解物的dpph清除效果影响
溶液体系ph的变化会影响蛋白酶自身的解离和底物的解离,从而对酶解反应表现出较大影响。从图5可看出,碱性蛋白酶在ph8.0降解猪血红蛋白时产生的可清除dpph自由基的产物最多,继续增大体系ph,酶解物的dpph清除能力降低。但值得注意的是,ph对猪血红蛋白酶解物的dpph清除效果影响相比其它因素要缓和,这可能是因为碱性蛋白酶对碱性环境有较强的适应性,体系ph变化对其酶解能力不会有太大影响。
3、酶量对猪血红蛋白酶解物的dpph清除效果影响
酶的专一性表现出其底物特异性和作用位点的不同。酶用量较小时,可作用于底物位点少,对底物的水解度不充分,不利于猪血红蛋白中抗氧化活性的肽类物质生成;酶用量过大时,会影响酶解产物的浓度,同样也会造成酶解肽类的抗氧化活性降低。从图6可看出,酶量小于6%时,猪血红蛋白酶解产物的dpph清除率随酶量增加而相应增大,而继续增大酶量后的酶解产物的dpph清除率下降;故本实验确定加酶量以6%为宜。
实施例6优化实验
在单因素试验基础上,采用box-behnken响应面法进行猪血红蛋白的酶解条件优化:各因子编码值及试验结果见表2。
表2box-beknhen中心组合试验设计方案及实验结果
由表2结果可看出:5组零水平中心试验点条件(即酶解温度55℃、ph8.0、酶用量6%)下的酶解产物的dpph清除率相对最高,平均值达94.95%,说明经碱性蛋白酶降解猪血红蛋白所得的肽类物质有较好的dpph清除效果。
1、回归模型的建立及可靠性检验
对表1中的17个实验点响应值进行回归拟合,得回归模型方程:y=94.55+6.28x1-0.60x2+2.44x3-3.25x1x2-0.18x1x3-1.06x2x3-5.74x12-3.43x22-3.34x32
上述回归模型的可靠性可通过方差分析及相关系数来考察,方差分析如表2所示。
表2回归模型方差分析结果
注:*表示差异显著(p<0.05);**表示差异极显著(p<0.01)。
回归方程中各变量对指标(响应值)影响的显著性由f检验来判定,概率(p)越小,则相应变量的显著程度越高。表2结果显示:此模型的p<0.0001,响应面回归模型达到极显著水平;方程复相关系数的平方r2为0.9862,说明回归效果较好,98.62%的变化能通过该模型解释。同时,一次项x1、x3,交互项x1x2,二次项x12、x22、x32对酶解产物的dpph自由基清除率均有显著影响;且回归方程中一次项系数的绝对值大小说明实验中温度对酶解产物的dpph清除率影响最大,其次是酶量,ph值影响则最小。
2、酶解条件的优化与验证
对回归模型分析可得到猪血红蛋白的最佳酶解条件为:酶解温度58.37℃,ph7.76,加酶量6.42%,此时预测的酶解产物dpph清除率可达97.32%。为酶解条件优化验证的便利,选择条件为温度58℃,ph7.7,加酶量6.5%进行3次实验,测得酶解产物dpph清除率为96.94%,与预测值97.32%接近,相对误差为0.39%,说明试验结果与模型拟合良好,适于对猪血红蛋白的碱性蛋白酶解条件进行回归分析和参数优化。
- 还没有人留言评论。精彩留言会获得点赞!