抗菌肽的多聚体形式的制作方法
本发明涉及具有抗菌特性的肽的新型多聚体形式。本发明还涉及制备这些多聚体的方法。本发明涉及这些多聚体用于抑制广谱微生物的生长的用途。本发明还涉及包含这些肽的组合物。
背景技术:
防御素为阳离子抗菌肽,并且是先天免疫系统的组分。在人体中,α防御素由嗜中性粒细胞或肠道的帕内特细胞(panethcell)产生,而β防御素则由上皮细胞产生。防御素具有针对革兰氏阴性和革兰氏阳性细菌、某些真菌以及包膜病毒的广谱抗菌特性。
所述抗菌特性的确切机制未被完全了解,但是在其相互作用和对微生物细胞壁和细胞膜的破坏中,所述肽的疏水性和净正电荷似乎是重要的。
数项研究表明,全长防御素在细菌膜处可形成二聚体,但是是非共价形式的(hoover等人,2000;hoover等人,2001schibili等人,2002),以及一项研究表明二聚作用可影响抗菌特性(campopiano等人,2004)。然而,这些二聚体的特性并未被详细研究或表征。
抗生素抗药性的发展在抗生素的发展中是个挑战。虽然防御素的抗菌活性未被完全了解,防御素可能的作用方式表明微生物的抗药性可很慢地或最低限度地发展,使用防御素作为抗菌剂的潜力是非常有前景的。然而,已知防御素对于宿主细胞(包括哺乳动物细胞)具有毒性,这可能限制它们作为抗菌剂的应用。
因此,期望开发具有高的抗菌活性和低的宿主细胞毒性的防御素的新型肽衍生物。
技术实现要素:
本发明涉及衍生自hbd3(seqidno:1)的分离的多聚体。
hbd3(seqidno:1)
giintlqkyycrvrggrcavlsclpkeeqigkcstrgrkccrrkk
根据第一个方面,本发明涉及通式为(u)n的防御素肽的分离的多聚体,其中,u是包含seqidno:2或者其片段或变体的肽,并且n≥2。
seqidno:2
giintlqkyyxrvrggrxavlsxlpkeeqigkxstrgrkxxrrzz
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。例如,z可包括但是不限于赖氨酸、鸟氨酸或精氨酸。具体地,z可以是赖氨酸。
根据另一个方面,本发明涉及一个分离的多聚体,所述分离的多聚体包含一个肽u的至少两个单元,其中,肽u包含seqidno:2或其片段或变体。
肽u在所述多聚体中重复。具体地,所述重复的肽u被共价连接在一起。此外,可通过至少一个氨基酸b将所述肽u连接在一起。每个b可以是具有至少两个胺基的氨基酸。例如,每个b可包括但不限于赖氨酸、鸟氨酸或精氨酸。
根据本发明的任何多聚体中的所述重复单元或所述肽u可以是wo2007/126392中描述的任何肽。
所述肽u可以包括衍生自seqidno:2的肽片段。所述片段可以是衍生自seqidno:2的任何长度的片段。具体地,所述肽u可包含seqidno:3或其片段或变体。
seqidno:3
giintlqkyyxrvrggrxavlsxlpkeeqigkxstrgrkxxrr
x包括任何氨基酸。
所述多聚体的肽u可以具有+1至+11的电荷。
根据另一个方面,本发明涉及式(u)nbmzj的分离的多聚体,其中u包含seqidno:3或其片段或变体,每个b包含至少一个氨基酸残基,所述至少一个氨基酸残基含有至少两个胺基,z包括任何氨基酸,n≥2,m≥1且j≥0。b可包括具有至少两个胺基的一个氨基酸。具体地,每个b包括但不限于赖氨酸、鸟氨酸或精氨酸。
根据本发明的一个方面,(u)nbmzj中的所述b和z可均包含赖氨酸(k),且所述通式可以被表达为(u)nkmkj。根据另一个方面,m也可以等于数字n-1,且j可等于1,同时所述多聚体的通式可被表达为(u)nkn-1k或(uk)n。(u)nkmkj或(u)nkn-1k中的肽u可包含seqidno:3或其片段或变体。
本发明中的多聚体可以是线性的或分支的。如果所述多聚体(u)n是线性的,重复了n次的肽u可包含seqidno:2或者seqidno:2的任何片段或变体。
对于分支的多聚体,例如多聚体(u)nbmzj,所述多聚体可以在末端bmzj残基处是分支的。
根据本发明的多聚体可包含任何数量的肽u的重复单元。例如,所述多聚体可包含2至10、2至20、2至30个肽u的重复单元。另外,所述多聚体可以是二聚体、三聚体、四聚体、五聚体、六聚体、七聚体、八聚体、九聚体和十聚体。具体地,n可以是偶数。更具体地,n可包含从2开始并以2的倍数增加的任何数字。
此外,所述多聚体的任何氨基酸残基可包含具有至少一个保护基团的氨基酸。所述保护基团可包括boc、but、fmoc、pbf或任何其他保护基团。
本发明还涉及制备本发明的至少一种多聚体的方法。
相应地,本发明涉及制备至少一个通式为(u)n的多聚体方法,其中u是包含seqidno:2或其片段或变体的肽,所述方法包括将u的至少两个单元连在一起。
本发明的多聚体还可通过重组dna技术制备。本发明的多聚体的任何部分或全部可通过重组dna技术制备。例如,所述肽单体可通过重组dna技术分别合成,然后通过化学方法连接在一起以形成多聚体。
相应地,本发明还涉及编码本发明的多聚体的部分或全部的分离的核酸分子。所述核酸分子可被插入到载体中。此外,所述核酸分子或包含所述核酸分子的载体均可被引入宿主细胞中,以表达本发明的多聚体的任何部分或全部。
本发明的多聚体还可通过化学合成重新制备。例如,本发明的多聚体可通过本发明的固相肽合成(spps)法制备。
本发明还涉及制备至少一个通式为(u)nbmzj的多聚体的方法,其中u包含seqidno:3或其片段或变体,每个b包含含有至少两个胺基的一个氨基酸,z包括任何氨基酸且n≥2,m≥1和j≥0。
(i)提供至少一个固相;
(ii)将至少第一个氨基酸z与所述固相偶联;
(iii)将至少一个经保护的氨基酸残基b与所述经偶联的第一氨基酸残基相连;
(iv)从所连的b残基上去除所述保护基团;
(v)根据所述肽u以从c末端至n末端的顺序的序列,通过连接经保护的氨基酸残基提供另外的链延伸,其中在每次连接之后,为了下一次连接而去除所述保护基团;和
(vi)取决于要添加的残基的数目终止氨基酸残基的连接。
所述经保护的氨基酸b包含至少两个经保护基团保护的侧链。具体地,每个b包括但不限于赖氨酸、鸟氨酸或精氨酸。首先与固相偶联的所述氨基酸z也可以是,但不限于赖氨酸、鸟氨酸或精氨酸。
所述方法可以扩展至制备其它多聚体。例如,所述制备其它多聚体的扩展的方法包括在步骤(iv)之后还包括,
(iv)(a)将其它经保护的b残基与已连接的b残基相连;
(iv)(b)去除(iv)(a)中的b残基的保护基团;
(iv)(c)重复步骤(iv)(a)和(iv)(b),或者
(iv)(d)进行步骤(v)和(vi)。
所形成的多聚体取决于b中的胺基数目。如果b中的胺基数目为2(例如在赖氨酸(k)或鸟氨酸中),所述经扩展的方法可制备从之前的多聚体以2的倍数增加的多聚体。从所述经扩展的方法形成的多聚体将为4、8、16、32、64等等。
如果b是具有3个胺基(两个伯胺基团和一个仲胺基团)的精氨酸(r),所形成的第一个多聚体将是三聚体。利用精氨酸随后形成的多聚体将以3的倍数增加。
对于每一轮多聚化而言,赖氨酸或鸟氨酸与精氨酸的组合或反之可被用于b,且可产生具有不同的重复单元数目的多聚体。
在完成多聚体的合成之后,可将所述多聚体从固相上释放。
附图说明
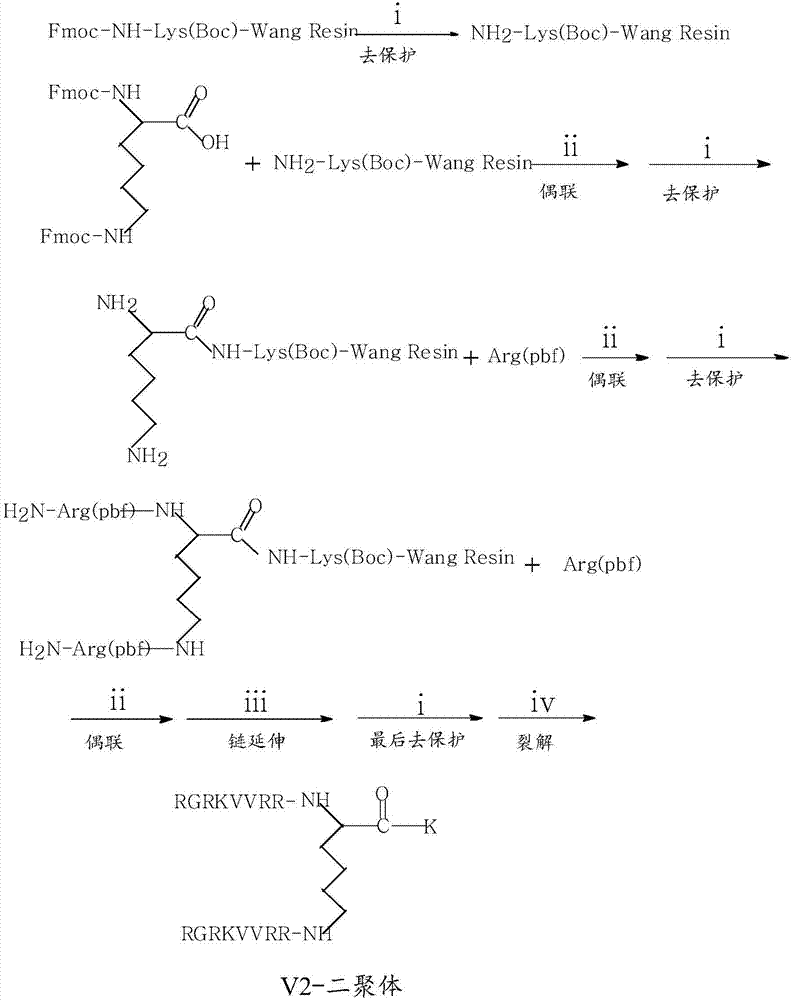
图1:示意经保护的赖氨酸残基lys(fmoc)、v2单体和v2二聚体的结构。粗体的赖氨酸(k)残基显示在合成过程中并入的lys(fmoc)的位置。
图2:表明了通过固相肽合成(spps)合成v2二聚体。
步骤(i)表明使用20%哌啶的dmf(n,n-二甲基甲酰胺)的去除保护基团。
步骤(ii)表明使用0.5mhbtu(n-[1h-苯并三唑-1-基]-(二甲基氨基)亚甲基)-n-甲基甲铵),0.5mhobt(n-羟基苯并三唑),2mdiea(二异丙基乙胺)的nmp(n-甲基吡咯烷酮)的偶联反应。
fmoc(lys)与结合在树脂上的赖氨酸残基偶联。重复步骤(i)。然后将两个精氨酸残基(r)加到每条链上。
步骤(iii)表明链延伸,包括使用0.5mhbtu/0.5mhobt/2mdiea的六个spps循环,以并入v2二聚体的剩余氨基酸。
步骤(iv)表明用于从所述树脂释放所述二聚体的裂解反应,所述裂解反应使用裂解剂90%tfa(三氟乙酸)、5.0%苯酚,1.5%水,1.0%tis(三异丙基硅烷),2.5%edt(乙二硫醇)。
在所述二聚体中重复rgrkvvrr(seqidno:44)。
图3:表明所述spps方法可用于形成以2的倍数增加的多聚体。例如,可产生二聚体、四聚体、八聚体和其中单体单元的数量以2的倍数增加的其它多聚体。粗斜体的赖氨酸(k)残基显示在合成过程中并入的lys(fmoc)的位置。
图3中的序列为:
rgrkvvrrkk(seqidno:45)
rgrkvvrr(seqidno:46)
图4:的图表明与天然hbd3相比,所述v2二聚体对人结膜上皮细胞不显示细胞毒性。所述结果来自四个单独的实验,且数据点显示平均值和标准偏差。x轴表明以g/ml表示的肽浓度,y轴表明细胞存活百分比。
图5:表明野生型hbd3及其c-末端肽在兔红血球上的溶血效果。
图6:表明野生型hbfd3及其c-末端肽在人结膜上皮细胞上的细胞毒性效果。
图7:表明制备杂二聚体的方法的示例。
图7中的序列为:
rgrkvvrr(seqidno:44)
rgrkvvrrvv(seqidno:46)
图8:图8表明制备杂四聚体的方法的示例。
图8中的序列为:
rrvvkrgrk(seqidno:58)
rgrkvvrr(seqidno:44)
rgrkvvrrvv(seqidno:46)
图9:表明均四聚体的方法的示例。
定义
当在肽序列或式中出现x时,x代表任何氨基酸,包括经保护的半胱氨酸残基,包括但不限于c(acm)、c(but)、c(cam)、c(t-buthio)、c(bzl)、c(4-meo-bzl)和c(mmt)。
肽或多聚体的变体指肽序列(或所述多聚体)中的变化,其中一个或多个氨基酸可被其它氨基酸取代。所述取代通常是保守的,例如利用具有相似性质的氨基酸。所述变体通常保留+1至+11的净电荷。所述变体通常是有活性的,并且具有良好的抗菌性和低细胞毒性。
经保护的氨基酸是这样的氨基酸:用惰性分子修饰其一个或多个反应基团以降低和/或防止所述反应基团的化学反应。
具体实施方式
根据第一个方面,本发明涉及通式为(u)n的防御素肽的分离的多聚体,其中,u是包含seqidno:2或者其片段或变体的肽,并且n≥2。
seqidno:2
giintlqkyyxrvrggrxavlsxlpkeeqigkxstrgrkxxrrzz
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。例如,z可包括但是不限于赖氨酸、鸟氨酸或精氨酸。具体地,z可以是赖氨酸。
根据另一个方面,本发明提供一个分离的多聚体,所述分离的多聚体包含一个肽u的至少两个单元,其中,肽u包含seqidno:2或其片段或变体。
肽u在所述多聚体中重复。具体地,所述重复的肽u被共价连接在一起。此外,可通过至少一个氨基酸b将所述肽u连接在一起。b可包括具有至少两个胺基的氨基酸。例如,每个b可包括但不限于赖氨酸、鸟氨酸或精氨酸。
根据本发明的任何多聚体中的所述重复单元或所述肽u可以是wo2007/126392中描述的任何肽。
所述肽u可以包括衍生自seqidno:2的肽片段。所述片段可以是衍生自seqidno:2的任何长度的片段。具体地,所述肽u可包含seqidno:3或其片段或变体。
seqidno:3
giintlqkyyxrvrggrxavlsxlpkeeqigkxstrgrkxxrr
x包括任何氨基酸。
所述多聚体的肽u可以具有+1至+11的电荷。
此外,所述肽u可还可以进一步包含seqidnos:4至58中的任一个或其片段或变体。
seqidno:4(衍生自hbd3c末端的38个氨基酸的肽)
kyyxrvrggrxavlsxlpkeeqigkxstrgrkxxrrzz
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。
seqidno:5(衍生自hbd3c末端的36个氨基酸的肽)
yxrvrggrxavlsxlpkeeqigkxstrgrkxxrrzz
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。
seqidno:6(衍生自hbd3c末端的40个氨基酸的肽)
lqkyyxrvrggrxavlsxlpkeeqigkxstrgrkxxrrzz
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。
seqidno:7(衍生自hbd3c末端的29个氨基酸的肽)
rxavlsxlpkeeqigkxstrgrkxxrrzz
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。
seqidno:8
keeqigkxstrgrkxxrrzz(衍生自hbd3c末端的20个氨基酸的肽)
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。
seqidno:9
kxstrgrkxxrrzz(衍生自hbd3c末端的14个氨基酸的肽)
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。
seqidno:10(衍生自hbd3氨基酸8-26的19个氨基酸的肽)
kyyxrvrggrxavlsxlpk
x包括任何氨基酸
seqidno:11
giintlqkyyxrvrggr(衍生自hbd3n末端的17个氨基酸的肽)
x包括任何氨基酸
seqidno:12(衍生自全长hbd3的肽,用w代替c)
giintlqkyywrvrggrwavlswlpkeeqigkwstrgrkwwrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:13(衍生自全长hbd3的肽,用f代替c)
giintlqkyyfrvrggrfavlsflpkeeqigkfstrgrkffrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:14(衍生自全长hbd3的肽,用y代替c)
giintlqkyyyrvrggryavlsylpkeeqigkystrgrkyyrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:15(衍生自全长hbd3的肽,用s代替c)
giintlqkyysrvrggrsavlsslpkeeqigksstrgrkssrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:16(衍生自全长hbd3的肽,用a代替c)
giintlqkyyarvrggraavlsalpkeeqigkastrgrkaarrzz
z包括任何氨基酸或可以是不存在的。
seqidno:17(衍生自全长hbd3的肽,用c(acm)代替c)
giintlqkyyc(acm)rvrggrc(acm)c(acm)vlsalpkeeqigkc(acm)strgrkc(acm)c(acm)rrzz
z包括任何氨基酸或可以是不存在的。
seqidno:18(衍生自全长hbd3的肽,用c(but)代替c)
giintlqkyyc(but)rvrggrc(but)c(but)vlsalpkeeqigkc(but)strgrkc(but)c(but)rrzz
z包括任何氨基酸或可以是不存在的。
seqidno:19(衍生自全长hbd3的肽,用c(t-buthio)代替c)
giintlqkyyc(t-buthio)rvrggrc(t-buthio)c(t-buthio)vlsalpkeeqigkc(t-buthio)strgrkc(t-buthio)c(t-buthio)rrzz
z包括任何氨基酸或可以是不存在的。
seqidno:20(衍生自全长hbd3的肽,用c(bzl)代替c)
giintlqkyyc(bzl)rvrggrc(bzl)c(bzl)vlsalpkeeqigkc(bzl)strgrkc(bzl)c(bzl)rrzz
z包括任何氨基酸或可以是不存在的。
seqidno:21(衍生自全长hbd3的肽,用c(4-mebzl)代替c)
giintlqkyyc(4-mebzl)rvrggrc(4-mebzl)c(4-mebzl)vlsalpkeeqigkc(4-mebzl)strgrkc(4-mebzl)c(4-mebzl)rrzz
z包括任何氨基酸或可以是不存在的。
seqidno:22(衍生自全长hbd3的肽,用c(4-meobzl)代替c)
giintlqkyyc(4-meobzl)rvrggrc(4-meobzl)c(4-meobzl)vlsalpkeeqigkc(4-meobzl)strgrkc(4-meobzl)c(4-meobzl)rrzz
z包括任何氨基酸或可以是不存在的。
seqidno:23(衍生自全长hbd3的肽,用c(mmt)代替c)
giintlqkyyc(mmt)rvrggrc(mmt)c(mmt)vlsalpkeeqigkc(mmt)strgrkc(mmt)c(mmt)rrzz
z包括任何氨基酸或可以是不存在的。
seqidno:24(衍生自全长hbd3的肽,用经修饰的c代替c)
giintlqkyyxrvrggrxxvlsalpkeeqigkxstrgrkxxrrzz
x包括c(acm)、c(but)、c(t-buthio)、c(bzl)、c(4-mebzl)、c(4-meobzl)或c(mmt);z包括任何氨基酸或可以是不存在的。
seqidno:25(衍生自hbd3的10个氨基酸c末端片段,用任何氨基酸x代替c)
rgrkxxrrzz
x包括任何氨基酸;z包括任何氨基酸或可以是不存在的。
seqidno:26(衍生自hbd3的10个氨基酸c末端片段,用w代替c)
rgrkwwrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:27(衍生自hbd3的10个氨基酸c末端片段,用f代替c)
rgrkffrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:28(衍生自hbd3的10个氨基酸c末端片段,用y代替c)
rgrkyyrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:29(衍生自hbd3的10个氨基酸c末端片段,用l代替c)
rgrkllrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:30(衍生自hbd3的10个氨基酸c末端片段,用i代替c)
rgrkiirrzz
z包括任何氨基酸或可以是不存在的。
seqidno:31(衍生自hbd3的10个氨基酸c末端片段,用i代替c)
rgrkhhrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:32(衍生自hbd3的10个氨基酸c末端片段,用(acm)、c(but)、c(t-buthio)、c(bzl)、c(4-mebzl)、c(4-meobzl)或c(mmt)代替c)
rgrkxxrrzz
x包括c(acm)、c(but)、c(t-buthio)、c(bzl)、c(4-mebzl)、c(4-meobzl)或c(mmt);z包括任何氨基酸或可以是不存在的。
seqidno:33(衍生自hbd3的10个氨基酸c末端片段,用v代替c)
rgrkvvrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:34(衍生自hbd3的10个氨基酸c末端肽)
rgrkccrrzz
z包括任何氨基酸或可以是不存在的。
seqidno:35(衍生自hbd3的10个氨基酸c末端肽,用c(acm)、c(but)、c(t-buthio)、c(bzl)、c(4-mebzl)、c(4-meobzl)或c(mmt)代替c)
rgrkxxrrkk
x包括c(acm)、c(but)、c(t-buthio)、c(bzl)、c(4-mebzl)、c(4-meobzl)或c(mmt)。
seqidno:36(衍生自hbd3的除末端kk以外的c末端肽,用任何氨基酸代替c)
rgrkxxrr
seqidno:37(衍生自hbd3的除末端kk以外的c末端肽,用w、w2-8氨基酸代替c)
rgrkwwrr
seqidno:38(衍生自hbd3的除末端kk以外的c末端肽,用f代替c)
rgrkffrr
seqidno:39(衍生自hbd3的除末端kk以外的c末端肽,用y、y2-8氨基酸代替c)
rgrkyyrr
seqidno:40(衍生自hbd3的除末端kk以外的c末端肽,用l代替c)
rgrkllrr
seqidno:41(衍生自hbd3的除末端kk以外的c末端肽,用i代替c)
rgrkiirr
seqidno:42(衍生自hbd3的除末端kk以外的c末端肽,用h代替c)
rgrkhhrr
seqidno:43(衍生自hbd3的除末端kk以外的c末端肽,用c(acm)、c(but)、c(t-buthio)、c(bzl)、c(4-mebzl)、c(4-meobzl)或c(mmt)代替c)
rgrkcxxrr
x包括c(acm)、c(but)、c(t-buthio)、c(bzl)、c(4-mebzl)、c(4-meobzl)或c(mmt)。
seqidno:44(衍生自hbd3的除末端kk以外的c末端肽,用v、v2-8氨基酸代替c)
rgrkvvrr
seqidno:45(v2单体)
rgrkvvrrkk
seqidno:46(v4单体,v4-10氨基酸)
rgrkvvrrvv
seqidno:47(y4单体,y4-10氨基酸)
rgrkyyrryy
seqidno:48(w4单体,w4-10氨基酸)
rgrkwwrrww
seqidno:49(v3单体)
rvrkvvrr
seqidno:50(v2r单体)
rrrkvvrr
seqidno:51(v2d单体)
rdrkvvrr
seqidno:52(e2单体)
rgrkeerr
seqidno:53(k2单体)
rgrkkkrr
seqidno:54
rrrrrrrrrr
seqidno:55
vvvv
seqidno:56
yyyy
seqidno:57
rrvvkrgr
seqidno:58
rrvvkrgrk
根据另一个方面,本发明涉及式(u)nbmzj的分离的多聚体,其中u包含seqidno:3或其片段或变体,每个b包含至少一个氨基酸残基,所述至少一个氨基酸残基含有至少两个胺基,z包括任何氨基酸,n≥2,m≥1且j≥0。b可包括具有至少两个胺基的一个氨基酸。具体地,每个b包括但不限于赖氨酸、鸟氨酸或精氨酸。
根据本发明的一个方面,(u)nbmzj中的所述b和z可均包含赖氨酸(k),且所述通式可以被表达为(u)nkmkj。根据另一个方面,m也可以等于数字n-1,且j可等于1,同时所述多聚体的通式可被表达为(u)nkn-1k或(uk)n。(u)nkmkj或(u)nkn-1k中的肽u可包含seqidno:3或其片段或变体。
通式(u)nbmzj、(u)nkmkj或(u)nkn-1k中的肽u可以包含seqidno:3或其片段或变体,例如,rgrkxxrr(seqidno:36)或seqidnos:37-44中的任何一个。
例如,如果m=n-1、j=1、b=z=k、u包含seqidno:44,所述多聚体具有式(seqidno:44)nkn-1k。如果n=2,所述多聚体具有式(seqidno:44)2kk。
本发明中的多聚体可以是线性的或分支的。如果所述多聚体(u)n是线性的,重复了n次的肽u可包含seqidno:2或者seqidno:2的任何片段或变体,如seqidnos:3-58中的任何一个。例如,所述多聚体可包含(seqidno:35)n、(seqidno:36)n或(seqidno:45)n。
对于分支的多聚体,例如多聚体(u)nbmzj,所述多聚体可以在末端bmzj残基处是分支的。
根据本发明的多聚体可包含任何数量的肽u的重复单元。例如,所述多聚体可包含2至10、2至20、2至30个肽u的重复单元。另外,所述多聚体可以是二聚体、三聚体、四聚体、五聚体、六聚体、七聚体、八聚体、九聚体和十聚体。
例如,对于式(seqidno:36)2bz的分支二聚体,所述分支二聚体可包含结构:
可选地,z可以是不存在,且所述二聚体可具有结构:
具体地,对于任何根据本发明的多聚体而言,x可以是v。所述v2单体具有序列rgrkvvrr(seqidno:44)。
根据另一个方面,本发明还涉及制备至少一种通式为(u)nkmzj的多聚体的方法,其中,u包含seqidno:3或其片段或变体,z包括任何氨基酸且n≥2、m≥1和j=1。
(i)提供至少一种固相;
(ii)将至少第一种氨基酸z与所述固相偶联;
(iii)将至少一个经保护的k残基与所述经偶联的第一氨基酸残基连接;
(iv)从所述已连接的k残基上去除保护基团;
(v)根据所述肽u以从c末端至n末端的顺序的序列,通过连接经保护的氨基酸残基提供另外的链延伸,其中在每次连接之后,为了下一次连接而去除所述保护基团;和
(vi)取决于要添加的残基的数目终止氨基酸残基的连接。
首先与固相偶联的所述氨基酸z也可以是任何氨基酸。例如,z可包括但不限于赖氨酸、鸟氨酸或精氨酸。
在完成多聚体的合成之后,可将所述多聚体从固相上释放。
例如,为肽序列rgrkkxxrr(seqidno:36)进行上述步骤将产生下述二聚体。粗体的赖氨酸(k)残基显示在合成过程中并入的lys(fmoc)的位置。
在所述合成方法中,z和赖氨酸残基在单体单元之间被共享。
具体地,当x是v且z是k时,产生下面的二聚体。所述二聚体是v2二聚体,(seqidno:44)2kk。
所述方法可以扩展至制备其它多聚体。例如,所述制备其它多聚体的扩展的方法包括在步骤(iv)之后还包括,
(iv)(a)将其它经保护的赖氨酸残基与所述已连接第二赖氨酸残基相连;
(iv)(b)从来自(iv)(a)的赖氨酸残基去除保护基团;
(iv)(c)重复步骤(iv)(a)和(iv)(b),或者
(iv)(d)进行步骤(v)和(vi)。
所述经扩展的方法可制备之前的多聚体以2的倍数增加的多聚体。从所述经扩展的方法形成的多聚体将为4、8、16、32、64等等。重复所述经扩展的方法的额外步骤一次,产生四聚体,如下所示。如果x是v,且b和z是k,则所述四聚体已知为v2-四聚体。在v2四聚体中的重复单元是rgrkvvrr(seqidno:44)。
此外,将所述经扩展的方法的额外步骤重复两次将产生八聚体。本发明的多聚体可排除末端的k残基。
如上所述制备的多聚体是均多聚体(均-多聚体),从而肽单体单元在所述多聚体中重复。本发明的肽多聚体可以是同二聚体、同四聚体或其他均-多聚体。
此外,所述制备方法可被扩展至制备杂多聚体,从而多聚体中的肽单元是不同的。在制备均-多聚体时,所述经保护的氨基酸b具有至少两个被相同的保护基团保护的侧链。然而,对于制备杂多聚体而言,例如,杂二聚体,可使用经区别保护的氨基酸c,其中,可用于链延伸的侧链经至少两种不同的保护基团保护。在这种情况下,可去除第一保护基团以允许从至少第一反应侧基团起的肽链延伸。在完成第一肽链延伸后,可去除另一保护基团以允许从至少第二反应侧基团起的随后的链延伸。这样,所述第一肽链和所述第二肽链可具有不同的氨基酸序列。
根据另一个方面,本发明涉及制备式[(u1)(u2)]n/2(c)n/2bmz的肽多聚体的制备方法,其中,u1和u2各自包括肽,且u1≠u2,n=2x,其中x=0或正整数,m=1或0;包括如下步骤:
(i)提供至少一个固相;
(ii)将至少第一个氨基酸z与所述固相偶联;
(iii)可选地,将至少一个氨基酸b与所述经偶联的z相连;
(iii)将至少一个经保护的氨基酸c与z或b相连;其中c包含至少两种经区别保护的基团;
(iv)从所连的氨基酸c上去除第一保护基团,以暴露第一反应侧链;
(v)向c的所述第一反应侧链提供第一肽u1的链延伸;
(vi)从所连的b氨基酸上去除第二保护基团,以暴露至少第二反应侧链;和
(viii)向c的所述第二反应侧链提供第二肽u2的链延伸。
可由此制备杂肽多聚体。
如果省略所述任选的步骤(ii),形成杂二聚体。如果进行所述可选的步骤(ii)一次,可制备杂四聚体。其他杂多聚体可通过相应地重复步骤(ii)而制备。
根据另一个方面,本发明涉及式[(u1)(u2)]n/2(c)n/2bmz的分离的肽多聚体,其中u1和u2包括肽序列且u1≠u2,c和b各包括具有至少两个胺基的氨基酸,z包括任何氨基酸,n=2x,其中x=0或正整数,m=1或0。
c,b和z可各包括但不限于赖氨酸(k)、鸟氨酸或精氨酸(r)。
具体地,u1或u2各自可以是包含序列seqidno:2或其片段或变体的肽。
u1可包括但不限于seqidno:1至58中的任何一个。
u2可包括但不限于seqidno:1至58中的任何一个。
如果n=2且m=1,所述多聚体是通式[(u1)(u2)]cz的杂二聚体。
例如,u1可包含rgrkvvrr(seqidno:44)且u2可包含rgrkvvrrvv(seqidno:46),c和z为k,m=0,n=2。所述杂二聚体的结构包括:
例如,u1可包含rrrrrrrrrr(seqidno:54)且u2可包含vvvv(seqidno:
55),c和z为k,m=0,n=2。所述杂二聚体的结构包括:
例如,u1可包含rrrrrrrrrr(seqidno:54)且u2可包含yyyy(seqidno:56),c和z为k,m=0,n=2。所述杂二聚体的结构包括:
如果n=4且m=1,则所述杂多聚体为杂四聚体。杂聚体可以是式[(u1)(u2)]2(c)2b1z。
本发明的方法还可扩展至合成其它多聚肽,例如三聚体。同三聚体和杂三聚体均可被合成。
一种制备通式为u3u2cu1z的肽三聚体的方法,其中,u1、u2和u3各自包含肽,c包括含有至少两个胺基的氨基酸,且z包含任何氨基酸,所述方法包括步骤:
(i)提供至少一个固相;
(ii)将至少第一个氨基酸z与所述固相偶联;
(iii)向z提供肽u1的链延伸;其中,(a)所述肽三聚体为通式u3u2(c)u1z的杂肽,所述方法还包括:
(iv)将经区别保护的氨基酸c与肽u1的氨基酸相连;
(v)从所连的氨基酸c上去除第一保护基团;
(vi)向氨基酸c提供肽u2的链延伸;
(vii)从所连的氨基酸c上去除第二保护基团;和
(viii)向氨基酸c提供肽u3的链延伸;
(b)u2=u3=u1,c=b,且所述肽三聚体包含式(u1)2bu1z,所述方法还包括:
(iv)将经保护的氨基酸b与肽u1的氨基酸相连;
(v)从所连的氨基酸b上去除保护基团;和
(vi)向氨基酸b提供两个肽u1的链延伸;或
(c)u2=u3≠u1,c=b,且所述肽包含通式(u2)2b(u1)z,所述方法还包括:
(iv)将经保护的氨基酸b与肽u1的氨基酸相连;
(v)从所连的氨基酸b上去除保护基团;和
(vi)向氨基酸b提供肽u2的至少两个单元的链延伸。
在上述(a)和(c)的情形中,可由此制备杂肽三聚体。
在上述(b)的情形中,可由此制备均肽三聚体。
根据另一个方面,本发明涉及通式u3u2cu1z的分离的肽三聚体;其中u1、u2、u3各自包含肽序列;c包含含有至少两个胺基的氨基酸,且z包括任何氨基酸。具体地,所述肽在氨基酸c处是分支的。
所述分离的肽三聚体的结构包括:
c,b和z可各自包括但不限于赖氨酸(k)、鸟氨酸或精氨酸(r)。
具体地,u1、u2或u3可各自包含seqidno:2或其片段或变体。
例如,u1、u2或u3可各自包含seqidno:1至58中的任何一个。对于杂肽三聚体,所述肽中的两种可包含相同的序列,而第三种肽具有不同的序列。
对于杂肽三聚体u3u2cu1z,u1、u2和u3可以是但不需要是不同的肽序列。例如,u1和u2可包含相同的序列而u3可包含不同的序列。可选地,u1和u3可包含相同的序列而u2具有相同的序列。
如果u2=u3≠u1且c=b,所述肽为通式(u2)2bu1z。
如果u1=u3≠u2,所述肽为通式u1u2cu1z。
如果u1=u2≠u3,所述肽为通式u3u1cu1z。
然而,如果u1=u2=u3且c=b,所述肽为式(u1)2bu1z(均肽三聚体)。
杂肽三聚体的实例及其合成在图8中被阐释并在实施例1d中被描述。
相应地,本发明涉及式u3u2ku1k的分离的肽三聚体:其中u1包含rrvvkrgr(seqidno:57)、u2包含rgrkvvrr(seqidno:44)且u3包含rgrkvvrrvv(seqidno:46)。此杂三聚体为v2v2v4杂三聚体并具有结构:
本发明的多聚体具有抗菌特性。相应地,所述多聚体可被用于抑制和/或减少微生物的生长。
本发明还提供抑制和/或减少微生物生长的方法,所述方法包括使所述微生物与至少一种本发明的多聚体相接触。
本发明还提供治疗至少一种微生物感染的方法,所述方法包括向受试者施用至少一种本发明的多聚体。本发明还提供抑制和/或减少受试者中至少一种微生物的生长,其包括向受试者施用至少一种本发明的多聚体。
所述微生物可以是病毒、真菌或细菌。
相应地,本发明还涉及根据本发明任一方面的多聚体在制备抗菌组合物中的应用。所述抗菌组合物可用于抑制和/或减少至少一种微生物的生长(例如,在受试者中)。
本发明还包括根据本发明任一方面的多聚体在制备用于治疗至少一种微生物感染的药物中的应用。
相应地,本发明的多聚体可被配制为抗菌组合物和/或药物组合物。所述抗菌和/或药物组合物可被配制为局部的、口服的或肠胃外施用或用于通过吸入施用。本发明的多聚体还可被配制为滴眼组合物和/或溶液和/或接触镜片溶液。
本发明的多聚体还可被配制为用于被覆设备的组合物。所述设备包括医疗设备,例如但不限于导管、针、鞘、支架或敷裹(dressing)。
本发明还进一步包括试剂盒,所述试剂盒包括至少一种根据本发明的多聚体,至少一种包含至少一种根据本发明的多聚体的抗菌组合物和/或药物组合物。
现已对本发明作出一般性描述,为使本发明更容易理解,同样的内容将通过参考下面的实施例进一步阐述,此处描述的实施例仅仅用以解释本发明,并不用于限定本发明。
实施例
本领域已知且未特别描述的标准分子生物学技术通常是依照sambrook和russel,molecularcloning:alaboratorymanual,coldspringsharborlaboratory,newyork(2001)中的描述。
实施例1多聚体的固相肽合成(spps)方法
(a)均二聚体的合成
肽的合成方法修改自krajewski等人,(2004)。芴甲氧羰基(fmoc)保护的l氨基酸和树脂购自advancedautomatedpeptideproteintechnologies,(aapptec)(ky,us)并与下列侧链保护基团共同使用:lys(fmoc)(仅并入自c末端的第二个残基处,用于二聚体的合成)、arg(pbf)、lys(boc)、tyr(but)、trp(boc)和fmoc-lys(boc)-wang树脂(替换0.72mmol/g)。二聚体的合成在apex396(advancedchemtech)上通过fmoc化学而进行。
使用商业上可得的fmoc-boc-lys-wang树脂作为起始点。可选地,第一个氨基酸与wang树脂的偶联用0.5mdic(n,n'-二异丙基碳二亚胺)进行。接下来的偶联反应(或酰化)用0.5mhbtu/0.5mhobt/2mdiea的nmp进行。作为备选,所述偶联反应也可用dmf中的hbtu-hobt,在0.08mmol的合成比例下进行。用20%哌啶的dmf的进行fmoc去保护。
用90%tfa(三氟乙酸),5.0%苯酚,1.5%水,1.0%tis(三异丙基硅烷),2.5%edt(乙二醇)处理所述树脂以从树脂上释放多聚体。可选地,可用新鲜配制的tfa/tis/苯酚/thionisole/水(90/1/2.5/5/1.5,体积百分比)混合物对所得到的肽基树脂在室温下处理2-3小时。
然后通过在冰冷却的二乙醚中过滤而沉淀粗制肽,通过离心将其分离,用冰冷却的乙醚清洗三次,并通过在通风橱中自动蒸发粗制固体产物中的乙醚和其他剩余的或残存的溶剂使其干燥,或者于室温真空干燥。从乙醚直接干燥的沉淀导致tfa(三氟乙酸)盐。tfa盐可能影响肽溶液的ph或培养物中细胞的存活。2ml2%乙酸冷冻干燥,用乙酸盐替代tfa盐,这使得对其他的肽处理更简单,并可以去除痕量的清除剂。
在图2中表明了合成方法的方案。
从此spps方法可获得高产量的粗制二聚体和纯化二聚体。例如,粗制和纯化v2二聚体的产量分别为90和27%。此外,基于0.08mmol的合成比例可获得50mg纯化的v2二聚体。
所述的方法是合成方法的示例,同时也可以对所述方法进行修饰。例如,在所述spps方法中可使用任何保护和去保护氨基酸残基的方法。
(b)均四聚体的合成
所述合成方法可被扩展至均四聚体的合成,如图9中所示意的。
在使连接至固定的nh2-lys(boc)的fmoc-lys去保护后,然后将两个fmoc-lys残基与所述lys相连。然后进行进一步氨基酸链延伸以产生所示的均四聚体(v2四聚体)。所述去保护(步骤i)、偶联(步骤ii)和链延伸的条件与用于制备均二聚体的条件相同。
(c)杂二聚体的合成
对于图7所示的杂二聚体的合成,使用区别保护的氨基酸fmoc-lys(aloc)-oh作为分支点以制备杂二聚体。fmoc和aloc基团具有不同的反应性,在用以去除fmoc的碱性条件下aloc是稳定的。
对于固定的fmoc-nh-lys(boc)-wang树脂的去保护按照上面所描述的进行。
如图7所示,然后将fmoc-lys(aloc)-oh与连至wang树脂上的赖氨酸残基相连(偶联步骤ii)。仅将fmoc-lys(aloc)的fmoc基团去除(fmoc去保护)然后以(步骤iii)进行第一链的延伸。当第一链中的所有氨基酸残基均已被连接时(即第一链已完成),使用钯催化剂去除lys(aloc)上的aloc基团(aloc去保护)并进行第二链延伸。当第二链中的所有氨基酸残基均已被连接时(即第一链也已完成),通过酸裂解释放所述产物。然后去除在合成过程中适合用于保护氨基酸残基的反应基团的任何余留的保护基团(例如boc、pbf、mtr)。
(d)杂肽三聚体的合成
图8表明了合成杂肽三聚体的示例。对固定的赖氨酸(k)残基的第一次延伸是第一种肽(u1)rgrkvvrr(seqidno:57)。随后,将fmoc-lys(aloc)-oh连至肽rgrkvvrrn末端的r残基。然后去除fmoc基团并通过链延伸将第二种肽(u2)rgrkvvrr(seqidno:44)加至lys(aloc)残基的第一胺基处。在第二链延伸之后,去除aloc基团并通过链延伸将第三种肽(u3)rgrkvvrrvv(seqidno:46)加至lys残基的第二胺基处。
可选地,也可在第一种肽u1的延伸完成之后添加fmoc-lys(fmoc)-oh。可以双份地延伸肽u2以形成杂三聚体u2u2(k)u1k。
对于均肽三聚体,可在肽u的延伸完成之后使用fmoc-lys(fmoc)-oh。可同时双份延伸同样的肽u以形成均三聚体。
实施例2抗菌测定
检测抗菌肽的抗菌活性的方法使用下述的完全杀死程序。
制备测试生物体
测试生物体是获得自美国典型培养物保藏中心(atcc)的参照培养物,或者是获得自新加坡中央医院病理学部门的临床分离物。在本研究中使用的所有培养物从来源起不超过5次传代。细菌培养物在胰酶解酪蛋白大豆琼脂(tsa)斜面上生长,且酵母培养物在沙保罗氏(sabouraud)葡萄糖琼脂(sda)斜面上生长,在35℃生长16小时。通过离心收获所述生物体并在ph7.2的磷酸盐缓冲液(unitedstatespharmacopeia,usp)中,于20℃清洗两次。
检测所使用的生物体
在本研究中使用了下述生物体:
1、蜡样芽胞杆菌(bacilluscereus)atcc11778
2、白色念珠菌(candidaalbicans)atcc10231
3、临床绿脓杆菌(pseudomonasaeruginosa)pae230dr4877/07。来源:痰
4、临床绿脓杆菌(pseudomonasaeruginosa)pae239dm5790/07。来源:伤口
5、临床绿脓杆菌(pseudomonasaeruginosa)pae240du14476/07。来源:尿
6、临床绿脓杆菌(pseudomonasaeruginosa)pae249dm15013。来源:伤口
7、临床绿脓杆菌(pseudomonasaeruginosa)07dm023257。来源:眼睛
8、临床绿脓杆菌(pseudomonasaeruginosa)07dm023376。来源:眼睛
9、临床绿脓杆菌(pseudomonasaeruginosa)07dm023155。来源:眼睛
10、临床绿脓杆菌(pseudomonasaeruginosa)07dm023104。来源:眼睛
11、绿脓杆菌(pseudomonasaeruginosa)atcc9027
12、绿脓杆菌(pseudomonasaeruginosa)atcc27853
13、大肠杆菌(escherichiacoli)atcc25922
14、临床大肠杆菌(escherichiacoli)db16027来源:血液
15、临床大肠杆菌(escherichiacoli)du46381r来源:尿
16、耐甲氧西林金黄色葡萄球菌(methicillin-resistantstaphylococcusaureus)(mrsa)dm09808r来源:眼睛
17、临床金黄色葡萄球菌(staphylococcusaureus)dm4001来源:眼睛
18、临床白色念珠菌(candidaalbicans)df2672r来源:尿
19、腐皮镰刀菌(fusariumsolani)atcc36031
制备化合物的测试溶液
将冷冻干燥的抗菌化合物溶于纯化的水中并将其分配到螺盖塑料管中,浓度为1,000微克(μg)/ml。这些作为储液并保存在-20℃。
在进行测试的当天,解冻一管所述储液并在纯化的水中稀释至浓度为500μg/ml。此后,在ph7.2的usp磷酸盐缓冲液中或其他溶液(包括但不限于10mm磷酸钠缓冲液ph7.4,10mm钾缓冲液7.2或155.2mmnacl)中进行进一步的稀释,直至要求的测试浓度,通常的范围为6.25μg/ml至50μg/ml。
将10微升(μl)标准化浓度的测试生物体接种到1ml特定测试浓度的化合物测试溶液中以尽可能提供1×105cfu/ml至1×106cfu/ml之间的最终计数。然后将已接种的测试溶液在35℃温育4小时。温育温度和时间可根据需要变化。
温育后,通过在d/e中和肉汤(nb)中的10倍稀释使测试溶液的抗菌活性失活。在所述nb中进行进一步稀释,且对于细菌培养物在tsa中涂板,对于酵母培养物在sda中涂板。将平板在35℃温育72小时。然后确定生存生物体的活菌记数。
作为接种物对照,与测试平行地,将测试生物体接种到制备测试溶液所使用的缓冲液中,并在与测试相同的条件下温育。同测试一样,测定接种物对照的活菌记数。
化合物的抗菌活性被表示为对数减少量(logreduction),所述对数减少量通过从测试生物体接种物对照的cfu的对数值中减去35℃下4小时暴露后测试生物体存活者的菌落形成单位(cfu)的对数值进行计算。
上述方法用于实施例3-7,并且具体地,实施例6中对于庆大霉素的方法是类似的,除了用庆大霉素代替所述抗菌化合物外。
实施例3v2二聚体针对绿脓杆菌atcc9027的抗菌活性
在绿脓杆菌atcc9027上检测v2二聚体的抗菌性质。
所述v2二聚体在usp磷酸盐缓冲液(依照美国药典委员会制备)中、在生理ph7.2时显示针对绿脓杆菌atcc9027的抗菌活性。所述抗菌活性是高效的,显示出细菌群体的大幅减少(见表1)。细菌的接种量为约107个生物体,在接触时间为4小时、v2二聚体为12.5μg/ml时,所述溶液几乎是无菌的。
表1在35℃、ph7.2的usp磷酸盐缓冲液中针对绿脓杆菌atcc9027的抗菌活性(对数减少)
上面使用的usp缓冲液的盐溶液相比于生理条件是稀释的,因此还使用10mmph7.2的磷酸盐缓冲液在生理盐条件下测试了所述v2二聚体的抗菌活性。在生理盐条件下,所述v2二聚体也保持了针对绿脓杆菌atcc9027的高抗菌活性(表2)。
表235℃、ph7.2的10mm磷酸钾缓冲液中针对绿脓杆菌atcc9027的抗菌活性(对数减少)
此外,还在155.2mmnacl的高盐浓度下测试了v2二聚体的抗菌活性。结果显示所述v2二聚体在浓度为12.5至50μg/ml时在高盐浓度下具有抗菌性。
表335℃时针对绿脓杆菌atcc9027的抗菌活性(对数减少)
nd-未测定
实施例4v2二聚体与衍生自hbd3的肽单体的比较
还测试了之前(wo2007/126392)描述过的衍生自hbd3的10个氨基酸的肽单体针对绿脓杆菌atcc9027的活性。
研究了v2,l2,c2,f2和h2的单体在usp磷酸盐缓冲液中的抗菌性质,并显示在表4中。
表435℃时10个氨基酸的肽单体针对绿脓杆菌atcc9027的抗菌活性(对数减少)
nd-未测定
注释:0.5对数减少等于68%的细菌被杀死;1对数减少等于90%的细菌被杀死;2对数减少等于99%的细菌被杀死;3对数减少等于99.9%的细菌被杀死。
将表1中v2二聚体的结果与表4中的v2单体进行比较,v2二聚体在杀死中显示比v2单体高得多的效率。所述v2二聚体在4小时、12.5μg/ml的浓度时显示>6的对数减少(表1),与之比较,v2单体在12.5μg/ml时显示3.23的对数减少,在50μg/ml时仅显示3.97的对数减少(表4)。
实施例5v2二聚体针对绿脓杆菌的临床分离物的抗菌活性
还针对数个来自痰、伤口、尿和眼睛的绿脓杆菌临床分离物测试了v2二聚体的抗菌活性。所述v2二聚体也显示了针对这些临床分离物的抗菌活性(见表5-8),这提示v2二聚体可被有效地用于针对实际临床标本。
表535℃时v2二聚体针对分离自痰的绿脓杆菌临床菌株的抗菌活性(对数减少)
表635℃时v2二聚体针对分离自伤口的绿脓杆菌临床菌株的抗菌活性(对数减少)
(a)来自绿脓杆菌pae239dm5790/07的数据
(b)来自绿脓杆菌pae249dm15013的数据
表735℃时v2二聚体针对分离自尿的绿脓杆菌临床菌株的抗菌活性(对数减少)
表835℃时,在usp磷酸盐缓冲液中v2二聚体针对分离自眼睛的绿脓杆菌的抗菌活性(对数减少)
(a)来自绿脓杆菌07dm02357的数据
(b)来自绿脓杆菌07dm023376的数据
(c)来自绿脓杆菌07dm023155的数据
(d)来自绿脓杆菌07dm023104的数据
使用10mm磷酸盐缓冲液还测试了生理盐条件下,v2二聚体对于临床分离物的抗菌活性。v2二聚体也在重复的实验中显示了针对来自眼睛(表9a、9b和9c)、伤口、痰和尿(表10a和b)的临床分离物的抗菌活性,提示所述v2二聚体也可在生理条件下被用于针对临床分离物。
表935℃时,在10mm磷酸钾缓冲液中v2二聚体针对分离自眼睛的绿脓杆菌的抗菌活性(对数减少)
(a)
(b)
(c)
表1035℃时,在10mm磷酸钾缓冲液中v2二聚体针对分离自伤口、痰和尿的绿脓杆菌的抗菌活性(对数减少)
(a)
(b)
实施例6v2二聚体与庆大霉素的抗菌活性的比较
针对绿脓杆菌的临床分离物进行了v2二聚体与庆大霉素的抗菌活性的比较。
在第一个研究中,针对来自伤口和痰的临床分离物测试了v2二聚体与庆大霉素二者并进行了比较(见表5)。这一研究显示了对于伤口分离物,v2二聚体具有与庆大霉素相当的活性。对于痰分离物,v2二聚体显示了更高的抗菌活性。
表1135℃时,v2二聚体与庆大霉素针对来自痰和伤口的临床绿脓杆菌分离物的抗菌活性(对数减少)比较
在第二个研究中,测试了v2二聚体与庆大霉素二者针对来自尿和痰的临床分离物的抗菌活性并进行了比较(见表6)。针对这两种分离物,v2二聚体也显示了与庆大霉素相当的活性。
表1235℃时,v2二聚体与庆大霉素针对来自尿和伤口的临床绿脓杆菌分离物的抗菌活性(对数减少)比较
在第三个研究中,测试了v2二聚体与庆大霉素二者针对来自眼睛的临床分离物的抗菌活性(见表13)。这一研究显示,针对来自眼睛的绿脓杆菌分离物,v2二聚体与庆大霉素具有相当的活性。
表1335℃时,v2二聚体与庆大霉素针对来自尿和伤口的临床绿脓杆菌分离物的抗菌活性(对数减少)比较
总之,上述研究提示v2二聚体与庆大霉素具有相当的抗菌活性并且可能以与庆大霉素相等同的效力利用所述v2二聚体对抗微生物。
实施例7v2二聚体针对其他生物体的抗菌活性
(a)白色念珠菌(candidaalbicans)atcc10231
测试了v2二聚体针对白色念珠菌atcc10231的抗菌活性。将usp磷酸盐缓冲液中7.2×105cfu的白色念珠菌与不同浓度的v2二聚体混合并在35℃温育4小时。结果显示v2二聚体在50μg、25μg和12.5μg/ml时针对白色念珠菌atcc10231达到了3.6至4的对数减少(表14)。
表1435℃时针对白色念珠菌atcc10231的抗菌活性(对数减少)
(b)蜡样芽胞杆菌(bacilluscereus)atcc11778
测试了v2二聚体针对蜡样芽胞杆菌atcc11778的抗菌活性。v2二聚体显示了针对蜡样芽胞杆菌的抗菌活性(表15)。
表1535℃时针对蜡样芽胞杆菌atcc11778的抗菌活性(对数减少)
(c)临床大肠杆菌(escherichiacoli)db0016027r
此外,所述v2二聚体针对多种抗生素耐受性菌株e.colidb0016027r(从血液临床分离)能够产生减少,所述e.colidb0016027r具有耐受庆大霉素、氨苄西林和其他抗生素的抗生描记图谱。
表1635℃时针对e.colidb0016027r的抗菌活性(对数减少)
v2二聚体针对白色念珠菌和其它细菌的抗菌性质提示其可能是有效的广谱抗菌剂。此外,v2二聚体针对耐受多种抗生素的e.coli菌株的效力表明:当不能使用其他抗生素时,其可能是有效的治疗剂。
实施例8v2二聚体的细胞毒性
根据wo2007/126392中描述的方法测试了v2二聚体针对人结膜细胞的细胞毒性并与天然hbd3进行了比较。图4显示,与野生型hbd3相比,v2二聚体对于人结膜细胞具有减少的细胞毒性。野生型hbd3在浓度为约15μg/ml时是细胞毒性的,然而,v2二聚体在100μg/ml的浓度时不是细胞毒性的。v2二聚体的细胞毒性谱与来自wo2007/126392的单体肽的细胞毒性谱相当。
v2二聚体对于人结膜细胞减少的细胞毒性和v2二聚体的高抗菌活性提示此二聚体能够被用于宿主中,用于治疗微生物感染和/或降低宿主中微生物的生长。类似地预期来自wo2007/126392的肽的其他二聚体也显示高的抗菌活性和低的细胞毒性。
实施例9通过肉汤大量稀释技术测定最小抑制浓度(mic)
通过对国家委员会为临床实验室标准(nccl)描述的方法修饰后的肉汤大量稀释方法测定mic。使用1/6强度的muellerhinton肉汤(mhb)并且不加ca2+和mg2+,用于稀释。在试管中,用mhb(1/6强度)制备v2二聚体溶液的连续对倍稀释液。将1mlmhb(1/6强度)中的测试生物体的接种物加入1mlv2二聚体的各稀释液中,以在各试管中产生104至105菌落形成单位/ml的终浓度。将试管在35℃温育16至20小时。与测试样本平行地,还温育仅含肉汤和生物体的阳性对照及仅含肉汤的阴性对照管。在单独的实验中对于每种不同的测试生物体重复上述过程。v2二聚体肽对于每种临床分离物或参照生物体的mic被当作抑制所述测试生物体的可见生长的最低肽浓度。
还针对其他肽测定了mic并与庆大霉素进行了比较。在表17-20中显示了mic结果。
表17v2-二聚体、y2-二聚体、w2-二聚体和庆大霉素针对革兰氏-阴性细菌绿脓杆菌和大肠杆菌的不同菌株的mic(μg/ml)结果
表18v2-二聚体、y2-二聚体、w2-二聚体和庆大霉素针对革兰氏-阳性细菌金黄色葡萄球菌、蜡样芽胞杆菌和真菌白色念珠菌、腐皮镰刀菌的不同菌株的mic(μg/ml)结果
表19数个c-末端单体针对革兰氏-阴性细菌绿脓杆菌和大肠杆菌的不同菌株的mic(μg/ml)结果
表20数个c-末端单体针对革兰氏-阳性细菌金黄色葡萄球菌、蜡样芽胞杆菌和真菌白色念珠菌、腐皮镰刀菌的不同菌株的mic(μg/ml)结果
序列表
<110>新加坡保健服务集团(singaporehealthservicespteltd)
新加坡科技研究局(agencyforscience,technologyandresearch)
<120>抗菌肽的多聚体形式
<130>fp4685
<150>us61/046,584
<151>2008-04-21
<160>58
<170>patentinversion3.4
<210>1
<211>45
<212>prt
<213>人类
<400>1
glyileileasnthrleuglnlystyrtyrcysargvalargglygly
151015
argcysalavalleusercysleuprolysglugluglnileglylys
202530
cysserthrargglyarglyscyscysargarglyslys
354045
<210>2
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被x取代
<220>
<221>x
<222>(11)..(41)
<223>x包括任何的氨基酸
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>2
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>3
<211>43
<212>prt
<213>人工序列
<220>
<223>hbd3片段去除终端kk,c残基被x取代
<220>
<221>x
<222>(11)..(41)
<223>x包括任何的氨基酸
<400>3
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaalavalleuserxaaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargarg
3540
<210>4
<211>38
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的38个氨基酸的肽
<220>
<221>x
<222>(4)..(34)
<223>x包括任何的氨基酸
<220>
<221>x
<222>(37)..(38)
<223>x包括任何的氨基酸或可能缺失
<400>4
lystyrtyrxaaargvalargglyglyargxaaalavalleuserxaa
151015
leuprolysglugluglnileglylysxaaserthrargglyarglys
202530
xaaxaaargargxaaxaa
35
<210>5
<211>36
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的36个氨基酸的肽
<220>
<221>x
<222>(2)..(32)
<223>x包括任何的氨基酸
<220>
<221>x
<222>(35)..(36)
<223>x包括任何的氨基酸或可能缺失
<400>5
tyrxaaargvalargglyglyargxaaalavalleuserxaaleupro
151015
lysglugluglnileglylysxaaserthrargglyarglysxaaxaa
202530
argargxaaxaa
35
<210>6
<211>40
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的40个氨基酸的肽
<220>
<221>x
<222>(6)..(36)
<223>x包括任何的氨基酸
<220>
<221>x
<222>(39)..(40)
<223>x包括任何的氨基酸或可能缺失
<400>6
leuglnlystyrtyrxaaargvalargglyglyargxaaalavalleu
151015
serxaaleuprolysglugluglnileglylysxaaserthrarggly
202530
arglysxaaxaaargargxaaxaa
3540
<210>7
<211>29
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的29个氨基酸的肽
<220>
<221>x
<222>(2)..(25)
<223>x包括任何的氨基酸
<220>
<221>x
<222>(28)..(29)
<223>x包括任何的氨基酸或可能缺失
<400>7
argxaaalavalleuserxaaleuprolysglugluglnileglylys
151015
xaaserthrargglyarglysxaaxaaargargxaaxaa
2025
<210>8
<211>20
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的20个氨基酸的肽
<220>
<221>x
<222>(8)..(16)
<223>x包括任何的氨基酸
<220>
<221>x
<222>(19)..(20)
<223>x包括任何的氨基酸或可能缺失
<400>8
lysglugluglnileglylysxaaserthrargglyarglysxaaxaa
151015
argargxaaxaa
20
<210>9
<211>14
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的14个氨基酸的肽
<220>
<221>x
<222>(2)..(10)
<223>x包括任何的氨基酸
<220>
<221>x
<222>(13)..(14)
<223>x包括任何的氨基酸或可能缺失
<400>9
lysxaaserthrargglyarglysxaaxaaargargxaaxaa
1510
<210>10
<211>19
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3氨基酸8-26位的19个氨基酸的肽
<220>
<221>x
<222>(4)..(16)
<223>x包括任何的氨基酸
<400>10
lystyrtyrxaaargvalargglyglyargxaaalavalleuserxaa
151015
leuprolys
<210>11
<211>17
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3n末端的17个氨基酸的肽
<220>
<221>x
<222>(11)..(11)
<223>x包括任何的氨基酸
<400>11
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
arg
<210>12
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被w取代
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>12
glyileileasnthrleuglnlystyrtyrtrpargvalargglygly
151015
argtrpalavalleusertrpleuprolysglugluglnileglylys
202530
trpserthrargglyarglystrptrpargargxaaxaa
354045
<210>13
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被f取代
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>13
glyileileasnthrleuglnlystyrtyrpheargvalargglygly
151015
argphealavalleuserpheleuprolysglugluglnileglylys
202530
pheserthrargglyarglysphepheargargxaaxaa
354045
<210>14
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被y取代
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>14
glyileileasnthrleuglnlystyrtyrtyrargvalargglygly
151015
argtyralavalleusertyrleuprolysglugluglnileglylys
202530
tyrserthrargglyarglystyrtyrargargxaaxaa
354045
<210>15
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被s取代
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>15
glyileileasnthrleuglnlystyrtyrserargvalargglygly
151015
argseralavalleuserserleuprolysglugluglnileglylys
202530
serserthrargglyarglysserserargargxaaxaa
354045
<210>16
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被a取代
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>16
glyileileasnthrleuglnlystyrtyralaargvalargglygly
151015
argalaalavalleuseralaleuprolysglugluglnileglylys
202530
alaserthrargglyarglysalaalaargargxaaxaa
354045
<210>17
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被c(acm)取代
<220>
<221>x
<222>(11)..(41)
<223>x包括c(acm)
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>17
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>18
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被c(but)取代、终端kk被xx取代
<220>
<221>x
<222>(11)..(41)
<223>x包括c(but)
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>18
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>19
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被c(t-buthio)取代
<220>
<221>x
<222>(11)..(41)
<223>x包括c(t-buthio)
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>19
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>20
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被c(bzl)取代、终端kk被xx取代
<220>
<221>x
<222>(11)..(41)
<223>x包括c(bzl)
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>20
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>21
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被c(4-mebzl)取代、终端kk被xx取代
<220>
<221>x
<222>(11)..(41)
<223>x包括c(4-mebzl)
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>21
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>22
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被c(4-meo-bzl)取代、终端kk被xx取代
<220>
<221>x
<222>(11)..(41)
<223>x包括c(4-meo-bzl)
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>22
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>23
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被c(mmt)取代、终端kk被xx取代
<220>
<221>x
<222>(11)..(41)
<223>x包括c(mmt)
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>23
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>24
<211>45
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,c被任何修饰后的c取代
<220>
<221>x
<222>(11)..(41)
<223>x包括c(cam),c(but),c(t-buthio),c(bzl),c(4-mebzl),
c(4-meobzl)orc(mmt)
<220>
<221>x
<222>(44)..(45)
<223>x包括任何的氨基酸或可能缺失
<400>24
glyileileasnthrleuglnlystyrtyrxaaargvalargglygly
151015
argxaaxaavalleuseralaleuprolysglugluglnileglylys
202530
xaaserthrargglyarglysxaaxaaargargxaaxaa
354045
<210>25
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被取代x
<220>
<221>x
<222>(5)..(6)
<223>x包括任何的氨基酸
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>25
argglyarglysxaaxaaargargxaaxaa
1510
<210>26
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被w取代
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>26
argglyarglystrptrpargargxaaxaa
1510
<210>27
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被f取代
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>27
argglyarglysphepheargargxaaxaa
1510
<210>28
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被y取代
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>28
argglyarglystyrtyrargargxaaxaa
1510
<210>29
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被l取代
<220>
<221>x
<222>(9)..(10)
<223>x可能包括任何的氨基酸或可能缺失
<400>29
argglyarglysleuleuargargxaaxaa
1510
<210>30
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被i取代
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>30
argglyarglysileileargargxaaxaa
1510
<210>31
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被h取代
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>31
argglyarglyshishisargargxaaxaa
1510
<210>32
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被修饰
<220>
<221>x
<222>(5)..(6)
<223>x包括,c(but),c(t-buthio),c(bzl),c(4-mebzl),
c(4-meobzl)orc(mmt)
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>32
argglyarglysxaaxaaargargxaaxaa
1510
<210>33
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段,c被v取代
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>33
argglyarglysvalvalargargxaaxaa
1510
<210>34
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端的10个氨基酸的片段
<220>
<221>x
<222>(9)..(10)
<223>x包括任何的氨基酸或可能缺失
<400>34
argglyarglyscyscysargargxaaxaa
1510
<210>35
<211>10
<212>prt
<213>人工序列
<220>
<223>衍生自hbd3c末端,c被修饰
<220>
<221>x
<222>(5)..(6)
<223>c(acm),c(but),c(t-buthio),c(bzl),c(4-mebzl),c(4-meobzl)or
c(mmt).
<220>
<221>x
<222>(9)..(10)
<223>x包括任何氨基酸或可能缺失.
<400>35
argglyarglysxaaxaaargarglyslys
1510
<210>36
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基被x取代
<220>
<221>x
<222>(5)..(6)
<223>x包括任何的氨基酸
<400>36
argglyarglysxaaxaaargarg
15
<210>37
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基被w取代
<400>37
argglyarglystrptrpargarg
15
<210>38
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基被f取代
<400>38
argglyarglysphepheargarg
15
<210>39
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基被y取代
<400>39
argglyarglystyrtyrargarg
15
<210>40
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基被l取代
<400>40
argglyarglysleuleuargarg
15
<210>41
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基i取代
<400>41
argglyarglysileileargarg
15
<210>42
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基h取代
<400>42
argglyarglyshishisargarg
15
<210>43
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基c(acm)取代
<220>
<221>x
<222>(5)..(6)
<223>c包括c(acm),c(but),c(t-buthio),c(bzl),c(4-mebzl),
c(4-meobzl)orc(mmt).
<400>43
argglyarglysxaaxaaargarg
15
<210>44
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3重复片段去除终端kk,c残基被v取代
<400>44
argglyarglysvalvalargarg
15
<210>45
<211>10
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,v2单体andkk残基.10个氨基酸
<400>45
argglyarglysvalvalargarglyslys
1510
<210>46
<211>10
<212>prt
<213>人工序列
<220>
<223>v4单体,v4-10氨基酸
<400>46
argglyarglysvalvalargargvalval
1510
<210>47
<211>10
<212>prt
<213>人工序列
<220>
<223>y4单体(y4-10氨基酸)
<400>47
argglyarglystyrtyrargargtyrtyr
1510
<210>48
<211>10
<212>prt
<213>人工序列
<220>
<223>w4单体,w4-10氨基酸
<400>48
argglyarglystrptrpargargtrptrp
1510
<210>49
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,v3单体
<400>49
argvalarglysvalvalargarg
15
<210>50
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,v2r单体
<400>50
argargarglysvalvalargarg
15
<210>51
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,v2d单体
<400>51
argasparglysvalvalargarg
15
<210>52
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,e2单体
<400>52
argglyarglysglugluargarg
15
<210>53
<211>8
<212>prt
<213>人工序列
<220>
<223>hbd3衍生肽,k2单体
<400>53
argglyarglyslyslysargarg
15
<210>54
<211>10
<212>prt
<213>人工序列
<220>
<223>包含10个精氨酸(r)的肽
<400>54
argargargargargargargargargarg
1510
<210>55
<211>4
<212>prt
<213>人工序列
<220>
<223>包括4个缬氨酸的肽
<400>55
valvalvalval
1
<210>56
<211>4
<212>prt
<213>人工序列
<220>
<223>包括4个酪氨酸的肽
<400>56
tyrtyrtyrtyr
1
<210>57
<211>8
<212>prt
<213>人工序列
<220>
<223>seqidno:44反向序列
<400>57
argargvalvallysargglyarg
15
<210>58
<211>9
<212>prt
<213>人工序列
<220>
<223>seqidno:57+k
<400>58
argargvalvallysargglyarglys
15
- 还没有人留言评论。精彩留言会获得点赞!