一种含氟有机半导体材料及其制备方法与应用与流程
本发明属于高分子材料领域,涉及一种含氟有机半导体材料及其制备方法与应用。
背景技术:
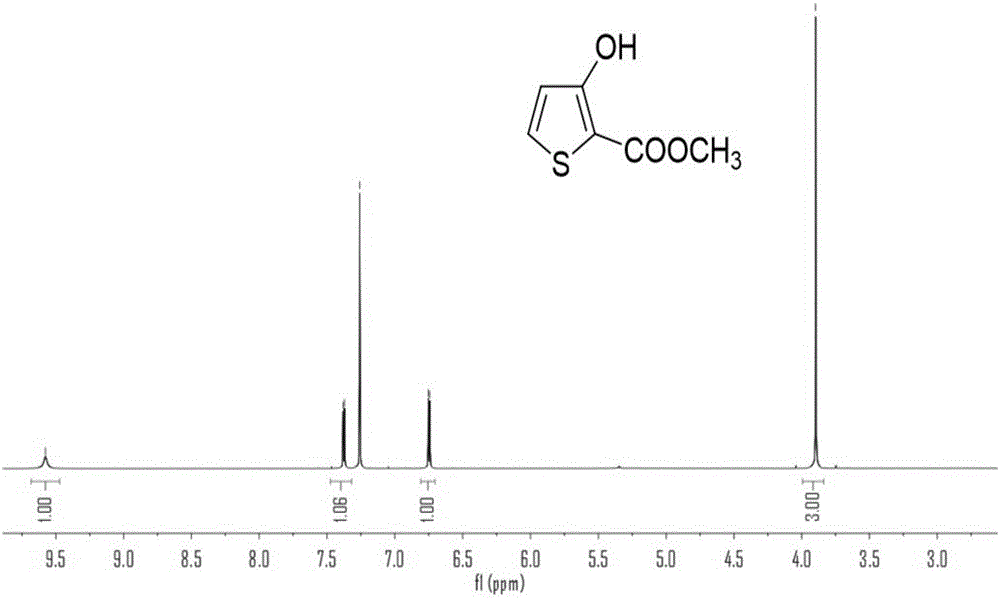
:高分子半导体材料是一类新型的半导体材料,它的出现引起了学术界和工业界的广泛关注,大量科研与技术人员投身于其独特光电性能的研究及其实际应用的开发。基于有机材料的半导体器件具有低成本、大面积、可折叠等一系列优点,在显示、照明、能源和医疗等领域引领了一场新的技术变革,这必将大大改善和影响人们的日常生活。例如,有机发光二极管已成功应用于手机、数码相机和电视机等电子产品,基于有机材料的新型有机太阳电池在新能源领域被认为是第三代太阳电池,兼具高灵敏度和自我发电功能的超级电子皮肤在人造电子皮肤领域中达到更为接近人类皮肤的目标,具有重要的意义。近20年来,经过材料化学家和器件物理学家不懈的努力,有机电子取得了令人瞩目的成就。其中,有机场效应晶体管的空穴迁移率已经突破10cm2/vs,远远超过了传统的基于无定型硅的半导体晶体管(1cm2/vs)。新型的太阳能电池也对传统意义上的无机硅电池发起强有力的挑战,具有低成本、大面积、环保等一系列优点的新型有机太阳能电池的能量转化效率也接近甚至超过13%,现在科学家们正致力于其效率和稳定性的进一步提升。研究结果表明,具有高度平面分子结构的高分子半导体在固态时将取得更为紧密的π-π堆积,进而有利于载流子在分子链间的跳跃式传输,这对有机电子材料实现优异的光电性能具有重要意义。同时,为了保证高分子半导体材料的加工性,高分子半导体的主链有必要引入烷基。在设计烷基的位点时,头对头的结构需要尽量避免。因为较大的空间位阻会降低聚合物的平面性及共轭长度,不利于载流子的传输。为了解决这些问题,两种常用的设计策略被广泛应用于有机电子材料的合成。例如,在有机电子材料设计中体现巨大优越性的给受体(donor-acceptor)思路中,通常在给/受体单元中间插入噻吩桥(spacer)来降低二者之间较大的二面角。但是,给/受体与噻吩偶联需要额外的合成步骤,降低了主链中关键单元的密度,同时不含烷基噻吩的引入也会降低高分子半导体材料的溶解性。另一种策略则通过共价键锁定分子的构象,这也有助于获得平面的高分子主链。但是,由于桥原子通常是sp3杂化,导致取代基处于分子平面外,增大了分子间的距离,降低了分子链间的有效排列和堆积,常常导致聚合物的迁移率较低,在有机太阳能电池中不利于载流子的提取,相应器件的填充因子通常较低(<70%)。聚3,4-二氧乙基噻吩(pedot)因其优异的导电性能在有机光电中发挥着重要的作用,其优异的导电性能主要得益于分子主链较高的平面性。通过研究3,4-二氧乙基噻吩的单晶发现,硫原子与氧原子的距离为2.96埃,远远小于硫原子与氧原子的范德华半径之和(3.25埃)。受此启发,通过分子内硫氧键弱相互作用促进分子链取得更加平面的构象引起了材料化学家们极大的兴趣。当在2,2'-联噻吩的3,3'位引入烷氧基修饰后,与传统烷基取代的2,2'-联噻吩对比发现,och2的引入比ch2与相比,噻吩之间的二面角显著减小,这正是分子内硫氧弱相互作用的贡献。将硫氧弱相互作用应用于联噻唑同样取得了成功,其与苯并酰亚胺共聚得到的聚合物空穴迁移率均大幅度提高。上述例子表明,在当今高分子半导体材料设计更加精细化的背景下,硫氧弱相互作用可以作为设计性能优异的有机电子材料的策略。同时需要注意的是,在联噻吩中引入烷氧基虽然可以促进分子的平面性和溶解性,但是氧原子的共轭效应和诱导效应同样应该引起重视。氧原子较强的供电子能力会大大抬高有机电子材料的最高占据轨道(homo)。理论与实验均表明,烷氧基修饰的联噻吩引入高分子半导体材料后,相应制备的有机太阳能电池开路电压明显偏低(0.5-0.6v),严重制约着效率的进一步提升。在有机场效应晶体管中,太高的homo则意味着聚合物容易被空气中的水和氧掺杂,对器件的稳定性极其不利。基于上述分析,不匹配的homo能级严重制约着基于分子内硫氧弱相互作用的“头碰头型”联噻吩单体在有机电子材料中的进一步应用和推广。因此,需要开发出新型有机材料来解决目前存在的问题。技术实现要素:针对现有技术的不足,本发明提供一种含氟有机半导体材料及其制备方法与应用。为达到此发明目的,本发明采用以下技术方案:第一方面,本发明提供一种含氟有机半导体材料,其具有如式i所示结构:其中,r为助溶性基团,π基团为π-共轭结构基团,n为4-80,例如可以是4、8、10、15、20、30、40、50、60、70或80。在本发明中,r为助溶性基团,提高了含氟有机半导体材料的在溶剂中的溶解性,有利于材料发挥优良的性能。本发明提供的含氟有机半导体材料,具有优异的光电性能,高度的可溶性,良好的分子间堆砌能力及热稳定性,克服基于分子内硫氧弱相互作用“头碰头型”联噻吩构筑的有机半导体的homo能级不匹配的不足,既可以作为有机太阳电池的活性层材料,又可以应用于有机场效应晶体管中作为载流子传输材料。优选地,r为如下基团中的任意一种:其中,虚线为基团的连接位置。优选地,π基团为如下基团中的任意一种:其中,波浪线表示基团连接位置。优选地,所述含氟有机半导体材料为具有如下式ii-式vi所示结构中的一种或至少两种的组合:其中,n为4-80,例如可以是4、10、20、30、40、50、60、70或80。第二方面,本发明提供一种含氟取代的有机半导体材料的制备方法,所述方法为氟代联噻吩单体与π基团结构单体在催化剂和催化剂配体存在下发生聚合反应,得到所述含氟有机半导体材料。其中,所述氟代联噻吩单体为溴化氟代联噻吩单体或三甲基锡化氟代联噻吩单体所述π基团结构单体为锡化π基团结构单体硼酸π基团结构单体硼酸酯π基团结构单体溴化π基团结构单体或碘化π基团结构单体中的任意一种;r1为烷基,例如可以是甲基、乙基、正丙基、异丙基、仲丁基或叔丁基。其中,当所述氟代联噻吩单体为溴化氟代联噻吩单体时,π基团结构单体为锡化π基团结构单体、硼酸π基团结构单体或硼酸酯π基团结构单体中的任意一种;当所述氟代联噻吩单体为三甲基锡化氟代联噻吩单体时,π基团结构单体为溴化π基团结构单体或碘化π基团结构单体,氟代联噻吩单体与π基团结构单体具体反应式如下:优选地,所述氟代联噻吩单体与π基团结构单体的摩尔比为1:(1-1.2),例如可以是1:1、1:1.05、1:1.1、1:1.15或1:1.2。优选地,所述催化剂与氟代联噻吩单体的摩尔比为(0.01-0.05):1,例如可以是0.01:1、0.02:1、0.03:1、0.04:1或0.05:1,进一步优选0.04:1。优选地,所述催化剂与催化剂配体的摩尔比为1:(4-15),例如可以是1:4、1:5、1:7、1:8、1:9、1:10、1:12、1:14或1:15,进一步优选1:8。优选地,所述催化剂为三(二亚苄基丙酮)二钯。优选地,所述三(二亚苄基丙酮)二钯的用量使得其中所含钯相对于氟代联噻吩单体为0.005-0.1当量,例如可以是0.005当量、0.01当量、0.03当量、0.04当量、0.05当量、0.06当量、0.08当量或0.1当量,进一步优选0.01-0.06当量。优选地,所述催化剂配体为三(邻甲基苯基)磷。优选地,所述聚合反应在保护性气体保护下进行,所述保护性气体优选氩气、氮气或氦气中的任意一种。优选地,所述聚合反应的溶剂为无水甲苯、无水氯苯或无水dmf中的任意一种或至少两种的组合,优选无水甲苯。优选地,相对于1mmol氟代联噻吩单体,所述反应溶剂的用量为10-50ml,例如可以是10ml、20ml、30ml、40ml或50ml,优选15-30ml。优选地,所述聚合反应的温度为50-170℃,例如可以是50℃、60℃、80℃、100℃、120℃、140℃、150℃、160℃或170℃,优选80-150℃。优选地,所述聚合反应的时间为1-72小时,例如可以是1小时、3小时、10小时、20小时、30小时、40小时、50小时、60小时、65小时、70小时或72小时,优选3-50小时。优选地,所述聚合反应的温度控制采用油浴或微波加热方式。优选地,所述聚合反应采取逐步加热的方式。优选地,所述逐步加热方式为:首先加热至80℃保持10分钟,继续加热至100℃保持10分钟,最后加热至140℃保持2小时。优选地,所述聚合反应结束时利用封端试剂进行封端。优选地,所述封端试剂为2-三丁基锡噻吩和2-溴噻吩的组合。优选地,所述封端时的温度为80-170℃(例如可以是80℃、100℃、120℃、140℃、150℃、160℃或170℃),所述封端的时间为10-40分钟(例如可以是10分钟、12分钟、14分钟、16分钟、20分钟、24分钟、25分钟、28分钟、30分钟或40分钟)。优选地,所述封端时的温度为120℃,所述封端的时间为30分钟。在本发明中,加入封端试剂后,将反应将至室温,滴加到甲醇(可包含12mol/l盐酸溶液,优选1mlhcl/100ml甲醇的比例)中,析出沉淀,搅拌3小时,而后将沉淀过滤干燥,得到粗产品,通过索氏提取器进行提取纯化(提取溶剂可以是甲醇、丙酮、正己烷、二氯甲烷、氯仿中任意三种或三种以上的溶剂各进行12小时抽提),最后用二氯甲烷或氯苯抽提,得到含氟有机半导体材料。第三方面,本发明提供一种氟代联噻吩单体的制备方法,具体方法包括如下步骤:(1)巯基甲酸乙酯与2,3-二氯丙酸甲酯在甲醇和氢氧化钠的条件下,得到化合物1,反应式如下:(2)化合物1与液溴溶剂中发生反应得到化合物2,反应式如下:(3)化合物2与碳酸钾和溴代物在溶剂中反应得到化合物3,反应式如下:(4)化合物3与氢氧化钠反应后经酸化得到化合物4,反应式如下:(5)化合物4在弱碱性溶剂中与铬酸铜反应得到化合物5,反应式如下:(6)化合物5与锂试剂、三甲基氯硅烷在溶剂中反应得到化合物6,反应式如下:(7)化合物6在锂试剂存在下,与氯化亚铜发生偶联反应得到化合物7,反应式如下:(8)将化合物7与锂试剂、n-氟代双苯磺酰胺反应得到化合物8,反应式如下:(9)将化合物8与液溴在溶剂中反应,得到溴化氟代联噻吩单体,反应式如下:(10)将溴化氟代联噻吩单体与锂试剂和三甲基氯化锡反应得到三甲基锡化氟代联噻吩单体,反应式如下:优选地,步骤(1)巯基甲酸乙酯与2,3-二氯丙酸甲酯与氢氧化钠的摩尔比为1:(1-2):(4-8),例如可以是1:1:4、1:1.5:6或1:2:8,进一步优选1:1:4.5。优选地,步骤(1)中的反应温度为10-50℃(例如可以是10℃、20℃、30℃、40℃或50℃),反应时间为24-48小时(例如可以是24小时、30小时、34小时、36小时、40小时或48小时。优选地,步骤(2)中化合物1与液溴的摩尔比为1:(1-2),例如可以是1:1、1:1.03、1:1.1、1:1.15或1:2,优选1:1。优选地,步骤(2)中反应的溶剂为乙酸。优选地,步骤(2)中反应的温度为10-30℃(例如可以是10℃、20℃或30℃),反应时间为24-48小时(例如可以是24小时、30小时、34小时、36小时、40小时或48小时。优选地,步骤(3)中化合物2与碳酸钾、溴代物反应的摩尔比为1:(5-10):(1-4),例如可以是1:5:1、1:7:3或1:10:4,优选1:9.4:1.5。优选地,步骤(3)中参与反应溴代物的r基为如下基团中的任意一种:优选地,步骤(3)中反应的温度为10-30℃(例如可以是10℃、20℃或30℃),反应时间为24-48小时(例如可以是24小时、30小时、34小时、36小时、40小时或48小时。优选地,步骤(4)中反应的溶剂为甲醇。优选地,步骤(4)中酸化为浓盐酸酸化。优选地,步骤(4)中化合物3与氢氧化钠反应的摩尔比为1:(1-20),例如可以是1:1、1:5、1:7、1:10、1:15或1:20,优选1:10。优选地,步骤(4)中反应温度为60-120℃(例如可以是60℃、70℃、80℃、90℃、100℃、110℃或120℃),反应时间为1~12小时(例如可以是1小时、2小时、4小时、8小时、10小时或12小时)。优选地,步骤(5)中所述弱碱性溶剂为喹啉。优选地,步骤(5)中化合物4与铬酸铜的摩尔比为1:(0.2-1),例如可以是1:0.2、1:0.4、1:0.6、1:0.8或1:1,优选1:0.4。优选地,步骤(5)中的反应温度为120-220℃(例如120℃、140℃、180℃、200℃或220℃),反应时间为1-10分钟(例如可以是1分钟、3分钟、5分钟、7分钟或10分钟)。优选地,步骤(6)中反应的溶剂为四氢呋喃。优选地,步骤(6)中所述锂试剂为二异丙基氨基锂。优选地,步骤(6)中化合物5与二异丙基氨基锂、三甲基氯硅烷反应的摩尔比为1:(1-1.5):(1-2),例如可以是1:1:1、1:1.1:1.3或1:1.5:2,优选1:1.1:1.3。优选地,步骤(6)中的反应温度为-80-30℃(例如可以是-80℃、-60℃、-30℃、-10℃、10℃、20℃或30℃),反应时间为1-48小时(例如可以是1小时、4小时、10小时、20小时、30小时、40小时或48小时)。优选地,步骤(7)中所述锂试剂为二异丙基氨基锂。优选地,步骤(7)中反应的溶剂为四氢呋喃。优选地,步骤(7)中化合物6与二异丙基氨基锂、氯化亚铜反应的摩尔比为1:(1-1.5):(1-2),例如可以是1:1:1、1:1.1:1.3或1:1.5:2,优选1:1.1:1.3。优选地,步骤(7)中的反应温度为-80-30℃(例如可以是-80℃、-60℃、-30℃、-10℃、10℃、20℃或30℃),反应时间为1-48小时(例如可以是1小时、4小时、10小时、20小时、30小时、40小时或48小时)。优选地,步骤(8)中所述锂试剂为叔丁基锂。优选地,步骤(8)中反应的溶剂为四氢呋喃。优选地,步骤(8)中化合物7与叔丁基锂、n-氟代双苯磺酰胺反应的摩尔比为1:(2-3):(2-3),例如可以是1:2:2、1:2.4:2.5或1:3:3,优选1:2.4:2.5。优选地,步骤(8)中的反应温度为-80-30℃(例如可以是-80℃、-60℃、-30℃、-10℃、10℃、20℃或30℃),反应时间为1-48小时(例如可以是1小时、4小时、10小时、20小时、30小时、40小时或48小时)。优选地,步骤(9)中反应的溶剂为氯仿。优选地,步骤(9)中化合物8与液溴的摩尔比为1:(2-3),例如可以是1:2、1:2.2、1:2.4、1:2.7或1:3,优选1:2.2。优选地,步骤(9)中的反应温度为10-50℃(例如可以是10℃、20℃、30℃、40℃或50℃),反应时间为1-48小时(例如可以是1小时、4小时、10小时、20小时、30小时、40小时或48小时)。优选地,步骤(10)中反应的溶剂为四氢呋喃。优选地,步骤(10)中所述锂试剂为正丁基锂。优选地,步骤(10)中溴化氟代联噻吩单体与正丁基锂、三甲基氯化锡反应的摩尔比为1:(2-3):(2-3),例如可以是1:2:2、1:2.3:2.4或1:3:3,优选1:2.3:2.4。优选地,步骤(1)到步骤(10)中所有反应均在保护性气体保护下进行,所述保护性气体优选氩气、氮气或氦气中的任意一种。第四方面,本发明提供的含氟有机半导体材料可以应用于有机太阳能电池中或有机场效应晶体管中。在本发明中,含氟有机半导体材料应用于有机太阳能电池中,可作为电池的活性层材料;而应用于有机场效应晶体管中时,可作为载流子传输材料。相对于现有技术,本发明具有以下有益效果:本发明提供的含氟有机半导体材料,具有优异的光电性能,高度的可溶性,良好的分子间堆砌能力及热稳定性,克服基于分子内硫氧弱相互作用“头碰头型”联噻吩构筑的有机半导体的homo能级不匹配的不足,既可以作为有机太阳电池的活性层材料,又可以应用于有机场效应晶体管中作为载流子传输材料。本发明提供的含氟有机半导体材料的合成路线效率高,收率高,制备成本低,后处理简单,适合应用于制备有机电子器件。附图说明图1a为本发明实施例1中化合物1的核磁共振氢谱图。图1b为本发明实施例1中化合物1的核磁共振碳谱图。图2a为本发明实施例1中化合物2的核磁共振氢谱图。图2b为本发明实施例1中化合物2的核磁共振碳谱图。图3a为本发明实施例1中化合物3的核磁共振氢谱图。图3b为本发明实施例1中化合物3的核磁共振碳谱图。图4a为本发明实施例1中化合物5的核磁共振氢谱图。图4b为本发明实施例1中化合物5的核磁共振碳谱图。图5a为本发明实施例1中化合物6的核磁共振氢谱图。图5b为本发明实施例1中化合物6的核磁共振碳谱图。图6a为本发明实施例1中化合物7的核磁共振氢谱图。图6b为本发明实施例1中化合物7的核磁共振碳谱图。图7a为本发明实施例1中化合物8的核磁共振氢谱图。图7b为本发明实施例1中化合物8的核磁共振碳谱图。图7c为本发明实施例1中化合物8的核磁共振氟谱图。图8a为本发明实施例1中溴化氟代联噻吩单体的核磁共振氢谱图。图8b为本发明实施例1中溴化氟代联噻吩单体的核磁共振碳谱图。图8c为本发明实施例1中溴化氟代联噻吩单体的核磁共振氟谱图。图9a为本发明实施例2中三甲基锡化氟代联噻吩单体的核磁共振氢谱图。图9b为本发明实施例2中三甲基锡化氟代联噻吩单体的核磁共振碳谱图。图9c为本发明实施例2中三甲基锡化氟代联噻吩单体的核磁共振氟谱图。图10为本发明实施例3聚合物pbdtbtfor的紫外-可见光光谱图。图11为本发明实施例4聚合物ptpdbtfor的紫外-可见光光谱图。图12为本发明实施例5聚合物pptitfor的紫外-可见光光谱图。图13为本发明实施例6聚合物pbti2btfor的紫外-可见光光谱图。图14为本发明实施例7聚合物pbtfor的紫外-可见光光谱图。图15a为本发明实施例7聚合物pbtfor的热重曲线图。图15b为本发明实施例7聚合物pbtfor的差示扫描量热曲线图。图16为本发明实施例7聚合物pbtfor的电化学性能曲线图。图17为本发明实施例8利用聚合物pbdtbtfor作材料的有机太阳电池的器件结构图。图18为本发明实施例8基于pbdtbtfor作材料的有机太阳电池j-v曲线图。图19为本发明实施例9利用聚合物pbtfor作载流子传输材料的有机场效应晶体管的器件结构图。图20a为本发明实施例9中有机场效应晶体管的转移曲线图。图20b为本发明实施例9中有机场效应晶体管的输出曲线图。具体实施方式下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。本发明中,所有基本试剂及化学品均通过商业化公司购买,如无特殊说明,使用前都经过进一步纯化处理。无水甲苯和无水四氢呋喃通过金属钠和二苯甲酮蒸馏处理制得。如无特殊说明,所有反应都在保护性气体保护下进行。核磁谱图通过布鲁克500mhz核磁共振仪测试得到。高分辨质谱通过热电公司的thermoscientifictmq-exactive完成。分子量测试由高温gpc(agilentpl-gpc220)测试完成。紫外光谱由shimadzuuv-3600光谱仪测试。循环伏安曲线由chi760电化学工作站测试得到。热分析由staresystem系统测试完成。实施例1本实施例通过以下步骤制备溴化氟代联噻吩单体:(1)巯基甲酸乙酯与2,3-二氯丙酸甲酯在甲醇和氢氧化钠的条件下,得到化合物1反应式如下:在氮气保护条件下,向250毫升的烧瓶中加入氢氧化钠(38.4g,457mmol)和甲醇(200ml)。将预先配好2,3-二氯丙酸甲酯(12.2ml,102mmol)和巯基甲酸乙酯(9.12ml,102mmol)的甲醇(20ml)溶液使用注射器慢慢滴加至反应烧瓶中,滴加完毕后,将反应液回流15小时。冷却至室温,使用浓盐酸将反应液的ph值调至1。使用二氯甲烷(80ml)萃取3次,合并有机相,干燥后旋干,将得到的粗产物使用硅胶填料的层析柱色谱提纯,最后得纯白色固体,化合物1,产率为43%。化合物的结构表征数据如下:氢谱(图1a所示):9.58(s,1h),7.37(d,j=5.4hz,1h),6.75(d,j=5.4hz,1h),3.89(s,3h)。碳谱(图1b所示):166.84,164.73,131.65,119.32,103.85,52.03。质谱:158。(2)化合物1与液溴溶剂中发生反应得到化合物2,反应式如下:在氮气保护条件下,向50毫升的烧瓶中加入步骤1的化合物1(5.62g,35.7mmol)和乙酸(20ml)。在避光条件下,慢慢向反应液中滴加液溴(1.82ml,35.7mmol)后在室温下搅拌24小时。将反应液倒入50毫升水中,使用二氯甲烷(20ml)萃取3次,合并有机相,干燥后旋干,将得到的粗产物使用硅胶填料的层析柱色谱提纯,最后得目标化合物2,产率为60%。化合物的结构表征数据如下:氢谱(图2a所示):9.73(s,1h),7.37(s,1h),3.91(s,3h)。碳谱(图2b所示):165.93,160.55,128.31,103.94,102.74,52.40。(3)化合物2与碳酸钾和溴代物在溶剂中反应得到化合物3,反应式如下:在氮气保护条件下,向250毫升加入步骤2的化合物2(10g,42.18mmol),dmf(120ml)和无水碳酸钾(56g,397mmol),慢慢将1-溴代十二烷(15.4ml,63.27mmol)滴加至反应液中。然后将反应液在室温下搅拌24小时,反应完毕后将反应液倒入500毫升水中,使用二氯甲烷(100ml)萃取3次,合并有机相,干燥后旋干,将得到的粗产物使用硅胶填料的层析柱色谱提纯,最后得淡黄色化合物3,产率为65%。化合物的结构表征数据如下:氢谱(图3a所示):7.38(s,1h),4.16(t,j=6.6hz,2h),3.87(s,3h),1.92–1.74(m,2h),1.57–1.46(m,2h),1.40–1.17(m,16h),0.93–0.80(m,3h)。碳谱(图3b所示):160.99,158.29,127.14,116.85,109.02,52.23,32.07,30.26,29.80,29.78,29.75,29.72,29.55,29.50,27.05,25.97,22.83,14.26。(4)化合物3与氢氧化钠反应后经酸化得到化合物4,反应式如下:在氮气保护条件下,向100毫升的反应烧瓶加入步骤3的化合物3(1.22g,3mmol)和甲醇(30ml),将预先配好的氢氧化钠水溶液(3.6ml,3.6g)慢慢滴加至反应液中,滴加完毕后回流3小时。冷却至室温后,使用浓盐酸将反应液的ph值调至1,使用二氯甲烷(15ml)萃取3次,合并有机相,干燥后旋干,将得到的粗产物(化合物4)不经纯化直接用于下一步反应。(5)化合物4在弱碱性溶剂中与铬酸铜反应得到化合物5,反应式如下:在氮气保护条件下,向10毫升的反应瓶中加入步骤4得到的化合物4,喹啉(4ml)和铬酸铜(373mg,0.4倍当量),封闭反应瓶。将反应瓶放入微波反应器中加热至200℃反应3分钟。冷却反应液至室温后,将其倒入2摩尔每升的硫酸溶液中,使用二氯甲烷(20ml)萃取3次,合并有机相,干燥后旋干,将得到的粗产物使用硅胶填料的层析柱色谱提纯,最后得无色液体,化合物5,步骤4与步骤5两步的总产率为97%。化合物5的结构表征数据如下:氢谱(图4a所示):7.17(d,j=3.5hz,1h),6.20(d,j=3.5hz,1h),3.98(d,j=6.6hz,2h),1.91–1.66(m,2h),1.54–1.39(m,2h),1.41–1.14(m,16h),0.97–0.83(m,3h)。碳谱(图4b所示):153.99,121.97,103.57,97.20,71.07,32.07,29.81,29.79,29.73,29.69,29.50,29.48,29.11,26.09,22.84,14.28。质谱:348.1。(6)化合物5与锂试剂、三甲基氯硅烷在溶剂中反应得到化合物6,反应式如下:在氮气保护条件下,向25毫升的反应烧瓶中加入步骤5得到的化合物5(800mg,2.3mmol),四氢呋喃(20ml),将反应液冷却至-78℃,缓缓滴加二异丙基氨基锂(1.38mmol,2m,1.1倍当量)。滴加完毕后维持在该温度下继续搅拌35分钟,然后一次性加入三甲基氯硅烷(0.4ml,1.3倍当量)继续搅拌1小时。然后将反应液回到室温反应过夜。将反应液倒入水中,使用二氯甲烷(15ml)萃取3次,合并有机相,干燥后旋干,将得到的粗产物使用硅胶填料的层析柱色谱提纯,最后得无色液体,化合物6,产率为91%。化合物6的结构表征数据如下:氢谱(图5a所示):6.43(s,1h),3.97(t,j=6.6hz,2h),1.91–1.71(m,2h),1.58–1.47(m,2h),1.39–1.18(m,16h),0.94–0.84(t,j=6.8hz,3h),0.38(s,9h)。碳谱(图5b所示):155.61,133.57,110.28,101.79,71.21,29.82,29.79,29.74,29.70,29.51,29.19,27.06,26.13,22.85,14.28,-1.06。质谱:420.2。(7)化合物6在锂试剂存在下,与氯化亚铜发生偶联反应得到化合物7,反应式如下:在氮气保护条件下,向50ml的反应瓶中加入步骤6得到的化合物6(2.1g,5mmol),四氢呋喃(40ml),将反应液冷却至-78℃,缓缓滴加二异丙基氨基锂(2.75ml,1.1倍当量)。滴加完毕后维持在该温度下反应30分钟,然后一次性加入氯化铜(878mg,1.3倍当量。将反应液回到室温反应过夜。将反应液倒入水中,使用二氯甲烷(30ml)萃取3次,合并有机相,干燥后旋干,将得到的粗产物使用硅胶填料的层析柱色谱提纯,最后得淡黄色固体,化合物7,产率为72%。化合物7的结构表征数据如下:熔点为52℃。氢谱(图6a所示):4.00(t,j=6.5hz,2h),1.98–1.76(m,2h),1.56–1.45(m,2h),1.42–1.19(m,16h),0.88(t,j=6.8hz,3h),0.40(s,9h)。碳谱(图6b所示):151.23,131.72,123.65,114.04,74.00,32.08,30.31,29.84,29.80,29.77,29.73,29.52,26.17,22.85,14.28,-0.96。高分辨率质谱:c38h69o2br2s2si2计算值为837.2618;测量值为837.2618。(8)将化合物7与锂试剂、n-氟代双苯磺酰胺反应得到化合物8,反应式如下:在氮气保护条件下,向50ml的反应瓶中加入步骤7得到的化合物7(1.75g,2.1mmol),四氢呋喃(30ml),将反应液冷却至-78℃,缓缓滴加叔丁基锂(3.9ml,2.4倍当量)。滴加完毕后维持在该温度下反应20分钟,然后一次性加入n-氟代双苯磺酰胺(1.5g,2.5倍当量)。将反应液回到室温反应过夜。反应完毕后将反应液倒入水中,使用二氯甲烷(25ml)萃取3次,合并有机相,干燥后旋干,得到的粗产物使用反相柱提纯,最后得到纯白色固体,化合物8,产率为35%。化合物8的结构表征数据如下:熔点为59℃。氢谱(图7a所示):4.12(t,j=6.4hz,2h),1.96–1.73(m,2h),1.52–1.48(m,2h),1.40–1.15(m,16h),0.88(t,j=6.8hz,3h),0.33(s,9h)。碳谱(图7b所示):154.96(d,j=257.1hz),141.17(d,j=22.7hz),121.85(dd,j=5.2,1.0hz),112.10(d,j=26.5hz),73.53(d,j=4.0hz),31.94,30.18,29.71,29.67,29.65,29.49,29.39,26.01,22.72,14.15,-0.69。氟谱(图7c所示):-125.12。高分辨率质谱:c38h69o2f2s2si2计算值为715.4240;测量值为715.4245。(9)将化合物8与液溴在溶剂中反应,得到溴化氟代联噻吩单体,反应式如下:在氮气保护条件下,向25ml的反应瓶中加入步骤8得到的化合物8(71.5mg,0.1mmol),二氟甲烷(10ml),在避光条件下慢慢滴加液溴(35mg,2倍当量)。滴加完毕后,将反应液加热至回流并反应过夜。反应完毕后将反应液倒入水中,使用二氯甲烷(10ml)萃取3次,合并有机相萃取液,干燥后旋干,将得到的粗产物使用反相柱提纯,最后得到纯白色晶体,溴化氟代联噻吩单体,产率为69%。溴化氟代联噻吩单体的结构表征数据如下:熔点为54℃。氢谱(图8a所示):4.14(t,j=6.2hz,2h),1.95–1.70(m,2h),1.50–1.41(m,2h),1.41–1.13(m,16h),0.88(t,j=6.8hz,3h)。碳谱(图8b所示):148.56(d,j=262.0hz),139.30(d,j=17.9hz),116.41(dd,j=6.3,2.4hz),90.57(d,j=18.5hz),73.98,73.95,32.08,30.09,29.81,29.79,29.73,29.70,29.52,29.41,25.84,22.85,14.29。氟谱(图8c所示):-131.42。高分辨质谱:c32h51o2br2f2s2si2计算值为729.1639;测量值为729.1628。实施例2本实施例通过以下步骤制备三甲基锡化氟代联噻吩单体:将溴化氟代联噻吩单体与锂试剂和三甲基氯化锡反应得到三甲基锡化氟代联噻吩单体,反应式如下:在氮气保护条件下,向25ml的反应瓶中加入溴化氟代联噻吩单体(103mg,0.14mmol),四氢呋喃(20ml),将反应液冷却至-78℃,缓缓滴加正丁基锂(0.1ml,2.3倍当量)。滴加完毕后维持在该温度下反应1小时,回到室温继续反应1小时。将反应液冷却至-78℃,然后一次性加入三甲基氯化锡(0.34ml,2.4倍当量)。将反应液回到室温反应过夜,反应完毕后将反应液倒入水中,使用二氯甲烷(5ml)萃取3次,合并有机相,干燥后旋干,将得到的粗产物使用甲醇重结晶后得纯白色晶体,三甲基锡化氟代联噻吩单体,产率为88%。三甲基锡化氟代联噻吩单体的结构表征数据如下:熔点为58℃.氢谱(图9a所示):4.10(t,j=6.5hz,2h),1.93–1.74(m,2h),1.55–1.44(m,2h),1.40–1.16(m,16h),0.88(t,j=6.8hz,3h),0.43(s,9h)。碳谱(图9b所示):155.80(d,j=251.6hz),140.78(d,j=24.6hz),123.28(dd,j=4.8,2.1hz),109.77(d,j=38.4hz),73.45(d,j=3.9hz),32.08,30.31,29.85,29.81,29.79,29.63,29.5226.12,22.85,14.28,-8.27。氟谱(图9c所示):-125.14。高分辨率质谱:c38h68o2f2s2sn2计算值为898.2667;测量值为898.2678。实施例3本实施例通过以下方法制备含氟有机半导体材料式ii所示结构,pbdtbtfor,具体反应式如下:在氮气保护条件下,将溴化氟代联噻吩单体(48.6mg,0.067mmol),4,8-双(5-((2-乙基己基)硫代(噻吩-2-基)苯并[1,2-b:4,5-b']二噻吩双三甲基锡(64.6mg,1倍当量,购于朔纶有机光电科技有限公司),三(二亚苄基丙酮)二钯(0.015倍当量)和三(邻苯甲基)膦(0.12倍当量),抽换三次气后,加入新蒸馏的甲苯(3ml),封管后放放微波中反应。反应时间与温度设置为:80℃反应10分钟,100℃反应10分钟,140℃反应2小时。反应完毕后,使用2-三甲基锡噻吩和2-溴噻吩封端,反应时间与温度统一设置为120℃下反应30分钟。冷却后,将反应液倒入剧烈搅拌的100ml甲醇与hcl的混合液中,体积比为20:1,室温搅拌3小时后过滤得到粗产品。将所得固体使用索氏抽提器进行纯化,抽提使用的溶剂依次为甲醇、丙酮、正己烷、二氯甲烷各12小时,最后用三氯甲烷抽提得到具有金属光泽的目标聚合物60毫克,产率为74%。结构表征数据如下:分子量:gpc:mn=19.1kda,mw=22.92kda,元素分析:c66h92f2o2s8计算值为c,65.41;h,7.65;f,3.14;o,2.64;s,21.16.测量值为c,66.1;h,7.52;s,21.55。由上可知该聚合物结构正确,为聚合物pbdtbtfor。将聚合物pbdtbtfor进行光谱性能测试,分别为聚合物pbdtbtfor的三氯甲烷溶液和薄膜的紫外-可见光吸收光谱测试。结果如图10所示。从图10可以看出,聚合物溶液的吸收峰位于575nm和612nm。当聚合物处于固态薄膜时,其紫外-可见光吸收光谱和溶液相差无几,说明该聚合物具有较强的分子间作用力。另外,其薄膜吸收边约在660nm,对应光学带隙为1.88ev。实施例4本实施例通过以下方法制备含氟有机半导体材料式iii所示结构,ptpdbtfor,具体反应式如下:在氮气保护条件下,将三甲基锡化氟代联噻吩单体(68.6mg,0.0765mmol),1,3-二溴5-十二烷基-4h-噻吩[3,4-c]并吡咯-4,6(5h)-二酮(64.6mg,1倍当量,制备参见文献j.am.chem.soc.,2011,133,13685-13697),三(二亚苄基丙酮)二钯(0.005倍当量)和三(邻苯甲基)膦(0.02倍当量),抽换三次气后,加入新蒸馏的甲苯(3.825ml),封管后放放微波中反应。反应时间与温度设置为:80℃反应10分钟,100℃反应10分钟,140℃反应2小时。反应完毕后,使用2-三甲基锡噻吩和2-溴噻吩封端,反应时间与温度统一设置为120℃下反应30分钟。冷却后,将反应液倒入剧烈搅拌的100ml甲醇与hcl的混合液中,体积比为20:1,室温搅拌3小时后过滤得到粗产品。将所得固体使用索氏抽提器进行纯化,抽提使用的溶剂依次为甲醇、丙酮、正己烷各12小时,最后用二氯甲烷抽提得到目标聚合物65毫克,产率为95%。结构表征数据如下:分子量:gpc:mn=9.5kda,mw=12.5kda,元素分析:c50h77f2no4s3计算值为c,67.45;h,8.72;f,4.27;n,1.57;o,7.19;s,10.80.测量值为c,67.81;h,8.52;s,10.97。由上可知该聚合物结构正确,为聚合物ptpdbtfor。将聚合物ptpdbtfor进行光谱性能测试,分别为聚合物ptpdbtfor的三氯甲烷溶液和薄膜的紫外-可见光吸收光谱测试。结果如图11所示。从图11可以看出,聚合物溶液和薄膜的吸收峰均处于同一位置,但是其薄膜在700-900nm处出现了弱吸收,说明该聚合物在薄膜状态出现了规整的聚集。实施例5本实施例通过以下方法制备含氟有机半导体材料式iv所示结构,pptibtfor,具体反应式如下:在氮气保护条件下,将三甲基锡化氟代联噻吩单体(73.8mg,0.0823mmol),4,7-二溴-2-十二烷基异吲哚啉-1,3-二酮(38.9mg,1倍当量,制备参见文献j.am.chem.soc.,2009,131,7206-7207),三(二亚苄基丙酮)二钯(0.05倍当量)和三(邻苯甲基)膦(0.15倍当量),抽换三次气后,加入新蒸馏的甲苯(0.0823ml),封管后放放微波中反应。反应时间与温度设置为:80℃反应10分钟,100℃反应10分钟,140℃反应2小时。反应完毕后,使用2-三甲基锡噻吩和2-溴噻吩封端,反应时间与温度统一设置为80℃下反应30分钟。冷却后,将反应液倒入剧烈搅拌的100ml甲醇与hcl的混合液中,体积比为20:1,室温搅拌3小时后过滤得到粗产品。将所得固体使用索氏抽提器进行纯化,抽提使用的溶剂依次为甲醇、丙酮、正己烷、二氯甲烷、三氯甲烷各12小时,最后用氯苯抽提得到红色目标聚合物60毫克,产率为83%。结构表征数据如下:分子量:gpc:mn=269kda,mw=403.5kda,元素分析:c52h79f2no4s2计算值为c,70.63;h,9.00;f,4.30;n,1.58;o,7.24;s,7.25.测量值为c,70.94;h,9.22;s,7.38。由上可知该聚合物结构正确,为聚合物pptibtfor。将聚合物pptibtfor进行光谱性能测试,分别为聚合物pptibtfor的氯苯溶液和薄膜的紫外-可见光吸收光谱测试。结果如图12所示。从图12可以看出,聚合物在溶液和固体状态下均出现一个较强的分子电荷转移吸收谱带。其中,溶液的吸收边为536nm,固体薄膜的吸收边则红移至563nm处。实施例6本实施例通过以下方法制备含氟有机半导体材料式v所示结构,pbti2btfor,具体反应式如下:在氮气保护条件下,将三甲基锡化氟代联噻吩单体(40mg,0.0446mmol),bti2(61.68mg,1.2倍当量,制备参见文献angew.chem.int.ed.,2017,56,9924-9929),三(二亚苄基丙酮)二钯(0.01倍当量)和三(邻苯甲基)膦(0.12倍当量),抽换三次气后,加入新蒸馏的甲苯(3ml),封管后放放微波中反应。反应时间与温度设置为:50℃反应10分钟,100℃反应10分钟,170℃反应40分钟。反应完毕后,使用2-三甲基锡噻吩和2-溴噻吩封端,反应时间与温度统一设置为170℃下反应30分钟。冷却后,将反应液倒入剧烈搅拌的100ml甲醇与hcl的混合液中,体积比为20:1,室温搅拌3小时后过滤得到粗产品。将所得固体使用索氏抽提器进行纯化,抽提使用的溶剂依次为甲醇、丙酮、正己烷各12小时,最后用二氯甲烷抽提得到蓝色目标聚合物45毫克,产率为64%。结构表征数据如下:分子量:gpc:mn=7.5kda,mw=18.75kda,元素分析:c90h136f2n2o6s6计算值为c,68.75;h,8.72;f,2.42;n,1.78;o,6.10;s,12.23.测量值为c,69.24;h,8.62;s,12.1。由上可知该聚合物结构正确,为聚合物pbti2btfor。将聚合物pbti2btfor进行光谱性能测试,分别为聚合物pbti2btfor的三氯甲烷溶液和薄膜的紫外-可见光吸收光谱测试。结果如图13所示。从图13可以看出,聚合物的溶液和薄膜吸收峰较为接近,其薄膜吸收边为800nm处,对应于其光学带隙为1.55ev。实施例7本实施例通过以下方法制备含氟有机半导体材料式vi所示结构,pbtfor,具体反应式如下:在氮气保护条件下,将氟代联噻吩单体(57.5mg,0.064mmol),三甲基锡化氟代联噻吩单体(46.74mg,1倍当量),三(二亚苄基丙酮)二钯(0.015倍当量)和三(邻苯甲基)膦(0.12倍当量),抽换三次气后,加入新蒸馏的甲苯(3ml),封管后放放微波中反应。反应时间与温度设置为:80℃反应10分钟,100℃反应10分钟,140℃反应71小时40分钟。反应完毕后,使用2-三甲基锡噻吩和2-溴噻吩封端,反应时间与温度统一设置为120℃下反应30分钟。冷却后,将反应液倒入剧烈搅拌的100ml甲醇与hcl的混合液中,体积比为20:1,室温搅拌3小时后过滤得到粗产品。将所得固体使用索氏抽提器进行纯化,抽提使用的溶剂依次为甲醇、丙酮、正己烷、二氯甲烷、三氯甲烷各12小时,最后用氯苯抽提得到具有金属光泽的目标聚合物60毫克,产率为82%。结构表征数据如下:分子量:gpc:mn=34.5kda,mw=61.25kda,元素分析:c32h52f2o2s2计算值为c,67.33;h,9.18;f,6.66;o,5.61;s,11.23。测量值为c,67.53;h,9.53;s,11.41。由上可知该聚合物结构正确,为聚合物pbtfor。将聚合物pbtfor进行光谱性能测试,分别为聚合物pbtfor的三氯甲烷溶液和薄膜的紫外-可见光吸收光谱测试。结果如图14所示。从图14可以看出,聚合物溶液和薄膜的吸收峰较为接近,说明该聚合物具有特别强的分子内/间聚集能力。从聚合物的薄膜吸收边缘计算出pbtfor的光学带隙约为1.82ev。将聚合物pbtfor进行热学性能测试,结果如图15a、15b所示。聚合物相对于5%质量损失,温度为326℃,说明该聚合物有良好的热稳定性。聚合物在50-320℃范围内并未见明显的吸热或者放热峰。将聚合物pbtfor进行电化学性能测试。电化学测试采用chi660a电化学工作站测试。工作电极为铂,对电极为铂丝,参比电极为银/氯化银,电解液为0.1m四丁基六氟膦酸胺的乙腈溶液。结果如图16所示。曲线表明,聚合物pbtfor的最高占据轨道(homo)能级为-4.98ev。说明氟原子的引入,可以有效补偿氧原子的供电子能力,大大拉低相应聚合物的homo能级。实施例8聚合物pbdtbtfor的有机太阳电池制备与光伏性能测试:有机太阳电池的器件结构为glass/ito/moox/pbdtbtfor:pc71bm/ca/al(图17所示)。在清洗完毕的方块电阻为10ω·sq-1ito玻璃上蒸镀一层厚度为10nm的moox作为空穴提取层,然后在上面甩上约100nm的活性层材料(pbdtbtfor:pc71bm=1:2,质量比,10mg·ml-1的邻二氯苯溶液),最后蒸镀上15nm的钙和100nm的铝。器件尺寸大小为0.045cm-2。器件的测试在手套箱中进行,氙灯模拟太阳光源(newport,orielam1.5g,100mw-2)。图为器件的电流-电压曲线(图18所示),对应数据如表1所示。表1聚合物溶剂开路电压短路电流填充因子转换效率pbdtbtforo-dcb0.59v5.91ma·cm-242%1.48%实施例9聚合物pbtfor的场效应晶体管制备与性能测试:如图所示,利用该聚合物作为活性层制备了顶栅-底接触(tgbc)结构(图19所示)的有机场效应管:采用光刻技术在硼硅玻璃上制备源漏电极(3nmcr和30nmau)。玻璃基底使用丙酮和异丙醇超声10分钟,然后用uv处理30分钟。将基底转移至手套箱中,趁热将聚合物的1,2,4-三氯苯溶液(5mg·ml-1,~160℃),然后将聚合物薄膜置于手套箱中200℃退火10分钟。随后,甩上一层约400nm的cytop介电层。最后,在相应的介电层上蒸镀一层厚度为50nm的铝作为栅极。在氮气中,使用keithley4200scs半导体测试仪测试器件的场效应晶体管性能。聚合物pbtfor作为活性层在不退火及退火条件下制备的场效应晶体管的转移曲线(图20a所示)和输出曲线(图20b所示),载流子迁移率可由方程计算出:ids=(w/2l)ciμ(vg-vt)2。其中,ids为漏极电流,μ为载流子迁移率,vg为栅极电压,vt为阈值电压,w为沟道宽度5mm,l为沟道长度20μm,ci为绝缘体电容7.5×10-2法每平方厘米。相应的场效应晶体管的器件性能如表2所示。表2聚合物退火温度空穴迁移率(cm2·v-1·s-1)阈值电压开关比pbtfor200℃0.24-12v103以聚合物pbtfor薄膜在200℃下退火10分钟时,饱和空穴迁移率为0.24cm2·v-1·s-1,阈值电压为-12v,开关比为103。通过有机太阳电池聚合物场效应晶体管性能分析得知,本发明的含氟有机半导体材料是一类优良的有机半导体材料。申请人声明,本发明通过上述实施例来说明本发明的一种含氟有机半导体材料及其制备方法与应用,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属
技术领域:
的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1