芘降解功能植物内生细菌PRd5及其应用的制作方法
本发明属于污染环境微生物修复领域,具体涉及了一株芘降解功能植物内生细菌prd5及其应用。
背景技术:
植物可以从大气、水和土壤中积累对身体健康有害的多环芳烃污染物,并通过食物链富集到人体内,危及人类健康。因此,亟需解决pahs在农作物体内的积累,保障农产品安全和人类健康。芘作为pahs中四环污染物的典型代表,由于其环境持久性以及毒性,常被用作测定环境中pahs污染的指示物和pahs生物降解的模型分子。
植物内生细菌是一类能定殖于植物健康组织间隙或细胞内,不受外部环境影响,能与宿主植物和谐共生的一类微生物。本实验筛选的功能内生细菌不仅可以调控植物对污染物的吸收同时可以提高植物降解有机污染物的能力。
技术实现要素:
发明目的:本发明所要解决的技术问题是提供一株高效芘降解功能植物内生细菌prd5以及确定其定殖方法和定殖数量。
本发明还要解决的技术问题是提供了上述芘降解功能植物内生细菌prd5的筛选方法。
本发明还要解决的技术问题是提供了芘降解功能植物内生细菌prd5在降低芘污染中的应用。
本发明还要解决的技术问题是提供了芘降解功能植物内生细菌prd5在降低农作物中芘污染的应用,具体是定殖于植物体内以降低植物和种植环境中的芘污染。
技术方案:为了解决上述技术问题,本发明所采用的技术方案为:芘降解功能植物内生细菌prd5,其分类命名为肠杆菌属(enterobactersp.),保藏编号为cgmccno.13218,该菌株已于2016年10月31日保藏于中国普通微生物菌种保藏管理中心(cgmcc),保藏地址:北京市朝阳区北辰西路1号院3号(中国科学院微生物研究所),邮编:100101。
本发明芘降解功能植物内生细菌prd5的分离过程为:采集江苏省南京市的扬子石化芳烃厂排污口生长良好的植物体,先将植物表面消毒,研磨液稀释涂布于芘无机盐固体培养基上分离纯化出菌株;挑选有明显降解圈且长势旺盛的菌株对其芘降解能力进行测定,最终筛选出芘降解功能植物内生细菌prd5。
一株芘降解功能植物内生细菌prd5的筛选方法,包括以下步骤:将采集的植物样品清洗干净后置于无菌操作台内依次用75%乙醇水溶液漂洗3~5min,再用无菌水冲洗3~4次,0.1%naclo漂洗2~5min,再用无菌水冲洗至确保植物表面消毒剂被洗干净。将消毒好的植物样品移入lb固体平板中30℃培养72h,检查植物表面是否存在残留的细菌。剪碎消毒好的植物样品,放进含有适量无菌水的灭菌研钵中充分研磨,静置20min,吸取研磨液的上清稀释涂布于制备好的芘无机盐固体培养基上,30℃培养48h,挑取不同形态的、生长良好的单菌落反复划线,纯化分离菌株。挑选有明显降解圈且长势旺盛的菌株对其芘降解能力进行测定,最终筛选出芘降解功能植物内生细菌prd5。
上述芘降解功能植物内生细菌prd5通过芘无机盐固体培养基筛选获得。
其中,上述芘无机盐培养基包含以下成分:(nh4)2so4、k2hpo4·3h2o、kh2po4、nacl、mgso4·7h2o、微量元素溶液,ph7.0~7.2,芘含量为50~100mg·l-1。
其中,上述微量元素溶液包含以下成分:cocl2·6h2o、mncl2·4h2o、zncl2、nicl2·6h2o、cuso4·5h2o、na2moo4·2h2o、na2seo4·2h2o。
作为优选,上述芘无机盐固体培养基具体由以下成分组成:(nh4)2so41.50g,k2hpo4·3h2o1.91g,kh2po40.50g,nacl0.50g,mgso4·7h2o0.20g,微量元素溶液2ml,蒸馏水定容至1000ml,ph7.0~7.2。液体培养基中加入1.5%~2%的琼脂后121℃高压灭菌20min,待培养基冷却至50℃~60℃加入适量的芘丙酮溶液,使培养基中芘的终浓度为50mg·l-1。
作为优选,上述微量元素溶液具体由以下成分组成:cocl2·6h2o0.1g,mncl2·4h2o0.425g,zncl20.05g,nicl2·6h2o0.01g,cuso4·5h2o0.015g,na2moo4·2h2o0.01g,na2seo4·2h2o0.01g,蒸馏水定容至1000ml。
其中,上述lb培养基由以下成分组成:蛋白胨10g,酵母粉5g,nacl10g,蒸馏水定容至1000ml,ph7.0~7.2。
其中,上述芘降解功能植物内生细菌prd5芘降解率的测定方法,芘降解培养基制作步骤为:5mg·ml-1的芘丙酮溶液过0.22μm滤膜除菌,取一定量置于灭菌的三角瓶中,待丙酮挥发完,加入已灭菌的无机盐培养液,使芘的最终浓度达到50mg·l-1。
其中,上述芘降解功能植物内生细菌prd5芘降解率的测定方法,培养基中芘含量的测定包括以下步骤:培养体系中加入等体积色谱甲醇,30min超声萃取混匀,静置后过0.22μm滤膜,用岛津高效液相色谱测定芘浓度。高效液相色谱设定参数为:inertsilods-sp-c18反相色谱柱(150mm×4.6mm,5μm),流动相甲醇:水=90:10,流速1.0ml·min-1,柱温40℃,检测波长245nm,进样量20μl。
本发明内容还包括添加了基础代谢物质葡萄糖后,芘降解功能植物内生细菌prd5对50mg·l-1芘的降解动力学曲线。
本发明内容还包括芘降解功能植物内生细菌prd5在降低芘污染中的应用。
上述的应用指的是芘降解功能植物内生细菌prd5定殖于植物中以降低植物体内与种植环境中的芘污染的应用。
上述的应用指的是所述的芘降解功能植物内生细菌prd5通过浸种和/或灌根+涂叶的定殖方法定殖于植物中以降低植物体内与种植环境中的芘污染的应用。
本发明通过利用浸种和/或灌根+涂叶等定殖方式将抗性标记过的芘降解功能植物内生细菌prd5通定殖于以空心菜或上海青等为代表的农作物体内以降低植物和种植环境中的芘污染。本发明的植物不仅限于上述的空心菜或上海青等植物,本发明可以用于其他植物中芘含量的降解。
其中,本发明对定殖数量的研究中利用了菌株的抗性标记。抗性平板的制作步骤为:将lb液体培养基或无机盐液体培养基中加入1.5%~2%的琼脂后121℃高压灭菌20min,待培养基冷却至50℃~60℃加入适量的抗生素溶液,使抗生素的最终浓度达到试验的目标浓度(10~150mg·l-1)。
其中,上述的浸种定殖方法为农作物种子经表面消毒、催芽、育苗48h后,用od600nm=1.0(约为8.77lgcfu·ml-1)的抗性菌株prd5菌悬液浸泡6h。经对功能菌抗性标记后证实,芘降解功能植物内生细菌prd5可定殖于作物体内。
其中,上述的灌根+涂叶定殖方法为农作物种子经表面消毒、催芽、育苗48h后播种于土壤中,培养至长出第一、二片真叶时,取od600nm=1.0(约为8.77lgcfu·ml-1)的抗性菌株prd5菌悬液浇灌于各植物根部土壤,并将菌悬液涂抹叶片。经对功能菌抗性标记后证实,芘降解功能植物内生细菌prd5可定殖于作物体内。
有益效果:芘降解功能植物内生细菌prd5在基础代谢基质存在条件下,对芘有较高的降解能力,并可通过浸种或者灌根+涂叶方式定殖到植物体内,促进植物生长同时降低植物体内和环境中的芘污染,芘污染浓度可达50~100mg·kg-1,确保农产品安全,改善环境质量。
附图说明
图1为芘降解功能植物内生细菌prd5菌落形态;
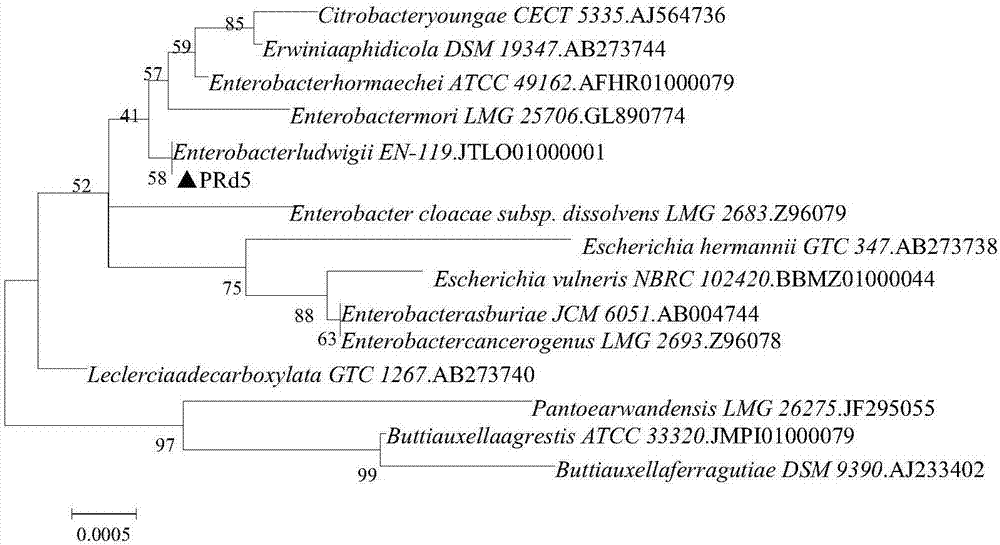
图2为基于16srrna基因序列同源性的芘降解功能植物内生细菌prd5的系统发育树;
图3为芘降解功能植物内生细菌prd5芘降解动力学曲线图;
图4为芘降解功能植物内生菌株prd5定殖对培养液中芘残留量的影响;(mg·l-1);注:“**”表示接菌与不接菌处理组对比,培养液中芘的残留浓度存在显著性差异(p<0.01);
图5为芘降解功能植物内生细菌prd5定殖对上海青体内芘降解的促进效率(%);
图6为芘降解功能植物内生细菌prd5定殖对50mg·kg-1芘污染土壤中芘残留量的影响(mg·kg-1);
图7为芘降解功能植物内生细菌prd5定殖对100mg·kg-1芘污染土壤中芘残留量的影响(mg·kg-1)。
具体实施方式
下面通过具体的实施例对本发明进一步说明,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。
实施例1:
1.材料准备
(1)菌源
菌源:江苏省南京市的扬子石化芳烃厂排污口生长良好的野生麦冬体内。
(2)培养基
①lb培养基:蛋白胨10g,酵母粉5g,nacl10g,蒸馏水定容至1000ml,ph7.0~7.2。培养基制备固体平板时添加1.5%~2%的琼脂。
②芘无机盐固体培养基:(nh4)2so41.50g,k2hpo4·3h2o1.91g,kh2po40.50g,nacl0.50g,mgso4·7h2o0.20g,微量元素溶液2ml,蒸馏水定容至1000ml,ph7.0~7.2得到无机盐液体培养基。无机盐液体培养基中加入1.5%~2%的琼脂后121℃高压灭菌20min,待培养基冷却至50℃~60℃加入适量的芘丙酮溶液,使培养基中芘的终浓度为50mg·l-1。
微量元素溶液由以下成分组成:cocl2·6h2o0.1g,mncl2·4h2o0.425g,zncl20.05g,nicl2·6h2o0.01g,cuso4·5h2o0.015g,na2moo4·2h2o0.01g,na2seo4·2h2o0.01g,蒸馏水定容至1000ml。
③芘降解培养基:5mg·ml-1的芘丙酮溶液过0.22μm滤膜除菌,取一定量置于灭菌的三角瓶中,待丙酮挥发完,加入已灭菌的无机盐液体培养基,使芘的最终浓度达到50mg·l-1。
(3)实验仪器参见表1
表1
2.菌株的分离和筛选
将采集的植物样品野生麦冬清洗干净后置于无菌操作台内依次用75%乙醇水溶液漂洗3~5min,再用无菌水冲洗3~4次,0.1%naclo漂洗2~5min,再用无菌水冲洗至确保植物表面消毒剂被洗干净。将消毒好的植物样品移入lb固体平板中30℃培养72h,检查植物表面是否存在残留的细菌。剪碎消毒好的植物样品,放进含有适量无菌水的灭菌研钵中充分研磨,静置20min后,取1ml上清液放入装有9ml无菌水的试管中,依次稀释得到各种浓度梯度的稀释液,分别取10-3、10-2和10-13个稀释梯度的稀释液0.1ml,涂布于制备好的芘无机盐固体培养基上,然后倒置于30℃培养箱中培养48h,挑取不同形态的、生长良好的单菌落反复划线,纯化分离菌株。挑选有明显降解圈且长势旺盛的菌株对其芘降解能力进行测定,其中9株菌在50mg·l-1的芘无机盐固体培养基上生长良好,其10d的降解率参见表2。挑选在共同代谢条件下,降解芘性能最佳的5号菌命名为芘降解功能植物内生细菌prd5,并用其进行植物体定殖实验。
表2
注:dpyr表示菌株10d对芘的降解率;dpyrg表示外加0.01%葡萄糖后菌株10d对芘的降解率。
实施例2:菌株的鉴定
1.芘降解功能植物内生细菌prd5形态,生理和生化特征
(1)芘降解功能植物内生细菌prd5菌落形态特征(图1)
菌株prd5在芘无机盐固体培养基上培养36h后可见,菌落形态为圆形、乳白色、边缘整齐、表面光滑、中间隆起、不透明。
(2)芘降解功能植物内生细菌prd5生理生化特征(参见表3)。
表3
注:+表示阳性,-表示阴性。
2.菌株prd5的16srrna基因序列的测定
(1)细菌总dna的提取
将菌株划线至芘无机盐固体平板上,观察菌株是否为纯菌。若菌落观察显示平板为纯菌,带菌落长至1-2mm以上,将平板上菌落用无机盐洗下来,收集到灭菌离心管中,用天根细菌基因组dna提取试剂盒(离心柱型)提取功能内生细菌的总dna。
(2)pcr扩增目的的基因片段
正向引物为16s-27f:5′-agagtttgatcctggctcag-3′;反向引物为16s-1492r:5′-taccttgttacgactt-3′。pcr反应体系(25μl):premix12.5μl,模板dna1μl,引物16s-27f和16s-1492r0.5μl,重蒸水10.5μl。
pcr扩增条件:①预变性:94℃,4min;变性:94℃,30s,退火:55℃,30s;②延伸:72℃,30s,30个循环;③终极延伸:72℃,10min;④保温:10℃,10min。将pcr扩增产物进行琼脂糖凝胶电泳,染色后置于bio-rad凝胶成像仪进行目标条带的成像分析。挑选有清晰条带的扩增产物,送至南京金斯瑞测序有限公司进行16srrna基因序列测序。该16srrna基因序列参加序列表seqidno:1。基于16srrna基因序列同源性的菌株prd5系统发育树参见图2。
实施例3:
芘降解功能植物内生细菌prd5在芘浓度为50mg·l-1、葡萄糖浓度为100mg·l-1的培养体系下的降解动力学曲线,步骤如下:
1.接种体的制作:将芘降解功能植物内生细菌prd5接种到的lb液体中分批培养,在lb液体中加入含芘丙酮溶液(丙酮含量低于0.5‰),使芘的终浓度为50mg·l-1,30℃、150r·min-1摇床培养12h,6000r·min-1离心10min,弃掉上清液,用无机盐液体培养基冲洗菌体使其混匀,再次离心,洗涤2~3次,用无机盐液体培养基制成菌悬液,并将其浓度调整为od600nm=1.0(约为8.77lgcfu·ml-1)。
2.将步骤1得到的菌悬液按5%接种量加入含100mg·l-1葡萄糖的芘降解培养基中,30℃、150r·min-1摇床培养21d,每24h整瓶取样,测定培养基中芘和1-羟基-2-萘甲酸的浓度和计算平板中菌落数量。含100mg·l-1葡萄糖的芘降解培养基的制作步骤为:5mg·ml-1的芘丙酮溶液过0.22μm滤膜除菌,取一定量置于灭菌的三角瓶中,待丙酮挥发完,加入已灭菌的含100mg·l-1葡萄糖的无机盐液体培养基,使芘的最终浓度达到50mg·l-1。
3.培养液中芘和代谢产物(1-羟基-2-萘甲酸)浓度的测定:测定采用定时整瓶提取培养基的方法。向三角瓶中加入等体积色谱甲醇,超声萃取混匀,静置后过0.22μm滤膜,用岛津高效液相色谱测定芘和1-羟基-2-萘甲酸浓度。岛津高效液相色谱(lc-20at)测定:hplc测定采用甲醇-水梯度洗脱法:0.00~12.50min甲醇100%;12.50~19.00min甲醇:水70:30;19.00~27.00min甲醇:水30:70。hplc分析条件:inertsilods-sp-c18反相色谱柱(150mm×4.6mm,5μm),流速0.800ml·min-1,柱温40℃,检测波长245nm,进样量20μl。
4.培养液中菌株prd5数量测定:吸取1ml培养液稀释涂布于芘无机盐固体培养基上,30℃恒温培养48h,计算细菌菌落数,每个处理设置3个重复。回收的菌株经菌落形态与16srrna基因鉴定来确定其为目标菌株,计算每毫升培养液中含菌量(lgcfu·ml-1)。
实验结果见图3,从图3中可以看出,芘降解功能植物内生细菌enterobactersp.prd5在100mg·l-1葡萄糖的50mg·l-1芘无机培养体系中,能高效降解芘含量。
随着时间增加,菌株prd5对芘的降解量平稳增长,15d后培养基中芘残留低于2%,且菌株prd5数量达到最大值3.83×108cfu·ml-1,芘降解产物1-羟基-2-萘甲酸浓度也开始迅速增加。
实施例4:芘降解功能植物内生细菌prd5降低水培空心菜中芘含量的应用
芘降解功能植物内生细菌prd5降低水培空心菜中芘含量的应用,其步骤如下:
1.材料准备
(1)供试植物:空心菜(ipomoeaaquaticforsk);抗生素有:氯霉素(chl)、氨苄青霉素(amp)、壮观霉素(spe)、盐酸四环素(tet)、链霉素(str)、卡那霉素(km)、红霉素(et)、庆大霉素(gm),浓度设定为:10、25、50、75、100、125、150mg·l-1。
(2)定殖菌株prd5准备,其步骤如下:
①lb抗性平板的制作步骤为:将lb液体培养基中加入1.5%~2%的琼脂后121℃高压灭菌20min,待培养基冷却至50℃~60℃加入适量的抗生素溶液,使抗生素的最终浓度达到试验的目标浓度(10~150mg·l-1)。
msm抗性平板的制作步骤为:将无机盐液体培养基中加入1.5%~2%的琼脂后121℃高压灭菌20min,待培养基冷却至50℃~60℃加入适量的抗生素溶液和芘丙酮溶液,使抗生素和芘的最终浓度均为50mg·l-1。
②接种体的制作:将芘降解功能植物内生细菌enterobactersp.prd5接种到的lb液体中分批培养,在lb液体中加入含芘丙酮母液(丙酮含量低于0.5‰),使芘的终浓度为50mg·l-1,30℃、150r·min-1摇床培养12h,6000r·min-1离心10min,弃掉上清液,用无机盐液体培养基冲洗菌体使其混匀,再次离心,洗涤2~3次,用无机盐液体培养基制成菌悬液,并将其浓度调整为od600nm=1.0(约为8.77lgcfu·ml-1)。
③菌株prd5对抗生素的抗性实验:将步骤①所得的芘降解功能植物内生细菌prd5的菌悬液分别点接于含有不同浓度抗生素的lb固体平板上,30℃培养48h,以不加抗生素作为阴性对照,试验设置3个平行,观察培养皿中菌落生长情况。结果见表4。
表4
注:“+”表示有抗性,“-”表示无抗性。
④菌株prd5抗性标记:将步骤①所得的芘降解功能植物内生细菌prd5的菌悬液,在lb抗性平板(所含抗生素为氨苄青霉素和红霉素)上点菌,30℃培养2~4d,待有菌落长出后,挑取单菌落移入浓度较高抗性的平板上,并获取抗性突变菌株,使抗生素的浓度由低到高逐渐增大,直至在lb抗性平板(两种抗生素终浓度均为50mg·l-1)上能稳定生长,且菌落形态及其他生物学特性保持不变的突变体菌株。挑选最稳定的抗性菌株在抗性平板上传代5次以上,验证其抗性是否稳定,获得稳定抗性突变菌株prd5。
⑤用于定殖接种的抗性菌株prd5菌悬液制备:将抗性标记过的芘降解功能植物内生细菌enterobactersp.prd5接种到lb的液体中分批培养,在lb液体中加入含芘丙酮母液(丙酮含量低于0.5‰),氨苄青霉素和红霉素,使芘和两种抗生素的终浓度均为50mg·l-1,30℃、150r·min-1摇床培养12h,6000r·min-1离心10min,弃掉上清液,用无机盐液体培养基冲洗菌体使其混匀,再次离心,洗涤2~3次,用无机盐液体培养基制成菌悬液,并将其浓度调整为od600nm=1.0(约为8.77lgcfu·ml-1),4℃保存备用。
(3)芘污染霍格兰营养液的配制:在霍格兰营养液中加入含芘的甲醇溶液(甲醇含量低于0.5‰)。
2.内生菌株定殖方法
采用浸种的方法将芘降解功能植物内生细菌prd5定殖于植物体内。试验选择适合于修复植物的浸种(ss)接种,空心菜种子经表面消毒,催芽、育苗48h后,用步骤1所得的稳定抗性突变菌株prd5菌悬液浸泡6h,以无菌水处理后作为ck对照,分别置于蛭石中,直到空心菜长出第一片功能叶。选择长势相同的植株,然后进行移苗。移入含有0、0.1、0.5mg·l-1浓度的芘污染霍格兰营养液的棕色广口瓶中。每瓶装有250ml芘污染霍格兰营养液,分别种植5颗空心菜,置于人工气候箱中培养,温度设置为昼夜25/20℃。培养过程中适量补充芘污染霍格兰营养液保持瓶中液面高度。培养4d,4d后采集植物样进行测定。实验中每个处理重复3次。参见表5。
表5
3.空心菜生物量的测定
将步骤2得到的植物样本的根和茎叶分离,然后用超纯水淋洗干净,滤纸擦浸干植物表面水分,并分别测植物样品根部、茎叶的鲜重。将新鲜植物冷冻干燥3d后,测定植物样品的干重。空心菜生物量的实验结果见表6,从表6可知接种功能细菌prd5可提高空心菜的生物量,说明接菌处理能够促进空心菜的生长,推测原因可能是菌株prd5促进了空心菜吸收营养物质。结果表明,培养4d后,无污染情况下,ss处理的空心菜鲜重、干重比ck提高了4.14%、3.02%;在污染浓度为0.1mg·l-1的培养液中,ss处理的空心菜鲜重、干重比ck提高了10.44%、1.17%;在芘污染浓度为0.5mg·l-1的培养液中,ss处理的空心菜鲜重、干重比ck提高了19.09%、10.11%。
表6
4.菌株prd5的定殖数量
其步骤如下:用超纯水清洗步骤3得到的植物样品,将植物样品置于滤纸上吸除表面水分,最后用剪刀将植物根和茎叶分离,用分析天平分别称取植物根和茎叶的鲜重,然后置于无菌操作台内依次用75%乙醇水溶液漂洗3~5min,再用无菌水冲洗3~4次,0.1%naclo漂洗2~5min,再用无菌水冲洗至确保植物表面消毒剂被洗干净。将消毒好的植物样品移入lb固体平板中30℃培养72h,检查植物表面是否存在残留的细菌。将消毒好的植物置于灭菌研钵,用无菌水研磨均匀。吸取上清液稀释涂布于msm抗性平板上,30℃恒温培养48h,计算细菌菌落数,每个处理设置3个重复。回收的菌株通过菌落形态与16srrna基因鉴定来确定其是否为接种菌株,并计算每g新鲜组织中菌株prd5数量(lgcfu·g-1)(参见表7)。本实验中将prd5菌株通过浸种方式定殖到空心菜体内,并设立ck对照组(没有定殖抗性菌株prd5的普通空心菜)。从表7可知,浸种处理组检测到目标菌,对照组均未检测到目标菌,回收菌株的基本形态与prd5原菌株一致,说明菌株prd5能够在空心菜体内定殖并转移。
表7
5.空心菜体内芘的提取与测定
其步骤如下:(1)冷冻干燥后的空心菜根和茎叶,充分研磨粉碎,过20目筛,然后称取一定量空心菜样品于30ml玻璃离心管中,再加入10ml正己烷和二氯甲烷(v∶v=1∶1)的溶液超声萃取30min,超声萃取重复3次。(2)将全部萃取液过无水硫酸钠柱-硅胶柱净化,用11ml的二氯甲烷和正己烷(v∶v=1∶1)混合液洗脱。(3)将旋转烧瓶中洗脱液于40℃恒温旋转浓缩至干,加甲醇定容至1ml,0.22μm孔径滤膜过滤,选用hplc法测定空心菜茎叶和根中芘含量,并计算芘浓度(mg·kg-1)、芘积累量(μg·pot-1)。
空心菜体内芘积累量(accumulation,a)的计算公式:a=cp×m,其中cp表示植物体内芘的浓度(mg·kg-1),m表示植物干重(mg·pot-1)。
表8
注:表中同一植物组织的同列不同字母表示差异达到显著水平(p<0.05)
由表8可知,植物根中芘含量远高于茎叶中芘含量,植株中芘含量随培养液中芘污染的加重而增大。在0.1mg·l-1污染浓度下,ss处理中的空心菜根、茎叶部芘含量分别为71.99mg·kg-1、5.11mg·kg-1,未定殖菌株prd5的空心菜根、茎叶部芘含量分别为102.38mg·kg-1、3.74mg·kg-1。在0.5mg·l-1污染浓度下,ss处理中的空心菜根、茎叶部芘含量分别为108.05mg·kg-1、7.01mg·kg-1;未定殖菌株prd5的空心菜根、茎叶部芘含量分别为190.22mg·kg-1、7.64mg·kg-1。结果可见,菌株prd5的定殖有益于植物中芘污染的减轻,特别是暴露于高污染环境下的植物。
从不同条件下植物积累芘结果可见,芘在植物根中积累量远高于茎叶,且植物体中芘积累量随着培养液中芘浓度的升高而显著增多。在芘污染条件下,菌株prd5定殖处理的空心菜中芘的积累量分别为1.65μg·pot-1(0.1mg·l-1芘暴露)和2.60μg·pot-1(0.5mg·l-1芘暴露),分别比未定殖菌株prd5的空心菜体内累积量降低了19.51%、35.32%。可知,随着芘污染浓度的增大,菌株prd5定殖处理中空心菜体内芘的积累量低于无菌株定殖的空心菜。
6.芘污染霍格兰营养液中芘的提取与测定
其步骤如下:分别吸取10ml步骤2中培养4d后的棕色广口瓶中的含有0.1、0.5mg·l-1浓度的芘污染霍格兰营养液于离心管中,加入等体积的甲醇,超声萃取30min,过0.22μm孔径滤膜,采用高效液相色谱(hplc)测定芘污染霍格兰营养液中芘含量(mg·l-1)。
菌株prd5对芘污染霍格兰营养液中芘污染去除的影响如图4。芘污染霍格兰营养液中芘的浓度下降的原因可以是植物吸收、微生物降解、芘的挥发和光降解等。实验操作过程中,采用棕色瓶子密闭培养植物,减少了芘由于挥发与光降解的损失量。与未定殖菌株prd5空心菜组相比,在0.1mg·l-1污染浓度下,培养4d后,ss芘含量减少率为52.97%;在0.5mg·l-1污染浓度下,培养4d后,ss芘含量减少率为32.75%。可见,菌株prd5定殖可以有效地促进芘污染霍格兰营养液中芘的去除。分析原因,芘污染霍格兰营养液中芘的去除可能来源于植物吸收与植物分解。
实施例5:芘降解功能植物内生细菌prd5降低土培上海青中芘含量的应用,验证菌株prd5接种在土培植物中的芘污染降解效率。
1.材料准备
(1)供试植物:上海青(brassicachinensisl.);抗生素、msm抗性平板同
实施例4。
(2)种植污染土壤制备:
采用本地常见黄棕壤进行土壤栽培实验。供试土壤采集后,风干后过4目筛。芘溶解于丙酮后,均匀加入到上述土壤中,待丙酮挥发后,充分搅拌、混匀,并用未污染土稀释,制得芘浓度为50mg·kg-1和100mg·kg-1的污染土壤,将污染的土壤置于黑暗处老化30d后,进行盆栽实验。称取1kg上述土样于周转箱(405×287×95mm)中,加入50%田间持水量平衡后待用。对污染土样中的实际芘含量进行测定。
表9
注:c0、c50、c100分别表示土样中污染物芘浓度的理论值为0、50、100mg·kg-1
(3)用于定殖接种的抗性菌株prd5菌悬液制备:
将实施例4抗性标记过的芘降解功能植物内生细菌prd5接种到lb的液体中分批培养,在lb液体中加入含芘丙酮溶液(丙酮含量低于0.5‰),氨苄青霉素和红霉素,使芘和两种抗生素的终浓度均为50mg·l-1,30℃、150r·min-1摇床培养12h,6000r·min-1离心10min,弃掉上清液,用无机盐液体培养基冲洗菌体使其混匀,再次离心,洗涤2~3次,用无机盐液体培养基制成菌悬液,并将其浓度调整为od600nm=1.0(约为8.77lgcfu·ml-1),4℃保存备用。
2.内生菌株定殖方法:
试验选择最常用的适合于修复植物的两种定殖方式接种,即浸种接种(ss)+浸根接种(sr)+叶片涂抹接种(pl)。上海青种子经表面消毒,催芽、育苗48h后,用步骤1得到的菌悬液浸泡6h后播种,培养至长出第一、二片真叶时,取10ml步骤1得到的菌悬液浇灌于各植物根部土壤,并用无菌药棉蘸取菌悬液涂抹叶片,也可采用喷雾的方法接种,在灌根后的7、14、21d取植物根部、茎叶、根系土壤。每盆(1kg土壤)种植12株幼苗生长。自然光照下培养,培养过程中适量补充半强度的霍格兰营养液(霍格兰营养液加等体积的水稀释),维持土壤养分。实验设置12种不同处理:(1)无污染土壤(c0);(2)无污染土壤+上海青(c0b);(3)无污染土壤+菌株prd5(c0p);(4)无污染土壤+上海青+菌株prd5(c0bp);(5)芘浓度为50mg·kg-1的污染土壤(c50);(6)芘浓度为50mg·kg-1的污染土壤+上海青(c50b);(7)芘浓度为50mg·kg-1的污染土壤+菌株prd5(c50p);(8)芘浓度为50mg·kg-1的污染土壤+上海青+菌株prd5(c50bp);(9)芘浓度为100mg·kg-1的污染土壤(c100);(10)芘浓度为100mg·kg-1的污染土壤+上海青(c100b);(11)芘浓度为100mg·kg-1的污染土壤+菌株prd5(c100p);(12)芘浓度为100mg·kg-1的污染土壤+上海青+菌株prd5(c100bp)。
表10
3.上海青生物量的测定
将本实施例步骤2得到的上海青的根和茎叶分离,然后用超纯水淋洗干净,滤纸擦浸干植物表面水分,并分别测植物样品根部、茎叶的鲜重。将新鲜植物冷冻干燥3d后,测定植物样品的干重。
上海青生物量的实验结果见表11,从表11中可以看出接种功能内生细菌prd5可以提高上海青的鲜重和干重。在无污染的土壤中,接种7d时,接种prd5的上海青(c0bp)的鲜重、干重比不接菌的上海青(c0b)提高了62.07%、52.54%;接种14d时,c0bp的鲜重、干重比c0b提高了47.52%、40.89%;接种21d时,提高了62.33%、40.93%。在污染浓度为50mg·kg-1的土壤中,接种7d时,c50bp的鲜重、干重比c50b提高了44.85%、50.48%;接种14d时,提高了6.67%、8.09%;接种21d时,提高了53.93%、96.29%。在污染浓度为100mg·kg-1的土壤中,接种7d时,c100bp的鲜重、干重比c100b提高了112.48%、85.68%;接种14d时,提高了51.24%、28.48%;接种21d时,提高了80.11%、105.55%。由以上结果说明,无论是否存在芘污染,功能菌株prd5定殖对植物生长都具有显著的促进作用。
表11
4.菌株prd5的定殖数量
上海青体内功能内生细菌prd5的定殖数量,其步骤如下:用超纯水清洗植物样品表面,将植物样品上海青置于滤纸上吸除表面水分,最后用剪刀将植物样品上海青根和茎叶分离,用分析天平分别称取植物样品上海青的根和茎叶的鲜重,然后置于无菌操作台内依次用75%乙醇水溶液漂洗3~5min,再用无菌水冲洗3~4次,0.1%naclo漂洗2~5min,再用无菌水冲洗至确保植物样品表面消毒剂被洗干净。将消毒好的植物样品上海青移入lb固体平板中30℃培养72h,检查植物样品表面是否存在残留的细菌。将消毒好的植物样品置于灭菌研钵中,用无菌水研磨均匀,静置20min,吸取上清液稀释涂布于msm抗性平板上,30℃恒温培养48h,计算细菌菌落数,每个处理设置3个重复。回收的菌株通过菌落形态与16srrna基因鉴定来确定其是否为接种菌株,并计算每g新鲜组织中菌株prd5数量(lgcfu·g-1)。
采用氨苄青霉素和红霉素2种抗生素抗性筛选标记,检测功能内生细菌prd5在上海青体内的定殖数量。接种7d后,菌株prd5能够有效地定殖在上海青体内,并随着蒸腾拉力作用扩散到植物茎叶中,并且菌株在根部的定殖能力要强于茎叶部。随着时间的迁移,上海青根和茎叶中的细菌数量都有所上升。由表12可知,在无污染土壤中,接种21d后,接种prd5的上海青的根和茎叶中prd5的定殖数量分别为5.14和4.88lgcfu·g-1;在芘污染浓度为50mg·kg-1的土壤中,菌株prd5在上海青根和茎叶中的定殖数量分别为5.84和5.58lgcfu·g-1;在芘污染浓度为100mg·kg-1的土壤中,菌株prd5在上海青根和茎叶中的定殖数量分别为5.69和5.35lgcfu·g-1。由此可见,菌株prd5可在芘污染土壤上生长的上海青体内生存繁殖,且芘污染有利于菌株prd5在上海青体内的定殖。
表12
注:表中同一植物组织的同列不同字母表示差异达到显著水平(p<0.05)
5.上海青体内芘的提取与测定
其步骤如下:(1)冷冻干燥后的上海青根和茎叶,充分研磨粉碎,过20目筛,然后称取一定量上海青样品于30ml玻璃离心管中,再加入10ml正己烷和二氯甲烷(v∶v=1∶1)的溶液超声萃取30min,超声萃取3次。(2)将全部萃取液过无水硫酸钠柱-硅胶柱净化,用11ml的二氯甲烷和正己烷(v∶v=1∶1)混合液洗脱。(3)将旋转烧瓶中洗脱液于40℃恒温旋转浓缩至干,加甲醇定容至1ml,0.22μm孔径滤膜过滤,选用hplc法测定上海青茎叶和根中芘含量,并计算芘浓度(mg·kg-1)、芘积累量(μg·pot-1)。
上海青体内芘积累量(accumulation,a)的计算公式:a=cp×m,其中cp表示植物体内芘的浓度(mg·kg-1),m表示植物干重(mg·pot-1);
菌株的促进效率(enhancementratio,e,%)的计算公式:e%=(ccp-ccpb)×100/ccp,其中ccp表示未接种功能菌株的植物体内芘的浓度,ccpb表示接种功能菌株的植物体内芘的浓度。
为了检验方法的准确度,采用之前上海青样品前处理方法和分析条件,确定上海青样品的芘本底(空白对照),同时取定量上述样品,分别加入芘标准液,暗处静置,待甲醇挥发后,测芘方法回收率。此方法芘的回收率≥98%,相对标准偏差rsd为1.86%(n=3)。
prd5定殖对上海青吸收芘的影响的实验结果如表13所示。随着时间的延长,上海青体内芘含量逐渐减少,推测上海青体内芘含量随时间减少的可能原因:上海青的生长稀释作用;菌株在上海青体内以芘为碳源进行代谢和生长繁殖;菌株调控上海青体内的酶系统来代谢体内的芘;土壤中芘的含量随时间逐渐降低,导致上海青可吸收积累的芘也相应的减少。同一污染浓度,种植上海青并接菌处理组(c50bp、c100bp)上海青根、茎叶中芘的浓度要比种植上海青处理组(c50b、c100b)低。为了进一步表征菌株prd5对上海青体内芘降解的作用,引入了促进效率。如图5所示,在污染浓度为50mg·kg-1的土壤中,接种7d后,上海青根、茎叶中菌株prd5的促进效率分别为40.35%、40.66%;接种14d后,上海青根、茎叶中菌株prd5的促进效率分别为34.63%、32.48%;接种21d后,上海青根、茎叶中菌株prd5的促进效率分别为51.14%、49.84%。在污染浓度为100mg·kg-1的土壤中,接种7d后,上海青根、茎叶中菌株prd5的促进效率分别为43.69%、48.53%;接种14d后,上海青根、茎叶中菌株prd5的促进效率分别为31.28%、57.92%;接种21d后,上海青根、茎叶中菌株prd5的促进效率分别为67.89%、65.21%。结果表明,功能植物内生细菌prd5在不同程度上都减少了上海青根和茎叶中芘的积累量。
表13
注:表中同一植物组织的同列不同字母表示差异达到显著水平(p<0.05)
6.土壤中芘的提取与测定
先冷冻干燥步骤2采集到的根系土壤,然后充分研磨,使用20目筛过筛,取1g过筛土壤样品置于30ml玻璃离心管中,再加入10ml的正己烷和二氯甲烷(v∶v=1∶1)的溶液于超声水浴锅中超声萃取1h;以4000r·min-1离心10min,取3ml离心上清液过无水硫酸钠柱-硅胶柱,再取用11ml体积比(1∶1)正己烷和二氯甲烷溶液洗脱;将洗脱液收集到旋转蒸发瓶内,于40℃恒温旋转蒸发浓缩至干,用甲醇定容至1ml,过0.22μm孔径滤膜,使用高效液相色谱(hplc)法定量分析。
为了检验方法的准确度,采用之前土壤样品的前处理方法和分析条件,分析土壤芘本底(空白对照),同时,称取上述土壤样品1g,分别加入芘标准液100μl,暗处静置,待甲醇挥发后,按前述方法,测芘方法回收率。此方法芘的回收率≥98%,相对标准偏差rsd为1.61%(n=3)。
prd5定殖对土壤中芘去除的影响结果如图6、图7所示。随着上海青生长时间的延长,土壤中芘的浓度显著下降。通过图6和图7可以看出,同一污染强度下,种植上海青(c50b、c100b)、接种菌株prd5(c50p、c100p)和种植上海青并接菌(c50bp、c100bp)三个处理组土样中的芘残留浓度均比空白对照组(c50、c100)显著降低。在芘污染浓度为50mg·kg-1的土壤中,接种7d后,c50b、c50p、c50bp处理组土样中芘含量相对于c50处理组减少了21.93%、12.23%、30.46%;接种14d后,c50b、c50p、c50bp处理组土样中芘含量相对于c50处理组减少了44.22%、26.71%、52.87%;接种21d后,c50b、c50p、c50bp处理组土样中芘含量相对于c50处理组减少了31.51%、36.15%、40.62%。在芘污染浓度为100mg·kg-1的土壤中,接种7d后,c100b、c100p、c100bp处理组土样中芘含量相对于c100处理组减少了27.23%、9.16%、43.38%;接种14d后,c100b、c100p、c100bp处理组土样中芘含量相对于c100处理组减少了48.85%、48.70%、63.29%;接种21d后,c100b、c100p、c100bp处理组土样中芘含量相对于c100处理组减少了52.99%、38.56%、51.88%。以上结果表明种植上海青和接种菌株prd5均能够增强土壤中芘的去除率,其中上海青和芘降解功能植物内生细菌prd5的结合作用效果最佳。
序列表
<110>南京农业大学
<120>芘降解功能植物内生细菌prd5及其应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>1395
<212>dna
<213>肠杆菌(enterobactersp.)
<400>1
cggtagcacagagagcttgctctcgggtgacgagtggcggacgggtgagtaatgtctggg60
aaactgcctgatggagggggataactactggaaacggtagctaataccgcataacgtcgc120
aagaccaaagagggggaccttcgggcctcttgccatcagatgtgcccagatgggattagc180
tagtaggtggggtaacggctcacctaggcgacgatccctagctggtctgagaggatgacc240
agccacactggaactgagacacggtccagactcctacgggaggcagcagtggggaatatt300
gcacaatgggcgcaagcctgatgcagccatgccgcgtgtatgaagaaggccttcgggttg360
taaagtactttcagcggggaggaaggtgttgtggttaataaccgcagcaattgacgttac420
ccgcagaagaagcaccggctaactccgtgccagcagccgcggtaatacggagggtgcaag480
cgttaatcggaattactgggcgtaaagcgcacgcaggcggtctgtcaagtcggatgtgaa540
atccccgggctcaacctgggaactgcattcgaaactggcaggctagagtcttgtagaggg600
gggtagaattccaggtgtagcggtgaaatgcgtagagatctggaggaataccggtggcga660
aggcggccccctggacaaagactgacgctcaggtgcgaaagcgtggggagcaaacaggat720
tagataccctggtagtccacgccgtaaacgatgtcgacttggaggttgtgcccttgaggc780
gtggcttccggagctaacgcgttaagtcgaccgcctggggagtacggccgcaaggttaaa840
actcaaatgaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgatgca900
acgcgaagaaccttacctactcttgacatccagagaactttccagagatggattggtgcc960
ttcgggaactctgagacaggtgctgcatggctgtcgtcagctcgtgttgtgaaatgttgg1020
gttaagtcccgcaacgagcgcaacccttatcctttgttgccagcggttaggccgggaact1080
caaaggagactgccagtgataaactggaggaaggtggggatgacgtcaagtcatcatggc1140
ccttacgagtagggctacacacgtgctacaatggcgcatacaaagagaagcgacctcgcg1200
agagcaagcggacctcataaagtgcgtcgtagtccggattggagtctgcaactcgactcc1260
atgaagtcggaatcgctagtaatcgtagatcagaatgctacggtgaatacgttcccgggc1320
cttgtacacaccgcccgtcacaccatgggagtgggttgcaaaagaagtaggtagcttaac1380
cttcgggagggcgct1395
<210>2
<211>20
<212>dna
<213>人工序列(16s-27f)
<400>2
agagtttgatcctggctcag20
<210>3
<211>16
<212>dna
<213>人工序列(16s-1492r)
<400>3
taccttgttacgactt16
- 还没有人留言评论。精彩留言会获得点赞!