脆弱拟杆菌荚膜多糖硫酸酯及其制备方法和应用与流程
本发明涉及生物医药领域,特别是涉及一种脆弱拟杆菌荚膜多糖硫酸酯及其制备方法和应用。
背景技术:
溃疡性结肠炎(ulcerativecolitis,uc)是炎症性肠病的一种,病因不明确,主要与遗传因素、免疫因素和环境因素有关。临床症状以黏液脓血便、腹痛、腹泻或里急后重为主;重症病例,全身症状明显,多伴有肝损害、关节炎、皮肤损害、心肌病变、虹膜睫状体炎及内分泌疾病等。
目前对uc的治疗方法主要为氨基水杨酸类药物,代表性品种为美沙拉秦。根据米内网数据显示,氨基水杨酸类药物2015年的销售额超过8亿元,同比增长15.2%;其中美沙拉秦占据87.9%的市场,同比增长率为17.2%;相比之下其它氨基水杨酸类药物的市场份额小,销售处于稳定趋势。
但是氨基水杨酸类药物副作用较大,常见恶心、呕吐、食欲缺乏、腹泻、腹痛等;起效量很高,为0.2-0.3g/kg。因此,有必要研究治疗溃疡性结肠炎的新药物。
技术实现要素:
基于此,本发明提供了一种脆弱拟杆菌荚膜多糖硫酸酯,该荚膜多糖硫酸酯对溃疡性结肠炎具有很好的防治效果。
具体技术方案如下:
一种脆弱拟杆菌荚膜多糖硫酸酯,由脆弱拟杆菌荚膜多糖和硫酸化试剂进行硫酸酯化反应得到,其中,所述脆弱拟杆菌荚膜多糖中的全部或部分羟基在反应后被替换为硫酸酯基,所述脆弱拟杆菌荚膜多糖具有式(i)所示结构:
式(i)中n大于或等于1。
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖的分子量为5-75kd。
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖硫酸酯的硫代度为0.5-1.2。
本发明还提供了上述脆弱拟杆菌荚膜多糖硫酸酯的制备方法。
具体技术方案如下:
一种上述脆弱拟杆菌荚膜多糖硫酸酯的制备方法,包括以下步骤:
1)取所述脆弱拟杆菌荚膜多糖,加入溶剂,制备成悬浮液;
2)在所述悬浮液中加入硫酸化试剂进行硫酸酯化反应,冷却后调节ph至中性,离心,收集上清液,将所述上清液用流水透析,再用乙醇水溶液进行沉淀,离心,收集沉淀物,将所述沉淀物冷冻干燥,得冻干粉末;所述硫酸化试剂由氯磺酸与无水吡啶制备得到;
3)将所述冻干粉末进行纯化,得到所述脆弱拟杆菌荚膜多糖硫酸酯。
在其中一些实施例中,步骤1)中所述溶剂为二甲基亚砜;步骤1)所述悬浮液中,脆弱拟杆菌荚膜多糖的浓度为10-50mg/ml。
在其中一些实施例中,步骤2)中所述硫酸酯化试剂的制备方法包括以下步骤:
在-15至-10℃以及剧烈搅拌的条件下,向预冷至0-4℃的无水吡啶中逐滴加入氯磺酸,所述氯磺酸与所述无水吡啶的体积比1:5-10,即得硫酸酯化试剂。
在其中一些实施例中,步骤2)中所述悬浮液和所述酯化试剂的体积比为1:2-6;
在其中一些实施例中,步骤2)中所述硫酸酯化反应的条件为:60-90℃持续搅拌反应2-4h;
在其中一些实施例中,步骤2)中所述流水透析的条件为:用3-10kd的透析膜流水透析24-36小时;所述乙醇水溶液的体积浓度为80-90%,所述用乙醇水溶液进行沉淀的时间为4-12小时。
在其中一些实施例中,步骤3)所述的纯化包括以下步骤:
将所述冻干粉末溶于ph为7.5-8.5的缓冲液中,用deaesepharosefastflow的阴离子交换填料进行离子交换层析,所用洗脱剂为0.18-0.22m的nacl水溶液,收集洗脱液,超滤除盐,冻干,即得所述脆弱拟杆菌荚膜多糖硫酸酯。
本发明还提供了脆弱拟杆菌荚膜多糖或者上述脆弱拟杆菌荚膜多糖硫酸酯的应用。
具体技术方案如下:
脆弱拟杆菌荚膜多糖或者上述的脆弱拟杆菌荚膜多糖硫酸酯在制备治疗和预防溃疡性结肠炎的药物中的应用;所述脆弱拟杆菌荚膜多糖具有式(i)所示结构:
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖的分子量为5-75kd。
本发明还提供了一种治疗和预防溃疡性结肠炎的药物。
具体技术方案如下:
一种治疗和预防溃疡性结肠炎的药物,其活性成分包括有脆弱拟杆菌荚膜多糖和/或上述的脆弱拟杆菌荚膜多糖硫酸酯;所述脆弱拟杆菌荚膜多糖具有式(i)所示结构:
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖的分子量为5-75kd。
所述的脆弱拟杆菌荚膜多糖硫酸酯可以单独给药,也可以与脆弱拟杆菌荚膜多糖或其它药物一起给药。所述脆弱拟杆菌荚膜多糖硫酸酯可以和其他辅料制备成丸剂、片剂、颗粒剂、胶囊、口服液,用于治疗和预防溃疡性结肠炎,所述辅料可包含以下药物可接受的辅料中的一种或多种:稀释剂、赋形剂、粘合剂、润滑剂、助悬剂、包衣剂和增溶剂等。
本发明的发明人经过长期经验积累以及大量创造性实验研究发现,脆弱拟杆菌荚膜多糖(尤其是分子量为5-75kd的脆弱拟杆菌荚膜多糖)具有治疗或预防溃疡性结肠炎的作用。发明人进一步对该脆弱拟杆菌荚膜多糖进行了深入研究,脆弱拟杆菌荚膜多糖含有羟基、羧基、氨基、乙酰基等官能团,可以进行硫酸酯化、磷酸化、羧甲基化、乙酰化、去乙酰化等化学修饰。目前并没有关于脆弱拟杆菌荚膜多糖(分子量为5-75kd)相关化学修饰方法及其活性的研究。本发明的发明人首次对脆弱拟杆菌荚膜多糖进行了硫酸酯化修饰,通过将脆弱拟杆菌荚膜多糖与硫酸化试剂进行硫酸酯化反应制备得到了脆弱拟杆菌荚膜多糖硫酸酯,通过进一步实验研究发现本发明的脆弱拟杆菌荚膜多糖硫酸酯具有显著的治疗和预防溃疡性结肠炎的作用,其效果优于被修饰前的脆弱拟杆菌荚膜多糖,其可以单独进行预防性或治疗性给药,或者与脆弱拟杆菌荚膜多糖或其它药物一起给药。
附图说明
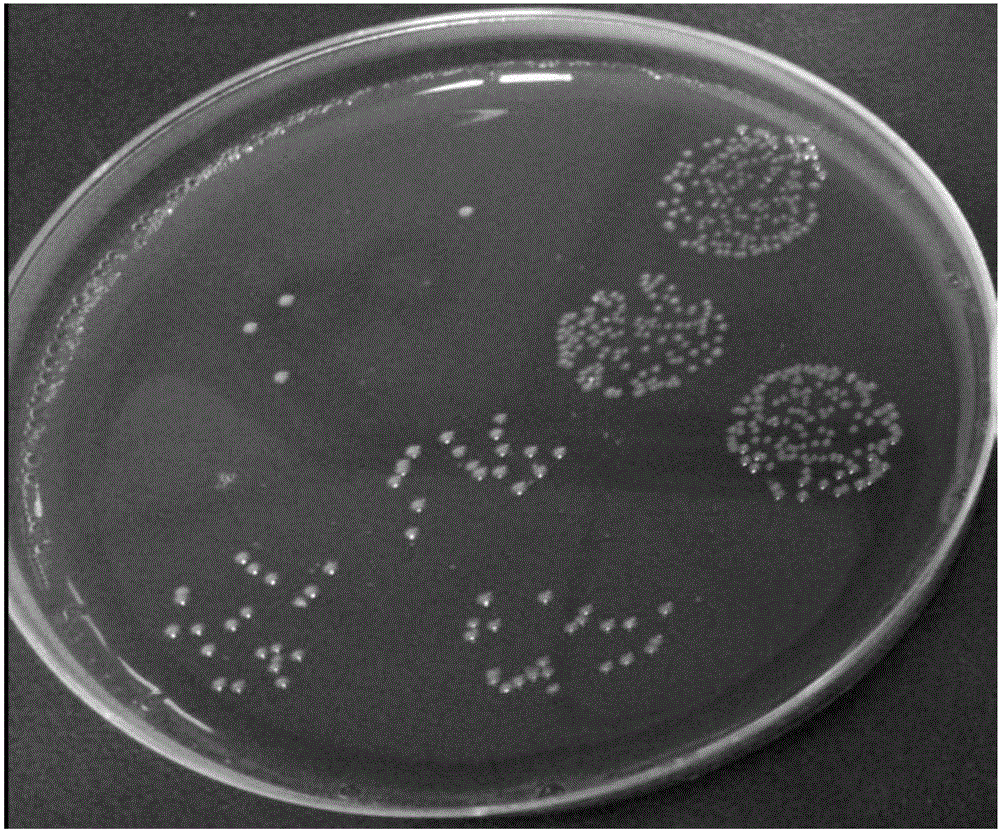
图1为实施例1的脆弱拟杆菌zy-312的菌落特征图;
图2为实施例1的脆弱拟杆菌zy-312进行革兰氏染色后的显微镜观察图;
图3为实施例1的脆弱拟杆菌荚膜多糖的1h谱;
图4为实施例1的脆弱拟杆菌荚膜多糖的13c谱;
图5为实施例1的脆弱拟杆菌荚膜多糖的cosy谱;
图6为实施例1的脆弱拟杆菌荚膜多糖的hsqc谱;
图7为实施例1的脆弱拟杆菌荚膜多糖的hmbc谱;
图8为实施例5中的硫酸基含量测定标准曲线。
具体实施方式
以下通过具体实施例对本发明做进一步详细地说明,这些实施例仅用来说明本发明,并不限制本发明的范围。
以下实施例中所用脆弱拟杆菌为脆弱拟杆菌zy-312(bacteroidesfragiliszy-312),于2015年4月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),其保藏编号为cgmccno.10685,保藏地址为北京市朝阳区北辰西路1号院3号。
实施例1脆弱拟杆菌荚膜多糖(tp2)的制备
(1)脆弱拟杆菌的发酵培养
将菌种划线接种于血平皿,厌氧培养48h。观察菌落形态特征、染色特性、大小、球杆状和分布情况等。
菌落特征:脆弱拟杆菌zy-312在血平皿上培养48h后,呈现圆形微凸、半透明、白色、表面光滑、不溶血,菌落直径在1-3mm之间,参见图1。
显微镜下形态:脆弱拟杆菌zy-312进行革兰氏染色镜检,为革兰阴性细菌,呈现典型的杆状,两端钝圆而浓染,菌体中间不着色部分形如空泡,参见图2。
选取单个菌落接种于胰蛋白胨肉汤中进行37℃发酵培养8小时,所得菌液离心沉淀,转速3000r/min,离心15min,去上清,收集沉淀物。
(2)脆弱拟杆菌荚膜多糖(tp2)的制备
1)取脆弱拟杆菌菌泥(上述步骤(1)获得的沉淀物)200g,加入68℃超纯水750ml,溶解后,再加入体积分数为75%苯酚溶液750ml,混合均匀,保持68℃搅拌萃取30min,15000g离心20min,取上层清液。
2)上层清液用等体积乙醚(1.5l)萃取去除苯酚,收集上层清液,重复萃取至无苯酚残留。水浴加热去除乙醚,收集水相。
3)水相15000g离心20min后测定体积,加入无水乙醇,至乙醇终浓度为80%(体积分数),4℃醇沉过夜(12小时),15000g离心20min,取沉淀。
4)称量步骤3)中的沉淀质量,加入5倍(体积(ml)于质量(g)比)的去离子水,搅拌混合均匀,加入质量浓度为10%的冰乙酸的水溶液,加热至沸,持续搅拌反应2h后,调节ph至7.0,15000g离心20min,收集上清,用3-10kd的透析袋流水透析28h,冷冻干燥,得脆弱拟杆菌提取物冻干品。
5)称量30mg步骤4)收集的脆弱拟杆菌提取物冻干品,溶于0.5mld2o,加入1μl丙酮(1h,2.22;13c,30.89)定标。采用500mhzbruker核磁共振波谱仪分析1h、13c、cosy、hsqc、hmbc谱(图3-图7)。确证步骤4)收集的脆弱拟杆菌提取物冻干品为荚膜多糖a,纯度约为70%。通过gpc(凝胶渗透色谱)分析,结果显示上述荚膜多糖a的重复单元分子量为781,单元重复数目n值为91,分子量约为70kd,分子式为-[c31n3o20h47]91-,其化学结构如式(i)所示:
实施例2脆弱拟杆菌荚膜多糖硫酸酯(s-tp2)的制备
将实施例1制备得到的脆弱拟杆菌荚膜多糖(tp2)制备成脆弱拟杆菌荚膜多糖硫酸酯(s-tp2),制备方法包括以下步骤:
1)将脆弱拟杆菌荚膜多糖用二甲基亚砜配制成浓度为10mg/ml的脆弱拟杆菌荚膜多糖悬浮液;
2)在步骤1)得到的悬浮液中加入硫酸化试剂(悬浮液与硫酸化试剂的体积比为1:2),90℃持续搅拌反应2h,冷却,调节ph至中性,离心,收集上清液,将所述上清液用3kd的透析膜流水透析28h,再用体积浓度为80%的乙醇水溶液4℃沉淀12h,离心,收集沉淀,冷冻干燥,得冻干粉末;
3)将步骤2)获得的冻干粉末用20mmtris-hcl缓冲液(ph8.0)溶解,经deaesepharosefastflow的阴离子交换填料进行离子交换层析纯化(洗脱液为0.2mnacl的水溶液),收集洗脱样品,超滤除盐,冻干,得到脆弱拟杆菌荚膜多糖硫酸酯(s-tp2),收率为65%。
步骤2)中硫酸化试剂的制备方法为:在有持续搅拌和冷凝装置的三口烧瓶中,加入预冷后的无水吡啶(0-4℃),-15℃至-10℃冰浴盐中剧烈搅拌10min,在无水吡啶中逐滴缓慢加入氯磺酸,氯磺酸与无水吡啶的体积比1:10,获得硫酸化试剂,-20℃保存备用。
实施例3脆弱拟杆菌荚膜多糖硫酸酯(s-tp2)的制备
将实施例1制备得到的脆弱拟杆菌荚膜多糖(tp2)制备成脆弱拟杆菌荚膜多糖硫酸酯(s-tp2),制备方法包括以下步骤:
1)将脆弱拟杆菌荚膜多糖用二甲基亚砜配制成浓度为50mg/ml的脆弱拟杆菌荚膜多糖悬浮液;
2)在步骤1)得到的悬浮液中加入硫酸化试剂(悬浮液与硫酸化试剂的体积比为1:6),60℃持续搅拌反应4h,冷却,调节ph至中性,离心,收集上清液,将所述上清液用10kd的透析膜流水透析28h,再用体积浓度为90%的乙醇水溶液沉淀8h,离心,收集沉淀,冷冻干燥,得冻干粉末;
3)将步骤2)获得的冻干粉末用20mmtris-hcl缓冲液(ph8.0)溶解,经deaesepharosefastflow的阴离子交换填料进行离子交换层析纯化(洗脱液为0.2mnacl),收集洗脱样品,超滤除盐,冻干,得到脆弱拟杆菌荚膜多糖硫酸酯(s-tp2),收率58%。
步骤2)中硫酸化试剂的制备方法为:在有持续搅拌和冷凝装置的三口烧瓶中,加入预冷后的无水吡啶(0-4℃),-15℃至-10℃冰浴盐中剧烈搅拌15min,在无水吡啶中逐滴缓慢加入氯磺酸,氯磺酸与无水吡啶的体积比1:5,获得硫酸化试剂,-20℃保存备用。
实施例4脆弱拟杆菌荚膜多糖硫酸酯(s-tp2)的制备
将实施例1制备得到的脆弱拟杆菌荚膜多糖(tp2)制备成脆弱拟杆菌荚膜多糖硫酸酯(s-tp2),制备方法包括以下步骤:
1)将脆弱拟杆菌荚膜多糖用二甲基亚砜配制成浓度为30mg/ml的脆弱拟杆菌荚膜多糖悬浮液;
2)在步骤1)得到的悬浮液中加入硫酸化试剂(悬浮液与硫酸化试剂的体积比为1:4),75℃持续搅拌反应3h,冷却,调节ph至中性,离心,收集上清液,将上清液用3kd的透析膜流水透析28h,再用体积浓度为85%的乙醇水溶液沉淀12h,离心,收集沉淀,冷冻干燥,得冻干粉末;
3)将步骤2)获得的冻干粉末用20mmtris-hcl缓冲液(ph8.0)溶解,经deaesepharosefastflow的阴离子交换填料进行离子交换层析纯化(洗脱液为0.2mnacl的水溶液),收集洗脱样品,超滤除盐,冻干,得到脆弱拟杆菌荚膜多糖硫酸酯(s-tp2),收率为62%。
步骤2)中硫酸化试剂的制备方法为:在有持续搅拌和冷凝装置的三口烧瓶中,加入预冷后的无水吡啶(0-4℃),-15℃至-10℃冰浴盐中剧烈搅拌12min,在无水吡啶中逐滴缓慢加入氯磺酸,氯磺酸与无水吡啶的体积比1:8,获得硫酸化试剂,-20℃保存备用。
实施例5硫代度测定
配制1.0mg/ml的硫酸钾标准溶液,吸取0、0.2、0.4、0.6、0.8、1.0ml标准溶液,补充蒸馏水使其体积为10ml,加入10ml0.18mol/l的盐酸溶液、1ml0.5%的明胶溶液,充分振荡混匀,迅速加入2ml氯化钡-明胶溶液(10g氯化钡溶于100ml0.5%明胶溶液中),振荡混匀,室温放置20min后以蒸馏水为参比,于360nm处测定吸光度。以硫酸根量为横坐标,吸光度为纵坐标,绘制标准曲线(如图8所示)。
取5mg实施例2-4制备得到的脆弱拟杆菌荚膜多糖硫酸酯(s-tp2),用蒸馏水溶解后加一定体积的浓盐酸至浓度为3mol/l,封口,100℃水解6h,冷却,减压旋转蒸干,再用少量水溶解后再次减压旋转蒸干,重复几次后,用超纯水将残留物溶解并定容于10ml容量瓶中,取此样液50μl,按照标准曲线方法测定。根据标准曲线计算硫酸基含量并根据以下公式计算硫代度。
ds=1.62×s%/(32-1.02×s%),式中:s%为硫酸基百分含量。
经测定,实施例2中硫酸酯化修饰后的s-tp2的硫代度为1.2;实施例3中硫酸酯化修饰后的s-tp2的硫代度为0.7;实施例4中硫酸酯化修饰后的s-tp2的硫代度为0.5。
实施例6s-tp2对dnbs诱导的wistar大鼠溃疡性结肠炎的治疗作用
1.实验概述
本实施例的目的为测试tp2以及实施例2制备的s-tp2对dnbs诱导的wistar大鼠溃疡性肠炎的治疗效果。在第2组到第5组,肠炎以向大鼠肠道内灌注0.5ml浓度为50mg/ml的dnbs诱导形成(dnbs溶解于30%乙醇中,现配现用)。共45只大鼠(不含备用动物),分组情况如下:
组1:假手术组,n=5;
组2:模型组,n=10;
组3:阳性药(柳氮磺吡啶,纯度98%)对照组,n=10;
组4:tp2给药组,n=10;
组5:s-tp2给药组,n=10;
造模当天记为day0。大鼠在day7解剖,解剖前收集外周血,分离血清,低温保存。在day7经麻醉后剪开腹腔,取出结直肠,记录溃疡面积、结直肠长度及重量,拍照。
2.分组及给药方案
表1分组及给药方案
3.结肠炎诱导
在day-0,45只大鼠被随机分为5组,见其中假手术组n=5,其他组为n=10。
day-0开始,大鼠禁食48h。用5%葡萄糖溶液作为禁食期间能量补充剂。
在day0,禁食大鼠用舒泰麻醉后从大鼠肛门至结肠左曲处注入0.5ml(50mg/ml)dnbs来诱导大鼠肠炎,假手术组注入30%的乙醇。
4.结果评价方法
表2宏观评估大鼠结直肠损伤评分
5.结果
结果参见表3和表4。
(1)造模后表现的结肠炎症状主要是结肠重量增加、溃疡面积增加、肠发生粘连等。
(2)阳性药柳氮磺吡啶降低了结肠重量、肠溃疡面积。
(3)tp2纯化多糖及s-tp2多糖均能降低肠重量、肠溃疡面积。s-tp2多糖降低肠重量、溃疡面积的参数指标、肠粘连程度评分、肠梗塞程度评分、肠溃疡程度评分均优于tp2纯化多糖。可见,s-tp2多糖治疗溃疡性结肠炎的效果优于tp2多糖。
表3结肠长度、重量、溃疡面积宏观评价
表4肠粘连程度、肠梗塞程度、肠溃疡程度宏观评价
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!