固定化酶、其制备方法及其在修复莠去津污染土壤中的应用与流程
本发明涉及微生物固定技术领域,具体而言,涉及一种固定化酶、其制备方法及其在修复莠去津污染土壤中的应用。
背景技术:
莠去津(atrazine)又名阿特拉津,化学名为2-氯-4-乙基胺-6-异丙基胺-1,3,5-均三氮苯,其是一种内吸选择性苗前、苗后封闭除草剂,其适于对玉米、高粱、茶园、果园和林地等防除一年生禾本科杂草和阔叶杂草进行处理。但是随着莠去津的广泛应用,导致了严重的环境污染问题,其作为内分泌干扰抑制剂能够影响生物体内的正常代谢机制和形态发育,导致乳腺癌和卵巢癌的发生,为了解决莠去津污染问题,必须要对使用莠去津的土壤进行处理。
目前现有的莠去津处理方法中以生物修复技术最具有发展前景,其由于高效环保的优点成为研究的热点,研究表明采用细菌降解莠去津具有较高的价值,微生物可以利用莠去津作为碳源和氮源,从而使莠去津分子脱烷基、脱n-烷基及三氮环裂解,释放出二氧化碳并彻底矿化降解,由于微生物降解莠去津的过程是由酶驱动,为了提高莠去津降解的效果,需要将酶固定于载体上以产生长效降解效果,因此,需要一种能够长时间稳定存在以降解土壤中莠去津污染物的固定化酶产物。
技术实现要素:
本发明提供了一种固定化酶的制备方法,其具有工艺简单、操作方便的优点。
本发明还提供了一种固定化酶,其具有粒度均匀,结构稳定的优点,且能够在土壤中缓慢降解以露出内部负载的莠去津降解酶。
本发明还提供了上述固定化酶在修复莠去津污染土壤中的应用。
本发明是这样实现的:
一种固定化酶的制备方法,包括以下步骤:
将hb-5菌种破碎离心分离得到酶液;
将酶液加入到壳聚糖的醋酸水溶液中搅拌均匀,随后滴入到氢氧化钠溶液中搅拌、过滤获得微球;
将微球和海藻酸钠溶液混合后滴入氯化钙溶液中。
在本发明较佳的实施例中,上述hb-5菌种按2%~4%的接种量使用液体培养基在28~35℃下培养48h以上,随后进行破碎离心分离作业,液体培养基包含蔗糖3~5g/l,酵母浸膏1~3g/l,k2hpo41.6~2.5g/l,kh2po40.4~0.6g/l,mgso4·7h2o0.2~0.5g/l,nacl0.1~0.4g/l,微量元素溶液2~4ml/l,莠去津100~300mg/l。
在本发明较佳的实施例中,上述微量元素溶液包含edta2~2.5g/l,feso4·7h2o1~2g/l,znso4·7h2o3~5g/l,mnso4·h2o1~2g/l,cuso4·5h2o0.4~0.8g/l,na2b4o7·10h2o0.2~0.5g/l,na2moo4·2h2o0.25~0.5g/l。
在本发明较佳的实施例中,上述破碎离心分离是将hb-5菌种在4℃下于8000~9000rpm离心8~12min后收集菌体,并用0.05~0.1mol/l的磷酸盐缓冲液洗涤1~3次后于8000~9000rpm二次离心8~12min收集菌体,随后将收集的菌体和磷酸盐缓冲液按1g:2~3ml的比例混合后冰水浴超声波破碎10~20min后在4℃下于9000~10000rpm离心15~20min收集上清液,超声功率为280~350w。
在本发明较佳的实施例中,上述超声波破碎时,每破碎5~20s,间隔5~20s。
在本发明较佳的实施例中,上述壳聚糖的醋酸水溶液中壳聚糖的质量分数为2%~5%,酶液和壳聚糖的质量比为1:30~40,氢氧化钠溶液的质量分数为5%~10%。
在本发明较佳的实施例中,上述氢氧化钠溶液中含有质量分数1%~2%的烷基磺酸盐。
在本发明较佳的实施例中,上述微球和质量浓度3%~5%的海藻酸钠溶液按1:25~40的质量比混合后滴入质量分数4%~8%的氯化钙溶液中。
本发明还提供了一种固定化酶,其是采用上述的固定化酶的制备方法制备得到。
本发明还提供了上述的固定化酶在修复莠去津污染土壤中的应用。
本发明的有益效果是:本发明提供的固定化酶的制备方法包括以下步骤:将hb-5菌种破碎离心分离得到酶液;将酶液加入到壳聚糖的醋酸水溶液中搅拌均匀,随后滴入到氢氧化钠溶液中搅拌、过滤获得微球;将微球和海藻酸钠溶液混合后滴入氯化钙溶液中。本发明提供的固定化酶的制备方法工艺简单、操作方便,能够制备得到粒度大小均匀、结构稳定的吸附有酶的双层固定化球。本发明还提供了使用上述方法制备得到的固定化酶,其具有粒度均匀、结构稳定性强的优点,该固定化酶能够在土壤中缓慢降解以露出内部负载的莠去津降解酶进行净化作业。本发明还提供了上述固定化酶在修复莠去津污染土壤中的应用。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
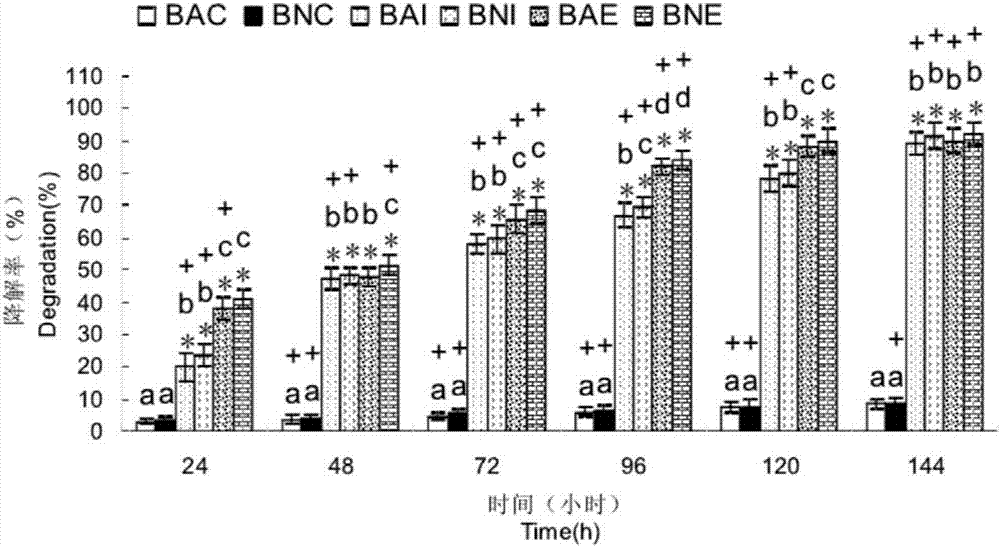
图1为使用实施例1制备的酶液和固定化酶在棕壤土中降解莠去津的效果对比图;
图2为使用实施例2制备的酶液和固定化酶在棕壤土中降解莠去津的效果对比图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例进行具体说明。
本实施例提供了一种固定化酶的制备方法,包括以下步骤:
s1、将hb-5菌种破碎离心分离得到酶液;优选的,hb-5菌种按2%~4%的接种量使用液体培养基在28~35℃下培养48h以上,随后进行破碎离心分离作业,液体培养基包含蔗糖3~5g/l,酵母浸膏1~3g/l,k2hpo41.6~2.5g/l,kh2po40.4~0.6g/l,mgso4·7h2o0.2~0.5g/l,nacl0.1~0.4g/l,微量元素溶液2~4ml/l,莠去津100~300mg/l。其中,微量元素溶液优选包含edta2~2.5g/l,feso4·7h2o1~2g/l,znso4·7h2o3~5g/l,mnso4·h2o1~2g/l,cuso4·5h2o0.4~0.8g/l,na2b4o7·10h2o0.2~0.5g/l,na2moo4·2h2o0.25~0.5g/l。进一步优选的,破碎离心分离是将hb-5菌种在4℃下于8000~9000rpm离心8~12min后收集菌体,并用0.05~0.1mol/l的磷酸盐缓冲液洗涤1~3次后于8000~9000rpm二次离心8~12min收集菌体,随后将收集的菌体和磷酸盐缓冲液按1g:2~3ml的比例混合后冰水浴超声波破碎10~20min后在4℃下于9000~10000rpm离心15~20min收集上清液,超声功率为280~350w;超声波破碎时,优选每破碎5~20s,间隔5~20s。
s2、将酶液加入到壳聚糖的醋酸水溶液中搅拌均匀,滴入到氢氧化钠溶液中搅拌、过滤获得微球;优选的壳聚糖的醋酸水溶液中壳聚糖的质量分数为2%~5%,酶液和壳聚糖的质量比为1:30~40,氢氧化钠溶液的质量分数为5%~10%;氢氧化钠溶液中优选含有质量分数1%~2%的烷基磺酸盐;干燥优选是30~40℃下烘干。
s3、将微球和海藻酸钠溶液混合后滴入氯化钙溶液中。优选的,微球和质量浓度3%~5%的海藻酸钠溶液按1:25~40的质量比混合后滴入质量分数4%~8%的氯化钙溶液中。
本发明固定化酶的制备方法选取节杆菌属(arthrobacter)降解菌hb-5的菌种进行培养后破碎、离心提取得到能够降解莠去津的酶,随后依次使用壳聚糖和海藻酸钠对酶进行二次包埋成球,从而得到结构稳定且对温度、湿度和酸碱性适应性强的固定化酶,以延长降解酶的有效作用周期,保证长时间稳定的修复效果;其中,将hb-5菌种使用含有微量元素溶液的液体培养基培养后进行酶提取作业,能够促进微生物快速繁殖,提高活菌的数量和活性,从而提升提取得到的酶量和活性,随后将培养的菌种和磷酸盐缓冲液混合后冰水浴超声波破碎,并在超声波破碎时每破碎5~20s后间隔5~20s,从而使菌种充分粉碎保证酶析出时保持活性,避免温度升高破坏酶的活性;将离心收集的酶液加入到壳聚糖的醋酸水溶液中搅拌均匀,滴入到含有烷基磺酸盐的氢氧化钠溶液中搅拌、过滤获得微球,能够获得粒度均匀且包埋良好的微球,烷基磺酸盐的加入能够通过调节表面张力使壳聚糖微球快速成形,保证壳聚糖微球的粒度均衡,结构稳定;将制备的微球和海藻酸钠溶液混合后滴入氯化钙溶液中二次包埋处理制成双层小球,能够进一步保证固定化酶的结构稳定性,延长其有效作用失效。
本发明还提供了一种固定化酶,其是采用上述的固定化酶的制备方法制备得到,该固定化酶具有粒度均匀、结构稳定的优点,可在土壤中缓慢降解并露出内部负载的莠去津降解酶以便于长效作用降解莠去津。
本发明还提供了上述的固定化酶在修复莠去津污染土壤中的应用,该固定化酶施用于土壤中能够长时间的稳定有效的降解土壤中的莠去津。
以下结合实施例对本发明方法的特征和性能作进一步的详细描述。
实施例1
实施例1提供了一种固定化酶的制备方法,其具体的制备步骤如下:
s101、将hb-5菌种破碎离心分离得到酶液;将hb-5菌种按2%的接种量接种于液体培养基中,在30℃下培养48h以上后在4℃下于8000rpm离心8min后收集菌体,并用0.05mol/l的磷酸盐缓冲液洗涤3次后于8000rpm二次离心12min收集菌体,随后将收集的菌体和磷酸盐缓冲液按1g:3ml的比例混合后冰水浴超声波破碎10min后在4℃下于10000rpm离心15min收集上清液得到酶液;超声功率为280w;超声波破碎时,每破碎5s,间隔5s,其中,液体培养基包含蔗糖3g/l,酵母浸膏1g/l,k2hpo41.6g/l,kh2po40.4g/l,mgso4·7h2o0.2g/l,nacl0.1g/l,微量元素溶液2ml/l,莠去津100mg/l;微量元素溶液优选包含edta2.5g/l,feso4·7h2o1g/l,znso4·7h2o5g/l,mnso4·h2o1g/l,cuso4·5h2o0.4g/l,na2b4o7·10h2o0.2g/l,na2moo4·2h2o0.25g/l。
s102、将酶液加入到壳聚糖的醋酸水溶液中搅拌均匀,壳聚糖的醋酸水溶液中壳聚糖的质量分数为3%,酶液和壳聚糖的质量比为1:30,随后滴入到质量分数为5%的氢氧化钠溶液中搅拌、过滤获得微球,氢氧化钠溶液中含有质量分数1.5%的烷基磺酸钠。
s103、将微球和质量浓度3%的海藻酸钠溶液混合后滴入质量分数4%的氯化钙溶液中形成粒径为2.5mm的固定化小球,将固定化小球于4℃的氯化钙溶液中保存6h,并储存于4℃下备用。
实施例2
实施例2提供了一种固定化酶的制备方法,其具体的制备步骤如下:
s201、将hb-5菌种破碎离心分离得到酶液;优选的,hb-5菌种按3%的接种量使用液体培养基35℃下培养48h以上后在4℃下于9000rpm离心10min后收集菌体,并用0.1mol/l的磷酸盐缓冲液洗涤2次后于9000rpm二次离心12min收集菌体,随后将收集的菌体和磷酸盐缓冲液按1g:2ml的比例混合后冰水浴超声波破碎15min后在4℃下于9500rpm离心20min收集上清液得到酶液;超声功率为350w;超声波破碎时,每破碎12s,间隔12s。其中,液体培养基包含蔗糖5g/l,酵母浸膏3g/l,k2hpo42g/l,kh2po40.5g/l,mgso4·7h2o0.4g/l,nacl0.3g/l,微量元素溶液3ml/l,莠去津250mg/l;微量元素溶液包含edta2.5g/l,feso4·7h2o2g/l,znso4·7h2o4g/l,mnso4·h2o1.5g/l,cuso4·5h2o0.5g/l,na2b4o7·10h2o0.3g/l,na2moo4·2h2o0.4g/l。
s202、将酶液加入到壳聚糖的醋酸水溶液中搅拌均匀,壳聚糖的醋酸水溶液中壳聚糖的质量分数为4%,酶液和壳聚糖的质量比为1:35,随后滴入到质量分数为8%的氢氧化钠溶液中搅拌、过滤获得微球。
s203、将微球和质量浓度4%的海藻酸钠溶液混合后滴入质量分数6%的氯化钙溶液中形成粒径为2.5mm的固定化小球,将固定化小球于4℃的氯化钙溶液中保存5h,并储存于4℃下备用。
以下通过使用实施例1、实施例2中制备的酶液和固定化酶对土壤中莠去津进行降解的效果进行对比。
选取泰安的棕壤表层耕作土,除去杂草、枯枝落叶,过40目筛,调整含水量为最大持水量的60%,将土壤分为灭菌处理组和不灭菌处理两组,其中,灭菌处理组包括对照组(bac组)即不添加酶液也不添加固定化酶的处理、添加酶液组(bae组)和添加固定化酶组(bai组),灭菌组在121℃下连续灭菌2h,不灭菌处理组包括对照组(bnc组)即不添加酶液也不添加固定化酶的处理、添加酶液组(bne组)和添加固定化酶组(bni组),每个处理设3个重复。将土样中的莠去津浓度调整为10mg/kg后分别装于125ml的棕色瓶中,每瓶装入土壤50g。添加酶液组按照20ml/kg的量添加实施例1制备得到的酶液,即每个棕色瓶中添加酶液1ml;添加固定化酶组按照200g/kg的量添加实施例1制备得到的固定化酶,即每个棕色瓶中添加固定化酶10g;随后在室温下避光培养,并于培养开始后的第0h、24h、48h、72h、96h、120h和144h从土壤中取样并分析莠去津的残留量,计算降解率,得到固定化酶对两种污染土壤中莠去津降解规律的影响,结果如图1所示,其中“*”表示处理组与灭菌对照组土样之间存在着显著性差异,字母不同表示每两个处理组之间存在着显著性差异,“+”表示两种土壤的相应处理组之间存在着显著性差异,其中p<0.05,图1中的数值均为三次平行的平均值,误差线表示标准误差。
土壤中莠去津的提取和分析方法如下:用百分之一天平称取25g土样于碘量瓶中,加入70ml丙酮振荡提取、减压抽滤,用30ml丙酮分三次冲洗碘量瓶和滤渣,滤液合并后,转移至500ml分液漏斗中,用50mlchcl3分三次洗涤抽滤瓶,洗涤液合并到分液漏斗中,加入50ml的质量浓度3%的氯化钠溶液,充分振荡混匀,静置30min,下层chcl3经烘干的无水硫酸钠干燥后滤入250ml的平底球形烧瓶。再用30mlchcl3萃取一次,同样收集下层chcl3,与上次的chcl3合并。向平底球形烧瓶中加入10ml石油醚,将全部萃取液用旋转蒸发器于50℃下浓缩至1-2ml,待柱层析净化。将规格为1.5cm×25cm的层析柱的上、下两端各加5g烘干的无水硫酸钠,中间加用质量分数为6%的蒸馏水失活处理的3g弗罗里硅土,将层析柱压实,用10ml石油醚预淋洗层析柱,然后将上述浓缩溶液全部转移至层析柱中,再用100ml混合淋洗液(石油醚:乙酸乙酯v:v=95:5)分三次洗脱,收集全部淋洗液,用旋转蒸发器50℃下浓缩至1-2ml,正己烷定容到25ml,于gc-ecd分析测定。测定条件:色谱柱为ov-1701毛细管柱(30m×0.53mmi.d.);温度:进样口260℃,检测器260℃,柱温230℃;气体:载气60kpa,尾吹70kpa;不分流进样,进样量1μl,根据样品定容体积和稀释倍数以及样品色谱峰和标样色谱峰的峰高,利用外标法计算培养液中莠去津的浓度。
由图1可以看出,随着时间的延长,添加酶液、固定化酶的处理组,莠去津均表现出良好的降解效果,144h时,莠去津降解率达到90%左右。所有添加酶的处理组与灭菌处理的对照组相比均有显著性差异,土著微生物在莠去津降解过程中发挥的作用,相对于酶液和固定化酶要小得多,且随着时间的延长,固定化酶最终与酶液对莠去津的降解效果一样,这是由于酶液可以直接与土壤中的莠去津分子接触,并开始催化其发生水解,因此不灭菌加酶液的处理降解速度最快;而固定化酶从包埋剂中析出需要一定的时间,所以处理前期降解速率低于酶液,但到144h时两者降解速率基本持平,表明固定化后的酶比酶液更能缓慢释放其对莠去津的降解能力,从而可以应用于较为长期的土壤修复中。
选取沈阳的褐土表层耕作土,除去杂草、枯枝落叶,过40目筛,调整含水量为最大持水量的60%,将土壤分为灭菌和不灭菌处理两组,其中,灭菌处理组包括对照组(cac组)即不添加酶液也不添加固定化酶的处理、添加酶液组(cae组)和添加固定化酶组(cai组),灭菌组在121℃下连续灭菌2h,不灭菌处理组包括对照组(cnc组)即不添加酶液也不添加固定化酶的处理、添加酶液组(cne组)和添加固定化酶组(cni组),每个处理设3个重复。将土样中的莠去津浓度调整为10mg/kg后,分装于125ml的棕色瓶中,每瓶50g。按照20ml/kg的量添加实施例2中制备得到的酶液,即每个棕色瓶中添加酶液1ml;按照200g/kg的量添加实施例2中制备得到的固定化酶,即每个棕色瓶中添加固定化酶10g。室温下避光培养,并于培养开始后的第0h、24h、48h、72h、96h、120h和144h取样分析莠去津的残留量,计算降解率,得到莠去津的固定化酶对两种污染土壤中莠去津降解规律的影响,如图2所示,其中“*”表示处理组与灭菌对照组土样之间存在着显著性差异,字母不同表示每两个处理组之间存在着显著性差异,“+”表示两种土壤的相应处理组之间存在着显著性差异,其中p<0.05,图2中的数值均为三次平行的平均值,误差线表示标准误差。
由图2可以看出,褐土中的主要降解规律与图1中棕壤土的降解类似,添加固定化酶的两组处理除了24h和96h外,降解速度是最快的。在棕壤土中,酶液由于可以直接与土壤中的莠去津分子接触,并开始催化其发生水解,因此不灭菌加酶液的处理降解速度最快,降解率最大;但是褐土由于其自身偏酸性,不接近酶液的最佳反应ph值因此酶液在其中不能发挥最佳的降解作用。而在酶液固定化以后,由于降解酶从包埋剂中析出需要一定的时间,且包埋材料可以为酶分子提供一定的保护作用,因此在各个处理中,不灭菌加固定化酶处理的降解速度和降解率要比直接加酶液的还高,但到了144h时,两种处理对莠去津的降解效果基本一样,两种土壤相比较,几乎所有的处理在不同的取样时间之间都有显著性差异出现,说明酶液和固定化酶在两种土壤中的修复效果并不是完全一样的,表明不同理化性质的土壤之间应用同样的酶和固定化酶来进行修复莠去津的污染,其效果是不尽相同的,而从柱状图的高低比较上可以看出,褐土中的土著微生物在辅助酶液或固定化酶降解土壤中的莠去津时,作用比棕壤土中的明显,这是因为沈阳的褐土中含有较高含量的有机质,为其中的土著微生物的生长提供了较好的营养条件,从而其中的土著微生物能发挥更好的降解莠去津的作用。
综上所述,本发明实施例提供的固定化酶能够有效的降解土壤中含有的莠去津,且该固定化酶的结构稳定性强,能够在土壤中缓慢的降解以释放莠去津降解酶来产生稳定长效降解作业,从而适应不同的土壤理化环境以对莠去津进行降解处理,相比直接将降解酶加入到土壤中具有巨大的优势。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!