一种研究细胞趋化的微流控芯片和方法与流程
本发明涉及微流控芯片技术在生物医学领域的应用,具体地说,提供了一种用于进行细胞趋化研究的微流控芯片及基于该芯片的细胞趋化研究方法。
背景技术:
在上个世纪90年代初出现的微流控芯片技术是在微米尺度下对生物、化学等样品进行精确操控的一门科学技术,具有液体流动可控、消耗试样和试剂量少、分析速度快、小型便携、高通量、多种操作单元集成化等优点。微流控芯片技术的发展不仅为进行生化分析提供了一个小型便携的片上实验室(labonachip),更为细胞生物学的研究带来了新的机遇。由于芯片的微管道尺寸与细胞尺寸相当,而且容易对细胞所处的微环境进行调控,微流控芯片已经成为进行细胞培养和研究的一个新的技术平台。
趋化性是最基本的细胞生理反应之一,指的是细胞沿浓度梯度向着化学刺激物的定向移动。具有吸引细胞定向移动的化学刺激物称为趋化因子,细胞受到趋化因子刺激后,沿浓度梯度定向移动。细胞趋化在伤口愈合、肿瘤转移、组织发育等过程中发挥着重要的作用。常规研究方法是使用transwell技术(细胞迁移侵袭试验技术),将transwell小室放入与之尺寸相匹配的培养孔板,小室内称上室,培养板内称下室,上室内加入上层培养液,下室内加入下层培养液,上下层培养液以聚碳酸酯膜相隔。将细胞种在上室内,由于聚碳酸酯膜具有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养液中的成分对细胞生长、运动等的影响,但这种方法并不能直观的观察到细胞的迁移过程。其他的细胞迁移常用研究方法包括划痕实验等,难以实现细胞的间接接触式共培养,无法应用于此类研究。
技术实现要素:
针对以上问题,本发明设计制作了一种微流控芯片,可在芯片上进行细胞的间接接触式共培养,并在此基础上进行细胞趋化的研究。该微流控芯片具有设计灵活、制作简单、操作简便、节约细胞和试剂、允许实时观测细胞迁移过程等优点,可用于进行各类细胞间接接触式共培养、细胞趋化、细胞迁移等研究。
本发明技术方案如下:
一种研究细胞趋化的微流控芯片(即多层微流控芯片),该微流控芯片从下到上依次包括基底层、细胞培养层、细胞迁移层,各层按照从下到上的顺序依次对齐并封合在一起。
进一步地,所述细胞迁移层上至少设有两个储液池(reservoir),所述储液池之间通过连通区域连接。
在本发明中,通过连通区域依次连接的储液池定义为连通结构。
所述细胞培养层至少为一层,其上至少设有一个储液池;且所述细胞迁移层上至少有一个储液池和细胞培养层上的至少一个储液池一一对应(即位置上下对齐),并在各层封合的时候对齐。
进一步地,所述细胞培养层也可以为二层或二层以上。
为方便描述,将最上面的细胞培养层定义为第一层细胞培养层;从上往下依次为第二层细胞培养层、第n层细胞培养层。n为自然数。
当所述细胞培养层为二层或二层以上时,最上面的细胞培养层(即第一层细胞培养层)上至少设有二个彼此独立(即相互不连通)储液池;且所述细胞迁移层上至少有二个储液池和最上面的细胞培养层上的至少二个储液池一一对应(即位置上下对齐),并在各层封合的时候对齐;其余各层细胞培养层上至少设有一个储液池。
在本发明一种具体实施方式中,提供一种结构最为简单的研究细胞趋化的微流控芯片,从下到上依次包括基底层、细胞培养层、细胞迁移层;各层按照从下到上的顺序依次对齐并封合在一起;所述细胞迁移层上至少设有一组连通结构,所述连通结构包括至少两个通过连通区域连接的储液池(其中一个储液池可用于培养细胞,另一个储液池可用于储液);所述细胞培养层上至少设有一个储液池(可用于进行细胞培养),所述细胞迁移层上至少有一个储液池与细胞培养层上的储液池上下对齐。
在本发明一种具体实施方式中,提供一种研究细胞趋化的微流控芯片,从下到上依次包括基底层、细胞培养层、细胞迁移层;各层按照从下到上的顺序依次对齐并封合在一起;所述细胞迁移层上至少设有两个储液池,所述储液池之间通过连通区域连接;所述细胞培养层为二层,最上面的细胞培养层(即第一层细胞培养层)上至少设有二个彼此独立(即相互不连通)储液池;且所述细胞迁移层上至少有二个储液池和最上面的细胞培养层上的至少二个储液池一一对应(即位置上下对齐),并在各层封合的时候对齐;最下面的细胞培养层(即从上往下数第二层细胞培养层)上至少设有一个储液池(用于进行细胞培养),且上下两层细胞培养层上至少有一个储液池上下对齐。
在本发明一种具体实施方式中,提供一种研究细胞趋化的微流控芯片,从下到上依次包括基底层、细胞培养层、细胞迁移层;各层按照从下到上的顺序依次对齐并封合在一起;所述细胞迁移层上至少设有三个依次通过连通区域连接的储液池;所述细胞培养层为二层,最上面的细胞培养层(即第一层细胞培养层)上至少设有三个彼此独立(即相互不连通)储液池;且所述细胞迁移层上至少有三个储液池和最上面的细胞培养层上的至少三个储液池一一对应(即位置上下对齐),并在各层封合的时候对齐;最下面的细胞培养层(即从上往下数第二层细胞培养层)上至少设有一个储液池(用于进行细胞培养),且上下两层细胞培养层上至少有一个储液池上下对齐。
在本发明一种具体实施方式中,提供一种研究细胞趋化的微流控芯片,从下到上依次包括基底层、细胞培养层、细胞迁移层;各层按照从下到上的顺序依次对齐并封合在一起;所述细胞迁移层上至少设有三个依次通过连通区域连接的储液池;所述细胞培养层为三层,最上面的细胞培养层(即第一层细胞培养层)上至少设有三个彼此独立(即相互不连通)储液池,且所述细胞迁移层上至少有三个储液池和最上面的细胞培养层上的至少三个储液池一一对应(即位置上下对齐),并在各层封合的时候对齐;中间层细胞培养层(即从上往下数第二层细胞培养层)上至少有二个彼此独立(即相互不连通)储液池,且所述最上面的细胞培养层上至少有二个储液池和所述第二层细胞培养层上至少二个储液池一一对应(即位置上下对齐),并在各层封合的时候对齐;最下面的细胞培养层(即从上往下数第三层细胞培养层)上至少设有一个储液池,且所述第二层细胞培养层上至少有一个储液池和所述第三层细胞培养层上至少一个储液池一一对应(即位置上下对齐),并在各层封合的时候对齐。
进一步地,本发明所述储液池为通孔;和/或,所述连通区域为明渠(openchannel)。
本发明所述储液池可用于培养细胞,也可用于储液(培养液),可根据实际应用需要进行常规设计。
细胞迁移层(通过其上面的连通区域)用来进行迁移实验的观察。
当所述细胞培养层上设一个以上的储液池时,则各个储液池彼此独立,即相互之间没有管道将储液池相互连通。
所述细胞培养层和细胞迁移层的厚度不限,优选地,厚度可采用100-1000μm,例如100μm、200μm、500μm、1000μm等厚度。
所述储液池的形状和大小不限,例如可以是圆形、方形、三角形等;优选地,可采用直径为4-10mm的圆形。
所述细胞迁移层上的连通区域的通道可以为各种形式,包括直通道、弯曲通道、单一通道、多条平行通道等。优选地,本发明的一个实施例采用直线型、长度为4mm、宽度为1mm的单一通道。
进一步地,所述基底层、细胞培养层、细胞迁移层可由透明材料制成。优选地,可由以下材料中的一种或几种制成:聚甲基丙烯酸甲酯(polymethylmethacrylate,pmma)、以聚二甲基硅氧烷(polydimethylsiloxane,pdms)为代表的硅橡胶类材料、聚对苯二甲酸乙二醇酯(polyethyleneterephthalate,pet)、聚碳酸酯(polycarbonate,pc)、玻璃、环氧树脂和水凝胶。在本发明优选地实施例中,所述微流控芯片的基底层为玻璃,细胞培养层和细胞迁移层由硅橡胶薄膜制成,玻璃和硅橡胶都具有光学透明、无毒、生物相容性好的性质,广泛用于微流控芯片领域。
本发明另一方面,还提供一种应用上述微流控芯片进行细胞趋化研究的方法,用于研究一种细胞(b)在另一种细胞(a)分泌的细胞产物(例如细胞因子)作用下的趋化,包括:
1)将细胞a和细胞b、c等分别培养在不同储液池内,进行间接接触式共培养;
2)所述细胞a在连通区域产生从所述细胞a到待测细胞b、c等由高到低的细胞产物(例如细胞因子)浓度梯度;
3)在连通区域(可用显微镜)实时检测待测细胞的迁移情况。
在实际应用当中,可同时进行多组这样的细胞迁移实验。
以两种细胞为例,上述方法具体包括以下步骤:
1)将含有细胞a的悬液加入其中一层细胞培养层上的储液池a,控制加入的液体体积,使细胞a悬液被限制在储液池a以内,将所述微流控芯片放置于培养箱内培养;
2)待细胞a贴壁之后,将含有细胞b的悬液加入另一层细胞培养层上的储液池b或细胞迁移层上的储液池b,控制加入的液体体积,使细胞b悬液被限制在储液池b以内,将所述微流控芯片放置于培养箱内培养;
3)待细胞a和细胞b均贴壁生长以后,在细胞迁移层上的连通区域加培养基,连通储液池a和b,在连通区域产生从a到b的细胞产物的浓度梯度;
4)(用显微镜)观察细胞b在连通区域的迁移情况。
在符合本领域常识的基础上,上述各优选条件,可以相互组合,即得本发明各较佳实例。
在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。术语“上”、“下”、“左”、“右”、“内”、“外”、“前端”、“后端”、“头部”、“尾部”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
本发明提供的基于微流控芯片的细胞趋化研究系统具有以下优点:1、芯片系统制作方便,设计灵活,无需任何复杂设备;2、细胞在芯片中进行间接接触式共培养,并产生二维平面分布的细胞因子的浓度梯度;3、可实时观测芯片中细胞的迁移;4、微流控芯片体积小,可节约细胞及试剂的消耗量,节约分析时间和成本;5、可同时进行多组细胞迁移研究;6、可与其他芯片上的单元技术灵活组合,规模集成。
附图说明
图1为本发明实施例1中的微流控芯片结构示意图;
其中,a表示细胞迁移层,b和c表示细胞培养层,d-f分别表示微流控芯片的斜视图、纵截面示意图和俯视图;
11、细胞迁移层,上有连通区域15和储液池16/17;
12、细胞培养层,上有储液池18(可以培养细胞)和储液池19(可以储细胞培养液);
13、细胞培养层,上有储液池110(可用于培养细胞);
14、基底层;
储液池18与16在上下位置上相对应,储液池110与19、17在上下位置上相对应。
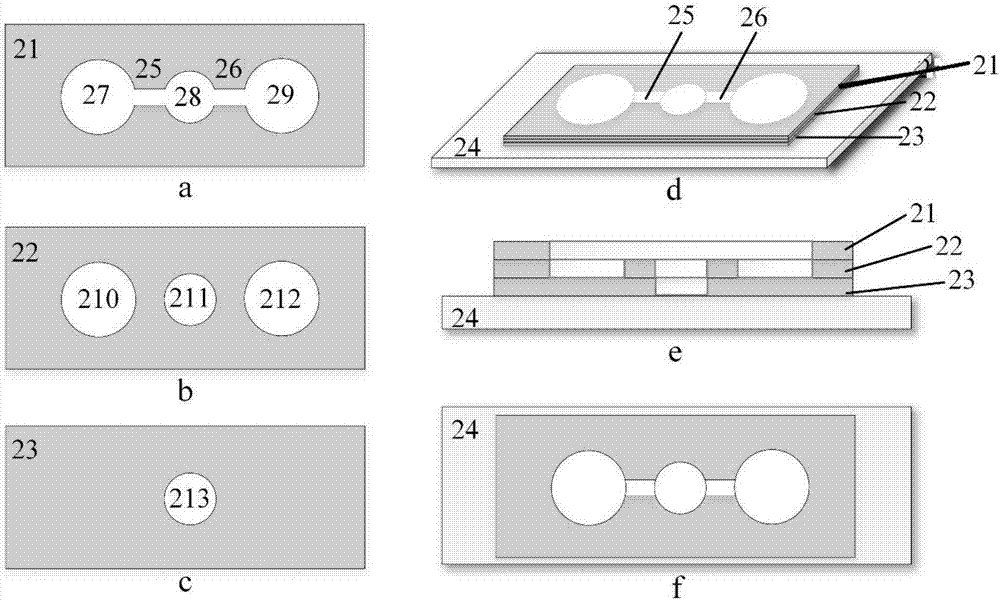
图2为本发明实施例2中的微流控芯片结构示意图;
其中,a表示细胞迁移层,b和c表示细胞培养层,d-f分别表示微流控芯片的斜视图、纵截面示意图和俯视图;
21、细胞迁移层,上有连通区域25/26和储液池27/28/29;
22、细胞培养层,上有储液池210/211/212(其中210可用于培养细胞,211/212可用于储液或作为空白对照);
23、细胞培养层,上有储液池213(用于培养细胞);
24、基底层;
储液池213与211、28在上下位置上相对应;储液池210与27、储液池212与29分别在上下位置上相对应。
图3为本发明实施例3中的微流控芯片结构示意图;
其中,a表示细胞迁移层,b-d分别表示细胞培养层,e-g分别表示微流控芯片的斜视图、纵截面示意图和俯视图;
31、细胞迁移层,上有连通区域36/37和储液池38/39/310;
32、细胞培养层,上有储液池311/312/313(其中311可用于细胞培养,312/313可用于储液);
33、细胞培养层,上有储液池314/315,其中315用于细胞培养,314用于储液;34、细胞培养层,上有储液池316(可用于细胞培养);
35、基底层;
储液池316与314、312、39在上下位置上相对应;储液池315与313、310在上下位置上相对应;储液池311与38在上下位置上相对应。
图4为本发明实施例4中的微流控芯片结构示意图;
其中,a表示细胞迁移层,b表示细胞培养层,c表示基底层;d-f分别表示微流控芯片的斜视图、纵截面示意图和俯视图;
41、细胞迁移层,上有连通区域4和储液池5/6(其中储液池5可用于细胞培养);
42、细胞培养层,上有储液池7(可用于细胞培养);
43、基底层;储液池7与6在上下位置上相对应。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
下面给出本发明微流控芯片几种具体结构以及使用方法:
实施例1细胞间接接触式共培养
如图1所示,一种研究细胞趋化的微流控芯片,该芯片从下到上依次包括基底层14、细胞培养层13、细胞培养层12、细胞迁移层11,各层按照从下到上的顺序依次对齐并封合在一起;细胞迁移层11上设有由连通区域15、储液池16和17构成的一组连通结构;细胞培养层12上有储液池18和19(各储液池互不相通);细胞培养层13上有储液池110;储液池18与16在上下位置上相对应,储液池110与19、17在上下位置上相对应。
基底层14为玻璃载玻片,细胞迁移层11、细胞培养层12和13均为厚度为1mm的pdms薄膜,膜大小为2cm×3cm。储液池直径均为1cm的圆形通孔,连通区域15的尺寸为2mm(宽度)×6mm(长度)。
储液池可以培养细胞也可以储细胞培养液;储液池均为通孔结构,连通区域15为明渠(openchannel)。
具体使用时,可将储液池110和18用作细胞培养,16、17、19可以储细胞培养液。
使用上述微流控芯片研究细胞趋化的方法如下:
以研究细胞b在细胞a分泌的细胞产物(例如细胞因子)作用下的趋化为例,首先将含有细胞a的悬液接种到储液池110中,控制加入的液体体积,使液体被限制在储液池110以内,将芯片放置于培养箱内培养;待细胞a贴壁之后,将含有细胞b的悬液加入储液池18,控制加入的液体体积,使液体被限制在储液池18以内,将芯片放置于培养箱内培养;待细胞a和b均贴壁生长以后,在连通区域15加培养基,连通储液池18和110,即实现了细胞a和b的间接接触式共培养。
进一步地,当在连通区域15产生从a到b的细胞a分泌产物浓度梯度后,可用显微镜观察细胞b在连通区域向a的迁移情况。
实施例2一种细胞在另一种细胞分泌的细胞因子作用下的迁移
如图2所示,一种研究细胞趋化的微流控芯片,该芯片从下到上依次包括基底层24、细胞培养层23、细胞培养层22、细胞迁移层21,各层按照从下到上的顺序依次对齐并封合在一起;细胞迁移层21上设有一组连通结构,其包括依次连接的储液池27、连通区域25、储液池28、连通区域26和储液池29;细胞培养层22上有储液池210/211/212(互不相通);细胞培养层23上有储液池213;
储液池213与211、28在上下位置上相对应;储液池210与27、储液池212与29分别在上下位置上相对应。
基底层24为玻璃载玻片,细胞迁移层21和细胞培养层22/23均为厚度为500μm的硅橡胶薄膜,大小为1.5cm×3cm,储液池28和储液池211/213均为直径为5mm的圆形通孔;储液池27/29和储液池210/212均为直径为8mm的圆形通孔,连通区域25/26的尺寸为1mm(宽度)×4mm(长度)。
储液池可以培养细胞也可以储细胞培养液;储液池均为通孔结构,连通区域25/26为明渠(openchannel)。
具体使用时,可将储液池210和储液池213用作细胞培养,储液池211/212可以储细胞培养液或作为空白对照。
使用上述微流控芯片研究细胞趋化的方法如下:
以研究细胞b在细胞a分泌的细胞产物(例如细胞因子)作用下的趋化为例,首先将含有细胞a的悬液接种到储液池210中,控制加入的液体体积,使液体被限制在储液池210以内,将该微流控芯片放置于培养箱内培养;储液池212不加入细胞,留作空白对照。待细胞a贴壁之后,将含有细胞b的悬液加入储液池213,控制加入的液体体积,使液体被限制在储液池213以内,将微流控芯片放置于培养箱内培养。待细胞a和b均贴壁生长以后,在连通区域25/26加培养基,将各个储液池连通,实现细胞a和b的间接接触式共培养,随后观察细胞b沿着连通区域25/26向储液池27/29的迁移情况。
实施例3在一块芯片上同时进行多组细胞迁移研究
如图3所示,一种研究细胞趋化的微流控芯片,该芯片从下到上依次包括基底层35、细胞培养层34、细胞培养层33、细胞培养层32、细胞迁移层31,各层按照从下到上的顺序依次对齐并封合在一起;细胞迁移层31设有一组连通结构,其包括依次连接的储液池38、连通区域36、储液池39、连通区域37和储液池310;细胞培养层32上有储液池311/312/313(各储液池互不相通);细胞培养层33上有储液池314/315(各储液池互不相通);细胞培养层34上有储液池316。
储液池316与314、312、39在上下位置上相对应;储液池315与313、310在上下位置上相对应;储液池311与38在上下位置上相对应。
基底层35为pmma材料,细胞迁移层和细胞培养层均为厚度为250μm的硅橡胶薄膜,大小为2cm×5cm。
储液池316/314/312/39均为直径为6mm的圆形通孔;储液池311/38/315/313/310均为直径为4mm的圆形通孔;连通区域36/37的尺寸为1.5mm(宽度)×4.5mm(长度)。
储液池可以培养细胞也可以储细胞培养液;储液池均为通孔结构,连通区域36/37为明渠(openchannel)。
具体使用时,可将储液池311/315/316用作细胞培养,储液池312/313/314可以储细胞培养液或作为空白对照。
使用上述微流控芯片研究细胞趋化的方法如下:
以研究细胞b和细胞c在细胞a分泌的细胞产物(例如细胞因子)作用下的趋化为例,首先将含有细胞a的悬液接种到储液池316中,控制加入的液体体积,使液体被限制在储液池316以内,将该微流控芯片放置于培养箱内培养;待细胞a贴壁之后,将含有细胞b的悬液加入储液池315,控制加入的液体体积,使液体被限制在储液池315以内,将该微流控芯片放置于培养箱内培养;待细胞a/b均贴壁之后,将含有细胞c的悬液接种到储液池311中,控制加入的液体体积,使液体被限制在储液池311以内,将该芯片放置于培养箱内培养。待细胞a/b/c均贴壁生长以后,在连通区域36/37加培养基,将各个储液池连通,实现多种细胞的间接接触式共培养。随后在连通区域36观察细胞a/b的迁移情况,在连通37观察细胞a/c的迁移情况,即实现了两组细胞趋化实验的同时进行。
实施例4
如图4所示,一种研究细胞趋化的微流控芯片,从下到上依次包括基底层43、细胞培养层42、细胞迁移层41;各层按照从下到上的顺序依次对齐并封合在一起;所述细胞培养层42上设有至少一个储液池7,所述细胞迁移层上设有至少一组连通结构,所述连通结构包括依次连接的储液池5、连通区域4(为明渠,openchannel)和储液池6,所述细胞迁移层上至少有一个储液池6与细胞培养层上的储液池7上下对齐。
基底层43为玻璃载玻片,细胞迁移层41和细胞培养层42均为厚度为250μm的硅橡胶薄膜,大小为1.5cm╳2cm,储液池7和6均为直径8mm的圆形通孔;储液池5为直径5mm的圆形通孔;连通区域4的尺寸为1mm(宽度)×2mm(长度)。
使用上述微流控芯片研究细胞趋化的方法如下:
以研究细胞b在细胞a分泌的细胞产物(例如细胞因子)作用下的趋化为例,首先将含有细胞a的悬液接种到储液池7中,控制加入的液体体积,使液体被限制在储液池7以内,将该微流控芯片放置于培养箱内培养;待细胞a贴壁之后,将含有细胞b的悬液加入储液池5,控制加入的液体体积,使液体被限制在储液池5以内,将芯片放置于培养箱内培养;待细胞a和b均贴壁生长以后,在连通区域4加培养基,连通储液池7和储液池5,即实现了细胞a和b的间接接触式共培养。在连通区域4产生从a到b的细胞分泌产物的浓度梯度;用显微镜观察细胞b在连通区域的迁移情况即可。
从以上实施例中可看出,使用本发明的微流控芯片及方法,可进行多种细胞的间接接触式共培养、形成稳定的浓度梯度、进行细胞趋化等研究,并能够利用显微镜方便的实时检测细胞的迁移情况。通过增加层数和储液池数目以及巧妙的芯片结构设计,能够同时进行多组细胞趋化研究。芯片设计灵活、制作简单、操作简便、节约细胞和试剂。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 包括测量巨噬细胞移动抑制因子(mif)的血浆浓度的诊断、预后或治疗急性冠状动脉综合 ...的制作方法
- 趋化素样因子-1在器官炎性损伤中的用途的制作方法
- 检测细胞趋化性及趋化细胞分离装置的单元孔的制作方法
- 涉及作为心脏衍生的心肌抑制因子的巨噬细胞迁移抑制因子(mif)的治疗和生物测定方法
- 一种重组人粒细胞巨噬细胞刺激因子的纯化方法
- 抑制巨噬细胞移动抑制因子(mif)的细胞因子或生物活性的萘衍生物的制作方法
- 新的人趋化因子——巨噬细胞炎性蛋白、其编码序列及用途的制作方法
- 具有免疫细胞趋化和造血刺激活性的趋化因子的制作方法
- 流产嗜性衣原体巨噬细胞感染增强因子的单克隆抗体及其杂交瘤细胞的制作方法
- 一种巨噬细胞转移抑制因子单克隆抗体及其制备方法