一种化合物、包含其的决明子提取物及其用途的制作方法
本发明涉及中药提取物技术领域,特别是涉及一种化合物、包含其的决明子提取物及其用途。
背景技术:
决明子为豆科决明属植物决明(Cassia obtusifolia L)或小决明(Cassia tora L)的干燥成熟种子,其性微寒,味甘,苦,咸,归肝,肾,大肠经,具有清肝明目,润肠通便的功效。用于目赤涩痛,羞明多泪,头痛眩晕,目暗不明,大便秘结等症。决明子始栽于《神农本草经》,列为120种上品药之一,称之“能治诸眼疾,久服益精光,轻身”。决明子的别名有草决明、羊明、羊角豆、还瞳子、浮绿豆,千里光、野青豆、夜花生等。决明子作为国家卫生部公布的69种药食同源的中药之一被广泛应用,主要分布于安徽,广西,四川,浙江,广东等地,决明子中含有多种化学成分,主要有蒽醌类,黄酮类,萘并吡喃酮类,挥发油类,脂肪酸类,氨基酸类,多糖类及多种无机元素。且具有多种药理活性如降血压,降血脂,利尿,明目,抗菌,抗氧化,抗癌,抗衰老等。
转运体(也称为转运蛋白)广泛存在于生命体中,主要包括有机阴离子转运体(也称为有机阴离子转运蛋白,OAT)和有机阳离子转运体(也称为有机阳离子转运蛋白,OCT)。OAT属于溶质转运蛋白家族(SLC)22A的成员,对各种内源性、外源性阴离子及其代谢物在肝脏以及肾脏的代谢和清除起着重要的作用,并且介导着大量小分子底物的转运。其中,OAT1(SLC22A6)和OAT3(SLC22A8)主要表达在肾脏近端小管基底膜,在清除外源性物质,环境毒素和内源性代谢物中扮演着重要的角色。很多药物如利尿剂、抗高血压药、抗生素、抗病毒以及抗癌药物等都是OAT1和OAT3的底物。此外,其转运的底物也包括很多内源性物质(如代谢中间体、副产物和激素)和环境毒素以及毒物(例如真菌毒素和农药)。因此,OAT1和OAT3在药物代谢动力学有着重要作用,影响着一些药物的使用剂量、药效以及毒性。
OCT也属于SLC22A的重要成员之一,其中OCT1主要分布于肝脏,介导着有机阳离子从血液进入肝脏进行生物转化的第一步。OCT2主要分布于肾脏,参与有机阳离子的肾清除。临床上大约有120种以上的药物的转运与OCT相关,同时OCT也介导着内源性物质的转运。OCT1和OCT2与临床用药的相互作用已经吸引了大量的关注。
综上,近些年来药学研究领域对OAT/OCT的关注越来越多,作为一种多特异性的转运体,OAT/OCT可作用于许多大小和结构不同的药物和内源性化合物。了解天然产物对OAT/OCT的作用,将有助于预测和预防药物有害的相互作用及药物的毒副作用,可指导人们充分利用有利的药物相互作用来达到更加安全有效的治疗目的。
技术实现要素:
发明人对决明子进行了深入的研究,制备了决明子提取物并进一步地从中提取分离出了全新的化合物;并意外地发现该化合物具有转运体抑制活性,可以用于制备抑制转运体作用的药物;并基于此完成了本发明。
本发明第一方面提供了一种化合物,其中该化合物的化学结构式如下式(Ⅰ)所示:
在本发明第一方面的一种具体实施方式中,该化合物从决明子中提取得到。
本发明第二方面提供了包含本发明第一方面提供的化合物的决明子提取物。
本发明第三方面提供了前述决明子提取物的制备方法,其包括:
1)将决明子用乙醇水溶液提取;浓缩后获得粗浸膏;
2)将所得粗浸膏溶散于水中后用乙酸乙酯及正丁醇萃取,分别得乙酸乙酯萃取部分浸膏、正丁醇萃取部分浸膏及水层浸膏;
3)将步骤2)中获得的各部分浸膏合并、干燥后即得决明子提取物。
本发明第三方面的一种具体实施方式中,前述决明子提取物的制备方法,其包括:
1)将决明子用乙醇水溶液热回流提取;浓缩至无醇后获得粗浸膏;其中,乙醇水溶液优选采用体积百分数为50-100%,更优选采用70-95%,最优选采用95%的乙醇水溶液;乙醇水溶液的用量优选为决明子的2-15倍量,更优选为4-10倍量,最优选为6倍量。提取时间优选为1-4小时,更优选为2小时;提取次数优选为1-6次,更优选为2-4次,最优选为3次;
2)将所得粗浸膏溶散于水中(水量为粗浸膏的3-10倍量,更优选为4-6倍量,最优选为4倍量。)后用乙酸乙酯和正丁醇萃取,去溶剂后分别得乙酸乙酯萃取部分浸膏、正丁醇萃取部分浸膏及水层浸膏;其中,优选用乙酸乙酯和正丁醇分别萃取1-6次,更优选为2-4次,最优选为3次;去溶剂可以通过减压蒸馏等本领域常用的方式实现,本发明在此不进行限定。
3)将步骤2)中获得的各部分浸膏合并、干燥后即得决明子提取物。干燥可以采用本领域常用的方式,本发明在此不进行限定。
本发明第四方面提供了一种药物组合物,其包含前述的化合物或前述的决明子提取物,及药学上可接受的载体或赋形剂。
本发明第四方面的一种具体实施方式中,其还包含具有抑制转运体作用的第二治疗剂;在一种实施方式中,第二治疗剂具有抑制有机阴离子转运体作用,例如抑制OAT1和/或OAT3作用;更为具体地,所述第二治疗剂选自但不限于奎宁、丙磺舒等。
本发明第五方面提供了第一方面的化合物、第二方面的决明子提取物或第四方面的药物组合物在制备用于抑制转运体作用的药物中的用途。
在本发明第五方面的一种具体实施方式中,所述转运体为有机阴离子转运体。
在本发明第五方面的另一种具体实施方式中,所述有机阴离子转运体为OAT1和/或OAT3。
本发明第五方面的再一种具体实施方式中,所述的药物用于预防和/或治疗以下疾病中的至少一种:高尿酸血症、痛风、病毒感染、高血压和肾脏汞中毒。
如本文使用的,术语“治疗”具有其一般含义,并且在本文特别地是指对已经罹患本发明所述与转运体功能(或作用)相关的疾病的哺乳动物个体(优选为人)采用本发明的药物进行处理,以期对所述疾病产生治疗、治愈、缓解、减轻等作用。类似地,如本文使用的,术语“预防”具有其一般含义,并且在本文特别地是指对可能罹患本发明所述与转运体功能(或作用)相关的疾病或者对本发明所述与转运体功能相关的疾病具有罹患风险的哺乳动物个体采用本发明的药物进行处理,以期对所述疾病产生防止、预防、阻止、隔断等作用。
如本文所用的,“药学上可接受的”表示当以通常用药剂量使用时没有实质的毒性作用,从而可被政府或与其相当的国际组织批准或者已被批准用于动物,更特别地用于人,或者被登录在药典上。
本发明药物组合物中可用的“药学上可接受的载体或赋形剂”可以是药物制剂领域中任何常规的载体,特定载体的选择将取决于用于治疗特定患者的给药方式或疾病类型和状态。用于特定给药模式的合适药物组合物的制备方法完全在药物领域技术人员的知识范围内。例如,可以作为药学可接受的载体包括药学领域常规的溶剂、稀释剂、分散剂、助悬剂、表面活性剂、等渗剂、增稠剂、乳化剂、粘合剂、润滑剂、稳定剂、水合剂、乳化加速剂、缓冲剂、吸收剂、着色剂、离子交换剂、脱模剂、涂布剂、矫味剂、和抗氧化剂等。必要时,还可以在药物组合物中加入香味剂、防腐剂和甜味剂等。
如本文使用的,术语“药物组合物”具有其一般含义。此外,本发明的“药物组合物”还可以以保健品、功能性食品、食品、食品添加剂等形式存在或提供。可采用制药领域特别是制剂领域中的常规技术,通过药品生产中常用的提取分离纯化手段得到本发明的药物组合物的原料的有效成分,任选地与一种或更多种药学可接受的载体混合,然后形成所需的剂型,来制备本发明的药物组合物。根据本发明的药物组合物,其为可以适用于口服给药、胃肠外给药或局部给药、外用给药的药物制剂。本发明的药物组合物可以制成片剂、粉剂、颗粒剂、胶囊、口服液等多种形式。上述各种剂型的药物均可以按照药学领域的常规方法制备。具体地说,根据本发明的药物组合物,所述的药物剂型包括但不限于:片剂、胶囊剂、颗粒剂、粉剂、注射液、注射用粉剂、透皮贴剂、软膏剂、凝胶剂、栓剂、口服溶液、口服混悬液、注射用乳剂、口服乳剂等、缓释片剂、控释片剂。上述各种剂型的药物均可以按照药学领域的常规方法制备。
用于口服施用的剂型可包括例如片剂、丸剂、硬或软胶囊剂、溶液剂、混悬剂、乳剂、糖浆剂、散剂、粉剂、细粒剂、颗粒剂、小丸剂、酏剂等,并不限于此。除了活性成分外,这些制剂还可包含稀释剂(例如乳糖、右旋糖、蔗糖、甘露糖醇、山梨糖醇、纤维素和甘氨酸)、润滑剂(例如二氧化硅、滑石、硬脂酸或其镁盐、钙盐和聚乙二醇)。片剂还可包含粘合剂,例如硅酸镁铝、淀粉糊、明胶、黄芪胶、甲基纤维素、羧甲基纤维素钠和聚乙烯吡咯烷。必要时,其还可包含药用添加剂,例如崩解剂(如淀粉、琼脂、海藻酸或其钠盐)、吸收剂、着色剂、香味剂、甜味剂等。片剂可根据常用的混合、造粒或包衣的方法制备。
用于肠道外施用的剂型可包括例如注射剂、药用滴剂、软膏剂、洗剂、凝胶剂、乳膏、喷雾剂、混悬剂、乳剂、栓剂、贴剂等,并不限于此。
根据本公开的药物组合物可口服或非肠道例如经直肠、经局部、经皮肤、经静脉内、经肌内、经腹膜内或经皮下施用。
如本文使用的,术语“约”其通常是指本领域允许的误差范围,例如±10%,例如±5%,例如±2%。
经研究表明,本发明所提供的式(Ⅰ)所示的化合物或含有它的决明子提取物或药物组合物能够抑制转运体的转运作用;基于此,可以预期本发明所提供的化合物或含有它的决明子提取物或药物组合物能够制备用于抑制转运体作用的药物;进一步地,所述的药物用于预防和/或治疗括以下疾病中的至少一种:高尿酸血症、痛风、病毒感染、高血压和肾脏汞中毒。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为式(Ⅰ)所示的化合物的1H-NMR图谱;
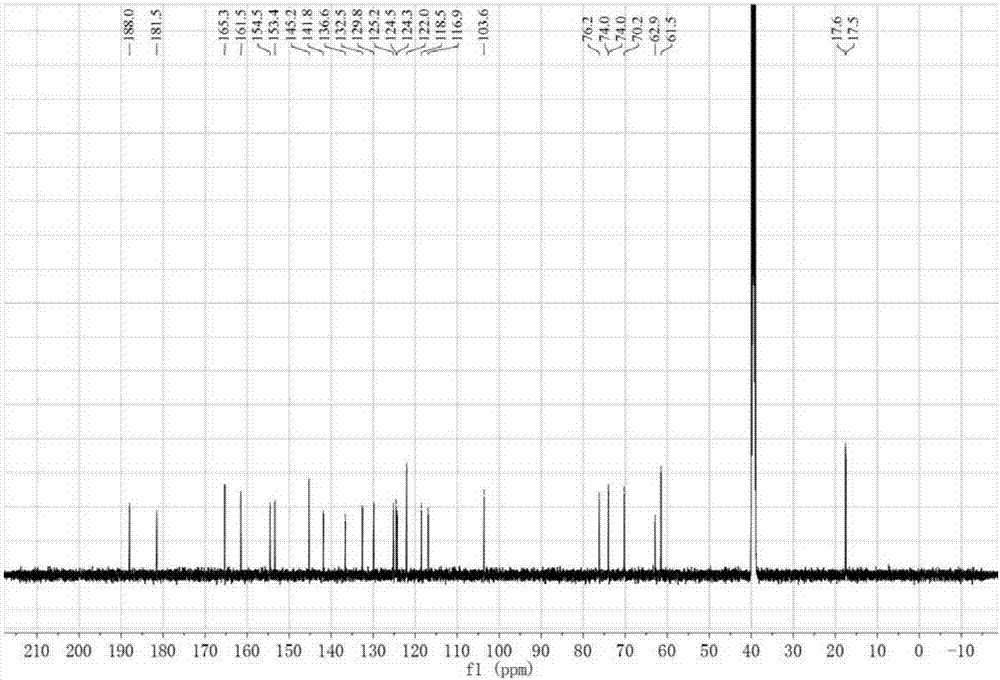
图2为式(Ⅰ)所示的化合物的13C-NMR图谱;
图3为式(Ⅰ)所示的化合物的HSQC图谱;
图4为式(Ⅰ)所示的化合物的HMBC图谱;
图5为式(Ⅰ)所示的化合物的1H-1H COSY图谱;
图6显示了式(Ⅰ)所示的化合物在100uM时,对6-CF在HEK-OAT1(OAT1)细胞中转运的影响;
图7显示了式(Ⅰ)所示的化合物在100uM时,对6-CF在HEK-OAT3(OAT3)细胞中转运的影响;
图8显示了式(Ⅰ)所示的化合物对6-CF在HEK-OAT1(OAT1)细胞中转运的浓度曲线;
图9显示了式(Ⅰ)所示的化合物对6-CF在HEK-OAT3(OAT3)细胞中转运的浓度曲线。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1决明子提取物的制备及式(Ⅰ)所示的化合物的分离
取20kg决明子(产地:河北),用120L 95%乙醇(由乙醇和水按体积比95:5配制)热回流提取,每次提取时间2小时,共提取3次。在50℃下减压蒸馏,浓缩至无醇,获得粗浸膏,质量约1.4kg。
将粗浸膏溶散于5L水中,用等量乙酸乙酯和正丁醇萃取3次,分别得乙酸乙酯萃取部分浸膏550g(命名为COB-E),正丁醇萃取部分浸膏150g(命名为COB-B),水层浸膏600g(命名为COB-W)。
乙酸乙酯部分(COB-E)550g,以700g硅胶拌样,1.5kg硅胶装柱,进行硅胶柱层析,柱体积4L。用二氯甲烷-甲醇做洗脱剂进行梯度洗脱,洗脱梯度(二氯甲烷与甲醇体积比)分别为1:0,20:1,10:1,5:1,2:1,1:1,0:1。每个梯度收集三个柱体积。所得各馏分通过TLC分析检测,共5个馏分。
其中第3馏分命名为COB-E3,Flash中压ODS-C18色谱柱层析(甲醇-水梯度洗脱,10:90→100:0),得到6个馏分,命名为:COB-E3-F1~F6;其中COB-E3-F3馏分(46mg)经制备液相色谱分离得到式(Ⅰ)所示的化合物(17mg)。
实施例2:式(Ⅰ)所示的化合物的结构的确定
通过HRESIMS(高分辨电喷雾电离质谱)、1H、13C NMR(氢、碳核磁共振谱)及HSQC(异核单量子相关谱)、HMBC(异核多键相关谱)及1H-1H COSY(氢-氢化学位移相关谱)谱,确定式(Ⅰ)所示的化合物的结构,具体表征结果如下:
式(Ⅰ)所示化合物的HRESIMS(负离子)离子峰:m/z 513.1383[M-H]-提示其分子式为C21H22O10。综合分析1H-NMR(图1),13C-NMR(图2)和HSQC谱(图3),推测化合物中应含有2个酮酯羰基,10个烯碳和9个sp3杂化的碳(其中6个为一组,2个甲基,1个甲氧基)。在氢谱中可见特征信号:δ12.75(1H,s),7.84(1H,s),7.75(1H,t,J=8.0Hz),7.65(1H,d,J=8.0,1.0Hz),7.35(1H,dd,J=8.0,1.0Hz),6.72(1H,m),5.71(1H,d-like,J=15.5,1.7Hz),5.00(1H,d,J=7.4Hz)。从特征氢信号出发,在HMBC谱(图4)中可以发现以下相关信号:δ12.75(1-OH)与124.3(C-2),161.5(C-1),116.9(C-10a)相关;δ7.35(2-H)与118.5(C-4),116.9(C-10a)相关;δ7.75(3-H)与132.5(C-4a),161.5(C-1)相关;δ7.65(4-H)与181.5(C-5),124.3(C-2),116.9(C-10a)相关;δ7.84(6-H)与181.5(C-5),154.5(C-8),124.5(C-9a)相关;2.36(11-H)与141.8(C-7),125.2(C-6),154.5(C-8)相关;δ3.88(9-OCH3)与153.4(C-9)相关,以上信号可以确定式(Ⅰ)所示化合物的蒽醌骨架结构。1H-1H COSY谱(图5)信号:δ5.00(1'-H)/3.3(2'-H);3.34(2'-H)/3.30(3'-H);3.34(3'-H)/3.20(4'-H);3.34(5'-H)/4.24(6'-Ha),4.16(6'-Hb),以及HMBC信号:δ5.00(1'-H)/76.2(C-3'),74.0(C-5');4.24(6'-Ha)/70.2(C-4'),3.30(3'-H)/74.0(C-5')],最终可确定糖基结构,并根据其和核磁信号确定其为一个β-吡喃葡糖糖。HMBC信号5.00(1'-H)/154.5(C-8)确认葡萄糖链接在苷元的C-8位上。1H-1H COSY信号:δ1.69(10'-H)/6.72(9'-H);6.72(10'-H)/5.71(8'-H),以及HMBC信号:6.72(9'-H)/165.3;4.24(6'-Ha)/165.3(C-7'),确证在葡萄糖C-6'位连接了一个α-丁酸基片段。根据δ5.71(C-8')的较大的耦合常数15.5Hz,鉴定α-丁酸基的双键构型应该为反式(E)。根据以上信息,最终鉴定该化合物的结构如下式(Ⅰ)所示,碳氢数据归属见表1。
表1式(Ⅰ)所示化合物的碳氢信号(氢谱500MHz,碳谱125MHz,DMSO-d6)
实施例3式(Ⅰ)所示的化合物对转运体功能抑制作用的筛选实验
试剂:DMEM为Cellgro公司生产;货号为R10-013-CV,规格为500ml/瓶;胎牛血清FBS为Gibco公司生产,货号为10099-141,规格为500ml/瓶;Penicillin streptomycin solution(青霉素链霉素溶液)为索莱宝公司生产,货号为P1400,规格为100ml/瓶;PBS为索莱宝公司生产,货号为:P1210-500规格500ml;0.05%Trypsin-EDTA(胰蛋白酶-EDTA)为Gibco公司生产货号:1772640规格500ml;DMSO为索来宝公司生产,细胞培养级别,货号:D8371规格50ml/瓶;TritonX-100为索莱宝公司生产货号T8200规格100ml/瓶;BCA试剂盒为康为公司生产货号:CW0014S;Probenecid(丙磺舒)为SIGMA公司生产货号:P8761规格100mg;6-羰基荧光素(6-CF)为Aladdin公司生产货号:C105327规格100mg;潮霉素B为索莱宝公司生产货号:H8080规格100ml;多聚赖氨酸为SIGMA公司生产货号:P1024规格50mg。
仪器:CO2培养箱为Thermo公司生产;可调速可定时漩涡混合器(SI-T256);电热式恒温水浴锅为天津欧诺仪器公司生产;移液枪为Eppendorf公司生产;尼康ECLIPSE Ti-U倒置生物显微镜;1.6R台式多用离心机为Thermo公司生产;制水机为美国密理博Milli-Q Century超纯水系统;4℃海尔冰箱;-20℃海尔冰箱。
化合物样品配制:用称取的样品质量m除以该样品的相对分子质量M,得到该样品的物质的量n,然后加入10倍n体积的DMSO,得到10-1mol/L的初始浓度。-20℃避光保存。
采用细胞摄取实验考察化合物对OAT1/3转运体功能的抑制。有机阴离子转运蛋白(organ anion transport protein,OAT)OAT1与OAT3主要表达于近端肾小管上皮细胞基底侧膜,功能为介导有机阴离子转运进入细胞,从而参与药物在肾脏的分泌代谢、重吸收等。这两种转运体均被FDA《药物相互作用研究技术指导原则》列为创新药物研究与申报过程中药代动力学研究实验的必备研究项目。
实验方法:
1、细胞及其培养
HEK-OAT1和HEK-OAT3过表达细胞由本实验室构建并传代培养。这两株细胞在37℃,5%CO2的细胞培养箱中,用10%胎牛血清/DMEM,1%青霉素/链霉素,50μg/ml潮霉素B的培养液培养。
HEK-OAT1和HEK-OAT3过表达细胞是指分别转染了包含OAT1、OAT3、基因的表达质粒的HEK细胞,可以采用本领域常规技术手段制备,本文不再详细描述。
2、细胞摄取实验步骤
在37℃,5%CO2的条件下,在细胞培养箱中使用含有10%胎牛血清,1%青霉素/链霉素及50μg/ml潮霉素B的DMEM培养液分别培养HEK-OAT1和HEK-OAT3过表达细胞。当细胞密度为80%左右时,将细胞按5*104/孔的密度铺于事先用0.05mg/ml多聚赖氨酸处理的96孔细胞培养板中,培养24小时至细胞贴壁完全后进行细胞摄取实验。用摄取缓冲液(OAT1和OAT3:135mM NaCl,5mM KCl,2.5mM CaCl2,1.2mM MgCl2,0.8mM MgSO4,28mM葡萄糖,13mM Hepes)于37℃平衡培养10分钟,而后于37℃条件下进行细胞摄取实验,摄取时间为5分钟。在96孔板中,实验孔每孔用摄取缓冲液稀释配制100μl浓度为100μM的药物(本发明的式(Ⅰ)化合物,简称化合物1)和转运体底物(OAT1和OAT3:5μM 6-羰基荧光素)的混合物;阳性对照孔为100μl转运体底物与阳性对照药(OAT1:30μM丙磺舒、OAT3:10μM丙磺舒)的混合物,空白对照孔为100μl转运体底物。实验设三个复孔。摄取实验结束时,用预冷的摄取缓冲液终止实验,每孔150μl,而后用摄取缓冲液洗细胞3遍。每孔加入1%TritonX-100的细胞裂解液裂解细胞半小时后,于酶标仪读取荧光值,OAT1和OAT3的吸收发射波长分别为485和528。实验结果用Graphpad软件作图,ANOVA处理数据,结果如图6、图7所示。通过对抑制剂浓度和底物进入细胞的速度作图,得到式(Ⅰ)所示的化合物抑制各种转运体的IC50,结果如图8、图9所示。
从图6、图8可以看出,式(Ⅰ)所示的化合物在100μM时均对OAT1的功能产生了较强的抑制作用,抑制率达到了50%以上,其IC50为51μM。从图7、图9可以看出,式(Ⅰ)所示的化合物在100μM对OAT3的功能有很强的抑制作用,其IC50为46μM。
在众多的现有技术中已报道,转运体OAT1和OAT3在肾脏中的表达相比其他器官比较高,它们对于尿酸的肾脏排出起着关键作用(Capasso et al.,2005;So and Thorens,2010)。实际上,目前用来治疗高尿酸血症和痛风的药物丙磺舒就是OAT1和OAT3的抑制剂。OAT3的敲除小鼠血压比野生型小鼠低15%,抑制OAT3有降血压的作用(Vallon et al.,2008)。此外,OAT3的抑制可以预防流行感冒病毒(Perwitasari et al.,2013)。因此,可以预期这些化合物(对OAT1和OAT3有抑制作用的化合物)对于痛风、高尿酸血症、高血压、以及感冒病毒感染有预防和/或治疗作用。
参考文献
1、Capasso,G.,Jaeger,P.,Robertson,W.G.,Unwin,R.J.,2005.Uric acid and the kidney:urate transport,stone disease and progressive renal failure.Current pharmaceutical design 11,4153-4159.
2、So,A.,Thorens,B.,2010.Uric acid transport and disease.The Journal of clinical investigation 120,1791-1799.
3、Vallon,V.,Eraly,S.A.,Wikoff,W.R.,Rieg,T.,Kaler,G.,Truong,D.M.,Ahn,S.Y.,Mahapatra,N.R.,Mahata,S.K.,Gangoiti,J.A.,Wu,W.,Barshop,B.A.,Siuzdak,G.,Nigam,S.K.,2008.Organic anion transporter 3contributes to the regulation of blood pressure.Journal of the American Society of Nephrology 19,1732-1740.
4、Perwitasari,O.,Yan,X.Z.,Johnson,S.,White,C.,Brooks,P.,Tompkins,S.M.,Tripp,R.A.,2013.Targeting Organic Anion Transporter 3with Probenecid as a Novel Anti-Influenza A Virus Strategy.Antimicrobial agents and chemotherapy 57,475-483.
以上对本发明所提供的一种化合物、包含其的决明子提取物及其用途进行了详细介绍。本文中应用了具体实施例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其中心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护。
- 还没有人留言评论。精彩留言会获得点赞!