磷脂酰肌醇3-激酶γ的新颖抑制剂的制作方法
该
技术领域:
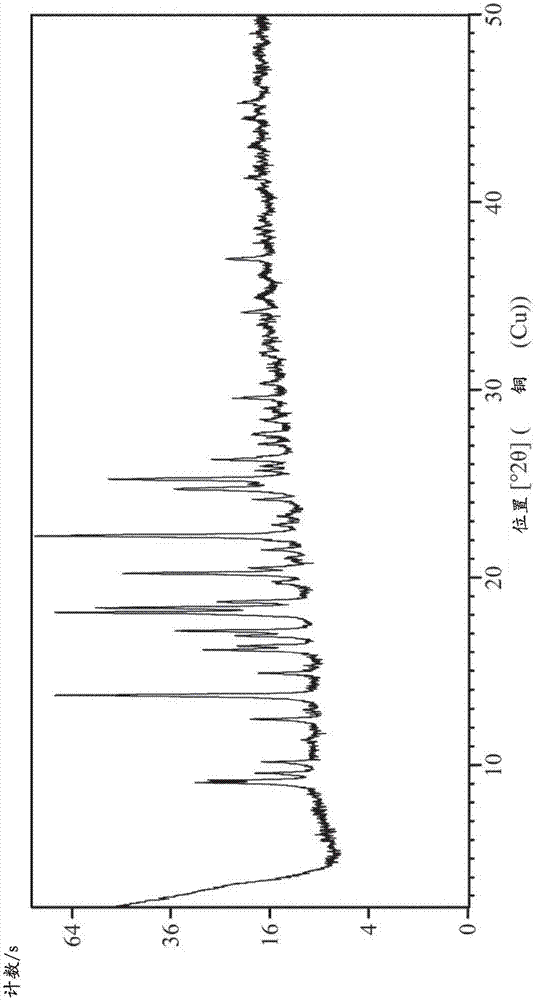
涉及抑制磷脂酰肌醇3-激酶γ(pi3kγ)活性的某些新颖化学化合物(包括其药学上可接受的盐);涉及它们在治疗和/或预防临床病症中的使用,这些临床病症包括呼吸性疾病,比如哮喘和慢性阻塞性肺病(copd);涉及它们在疗法中的用途;涉及包含它们的药物组合物并且涉及用于制备这些化合物的方法。发明背景磷酸肌醇3-激酶(pi3k)家族是一系列不同细胞功能(包括生长、增殖、迁移和存活)中的中枢信号元素。pi3k通过对磷酸肌醇脂质的肌醇环上的3-羟基位置进行磷酸化而发挥功能,并且基于结构域结构、其作用的脂质底物类型和调节模式,可以将pi3k分为三类[生物化学与生物物理学报(biochimbiophysacta),1436(1998),127-150]。可以将i类pi3k催化亚基进一步细分为1a类(同种型α、β、δ)和ib类(γ同种型),已知所有这些都能转化磷脂酰肌醇4,5-二磷酸酯(ptdins(4,5)p2)以在体内形成ptdins(3,4,5)p3[生物化学与生物物理学报,1179(1993),27-75和科学(science),296(2002),1655-1657]。通过与p101或p84/p87衔接子的结合由g-蛋白偶联受体(gpcr)激活pi3kγ,其加强了由异源三聚体gtp结合蛋白的βγ-亚基的激活[当代生物学(currbiol),15(2005),566-570]。在质膜处生成的ptdins(3,4,5)p3用作针对含有例如蛋白激酶b(pkb/akt)等蛋白的普列克底物蛋白同源(ph)结构域的对接位点,这进而可以影响广泛的蛋白质并因此影响许多不同的细胞反应[细胞(cell),129(2007),1261-1274]。pi3kγ表达限于嗜中性粒细胞、嗜酸性粒细胞、巨噬细胞、树突细胞、t细胞和肥大细胞,以及在内皮、气道平滑肌细胞和心脏中可检测的低水平[细胞生物学新观点(curr.opin.cellbiol.),17(2005),141-149]。基因敲除小鼠是能生存的且能育的[科学,287(2000),1049-1052],并且已经在多种临床前模型(作为pi3kγ在多种疾病中的验证过程的一部分)中对其进行了研究。大多数研究集中在这种同种型作为迁移细胞的生化指南针的功能,其中pi3k敲除嗜中性粒细胞实验得出的结论是,尽管化学增活现象不受影响,细胞缺乏对gpcr介导的刺激的方向[科学,287(2000),1049-1052,自然细胞生物学(natcellbiol),4(2002),513-518和细胞生物学杂志(jcellbiol.),167(2004),505-518],并且因此提供了在多种病症(其中炎症效应细胞的流入在病理学中发挥关键作用)的背景下pi3kγ抑制的基本原理。嗜中性粒细胞在宿主防御入侵病原体中起着关键作用。嗜中性粒细胞在骨髓中产生,并且当嗜中性粒细胞被释放到循环中来发挥作为第一道细胞防线的作用时,是完全成熟的。促炎性介质和趋化引诱剂活化嗜中性粒细胞并且将它们带到感染部位,在那里它们通过吞噬作用吞噬细菌,然后使用强大的丝氨酸蛋白酶-嗜中性粒细胞弹性蛋白酶来杀死病原体。然而,嗜中性粒细胞弹性蛋白酶也会对其宿主造成问题。嗜中性粒细胞弹性蛋白酶是体内最具破坏性的酶之一,具有降解细胞外基质蛋白(包括胶原蛋白、蛋白多糖、纤维连接蛋白、血小板受体、补体受体、凝血调节蛋白、肺表面活性物质和钙粘素)和关键血浆蛋白(包括凝血和补体因子、免疫球蛋白、若干种蛋白酶和蛋白酶抑制剂)的能力。在生理状态下,内源性蛋白酶抑制剂(如α1-抗胰蛋白酶)严格调节嗜中性粒细胞弹性蛋白酶的活性。然而,在炎性部位,嗜中性粒细胞弹性蛋白酶能够避开调节,并且一旦不受调节,它可以诱导促炎细胞因子(如白介素-6和白介素-8)的释放,从而导致急性肺损伤。嗜中性粒细胞弹性蛋白酶甚至可以通过降解吞噬细胞表面受体和噬菌素来削弱宿主对感染的防御。嗜中性粒细胞弹性蛋白酶的负面作用由它参与表征多种疾病的组织破坏和炎症进行阐明,这些疾病包括遗传性肺气肿、慢性阻塞性肺病、囊性纤维病、成人呼吸窘迫综合征、缺血再灌注损伤和类风湿关节炎。体外和体内研究均已经显示pi3kγ在嗜中性粒细胞寻靶到炎症部位以及它们的脱粒和弹性蛋白酶的释放中是至关重要的[微生物学与免疫学的当前课题(currtopmicrobiolimmunol)2010,346,183-202]。嗜酸性粒细胞也来源于骨髓,并在健康个体的血液中以低水平循环。这些粒状的细胞优先离开循环并迁移到组织中,在组织中它们参与先天免疫和适应性免疫的调节。在诸如过敏性炎症的疾病中,嗜酸性粒细胞数量在炎症病灶所处的血液和组织中显著升高。嗜酸性粒细胞具有一系列免疫调节因子,在细胞活化时免疫调节因子得以释放,这些免疫调节因子包括超过35种细胞因子、生长因子和趋化因子,这些细胞因子可以在刺激后迅速释放[免疫学前沿(frontimmunol)2014年11月10日,5,570]。来自基于动物模型的研究的新证据表明,pi3kγ的缺乏在体外和体内均削弱了嗜酸性粒细胞的迁移[免疫学(immunology)2009,126(3),413-22],进一步支持了证明在哮喘的ova/明矾模型中基因敲除小鼠的保护性表型的数据[白细胞生物学杂志(j.leukoc.biol.),77(2005),800-810]。发现巨噬细胞存在于全身组织中,并形成了对抗损伤和病原体的第一道防线。pi3kγ基因敲除小鼠的早期实验证明了,源自突变动物的巨噬细胞不能响应于各种趋化物质的刺激而产生ptdins(3,4,5)p3,并且随后的运动被抑制[科学2000,287(5455),1040-6]。可以将巨噬细胞进一步分为促炎症(m1)巨噬细胞和“交替活化的”抗炎症(m2)巨噬细胞,这些巨噬细胞通常分别在炎症和修复/重塑中起连续作用。趋化因子是两个亚类中趋化性的主要介质,但是控制细胞运动的gpcr表达模式不同。趋化因子ccl19或ccl21诱导m1巨噬细胞而非m2巨噬细胞中的mek1-erk1/2和pi3k-akt级联的活化,尽管通过渥曼青霉素的泛pi3k抑制能够阻断迁移(据推测是通过pi3kγ活性的缺乏)[白细胞生物学杂志2015,97(1),61-9]。适应性免疫系统依赖于通过专职呈递细胞(特别是树突细胞(dc))向淋巴结中的t淋巴细胞呈递抗原,所述淋巴结排空抗原进入/发现的位点。在敲除研究中,已经显示pi3kγ参与了dc有效运输至淋巴结[欧洲分子生物学学会杂志(emboj.)2004,23(17),3505-15]。一旦以适当的亲和力呈递给t细胞,就会出现克隆扩增和分化成不同亚型的过程。cd4t细胞亚群可以大致分为帮助b淋巴细胞反应和募集粒细胞的th1、th2和th17,或抑制免疫反应的treg细胞。cd8t细胞亚群由细胞毒性/tc1表型支配,所述表型负责杀死从细胞(例如病毒感染的细胞)中呈递抗原的细胞。几乎没有证据表明pi3kγ在t细胞分化过程中起作用,但是已知其控制cd4和cd8t细胞亚群向炎症部位的运动[生物化学与生物物理学报2015,1851(6),882-97]。适应性免疫系统的调节异常可引发自身免疫,其中t细胞亚群与自身抗原起反应。有证据表明pi3kγ驱动这些群体的引发和存活,特别是在中枢神经系统(cns)相关的炎性疾病(例如多发性硬化(ms))中[公共科学图书馆·综合(plosone.)2012,7(9),e45095]。在许多组织中发现肥大细胞,但是更多数沿着身体的上皮层(如皮肤、呼吸道和胃肠道)而存在。在人类中,已经鉴定出两种类型的肥大细胞。t-类型(其仅表达类胰蛋白酶),和tc-类型(其表达类胰蛋白酶和糜酶)。在人类中,t-类型肥大细胞主要位于肺泡组织和肠黏膜中,而tc-类型细胞在皮肤和结膜中占优势。类胰蛋白酶和糜酶似乎是过敏性疾病的重要介质,它们参与炎症、支气管收缩和黏液分泌的过程。已经显示pi3kγ在肥大细胞定位至/保持在炎症部位和它们的脱粒(与1a类pi3kδ同种型结合)中发挥关键作用[变态反应与临床免疫学杂志(jallergyclinimmunol)2013,132(4):959-68]。已经将pi3kγ的气道平滑肌细胞表达与激动作用后的β2肾上腺素能受体的降敏作用联系了起来-针对哮喘中支气管收缩的常见治疗。该机制似乎借助了内质网中内化受体的螯合,因此pi3kγ的抑制可能恢复由于长期使用而丧失的β2激动剂的一些功效[公共科学图书馆·综合(plosone.)2015,10(5),e0125803]。pi3kγ被鉴定为癌症中可能重要的信号传导介质。已经显示pi3kγ上调在癌症(例如胰腺上皮内瘤病变和导管癌)中是致癌的[临床癌症研究(clincancerres.)2010,16(20),4928-37],并且在肿瘤生长和转移中的作用已经在啮齿动物肿瘤学模型中示出[致癌基因(oncogene)2012,31(18),2350-61]。已经证明了pi3kγ在促进免疫抑制性肿瘤微环境中的间接作用,该间接作用有助于癌细胞逃避免疫系统-这是导致复发到当前检查点和抗血管生成抑制剂治疗的过程。髓源性抑制细胞(mdsc)是所述免疫逃避的关键,通过信号机制进行,所述信号机制的特征在于pi3kγ不仅在gpcr的下游,而且在细胞因子和生长因子受体的下游[癌细胞(cancercell)2011,19(6),715-27和细胞报告(cellrep)2015,11(4),577-91]。结果表明,上调的pi3kγ传递由gpcr在乳腺癌细胞中发起的转移信号,并且表明了pi3kγ可以是用于开发预防乳腺癌转移的化疗剂的新颖治疗靶标。[生化药理学(biochempharm)2013,85,1454-1462]总之,这些数据揭示了pi3kγ信号传导在广泛的免疫应答中的重要作用以及有效的和选择性抑制剂可能对许多疾病提供的治疗潜力。wo2015048318披露了(r)-6-(1-(2,2-二氟乙基)-1h-吡唑-4-基)-4,7,7-三甲基-2-(5-(2,2,2-三氟-1-羟乙基)吡啶-3-基)-6,7-二氢-5h-吡咯[3,4-b]吡啶-5-酮,其作为pi3kγ的选择性抑制剂是有用的。wo2011087776披露了pi3k(特别是pi3kγ)的异吲哚啉酮抑制剂。wo2015162461和wo2015162459披露了pi3kγ的吡嗪抑制剂。wo2015162456披露了pi3kγ的氨基吡啶抑制剂。目的是提供适用于疗法的新颖pi3kγ抑制剂。另外的目的是提供显示出比对pi3k1a类同种型α、β和δ更高选择性的pi3kγ抑制剂。概述提供了磷脂酰肌醇3-激酶γ(pi3kγ)抑制剂的化合物、其作为药物的用途、包含它们的药物组合物和生产它们的合成途径。根据第一方面,提供了具有化学式(i)的化合物其中x是c(o)或so2;y选自-ch2-、-ch=ch-、-c(ch2)-、-ch(ch3)-、-ch2ch2、-ch(oh)-、-n=ch-或-c(o)-;r1是(3,3-二甲基丁-2-基)或c1-4烷基,其中所述c1-4烷基任选地被环丙基和0个f、1个f、2个f或3个f取代;r2选自ch3、nhr4、so2r5或(1-甲基-1h-吡唑-5-基)甲基;r3选自r4是c(o)ch3或so2r6;r5选自(3-腈基苯基)氨磺酰基、ch3、nhch3、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代;r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3、nch3或环丙基的取代基取代;r7选自h、cl或ch3;r8选自-nh(c=o)ch3、r9选自h、cl或nh2;r10选自h或nh2;r11选自c(o)nh2、c(o)nhch3或c(o)nhch2苯基;r12选自co2h、co2ch2ch3或co2nh(ch2)3nh2;r13选自h或ch3;y选自n或ch;或其药学上可接受的盐。根据另外的方面,提供了具有化学式(ia)的化合物其中r1是(3,3-二甲基丁-2-基)或c1-4烷基,其中所述c1-4烷基任选地被环丙基和0个f、1个f、2个f或3个f取代;r2是nhr4或so2r5;r7选自h、cl或ch3;r4是c(o)ch3或so2r6;r5选自(3-腈基苯基)氨磺酰基、ch3、n(ch3)2、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代;r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代;或其药学上可接受的盐。具有化学式(i)的化合物是pi3kγ抑制剂。因此,具有化学式(i)的化合物可以用作药物,特别是用于对pi3kγ抑制有响应的障碍、疾病或病症,并且更具体地是呼吸性疾病(例如copd和哮喘)、cns相关的障碍(例如ms)或癌症(例如胰腺上皮内瘤病变、导管癌和乳腺癌)。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,其显示出比对pi3k1a类同种型α、β和δ更高的选择性。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,当在相关酶活性测定中测量活性时,其显示出比对pi3k1a类同种型α、β和δ高至少50倍的选择性。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,当在相关酶活性测定中测量活性时,其显示出比对pi3k1a类同种型α、β和δ高至少100倍的选择性。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,当在相关酶活性测定中测量活性时,其显示出比对pi3k1a类同种型α、β和δ高至少1000倍的选择性。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,其中该立体化学是未定义的,例如,外消旋体或非对映异构体的混合物。在另一个实施例中,提供了药物配制品,该药物配制品包含治疗有效量的具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,以及药学上可接受的稀释剂、赋形剂和/或惰性载体。在另一个实施例中,提供了包含具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐的药物配制品,用于在抑制pi3kγ将是有益的病症的治疗中使用。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,用于在疗法尤其是在哺乳动物(特别是人)的呼吸性疾病的预防或治疗中使用。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,用于在疗法尤其是在哺乳动物(特别是人)的哮喘的预防或治疗中使用。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,用于在疗法尤其是在哺乳动物(特别是人)的copd的预防或治疗中使用。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,用于在疗法尤其是在哺乳动物(特别是人)的cns相关的障碍的预防或治疗中使用。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐,用于在疗法尤其是在哺乳动物(特别是人)的癌症的预防或治疗中使用。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐用于制造用于治疗和预防呼吸性疾病的药物的用途。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐用于制造用于治疗和预防哮喘的药物的用途。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐用于制造用于治疗和预防copd的药物的用途。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐用于制造用于治疗和预防cns相关的障碍的药物的用途。在另一个实施例中,提供了具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐用于制造用于治疗和预防癌症的药物的用途。在再一个另外的实施例中,给予具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐导致哺乳动物中、具体地人类中pi3kγ水平的降低。根据另一方面,提供了用于制备具有化学式(i)的化合物或具有化学式(i)的化合物的药学上可接受的盐的方法,以及在其制备中使用的中间体。本文例举的具有化学式(i)的化合物在酶活性测定(例如下文所述的测试a)中针对pi3kγ具有小于100nmol/l的ic50。通过在体内分离所需的和不期望的效应,这些具有化学式(i)的化合物也显示出有希望的药理学分布。附图的简要说明图1显示出实例1的x-射线粉末衍射图:n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺。图2显示出实例6的x-射线粉末衍射图:n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺。图3显示出实例9的x-射线粉末衍射图:n-(5-{2-[(1s)-1-环丙基乙基]-7-[(甲基磺酰基)氨基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺。发明详细说明本发明详细说明和它的特定实例,尽管表明了实施例,但是仅旨在用于说明的目的。因此,不局限于在本说明书中描述的说明性实施例。此外,应理解的是,出于清楚性的原因,还可以将在分开的实施例的上下文中描述的不同特征进行组合,用来形成单个的实施例。相反地,出于简洁性的原因,还可以将在单个实施例的上下文中描述的不同特征进行组合,用来形成它们的子组合。以下列出了说明书和权利要求书中使用的多种术语的定义。为避免疑义,应了解,如果在本说明书中某一基团经“上文所定义(definedabove)”限定,那么所述基团涵盖首次出现且最广泛的定义以及对该基团的每一和所有其他定义。为免生疑,应当理解的是在本说明书中,“c1-4”意指具有1、2、3或4个碳原子的碳基团。在本说明书中,除非另有说明,术语“烷基”包括直链和支链烷基基团,并且可以是但不限于:甲基、乙基、正丙基、异丙基、正丁基、仲丁基或叔丁基。在本说明书中,术语“药学上可接受的”用于表征如根据合理的医学判断,适合使用的一个部分(例如,盐、剂型、或赋形剂)。一般地,药学上可接受的部分具有超过该部分可能具有的任何有害作用的一个或多个益处。有害作用可以包括例如过度毒性、刺激、过敏反应、以及其他问题和并发症。提供了具有化学式(i)的化合物,其中x、y和r1-r13是如在化学式(i)中所定义的。在一个实施例中,x是c(o)或so2;在另一个实施例中,x是c(o);仍在另外的实施例中,x是so2;在一个实施例中,y选自-ch2-、-ch=ch-、-c(ch2)-、-ch(ch3)-、-ch2ch2、-ch(oh)-、-n=ch-或-c(o)-;在另一个实施例中,y选自-ch2-;在一个实施例中,r1是(3,3-二甲基丁-2-基)或c1-4烷基,其中所述c1-4烷基任选地被环丙基和0个f、1个f、2个f或3个f取代。在另一个实施例中,r1是c1-4烷基。仍在另外的实施例中,r1是异丙基或1-环丙基乙基。仍在另外的实施例中,r1是1-环丙基乙基。仍在另外的实施例中,r1是(1s)-1-环丙基乙基。在一个实施例中,r2是ch3、nhr4、so2r5或(1-甲基-1h-吡唑-5-基)甲基;r4是c(o)ch3或so2r6;r5选自(3-腈基苯基)氨磺酰基、ch3、nhch3、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代;在另一个实施例中,r2是nhr4或so2r5;r4是c(o)ch3或so2r6;r5选自(3-腈基苯基)氨磺酰基、ch3、n(ch3)2、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代;r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代。在另一个实施例中,r2是nhr4;r4是c(o)ch3或so2r6;r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代。仍在另外的实施例中,r2是so2r5;r5选自(3-腈基苯基)氨磺酰基、ch3、n(ch3)2、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代。在一个实施例中,r3选自r7选自h、cl或ch3;r8选自-nh(c=o)ch3、r9选自h、cl或nh2;r10选自h或nh2;r11选自c(o)nh2、c(o)nhch3或c(o)nhch2苯基;r12选自co2h、co2ch2ch3或co2nh(ch2)3nh2;r13选自h或ch3。在另一个实施例中,r3选自r7选自h、cl或ch3;r8选自-nh(c=o)ch3、仍在另外的实施例中,r3选自r7选自h、cl或ch3;并且r8选自-nh(c=o)ch3;在一个实施例中,r4是c(o)ch3或so2r6;r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代。在一个实施例中,r5选自(3-腈基苯基)氨磺酰基、ch3、n(ch3)2、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代。在另一个实施例中,r5是ch3或nhch3。在一个实施例中,r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代。在另一个实施例中,r6是ch3。在一个实施例中,r7选自h、cl或ch3;在一个实施例中,r8选自-nh(c=o)ch3、在另一个实施例中,r8是-nh(c=o)ch3。在一个实施例中,r9选自h、cl或nh2;在一个实施例中,r10选自h或nh2;在一个实施例中,r11选自c(o)nh2、c(o)nhch3或c(o)nhch2苯基;在一个实施例中,r12选自co2h、co2ch2ch3或co2nh(ch2)3nh2;在一个实施例中,r13选自h或ch3;提供了具有化学式(ia)的化合物,其中r1、r2和r7是如在化学式(ia)中所定义的。在一个实施例中,r1是(3,3-二甲基丁-2-基)或c1-4烷基,其中所述c1-4烷基任选地被环丙基和0个f、1个f、2个f或3个f取代。在另一个实施例中,r1是c1-4烷基。在另一个实施例中,r1是异丙基或1-环丙基乙基。仍在另外的实施例中,r1是1-环丙基乙基。仍在另外的实施例中,r1是(1s)-1-环丙基乙基。在一个实施例中,r2是nhr4或so2r5;r4是c(o)ch3或so2r6;r5选自(3-腈基苯基)氨磺酰基、ch3、n(ch3)2、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代;r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代。在另一个实施例中,r2是nhr4;r4是c(o)ch3或so2r6;r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代。仍在另外的实施例中,r2是so2r5;r5选自(3-腈基苯基)氨磺酰基、ch3、n(ch3)2、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代。在一个实施例中,r7选自h、cl或ch3。在另一个实施例中,r7是氢。仍在另外的实施例中,r7是ch3。仍在另外的实施例中,r7是cl。在一个实施例中,r4是c(o)ch3或so2r6;r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代。在一个实施例中,r5选自(3-腈基苯基)氨磺酰基、ch3、nhch3、nh2、nhch2cf3、nh(氧杂环丁烷-3-基)、nhc1-3烷基,其中所述c1-3烷基任选地被0-3个f以及0-1个独立地选自och3、环丙基或nhc3-4环烷基的取代基取代,其中所述环烷基可以被0-2个f取代。在另一个实施例中,r5是ch3或nhch3。在一个实施例中,r6选自环丙基、(1,3-二甲基-1h-吡唑-4-基)甲基或c1-4烷基,其中所述c1-4烷基任选地被0-1个独立地选自och3或环丙基的取代基取代。在另一个实施例中,r6是ch3。可以组合一个或多个以上实施例,来提供进一步的具体实施例。在一个实施例中,具有化学式(i)的化合物选自:n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺,n-{4-甲基-5-[7-(甲基磺酰基)-1-氧代-2-(丙-2-基)-2,3-二氢-1h-异吲哚-5-基]-1,3-噻唑-2-基}乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-1-氧代-7-氨磺酰基-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{7-(乙酰氨基)-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-(二甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-[(甲基磺酰基)氨基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{7-(环丁基氨磺酰基)-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-{4-甲基-5-[7-(甲基氨磺酰基)-1-氧代-2-(丙-2-基)-2,3-二氢-1h-异吲哚-5-基]-1,3-噻唑-2-基}乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-1-氧代-7-氨磺酰基-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-[(环丙基甲基)氨磺酰基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-(环丙基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-(乙基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-(氧杂环丁-3-基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-[(3,3-二氟环丁基)氨磺酰基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-[(2-甲氧基乙基)氨磺酰基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-({[1-(氟甲基)环丙基]甲基}氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-1-氧代-7-[(2,2,2-三氟乙基)氨磺酰基]-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-{4-甲基-5-[1-氧代-2-(丙-2-基)-7-氨磺酰基-2,3-二氢-1h-异吲哚-5-基]-1,3-噻唑-2-基}乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-[(甲基磺酰基)氨基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-[(环丙基磺酰基)氨基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-1-氧代-7-[(丙基磺酰基)氨基]-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{2-[(1s)-1-环丙基乙基]-7-[(乙基磺酰基)氨基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{7-[(叔丁基磺酰基)氨基]-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-[5-(2-[(1s)-1-环丙基乙基]-7-{[(2-甲氧基乙基)磺酰基]氨基}-1-氧代-2,3-二氢-1h-异吲哚-5-基)-4-甲基-1,3-噻唑-2-基]乙酰胺,n-[5-(2-[(1s)-1-环丙基乙基]-7-{[(环丙基甲基)磺酰基]氨基}-1-氧代-2,3-二氢-1h-异吲哚-5-基)-4-甲基-1,3-噻唑-2-基]乙酰胺,n-[5-(2-[(1s)-1-环丙基乙基]-7-{[(1,3-二甲基-1h-吡唑-4-基)磺酰基]氨基}-1-氧代-2,3-二氢-1h-异吲哚-5-基)-4-甲基-1,3-噻唑-2-基]乙酰胺,n-(4-氯-5-{2-[(1s)-1-环丙基乙基]-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺,6-(8-氨基咪唑并[1,2-a]吡嗪-3-基)-2-[(1s)-1-环丙基乙基]-n-甲基-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰胺,n-{5-[2-(2-环丙基丙-2-基)-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基]-4-甲基-1,3-噻唑-2-基}乙酰胺,n-(5-{2-[(2s)-3,3-二甲基丁-2-基]-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-{5-[2-叔丁基-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基]-4-甲基-1,3-噻唑-2-基}乙酰胺,n-(4-甲基-5-{7-(甲基氨磺酰基)-1-氧代-2-[(2s)-1,1,1-三氟丙-2-基]-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺,n-(5-{7-[(3-腈基苯基)氨磺酰基]-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,n-(5-{7-[(3-腈基苯基)氨磺酰基]-1-氧代-2-(丙-2-基)-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺,及其药学上可接受的盐。应注意,这些具体化合物中的任一种可以从任何在此提及的实施例中被放弃。另一个实施例是可通过在此披露的任何方法或实例获得的产物。药理学特性具有化学式(i)的化合物及其药学上可接受的盐具有作为药物制剂的活性,具体地作为磷脂酰肌醇3-激酶γ活性的抑制剂,并且因此可以用于治疗气道阻塞性疾病,这些疾病包括:哮喘,包括支气管性、过敏性、内源性、外源性、运动诱发、药物诱发(包括阿司匹林和nsaid-诱发)和粉尘诱发的哮喘,均为间歇性和持续性以及所有严重程度,以及其他由气道高应答性引起的哮喘;慢性阻塞性肺病(copd);支气管炎,包括传染性和嗜酸粒细胞性支气管炎;肺气肿;支气管扩张;囊性纤维化;肉状瘤病;α-1抗胰蛋白酶缺乏症;农民肺和相关疾病;过敏性肺炎;肺纤维化,包括隐发性纤维化肺泡炎、特发性间质性肺炎、纤维化并发抗肿瘤治疗和慢性感染,包括结核病和曲霉病和其他真菌感染;肺移植的并发症;肺血管的血管炎性和血栓性病症,和肺动脉高压;镇咳活性,包括治疗与气道炎症和分泌病状相关的慢性咳嗽,和医源性咳嗽;急性和慢性鼻炎包括药物性鼻炎,和血管舒缩性鼻炎;常年性和季节性过敏性鼻炎包括神经性鼻炎(花粉热);鼻息肉病;急性病毒感染包括常见感冒,和归因于呼吸道合胞体病毒、流感、冠状病毒(包括sars)和腺病毒的感染;急性肺损伤、成人呼吸窘迫综合征(ards)、连同每个前述的呼吸道的疾病状态的恶化,具体而言所有类型的哮喘或copd的恶化。此外,具有化学式(i)的化合物可用于治疗cns相关的炎性疾病(例如ms)。此外,具有化学式(i)的化合物可用于治疗癌症(例如胰腺上皮内瘤病变、导管癌和乳腺癌)。因此,提供了如上文所定义的用于疗法的具有化学式(i)的化合物或其药学上可接受的盐。在另一个方面,提供了如上文所定义的具有化学式(i)的化合物或其药学上可接受的盐在制造用于疗法的药物中的用途。在本说明书的上下文中,除非给出相反的具体说明,术语“疗法”也包括“预防”。术语“治疗的”和“治疗地”应当相应地解释。据预期,预防对于已经遭受所讨论的疾病或病症的先前发作或者被认为处于所讨论的疾病或病症的增加的风险中的人的治疗特别相关。处于发展特定疾病或病症的风险中的人通常包括具有该疾病或病症的家族史的那些人,或通过遗传测试或筛选鉴定为特别易于发展该疾病或病症的那些人。特别地,具有化学式(i)的化合物或其药学上可接受的盐(包括药学上可接受的盐)可用于治疗哮喘{例如支气管,过敏性、内源性、外源性或尘埃性哮喘,特别是慢性或顽固性哮喘(例如晚期哮喘或气道高反应性)}、慢性阻塞性肺病(copd)或过敏性鼻炎。还提供了治疗阻塞性气道疾病或病症(例如哮喘或copd)或降低其风险的方法,该方法包括向对其有需要的患者给予治疗有效量的如上文所定义的具有化学式(i)的化合物,或其药学上可接受的盐。在另一个方面,提供了如上文所定义的具有化学式(i)的化合物或其药学上可接受的盐在制造用于治疗copd的药物中的用途。在另一个方面,提供了如上文所定义的具有化学式(i)的化合物或其药学上可接受的盐在制造用于治疗哮喘的药物中的用途。在另一个方面,提供了如上文所定义的用于治疗copd的具有化学式(i)的化合物或其药学上可接受的盐。在另一个方面,提供了如上文所定义的用于治疗哮喘的具有化学式(i)的化合物或其药学上可接受的盐。还提供了治疗cns相关的障碍(例如ms)或降低其风险的方法,该方法包括向对其有需要的患者给予治疗有效量的如上文所定义的具有化学式(i)的化合物,或其药学上可接受的盐。还提供了治疗癌症(例如胰腺上皮内瘤病变、导管癌和乳腺癌)或降低其风险的方法,该方法包括向对其有需要的患者给予治疗有效量的如上文所定义的具有化学式(i)的化合物,或其药学上可接受的盐。组合疗法具有化学式(i)的化合物或其药学上可接受的盐也可以与用于治疗以上病症的其他化合物结合给予。在另一个实施例中,存在一种组合疗法,其中具有化学式(i)的化合物或其药学上可接受的盐和第二活性成分同时、依序或混合给予,以用于治疗以上列举的一种或多种病症。这种组合可以与一种或多种另外的活性成分组合使用。另一个实施例涉及具有化学式(i)的化合物或其药学上可接受的盐,与抗炎和/或支气管扩张化合物一起的组合。另一个实施例涉及具有化学式(i)的化合物或其药学上可接受的盐,与糖皮质激素受体激动剂(甾体性或非甾体性)一起的组合。另一个实施例仍然进一步涉及具有化学式(i)的化合物或其药学上可接受的盐,与选择性β2肾上腺素受体激动剂一起的组合。另一个实施例仍然进一步涉及具有化学式(i)的化合物或其药学上可接受的盐,与pi3kδ的选择性抑制剂一起的组合。另一个实施例仍然进一步涉及具有化学式(i)的化合物或其药学上可接受的盐,与抗毒蕈碱剂一起的组合。另一个实施例仍然进一步涉及具有化学式(i)的化合物或其药学上可接受的盐,与双重β2肾上腺素受体激动剂/抗毒蕈碱剂一起的组合。另一个实施例仍然进一步涉及具有化学式(i)的化合物或其药学上可接受的盐,与p38拮抗剂一起的组合。另一个实施例仍然进一步涉及具有化学式(i)的化合物或其药学上可接受的盐,与磷酸二酯酶(pde)抑制剂(包括pde4抑制剂或同种型pde4d的抑制剂)一起的组合。在另一个方面中,提供了一种药物组合物(例如,用作用于治疗在此列举的疾病或病症之一的药物,这些疾病或病症是如copd或哮喘),该药物组合物包括具有化学式(i)的化合物或其药学上可接受的盐以及选自以下的至少一种活性成分:a)糖皮质激素受体激动剂(甾体性或非甾体性);b)选择性β2肾上腺素受体激动剂;c)pi3kδ的选择性抑制剂;d)抗毒蕈碱剂;e)p38拮抗剂;或f)pde4拮抗剂;如上所定义。在一个实施例中,将具有化学式(i)的化合物或其药学上可接受的盐与选自以上定义的那些的一种或多种另外活性成分同时地或顺序地给予。例如,可以将具有化学式(i)的化合物或其药学上可接受的盐与用作用于治疗在此列出的疾病或病症之一的药物的另外的药物组合物同时地或顺序地给予,该疾病或病症如呼吸道病症(例如,copd或哮喘)。所述另外的药物组合物可以是已经给患者开具处方的药物(例如,现有的标准或保健药物),并且本身可以是如下组合物,该组合物包括选自以上定义那些的一种或多种活性成分。药用组合物对于上述治疗用途,所给予的剂量将随着所使用的化合物、给予方式、所希望的治疗和所指示的障碍而变化。例如,具有化学式(i)的化合物的每日剂量,如果吸入,可以在从0.05微克/千克体重(μg/kg)至100微克/千克体重(μg/kg)的范围内。可替代地,如果该化合物是口服给予的,那么具有化学式(i)的化合物的每日剂量可以在从0.01微克/千克体重(μg/kg)至100毫克/千克体重(mg/kg)的范围内。可以单独使用具有化学式(i)的化合物或其药学上可接受的盐,但是通常以药物组合物的形式给予,在药物组合物中,化学式(i)的化合物/盐(活性成分)是与药学上可接受的一种或多种佐剂、一种或多种稀释剂或一种或多种载体结合的。用于选择和制备适合的药物配制品的常规程序描述于例如“制药学—剂型设计科学”(pharmaceuticals-thescienceofdosageformdesigns),m.e.奥尔顿(m.e.aulton),丘吉尔利文斯顿出版社(churchilllivingstone),第2版2002中。基于给予模式,该药物组合物将优选地包括从0.05%w至99%w(重量百分数)、更优选地从0.05%w至80%w、仍然更优选地从0.10%w至70%w、甚至更优选地从0.10%w至50%w的活性成分,所有重量百分数都基于总组合物。还提供了一种或多种药物组合物,其包括:如以上定义的具有化学式(i)的化合物或其药学上可接受的盐,与药学上可接受的一种或多种佐剂、一种或多种稀释剂或一种或多种载体结合。还提供了用于制备药物组合物的方法,该方法包括将如以上定义的具有化学式(i)的化合物或其药学上可接受的盐与药学上可接受的一种或多种佐剂、一种或多种稀释剂或一种或多种载体混合。例如,可以以乳剂、溶液、悬浮液、七氟烷烃(hfa)气雾剂和干粉配制品的形式局部给予药物组合物(例如,向皮肤或向肺和/或气道),例如,在被称为的吸入装置中的配制品;或全身性地给予,例如通过片剂、胶囊剂、糖浆剂、散剂或颗粒剂形式的口服给予;或通过以用于注射的无菌溶液、悬浮液或乳剂的形式的非消化道给予(包括静脉内、皮下、肌内、血管内或输注);或者通过以栓剂形式的直肠给予。为了口服给予,可以将具有化学式(i)的化合物与一种或多种佐剂、一种或多种稀释剂或一种或多种载体,例如,乳糖、蔗糖、山梨醇、甘露醇;淀粉,例如,马铃薯淀粉、玉米淀粉或支链淀粉;纤维素衍生物;粘合剂,例如,明胶或聚乙烯吡咯烷酮;崩解剂,例如,纤维素衍生物、和/或滑润剂,例如,硬脂酸镁、硬脂酸钙、聚乙二醇、蜡、石蜡、等等混合,并且然后压制成片剂。如果需要包衣片剂,可以将如以上描述所制备的芯用在水或易挥发的一种或多种有机溶剂中所溶解的或分散的适合的聚合物进行包衣。可替代地,可以将该片剂用浓缩的糖溶液进行包衣,该浓缩的糖溶液可以包含,例如,阿拉伯树胶、明胶、滑石和二氧化钛。为了制备软胶囊剂,例如,可以将具有化学式(i)的化合物与植物油或聚乙二醇混合。硬胶囊可以包含使用药物赋形剂的化合物的颗粒,这些物赋形剂像上述的用于片剂的赋形剂。还可以将具有化学式(i)的化合物的液体或半固体配制品填装到硬胶囊中。用于口服施用的液体制品可以是糖浆剂、溶液或悬浮液形式的。例如,溶液可以包含具有化学式(i)的化合物,余量是糖以及乙醇、水、甘油和丙二醇的混合物。此类液体制品任选地可以包含着色剂、调味剂、糖精和/或作为增稠剂的羧甲纤维素。此外,当制备口服施用的配制品时,可以使用本领域技术人员已知的其他赋形剂。化合物的制备本领域技术人员将理解,在这些方法中,某些功能基团如在试剂中的羟基或氨基基团可能需要由保护基团来保护。因此,在适当的阶段,具有化学式(i)的化合物的制备可以涉及一个或多个保护基团的去除。官能团的保护和脱保护描述于有机合成中的保护基团(protectivegroupsinorganicsynthesis),第4版,t.w.格林(t.w.greene)和p.g.m.伍兹(p.g.m.wuts),威利(wiley)(2006)和保护基团(protectinggroups),第3版,p.j.科辛斯基(p.j.kocienski),乔治蒂姆出版社(georgthiemeverlag)(2005)中。本领域技术人员将认识到,在制备具有化学式(i)的化合物的任何阶段,可以使用化合物的异构体(例如外消旋体)的混合物。在制备的任何阶段,可以通过使用例如手性层析分离将单一立体异构体从异构体(例如,外消旋体)的混合物中分离来获得它。另一个实施例涵盖具有化学式(i)的化合物的药学上可接受的盐。具有化学式(i)的化合物的盐可以是有利的,这是由于一个或多个它的化学的或物理的特性,如在不同温度和湿度下的稳定性,或在h2o、油、或其他溶剂中的所希望的溶解度。在一些实例中,盐可以用于帮助分离或纯化该化合物。在一些实施例中(特别是在该盐旨在用于给予至动物,例如人,或是用于制造旨在用于给予至动物的化合物或盐的试剂的情况下),该盐是药学上可接受的。在化合物是足够酸性的情况下,药学上可接受的盐包括但不限于:碱金属盐,例如,na或k,碱土金属盐,例如ca或mg,或有机胺盐。在该化合物具有足够碱性的情况下,药学上可接受的盐包括但不限于无机或有机酸加成盐。可能存在不止一个阳离子或阴离子,这取决于带电官能团数和阳离子或阴离子的化合价。关于适合的盐的综述,参见伯杰(berge)等人,药物科学杂志(j.pharm.sci.),1977,66,1-19或“药用盐手册:特性、选择和使用(handbookofpharmaceuticalsalts:properties,selectionanduse)”,p.h.斯特尔(p.h.stahl)、p.g.维穆斯(p.g.vermuth),iupac,威利-vch出版社(wiley-vch),2002。在盐中,质子传递发生在具有化学式(i)的化合物和盐的抗衡离子之间。然而,在一些情况下,质子传递可能没完成,并且因此固体并不是真的盐。在此类情况下,固体中的具有化学式(i)的化合物和“共形成剂”分子主要通过非离子力(如氢键合)来相互作用。应当接受的是,该质子传递事实上是一个连续体,并且可以随温度而变化,并且因此最好将盐描述为共结晶体的观点是有些主观的。在酸或碱共形成剂在环境温度下为固体并且在具有化学式(i)的化合物与这种酸或碱共形成剂之间不存在质子转移或仅存在部分质子转移的情况下,可以产生该共形成剂与具有化学式(i)的化合物的共晶体而不是盐。涵盖了具有化学式(i)的化合物的所有这类共晶体形式。具有化学式(i)的化合物可以形成其盐和共结晶体形式的混合物。还应当理解的是,涵盖了具有化学式(i)的化合物的盐/共结晶体混合物。盐和共结晶体可以使用熟知的技术来表征,例如x射线粉末衍射、单晶x射线衍射(例如,来评估质子位置、键长或键角)、固态核磁共振(例如,来评估c、n或p化学位移)、或光谱技术(例如,来测量o-h、n-h或cooh信号和由氢键合造成的ir峰位移)。还应了解,具有化学式(i)的某些化合物可以以溶剂化形式(例如水合物)存在,包括具有化学式(i)的化合物的药学上可接受的盐的溶剂化物。在另一个实施例中,具有化学式(i)的某些化合物可以作为外消旋体和外消旋混合物、单一对映异构体、单独非对映异构体和非对映异构体混合物存在。应当理解,涵盖了所有这类异构体形式。具有化学式(i)的某些化合物还可以包含键联(例如,碳-碳键、碳-氢键如酰胺键),其中键旋转围绕该具体键联受限制,例如由一个环键或双键的存在而产生的限制。因此,应当理解,涵盖了所有这类异构体。某些具有化学式(i)的化合物还可以包含多种互变异构形式。应当理解,涵盖了所有这类互变异构形式。可以使用常规技术,例如色谱法或分步结晶来分离立体异构体,或者这些立体异构体可以通过立体选择合成来制备。在另一个实施例中,具有化学式(i)的化合物涵盖具有化学式(i)的化合物的任何同位素-标记的(或“放射性-标记的”)衍生物。这样的衍生物是具有化学式(i)的化合物的衍生物,其中一个或多个原子被具有不同于在自然中典型发现的原子质量或质量数的原子质量或质量数的原子取代。可以被并入的放射性核素的实例包括2h(对于氘还被书写为“d”)。在另一个实施例中,具有化学式(i)的化合物可以按一种前药形式给予,该前药在人或动物体内分解以便得到一种具有化学式(i)的化合物。前药的实例包括具有化学式(i)的化合物的体内可水解的酯。包含羧基或羟基基团的具有化学式(i)的化合物的体内可水解的(或可裂解的)酯是例如在人体或动物体内水解产生母体酸或醇的药学上可接受的酯。针对酯前药衍生物的实例,参见:药物代谢研究最新进展(curr.drug.metab.)2003,4,461。各种其他形式的前药是在本领域已知的。关于前药衍生物的实例,参见:药物发现自然评论(naturereviewsdrugdiscovery)2008,7,255以及其中引用的参考文献。实例本披露现在将通过参考以下非限制性实例来进行进一步说明。(i)除非另有说明,将1hnmr谱记录在300mhz、400mhz、500mhz或600mhz的场强度下操作的brukeravance、avanceii或avanceiii光谱仪上。将氯仿-d(cdcl3;δh7.27ppm),二甲亚砜-d6(dmso-d6;δh2.50ppm)或甲醇-d4(cd3od;δh3.31ppm)的中心峰用作参考。(ii)按两个设定运行lcms:1)(碱)behc18柱(1.7μm2.1x50mm)在流速1.0ml/min下与ph10的46mm碳酸铵/氨水缓冲液(a)和mecn(b)的梯度(5分钟内2%-95%b)组合或2)(酸)与在1.0ml/min的流速下的水和tfa(0.05%)(a)和mecn和tfa(0.05%)(b)的梯度(2分钟内5%-95%b)组合。(iii)使用具有整合的ms检测并且装备有来自x-bridge或sunfire的制备型c18obd5μm19x150mm柱的沃特斯fractionlynx系统来进行制备型hplc。可替代地,使用具有整合的uv检测的gilsongx-281,装备有kromasilc810μm,20x250id抑或50x250idmm。作为洗脱液(酸性的),应用以下梯度:水/mecn/乙酸(95/5/0.1)或水/0.05%tfa(a),以及mecn/0.05%tfa(b),或(碱性的)mecn或meoh(a),以及0.03%水中的氨或0.03%nh4hco3(b)。(iv)用具有整合的ms检测,装备有沃特斯viridis2-ep或phenomenexlunahilic,30x250mm,5μm的沃特斯prep100sfc系统来进行制备型sfc。作为洗脱液,应用以下梯度:co2(100g/min,120巴,40℃)(a),以及meoh/nh3(20mm)或meoh(5%甲酸)或meoh(b)。(v)实例和制备的标题和亚标题化合物是使用来自acdlabs的iupac命名程序acd/名称2014来命名。(vi)除非另有说明,起始材料是可商购的,并且所有溶剂和商业试剂均为实验室级,并按原样使用。除非另有说明,操作在环境温度(即在17℃-28℃的范围内)下进行,并且如果合适,在惰性气体如氮气的气氛下进行。(vii)根据标准方法进行x射线衍射分析,这些方法可以见于例如基戈罗斯基(kitaigorodsky),a.i.(1973),分子晶体与分子(molecularcrystalsandmolecules),学术出版社(academicpress),纽约;邦恩(bunn),c.w.(1948),化学结晶学(chemicalcrystallography),克拉伦登出版社(clarendonpress),伦敦;或格鲁(klug),h.p.和亚历山大(alexander),l.e.(1974),x射线衍射程序(x-raydiffractionprocedures),约翰威利父子出版公司(johnwileyandsons),纽约。将样品安装在单晶硅(ssc)晶片底座上,并用panalyticalx'pertpro(反射几何,x-射线波长镍过滤的cu辐射,电压45kv,灯丝发射40ma)记录粉末x-射线衍射。使用自动可变发散和防散射狭缝,并且使这些样品在测量期间旋转。使用pixcel检测器(有效长度3.35°2θ),使用0.013°步长和在44秒和233秒计数时间之间,从2-50°2θ或2-40°2θ扫描样品。本领域已知,取决于测试条件(例如设备、样品制备或所用的机器),可得到具有一个或多个测量误差的x-射线粉末衍射图。具体来说,总体上已知x射线粉末衍射图的强度可以波动,取决于测量条件和样品制备。例如,x射线粉末衍射领域的技术人员将认识到,峰的相对强度可以根据测试的样品的取向和所使用的仪器的类型和设置而变化。本领域技术人员还将认识到,反射位置可以受到样品在衍射仪中的精确高度和衍射仪的零点校准的影响。样品的表面平面性也可以具有细微影响。因此,本领域技术人员将理解,本文呈现的衍射图案数据不应被解释为绝对的,并且提供与本文公开的那些基本上一致的粉末衍射图的任何晶体形式属于本披露的范围内(更多信息参见詹金斯(jenkins),r和斯奈德(snyder),r.l.“x射线粉末衍射的介绍”(“introductiontox-raypowderdiffractometry”)约翰威利父子出版公司(johnwiley&sons),1996)。通常,x射线粉末衍射图中的衍射角的测量误差可以是大约±0.2°2-θ,并且当考虑x射线粉末衍射数据时,应当将这种程度的测量误差考虑在内。此外,应当理解的是,强度可以根据实验条件和样品制备(例如优选取向)而波动。以下定义用于相对强度(%):81%-100%,vs(非常强);41%-80%,str(强);21%-40%,med(中);10%-20%,w(弱);1%-9%,vw(非常弱)。使用了以下缩写:acoh乙酸aq水性cdcl3氯仿-dcv柱体积dcm二氯甲烷dmfn,n-二甲基甲酰胺dmso二甲亚砜dppf1,1'-双(联苯膦基)二茂铁etoac乙酸乙酯eq当量fa甲酸g克h小时hplc高效液相色谱法l升lc液相色谱法m-cpba3-氯过氧苯甲酸mecn乙腈meoh甲醇min分钟ml毫升nm纳米rt室温sat饱和的tfa三氟乙酸tr滞留时间中间体的制备中间体1(方法a)5-溴-7-氯-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮将(s)-1-环丙基乙胺(2.43ml,22.8mmol)添加到在mecn(80ml)中的4-溴-2-(溴甲基)-6-氯苯甲酸甲酯(7.8g,22.8mmol)中。一次性添加呈干燥固体的硼酸(1.41g,22.8mmol),然后经2min分批添加碳酸钾(6.3g,45.6mmol)。将该混合物在室温下搅拌过夜。将无机物滤出,用mecn洗涤。将合并的mecn滤液浓缩,以得到8.3g的棕色油状物。将残余物在kp-sil340g柱上通过自动快速色谱法纯化。庚烷中的梯度从5%至30%的etoac经过12cv。使用254nm的波长收集该产物。蒸发纯级分,以给出呈粉红色固体的标题化合物(2.4g,34%)。1h-nmr(500mhz,cdcl3)δ0.33-0.51(m,3h),0.57-0.69(m,1h),0.94-1.05(m,1h),1.34(d,3h),3.67-3.81(m,1h),4.37(d,1h),4.48(d,1h),7.5-7.55(m,1h),7.58(s,1h)。中间体2(方法b)n-(5-{7-氯-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺将cs2co3(37.3g,114.4mmol)添加到在dmf(300ml)中的5-溴-7-氯-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮(中间体1,18g,57.2mmol)、n-(4-甲基-1,3-噻唑-2-基)乙酰胺(10.72g,68.66mmol)、三叔丁基四氟硼酸鏻(3.32g,11.44mmol)和pdoac2(1.28g,5.7mmol)中。将所得混合物在100℃下搅拌2小时并且然后冷却至室温。将该混合物通过硅藻土垫过滤。将该溶剂在减压下去除。将该粗产物通过快速硅胶色谱(在dcm中的0至25%meoh洗脱梯度)纯化。将纯级分蒸发至干燥,以提供呈黄色固体的标题化合物(14g,63%)。1h-nmr(500mhz,dmso-d6)δ0.2-0.27(m,1h),0.40(ddd,2h),0.52-0.61(m,1h),1.12(qt,1h),1.28(d,3h),2.16(s,3h),2.40(s,3h),3.32(s,2h),3.5-3.63(m,1h),7.50(d,1h),7.64(s,1h),12.23(s,1h)。m/z(es+),[m+h]+=390;酸,hplctr=2.031min。中间体3(方法c)n-(5-{7-(苄基硫烷基)-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺在50ml圆底烧瓶中添加在dmf(500ml)中的n-(5-{7-氯-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺(中间体2,20g,51.3mmol)、苯基甲硫醇(12.74g,102.59mmol)和2-甲基丁-2-醇钠(11.30g,102.59mmol)中,以给出橙色悬浮液。将反应混合物在110℃下搅拌2小时。将该反应混合物通过硅藻土过滤。将溶剂在减压下去除。将该粗产物通过快速二氧化硅色谱法(在dcm中的0%到25%etoac的洗脱梯度)进行纯化。将纯级分蒸发至干燥,以提供呈黄色固体的标题化合物(18g,73%)。m/z(es+),[m+h]+=478;酸,hplctr=1.177min。1hnmr(500mhz,dmso-d6)δ0.12-0.27(m,1h),0.38(dtt,2h),0.5-0.64(m,1h),1.01-1.14(m,1h),1.26(d,3h),2.15(s,3h),2.24(s,3h),3.43-3.59(m,1h),4.35(s,2h),4.52(s,2h),7.27(d,2h),7.34(qd,3h),7.48(d,2h),12.16(s,1h)。m/z(es+),[m+h]+=478;酸,hplctr=1.177min。中间体4(方法d)6-[2-(乙酰氨基)-4-甲基-1,3-噻唑-5-基]-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰氯在0℃下,将硫酰氯(8.48g,62.81mmol)分批添加到在乙酸(60ml)、mecn(400ml)和水(4ml)中的n-(5-{7-(苄基硫烷基)-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺(中间体3,10g,20.9mmol)中。将所得混合物在5℃下搅拌1小时。将溶剂在减压下去除。将该反应混合物用dcm(500ml)稀释,并且依次用饱和的nahco3(100ml)和饱和盐水(200ml)洗涤。将该有机层经na2so4干燥、过滤并蒸发。将该残余物悬浮于二乙醚中,并通过过滤收集固体。将该固体真空干燥,以提供标题化合物(8g,84%)。m/z(es+),[m+h]+=454;酸,hplctr=1.541min1hnmr(500mhz,dmso-d6)δ0.28(dt,1h),0.43(ddp,2h),0.52-0.64(m,1h),1.16(ddq,1h),1.31(d,3h),2.17(s,3h),2.41(s,3h),3.60(dt,1h),4.70(s,2h),7.76(s,1h),7.90(d,1h),12.26(s,1h)。m/z(es+),[m+h]+=454;酸,hplctr=1.541min中间体5-24以下化合物使用上述的方法和中间体进行制备中间体25n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基硫烷基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺将甲硫醇钠(90mg,1.28mmol)添加到n-(5-{7-氯-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺(中间体2,250mg,0.64mmol)在干燥dmf(5ml)中的浆液中。将小瓶盖住并在100℃下插入铝块中。将该反应搅拌过夜。16小时后,起始原料仍存在于该反应中,并添加更多的甲硫醇钠(200mg,2.85mmol)。将该反应加热至100℃持续另外的6小时。将反应冷却并用水稀释。滤出形成的固体,用水洗涤并干燥,给出固体状的标题化合物(142mg,55%)。1h-nmr(600mhz,dmso-d6)δ0.19-0.25(m,1h),0.33-0.43(m,2h),0.53-0.6(m,1h),1.06-1.14(m,1h),1.26(d,3h),2.15(s,3h),2.40(s,3h),2.48(s,3h),3.47-3.57(m,1h),4.54(s,2h),7.18(s,1h),7.36(s,1h),12.19(s,1h)。es(m+h)+=402.1,碱,hplctr=1.64min中间体265-溴-2-[(1s)-1-环丙基乙基]-7-(甲基硫烷基)-2,3-二氢-1h-异吲哚-1-酮将5-溴-7-氯-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮(中间体1,5.08g,16.15mmol)、甲硫醇钠(3.38g,48.22mmol)和1,4-二噁烷(60ml)置于用惰性气氛冲洗的单颈100ml烧瓶中并在120℃下加热5.5小时。随后将该反应混合物通过用乙酸乙酯洗涤过的硅藻土过滤。将有机溶剂用水、盐水洗涤两次,经硫酸钠干燥,过滤并在真空中浓缩,以给出黄色固体。向该固体中添加乙醚,并搅拌混合物。通过抽吸过滤收集该固体。将该固体用乙醚洗涤三次并进行空气干燥,以给出呈白色固体的标题产物(4.95g,94%)。1h-nmr(500mhz,dmso-d6)δ0.20(tt,1h),0.31-0.43(m,2h),0.51-0.59(m,1h),1.04-1.12(m,1h),1.24(d,3h),2.46(s,3h),3.45-3.54(m,1h),4.49(s,2h),7.32(s,1h),7.51-7.55(m,1h)。中间体275-溴-2-[(1s)-1-环丙基乙基]-7-(甲基磺酰基)-2,3-二氢-1h-异吲哚-1-酮在氮气下,将m-cpba(4.62g,26.79mmol)添加到在dcm(50ml)中的5-溴-2-[(1s)-1-环丙基乙基]-7-(甲基硫烷基)-2,3-二氢-1h-异吲哚-1-酮(中间体26,3.8g,11.65mmol)中并将得到的混合物在室温下搅拌2小时。将该反应混合物用dcm(200ml)稀释,并且依次用饱和的nahco3(2x150ml)和饱和盐水(150ml)洗涤。将该有机层经na2so4干燥、过滤并蒸发以提供粗产物。将该粗产物通过快速硅胶色谱(在dcm中的0至5%meoh洗脱梯度)纯化。将纯级分蒸发至干燥,以提供呈黄色固体的标题化合物(3.1g,74%)。1h-nmr(500mhz,dmso-d6)δ0.21-0.3(m,1h),0.36-0.48(m,2h),0.55-0.63(m,1h),1.10-1.18(m,1h),1.29(d,3h),3.55-3.61(m,1h),3.62(s,3h),4.66(s,2h),8.05(d,1h),8.24-8.29(m,1h)。es(m+h)+=360.1,酸,hplctr=0.81min中间体285-溴-7-氯-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮在25℃下,在氮气下,在30分钟时间段内,将丙-2-胺(3.28g,55.49mmol)滴加到在二噁烷(200ml)中的4-溴-2-(溴甲基)-6-氯苯甲酸甲酯(19g,55.49mmol)中。将所得溶液在100℃下搅拌12小时。将溶剂在减压下去除。将该粗产物通过快速二氧化硅色谱法(在石油醚中的30%到50%etoac的洗脱梯度)进行纯化。将纯级分蒸发至干燥,以得到呈固体的标题化合物(7g,44%)。1h-nmr(500mhz,dmso-d6)δ1.21(d,6h),4.37(hept,1h),4.40(s,2h),7.72-7.74(m,1h),7.8-7.82(m,1h)。m/z(es+),[m+h]+=288;酸,hplctr=1.484min中间体295-溴-7-(甲基硫烷基)-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮向100ml圆底烧瓶中放入5-溴-7-氯-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮(中间体28,1g,3.47mmol,1.00当量)、mesna(610mg,8.7mmol,4当量)和无水1,4-二噁烷(10ml)。将所得溶液在油浴中在110℃下搅拌6小时。将反应混合物冷却。将水添加到此溶液中。将所得溶液用dcm萃取,并且将有机层合并,并用无水硫酸钠干燥,并在真空下浓缩。给出呈固体的标题化合物(800mg,77%)。1h-nmr(500mhz,dmso-d6)δ1.19(d,6h),2.46(s,3h),4.32(hept,1h),4.38(s,2h),7.30(s,1h),7.49-7.53(m,1h)。m/z(es+)[m+h]+=300and302,酸,hplctr=1.77min。中间体305-溴-7-(甲基磺酰基)-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮向100ml圆底烧瓶中放入5-溴-7-(甲基硫烷基)-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮(中间体29,1g,3.33mmol,1.00当量)和氯仿(10ml)。向此溶液中缓慢添加m-cpba(1.4g,8.11mmol,2.5当量)。将所得溶液在25℃下搅拌过夜。通过添加饱和nahso3来淬灭所得溶液,并搅拌30分钟。向此溶液中添加碳酸氢钠水溶液。将所得溶液用dcm萃取,并且将有机层合并,并用无水硫酸钠干燥并在真空下浓缩。得到呈黄色固体的标题化合物(800mg,72%)。1h-nmr(500mhz,dmso-d6)δ1.25(d,6h),3.62(s,3h),4.41(hept,1h),4.54(s,2h),8.05(d,1h),8.22-8.25(m,1h)。m/z(es+)[m+h]+=332and334,酸,hplctr=1.32min。中间体317-(苄基硫烷基)-5-溴-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮向100ml圆底烧瓶中放入5-溴-7-氯-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮(中间体28,1g,3.47mmol,1.00当量)、苯基甲硫醇(860mg,6.92mmol,2.00当量)、[(2-甲基丁-2-基)氧基]钠(760mg,6.90mmol,2.00当量)、二噁烷(10ml)。将所得的溶液在110℃下搅拌2小时。将该反应混合物冷却至室温。添加水,且用dcm萃取该溶液。将有机层合并,并经无水硫酸钠干燥。将该残余物施加到使用乙酸乙酯/石油醚(1/6)的硅胶柱上。将该产物在真空下浓缩,以给出呈白色固体的标题化合物(1g,77%)。1h-nmr(500mhz,cdcl3)δ1.29(d,6h),4.29(s,2h),4.65(hept,1h),7.51(s,1h),7.57(s,1h)。m/z(es+)[m+h]+=378,碱,hplctr=2.37min。中间体326-溴-3-氧代-2-(丙-2-基)-2,3-二氢-1h-异吲哚-4-磺酰氯向100ml圆底烧瓶中放入在mecn(4.1ml)、acoh(0.6ml)和水(0.4ml)中的7-(苄基硫烷基)-5-溴-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮(中间体31,200mg,0.53mmol,1.00当量)。将该溶液冷却至5℃并在5℃下添加1,3-二氯-5,5-二甲基咪唑啉-2,4-二酮(210mg,1.07mmol,2.00当量)。将所得溶液搅拌2小时,在水/冰浴上冷却,并且然后在室温下冷却1小时。滤出固体,并将该产物滤液在真空下浓缩,以给出呈固体的粗标题化合物(200mg)。m/z(es+)[m+h]+=354,酸,hplctr=1.04min。中间体336-溴-n-甲基-3-氧代-2-(丙-2-基)-2,3-二氢-1h-异吲哚-4-磺酰胺向100ml圆底烧瓶中放入在dcm(5ml)中的甲胺(2m在thf中,0.55ml,1mmol,2当量)、6-溴-3-氧代-2-(丙-2-基)-2,3-二氢-1h-异吲哚-4-磺酰氯(中间体32,200mg,0.57mmol)。将所得溶液在室温下搅拌1小时。将水添加到此混合物中。将所得溶液用dcm萃取并且将有机层合并。将所得溶液在真空下浓缩,以给出呈白色固体的标题化合物(170mg,85%)。m/z(es+)[m+h]+=349,酸,hplctr=1.47min。中间体34n-甲基-3-氧代-2-(丙-2-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3-二氢-1h-异吲哚-4-磺酰胺向100ml圆底烧瓶中放入6-溴-n-甲基-3-氧代-2-(丙-2-基)-2,3-二氢-1h-异吲哚-4-磺酰胺(中间体33,500mg,1.44mmol)、4,4,5,5-四甲基-2-(四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1,3,2-二氧杂环戊硼烷(730mg,2.87mmol)、koac(422mg,4.30mmol)、二噁烷(5ml)、pd(pph3)4(165mg,0.14mmol)。在氮气氛下,将所得溶液在110℃下搅拌1小时。将所得的混合物在真空下浓缩。将该残余物施加到使用乙酸乙酯/石油醚(1:4)的硅胶柱上。得到呈黄色固体的粗标题化合物(400mg)。m/z(es+)[m+h]+=313,酸,hplctr=0.81min。中间体357-(苄基硫烷基)-5-溴-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮向500ml圆底烧瓶中放入在1,4-二噁烷(5ml)中的(s)-5-溴-7-氯-2-(1-环丙基乙基)异吲哚啉-1-酮(中间体1,2.5g,7.95mmol)、苯基甲硫醇(1.97g,15.9mmol)和2-甲基丁-2-醇钠(1.75g,15.9mmol),以给出橙色悬浮液。将反应混合物在110℃下搅拌2小时。将该反应混合物通过硅藻土过滤。将该溶剂在减压下去除。将该粗产物添加到硅胶柱中,并用dcm/etoac(5/1)进行洗脱。将纯级分蒸发至干燥,以提供呈黄色固体的标题化合物(1.2g,37%)。1h-nmr(500mhz,cdcl3)δ0.29-0.49(m,3h),0.54-0.67(m,1h),0.89-1.04(m,1h),1.31(d,3h),3.69(dq,1h),4.22(s,2h),4.34(d,1h),4.45(d,1h),7.23-7.27(m,1h),7.32(dd,3h),7.35(s,1h),7.39-7.49(m,2h)。m/z(es+),[m+h]+=404;酸,hplctr=1.271min。中间体366-溴-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰氯在0℃下,将硫酰二氯(3.44ml,42.25mmol)添加到在dcm(30ml)中的水(0.76ml,42.2mmol)、7-(苄基硫烷基)-5-溴-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮(中间体35,4.25g,10.56mmol)和乙酸(2.6ml,52.8mmol)中。将所得混合物在0℃下搅拌1小时。将反应混合物用饱和nahco3(100ml)淬灭,用etoac(3x100ml)萃取,将有机层经na2so4干燥,过滤并蒸发,以提供呈固体的标题化合物(3.76g,94%)。1h-nmr(500mhz,cdcl3)δ0.28-0.53(m,3h),0.61-0.74(m,1h),0.98-1.05(m,1h),1.37(d,3h),3.78-3.84(m,1h),4.50(d,1h),4.62(d,1h),7.91-7.99(m,1h),8.27(d,1h)。m/z(es+),[m+h]+=380;酸,hplctr=1.612min中间体376-溴-2-[(1s)-1-环丙基乙基]-n-甲基-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰胺将7-(苄基硫烷基)-5-溴-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮(中间体35,2.54g,6.31mmol)溶于乙腈(50ml)中。添加水(5ml)和乙酸(8ml),并将该反应在冰浴中在搅拌下冷却至约5℃,然后在约2分钟内分批添加1,3-二氯-5,5-二甲基乙内酰脲(2.114g,10.73mmol)。将该反应在室温下搅拌1小时并且然后蒸发。将残余物在dcm和50ml的水之间分配。将该水相用dcm再萃取两次,并且将合并的有机相用10%na2s2o3洗涤,经mgso4干燥并蒸发,以给出浅黄色固体。将该粗产物溶解在干燥thf(50ml)中并滴加到35%menh2在乙醇(5ml)和thf(20ml)中的搅拌混合物中。白色沉淀立即开始形成。将该混合物在室温下搅拌1小时并随后进行蒸发。将残余物与水(55ml)一起搅拌1小时。将固体过滤,用少量水洗涤两次并从乙醇中重结晶。1h-nmr(500mhz,cdcl3)δ0.39(m,2h),0.49(tt,1h),0.68(tt,1h),1.01(dtd,1h),1.36(d,3h),2.65(d,3h),3.71-3.81(m,1h),4.47(d,1h),4.59(d,1h),7.82(s,1h),8.21(d,1h)。m/z(es+),[m+h]+=374.8;碱,hplctr=1.514min。中间体386-溴-2-[(1s)-1-环丙基乙基]-n,n-二甲基-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰胺向100ml圆底烧瓶中放入6-溴-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰氯(中间体36,400mg,1.06mmol)和dcm(3ml)。滴加在dcm(0.1g,2mmol)中的二甲胺。将所得的溶液在25℃下搅拌1小时。用h2o稀释所得到的溶液。将所得溶液用二氯甲烷进行萃取,并且将有机层合并,并且在真空下浓缩。提供呈固体的粗标题化合物(0.4g)。m/z(es+)[m+h]+=389,酸,hplctr=1.52min。中间体396-溴-2-[(1s)-1-环丙基乙基]-3-氧代-异吲哚啉-4-磺酰胺将来自前述步骤假定为定量的6-溴-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰氯(中间体36,1.204g,3.18mmol)溶于二噁烷(25ml)中并在冰浴中冷却至0℃。形成浆液,并向其中添加30%氢氧化铵水溶液(32ml,246.5mmol)。允许将反应升温至室温过夜。添加水,且用dcm萃取该产物。使用相分离器干燥有机物并真空浓缩,以给出粗产物(0.4g)。m/z(es+)[m+h]+=361,碱,hplctr=1.52min。中间体402-[(1s)-1-环丙基乙基]-n-甲基-3-氧代-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3-二氢-1h-异吲哚-4-磺酰胺在25℃在氮下,将pdcl2(dppf)(1.451g,1.98mmol)添加到在1,4-二噁烷(200ml)中的6-溴-2-[(1s)-1-环丙基乙基]-n-甲基-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰胺(中间体37,7.4g,19.83mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(10.07g,39.65mmol)和乙酸钾(5.84g,59.48mmol)中。将所得混合物在80℃搅拌12小时。用etoac(300ml)对该反应混合物进行稀释,并用水(350ml)和饱和的盐水(300ml)进行两次洗涤。将该有机层经na2so4干燥、过滤并蒸发以提供粗产物。将该粗产物通过快速二氧化硅色谱法(在石油醚中0至30%etoac的洗脱梯度)纯化。将纯级分蒸发至干燥,以提供呈固体的标题化合物(7.0g,84%)。1h-nmr(500mhz,cdcl3)δ0.34-0.55(m,3h),0.63-0.75(m,1h),1.05(tt,1h),1.25-1.30(m,3h),1.38(s,12h),2.53-2.73(m,3h),3.79(dq,1h),4.44-4.70(m,2h),7.45(s,1h),8.09(s,1h),8.51(s,1h)。m/z(es+),[m+h]+=421;酸,hplctr=1.665min中间体41{2-[(1s)-1-环丙基乙基]-7-(二甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}硼酸向100ml圆底烧瓶中放入6-溴-2-[(1s)-1-环丙基乙基]-n,n-二甲基-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰胺(中间体38,400mg,1.03mmol)、4,4,5,5-四甲基-2-(四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1,3,2-二氧杂环戊硼烷(340mg)、koac(330mg,3.36mmol)、pd(pph3)4(50mg,0.04mmol)、1,4-二噁烷(5ml)。在氮下,将所得溶液在110℃下搅拌1小时。将所得的混合物在真空下浓缩。将该残余物施加到使用乙酸乙酯/石油醚(1:3)的硅胶柱上。提供呈固体的标题化合物(300mg,82%)。m/z(es+)[m+h]+=353,酸,hplctr=0.88min。中间体42n-(5-{7-氯-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺将cs2co3(4.14g,12.71mmol)添加到在(30ml)中的5-溴-7-氯-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮(中间体1,2g,6.36mmol)、n-(噻唑-2-基)乙酰胺(1.085g,7.63mmol)、三叔丁基四氟硼酸鏻(0.369g,1.27mmol)和pdoac2(0.143g,0.64mmol)中。将所得混合物在100℃下搅拌4小时并且冷却至室温。将该反应混合物倒入水(100ml)中,用etoac(3×100ml)萃取,将有机层经na2so4干燥,过滤并蒸发,以提供黄色油状物。将该粗产物通过快速二氧化硅色谱法(在石油醚中0至60%etoac的洗脱梯度)纯化。将纯级分蒸发至干燥,以提供呈黄色固体的标题化合物(1.8g,75%)。1h-nmr(400mhz,dmso-d6)δ0.24(dt,1h),0.40(dt,2h),0.58(dt,1h),1.03-1.19(m,1h),1.28(d,3h),2.19(s,3h),3.47-3.73(m,1h),4.54(s,2h),7.77-7.78(m,2h),8.11(s,1h),12.33(s,1h)。m/z(es+),[m+h]+=376.2;酸,hplctr=1.464min中间体43(3as,6r)-5-溴-2-[(1s)-1-环丙基乙基]-1-氧代-1,2,3,6,7,7a-六氢-3a,6-环氧异吲哚-7-甲酸在室温下,在甲苯(170ml)中混合(s)-n-((4-溴呋喃-2-基)甲基)-1-环丙基乙胺(20.37g,83.44mmol)和呋喃-2,5-二酮(9.00g,91.78mmol)。将反应在室温下搅拌过夜。通过过滤收集形成的沉淀,并用乙醚洗涤。获得呈白色固体的标题化合物(24.4g,85%)。该材料未经纯化即用于下一步骤中。1h-nmr(500mhz,cdcl3)δ0.23-0.39(m,2h),0.43-0.53(m,1h),0.57-0.68(m,1h),0.83-0.93(m,1h),1.22,(d,1.5h),1.26(d,1.5h),2.98-3.11(m,2h),3.46-3.59(m,2h),3.86(d,0.5h),3.93(d,0.5h),3.96(d,0.5h),4.03(d,0.5h),5.18(s,0.5h),5.20(s,0.5h),6.53(s,0.5h),6.55(s,0.5h)。中间体446-溴-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-甲酸在氮气氛下,将(3as,6r)-5-溴-2-((s)-1-环丙基乙基)-1-氧代-1,2,3,6,7,7a-六氢-3a,6-环氧异吲哚-7-甲酸(中间体43,10g,29.22mmol)溶于二噁烷(200ml)中,并向其中添加bf3xoet2(14.81ml,116.9mmol)。然后将该反应在回流下加热2小时。允许该反应冷却至室温,用dcm稀释并用盐水洗涤。使用相分离器筒分离该有机层,并在真空中浓缩。将该残余物用甲醇研磨。通过过滤收集获得的固体,并用甲醇洗涤,以给出呈灰白色固体的标题化合物(6.65g,70%)。1h-nmr(500mhz,cdcl3)δ0.37-0.43(m,1h),0.43-0.5(m,1h),0.49-0.59(m,1h),0.68-0.78(m,1h),0.99-1.13(m,1h),1.43(d,3h),3.73-3.82(m,1h),4.58(d,1h),4.69(d,1h),7.84-7.87(m,1h),8.57(d,1h),1h遮蔽的。中间体457-氨基-5-溴-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮将二苯基磷酰基叠氮化物(0.5ml,2.3mmol)添加到6-溴-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-甲酸(中间体44,0.5g,1.5mmol)和三乙胺(0.32ml,2.3mmol)在叔丁醇(8ml)中的悬浮液中。将混合物在回流中加热20小时。将该反应在真空中浓缩并将残余物通过快速色谱纯化,用在庚烷中的0-3%etoac洗脱。将含产物的级分合并,并且在真空中浓缩。将残余物溶解于dcm(2ml)中并且添加tfa(2ml,12.95mmol)。将该反应在室温下搅拌2小时。在真空中浓缩反应,并且将残余物在dcm与饱和nahco3水溶液之间分配。分离这些层并在真空中去除dcm。用mecn研磨该残余物并获得固体。通过过滤收集该固体并用mecn洗涤。获得呈白色固体的标题化合物(0.37g,83%)。1h-nmr(500mhz,cdcl3)δ0.3-0.42(m,2h),0.43-0.49(m,1h),0.59-0.67(m,1h),0.91-1.04(m,1h),1.32(d,3h),3.61-3.7(m,1h),4.32(d,1h),4.42(d,1h),6.75-6.77(m,1h),6.88(d,1h)。中间体46n-{6-溴-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-基}乙酰胺向7-氨基-5-溴-2-[(1s)-1-环丙基乙基]-2,3-二氢-1h-异吲哚-1-酮(中间体45,200mg,0.68mmol)和三乙胺(0.189ml,1.36mmol)在dcm(5ml)中的溶液中添加乙酰氯(0.058ml,0.81mmol)。在室温下搅拌过夜。将该反应用dcm稀释并且用水洗涤。使用相分离器筒分离这些相,并在真空中去除dcm。将获得的残余物通过快速色谱法纯化,用在庚烷中的20%etoac洗脱。获得呈固体的标题化合物(118mg,52%)。1h-nmr(400mhz,cdcl3)δ0.3-0.55(m,3h),0.61-0.74(m,1h),0.94-1.09(m,1h),1.36(d,3h),2.23(s,3h),3.56-3.74(m,1h),4.39(d,1h),4.50(d,1h),7.28(s,1h),8.71(s,1h),10.39(s,1h)。实例实例1n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺将m-cpba(3.33g,19.3mmol)添加到在dcm(120ml)中的n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基硫烷基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺(中间体25,3.1g,7.72mmol)中。将所得混合物在0℃下搅拌1小时,然后升温至室温并搅拌1小时。将反应混合物用饱和nahco3(200ml)淬灭并用dcm(3×200ml)萃取。将有机层经na2so4干燥,过滤并蒸发,以提供黄色固体。将粗产物用以下条件通过制备型hplc纯化:柱:xbridgerp18,19*150mm,5um;流动相a:水0.03%nh4hco3,流动相b:mecn;流速:30ml/min;梯度:8min内25%b至75%b;254nm。将纯级分蒸发至干燥,以提供呈白色固体的标题化合物(1.2g,36%)。1h-nmr(500mhz,dmso-d6)δ0.24-0.29(m,1h),0.38-0.46(m,2h),0.57-0.62(m,1h),1.11-1.19(m,1h),1.31(d,3h),2.17(s,3h),2.44(s,3h),3.59-3.65(m,4h),4.70(s,2h),8.00(d,1h),8.05(d,1h),12.30(s,1h)。m/z(es+),[m+h]+=433.9;碱,hplctr=2.553min通过xrpd固体残余物被发现是结晶的并且典型衍射图展示在图1中。特征性峰位置列于以下表1和表2中。表1.实例1形式a的五个特征性峰表2.实例1形式a的十个特征性峰实例2n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺将5-溴-2-[(1s)-1-环丙基乙基]-7-(甲基磺酰基)-2,3-二氢-1h-异吲哚-1-酮(中间体27,1.03g,2.88mmol)、n-(噻唑-2-基)乙酰胺(0.573g,4.03mmol)和dmf(14ml)一起添加到100ml三颈烧瓶中并脱气并用氮气填充3次。向反应混合物中添加乙酸钯(24.2mg,0.11mmol)和三叔丁基四氟硼酸鏻(75.1mg,0.26mmol),并在100℃下加热搅拌过夜。允许反应混合物达到室温,并且然后在搅拌下滴加到水溶液(200ml)中,随后用etoac萃取。将有机层用水、盐水洗涤,经硫酸钠干燥,过滤并真空浓缩。将残余物悬浮在etoac中,搅拌一段时间,并且然后通过抽滤收集固体。将固体用etoac/乙醚洗涤,并进行空气干燥以得到0.59g呈黄色粉末的产物。将残余物溶于二氯甲烷中,加载在二氧化硅柱上,并通过用100mldcm,然后用在dcm(500ml)中的2-丙醇(0-20%),并且然后用在dcm(150ml)中的2-丙醇(20%-100%)洗脱进行色谱层析。在320nm处收集该化合物。将包含级分的纯产物蒸发,以给出呈黄色固体的标题化合物(0.87g,72%)。1h-nmr(500mhz,dmso-d6)δ0.24-0.3(m,1h),0.41(dddd,2h),0.56-0.63(m,1h),1.12-1.18(m,1h),1.31(d,3h),2.20(s,3h),3.57-3.62(m,1h),3.63(s,3h),4.68(s,2h),8.09(d,1h),8.12(s,1h),8.21(d,1h),12.37(s,1h)。m/z(es+),[m+h]+=420.2;酸,hplctr=1.51实例3n-{4-甲基-5-[7-(甲基磺酰基)-1-氧代-2-(丙-2-基)-2,3-二氢-1h-异吲哚-5-基]-1,3-噻唑-2-基}乙酰胺向100ml圆底烧瓶中放入5-溴-7-甲磺酰基-2-(丙-2-基)-2,3-二氢-1h-异吲哚-1-酮(中间体30,250mg,0.75mmol)、n-(4-甲基-1,3-噻唑-2-基)乙酰胺(130mg,0.83mmol)、cs2co3(492mg,1.51mmol)、pd(oac)2(17mg,0.08mmol)、dmf(5ml)、三叔丁基四氟硼酸鏻(44mg,0.15mmol)。在氮气氛下将所得溶液在油浴中在110℃下搅拌2小时。将该反应混合物冷却并且添加水。将所得溶液用二氯甲烷萃取,并且将合并的有机层经无水硫酸钠干燥,过滤,并在真空下浓缩。将粗产物用以下条件通过制备型hplc纯化:柱:xbridgec18,19x150mm,5um;流动相a:水/0.05%fa,流动相b:mecn;流速:20ml/min;梯度:10min内30%b至70%b;254nm。提供呈白色固体的标题化合物(40mg,1%)。1h-nmr(300mhz,cd3od)δ1.35(d,6h),2.24(s,3h),2.47(s,3h),3.60(s,3h),4.51-4.68(m,3h),8.00(s,1h),8.17(s,1h)。m/z(es+)[m+h]+=408,hplctr=2.24min。实例4n-(5-{2-[(1s)-1-环丙基乙基]-1-氧代-7-氨磺酰基-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺在100ml圆底烧瓶中,将6-[2-(乙酰氨基)-4-甲基-1,3-噻唑-5-基]-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰氯(中间体4,2.0g,4.41mmol)和氨水(5.15g,44.06mmol)溶解在dcm(40ml)中,以给出黄色悬浮液。将反应混合物在室温下搅拌2小时。将粗产物通过具有以下条件的制备型hplc进行纯化:柱:xbridgec18,19*150mm,5um;流动相a:水/0.03%nh3。流动相b:acn;流速:20ml/min;梯度:10min内30%b至70%b;254nm。将包含所希望的化合物的级分蒸发至干燥,以得到呈黄色固体的标题化合物(0.89g,46%)。1h-nmr(400mhz,dmso-d6)δ0.21-0.31(m,1h),0.37-0.49(m,2h),0.60-0.63(m,1h),1.14-1.23(m,1h),1.33(d,3h),2.17(s,3h),2.43(s,3h),3.33-3.67(m,1h),4.75(s,2h),7.73(brs,2h),7.87(s,1h),7.98(s,1h),12.29(brs,1h)。m/z(es+),[m+h]+=435;酸,hplctr=1.356min实例5n-(5-{7-(乙酰氨基)-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺将n-{6-溴-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-基}乙酰胺(中间体46,110mg,0.33mmol)、n-(4-甲基噻唑-2-基)乙酰胺(56.1mg,0.36mmol)、cs2co3(213mg,0.65mmol)、三叔丁基四氟硼酸鏻(18.93mg,0.07mmol)和乙酸钯(ii)(7.32mg,0.03mmol)在dmf(2ml)中的混合物脱气,并在100℃下加热2小时。将反应冷却至室温并添加饱和的nahco3和etoac,随后分离该有机相。将该水相用etoac萃取。将合并的有机相通过相分离器筒过滤,并在真空中浓缩。将残余物通过sfc纯化,色谱条件:meoh/nh320mm。柱:phenomenexlunahilic5μ30x250mm,以给出标题化合物(40mg,30%)。1h-nmr(600mhz,dmso-d6)δ0.18-0.27(m,1h),0.33-0.46(m,2h),0.53-0.62(m,1h),1.07-1.18(m,1h),1.30(d,3h),2.15(s,3h),2.16(s,3h),2.39(s,3h),3.48-3.58(m,1h),4.59(s,2h),7.34(s,1h),8.43(s,1h),10.31(s,1h),12.18(s,1h)。m/z(es+),[m+h]+=413。实例6(方法e)n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺在25℃在氮气下历时30分钟,将在thf(2m,22ml,44mmol)中的甲胺滴加到在dcm(40ml)中的6-[2-(乙酰氨基)-4-甲基-1,3-噻唑-5-基]-2-[(1s)-1-环丙基乙基]-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰氯(中间体4,2g,4.41mmol)中。将所得混合物在25℃下搅拌12小时。在减压下除去该溶剂。将该粗产物通过快速二氧化硅色谱法(在石油醚中30%至50%etoac的洗脱梯度)纯化。将纯级分蒸发至干燥,以提供呈黄色固体的标题化合物(1.8g,91%)。1h-nmr(400mhz,dmso-d6)δ0.22-0.34(1h,m),0.44(2h,m),0.61(1h,m),1.17(1h,m),1.33(3h,d),2.18(3h,s),2.45(3h,s),2.53(2h,s),3.66(1h,dq),4.75(2h,s),5.67(1h,s),7.59(1h,q),7.88(1h,d),8.02(1h,d),12.31(1h,s)。m/z(es+),[m+h]+=449;酸,hplctr=0.867min。通过xrpd固体残余物被发现是结晶的并且典型衍射图展示在图2中。特征性峰位置列于以下表3和表4中。表3.实例6形式a的五个特征性峰表4.实例6形式a的十个特征性峰实例7(方法f)n-(5-{2-[(1s)-1-环丙基乙基]-7-(二甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺向100ml的圆底烧瓶中放入{2-[(1s)-1-环丙基乙基]-7-(二甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}硼酸(中间体41,300mg,0.85mmol)、n-(5-溴-4-甲基-1,3-噻唑-2-基)乙酰胺(134mg,0.57mmol)、k3po4(360mg,1.70mmol)、pd(dppf)cl2(50mg,0.07mmol)、1,4-二噁烷(5ml)、水(1ml)。在氮下,在110℃下,将所得溶液搅拌过夜。将粗产物用以下条件通过hplc纯化:柱:xbridgec18,19x150mm,5um;流动相a:水/0.05%fa,流动相b:mecn;流速:20ml/min;梯度:10min内30%b至70%b;254nm。提供呈白色固体的标题化合物(13mg,5%)。1h-nmr(300mhz,cd3od)δ0.30-0.80(m,4h),1.15-1.30(m,1h),1.41(d,3h),2.20(s,3h),2.50(s,3h),2.90(s,6h),3.60-3.81(m,1h),4.68-4.90(m,2h),7.96(s,1h),8.05(s,1h)。m/z(es+)[m+h]+=463,酸,hplctr=1.38min。实例8(方法g)n-(5-{2-[(1s)-1-环丙基乙基]-7-(甲基氨磺酰基)-1-氧代-2,3-二氢-1h-异吲哚-5-基}-1,3-噻唑-2-基)乙酰胺将n-(噻唑-2-基)乙酰胺(64mg,0.45mmol)、6-溴-2-[(1s)-1-环丙基乙基]-n-甲基-3-氧代-2,3-二氢-1h-异吲哚-4-磺酰胺(中间体37,130mg,0.35mmol)、cs2co3(227mg,0.70mmol)和三叔丁基四氟硼酸鏻(20mg,0.07mmol)和pdoac2(8mg,0.03mmol)添加至如下烧瓶中,该烧瓶用隔膜密封并置于真空下,并且然后用氮气冲洗。添加dmf并加热至110℃并搅拌18小时。将该反应混合物通过硅藻土过滤,用dcm洗涤硅藻土,并且收集滤液,并用水和nh4cl(水性)洗涤。将有机相分离并且将水相用dcm萃取。将合并的有机相干燥,过滤并浓缩。将残余物溶于dcm中,并添加100mgmp-tmt(安捷伦)pd清除剂(负载量0.6mmol/g),并将混合物搅拌过夜。将悬浮液通过相分离器过滤并浓缩。将粗产物用以下条件通过hplc纯化:梯度5%-95%mecn在0.2%nh3中,ph10。柱:沃特斯(waters)xbridgec185μodb30x150mm。1h-nmr(600mhz,dmso-d6)δ0.23-0.31(m,1h),0.37-0.49(m,2h),0.57-0.62(m,1h),1.13-1.20(m,1h),1.32(d,3h),2.20(s,3h),3.63(dq,1h),4.72(s,2h),7.60(q,1h),7.99(d,1h),8.15-8.16(m,2h),12.37(s,1h),遮蔽在溶剂下的1甲基共振。m/z(es+)[m+h]+=435,酸,hplctr=1.50min实例9(方法h)n-(5-{2-[(1s)-1-环丙基乙基]-7-[(甲基磺酰基)氨基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺将n-(5-{7-氯-2-[(1s)-1-环丙基乙基]-1-氧代-2,3-二氢-1h-异吲哚-5-基}-4-甲基-1,3-噻唑-2-基)乙酰胺(中间体2,2g,5,13mmol)、甲磺酰胺(1,464g,15,39mmol)、叔丁醇钠(1340ml,15,39mmol)、pdoac2(0.115g,0,51mmol)和二-叔丁基(2',4',6'-三异丙基-[1,1'-二苯基]-2-基)膦(0,479g,1,13mmol)在dmf(60ml)中混合。将该反应在140℃下加热7小时。冷却到室温后,将该混合物通过硅藻土垫过滤。将溶剂在减压下去除。将该粗产物通过快速二氧化硅色谱法(在dcm中的0%到25%etoac的洗脱梯度)进行纯化。将纯级分蒸发至干。将粗产物用以下条件通过制备型hplc纯化:柱:rpxbridgec18,19*150mm,5um;流动相a:水/0.05%tfa,流动相b:mecn;流速:25ml/min;梯度:8min内5%b至70%b;254nm。将包含所希望的化合物的级分蒸发至干燥,以得到呈黄色固体的标题化合物(1.2g,52%)。1h-nmr(600mhz,dmso-d6)δ0.21-0.27(m,1h),0.36-0.45(m,2h),0.55-0.61(m,1h),1.1-1.18(m,1h),1.30(d,3h),2.15(s,3h),2.40(s,3h),3.25(s,3h),3.5-3.56(m,1h),4.61(s,2h),7.37(s,1h),7.44(s,1h),9.56(s,1h),12.20(s,1h)。m/z(es+),[m+h]+=449;酸,hplctr=2.037min。通过xrpd固体残余物被发现是结晶的并且典型衍射图展示在图3中。特征性峰位置列于以下表5和表6中。表5.实例9形式a的五个特征性峰表6.实例2形式a的十个特征性峰实例10-37以下化合物使用上述的方法和中间体进行制备药理学活性测试a:重组人类pi3kγ的酶活性测定通过使用购自普洛麦格公司(promega)的市售adp-glotm试剂盒测量dic8-pip2磷酸化后的adp水平,测定重组人类pi3kγ(aa144-1102)-6his的活性。在室温下,在终体积为14μl的白色低容量384孔板中进行测定。测定条件包含如下各项:50mmtris缓冲液ph7.4,2.1mmdtt,3mmmgcl2,0.05%chaps,20μmatp,80μmdic8-pip2和1.2nmpi3kγ。在dmso中制成潜在的抑制剂,并且然后在测定中稀释,以给出不超过1%(v/v)dmso的终浓度。对抑制剂的10-点半稀释系列进行测试(最高浓度典型地0.1μm),并且在非线性曲线拟合途径中使用4参数逻辑斯谛方程来确定pic50。通常,将抑制剂与3μl的pi3kγ预温育15min,然后添加2μl底物混合物进行另外60min的酶反应。通过添加3μl的adp-glotm试剂(终止溶液),然后孵育40min来终止磷酸化。在检测之前,添加6μl的adp-glotm激酶检测试剂,并使用发光滤光片在微量板读数器中读取平板。获得的结果显示于以下表7中。表7当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1