使用聚二烯丙基二烷基铵盐分离腺相关病毒的方法与流程
本发明涉及使用絮凝剂从水性生物质选择性纯化腺相关病毒(aav)的方法。在一些实施方式中,絮凝剂是聚二烯丙基二烷基铵盐,例如,聚二烯丙基二甲基氯化铵(pdadmac)。
背景技术:
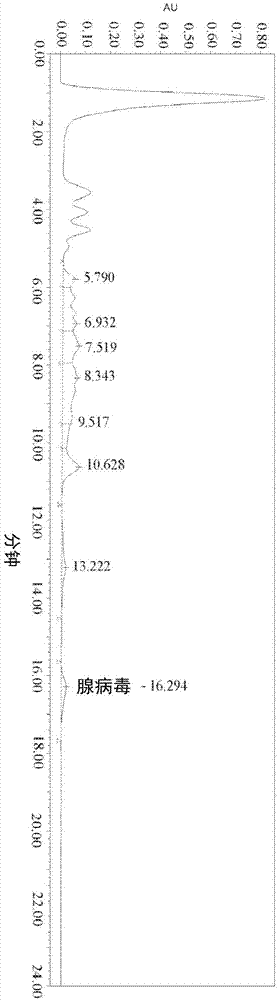
:腺相关病毒(aav)是一种在基因治疗中用作载体的辅助病毒依赖性细小病毒,因为它能够转导分裂和非分裂细胞,其免疫原性低,并且能够产生组织特异性广泛或狭窄的aav血清型。在使用重组腺相关病毒(raav)载体的许多成功的组织培养和小动物研究中,很少进入临床试验。临床前功效测试需要在实验室和大多数研究级载体核心设备中不易产生的载体量,在大型动物模型和毒理学研究中尤为如此。aav在临床研究中显示出稳定和有效的基因转移。对aav与日俱增的兴趣推动了改进用于临床供应的大规模载体生产的需求。产生aav基因治疗产物的最可放大方法之一是使用重组生产细胞系,其产生组装aav所需的必要遗传元件,例如复制酶和衣壳蛋白编码序列以及感兴趣的靶转基因。这些感兴趣的转基因和遗传元件已稳定转染到允许的宿主细胞系中。然而,为了触发aav的包装和释放,需要aav辅助病毒编码区域如e1、e2a和e4,要求用aav辅助病毒感染生产细胞系。尽管该过程非常稳健,并且产生超过80%的含有靶转基因的完整aav衣壳,但为了确保aav产品的安全性、纯度和质量,必须在随后的纯化步骤中完全清除aav辅助病毒。为了解决这一关键步骤,目前的工业标准依赖于单独或组合的热灭活、色谱、和病毒清除过滤器。技术实现要素:在一些实施方式中,本发明提供一种从含有腺相关病毒(aav)和至少一种aav辅助病毒的水性生物质纯化所述腺相关病毒的方法,所述方法包括:(a)使得所述生物质与聚二烯丙基二烷基铵盐接触以形成聚集物和澄清溶液,其中,所述聚集物包含所述至少一种aav辅助病毒,(b)从澄清溶液中去除所述聚集物;以及(c)从澄清溶液中进一步分离aav。在一些实施方式中,本发明还提供一种分离含靶转基因的腺相关病毒(aav)的方法,所述方法包括:(a)用aav和aav辅助病毒转染生产细胞以产生转染的生产细胞;(b)对所述转染的生产细胞进行培养;(c)使得所述转染的生产细胞裂解以产生水性生物质;(d)将聚二烯丙基二烷基铵盐引入所述生物质中以产生包含所述aav-辅助病毒的聚集物和包含aav的澄清溶液;以及(e)使所述澄清溶液与纯化柱接触以产生分离的aav。在一些实施方式中,本发明还提供一种分离含靶转基因的腺相关病毒(aav)的方法,所述方法包括:(a)用aav和aav辅助病毒转染生产细胞以产生转染的生产细胞;(b)对所述转染的生产细胞进行培养以产生水性生物质;(c)将聚二烯丙基二烷基铵盐引入所述生物质;以及(d)用纯化柱处理所述澄清溶液以产生分离的aav。附图说明图1:克拉利瑟(clarisolve)裂解物的分析型hplc色谱图:无pdadmac(对照):在约16分钟的预期保留时间检测到ad5峰。图2:克拉利瑟裂解物的分析型hplc色谱图(具有pdadmac),在约16分钟的预期保留时间没有检测到ad5病毒峰。图3:裂解物的分析型hplc色谱图:0.01%和0.025%的pdadmac的影响;对照样品在约16分钟预期保留时间检测到ad5峰,但用0.01%和0.025%的pdadmac处理的样品未检测到。图4:裂解物的分析型hplc色谱图:0.05%和0.1%的pdadmac的影响;对照样品在约16分钟预期保留时间检测到ad5峰,但用0.05%和0.1%的pdadmac处理的样品未检测到。具体实施方式本发明提供一种在含有腺相关病毒(aav)病毒和aav辅助病毒的水性生物质中从至少一种aav辅助病毒中纯化所述aav的方法。在一些实施方式中,本发明提供:使生物质与包含强阳离子性和活化的吸附基团的聚合物[例如聚二烯丙基二甲基氯化铵(pdadmac)]接触,以形成含有aav-辅助病毒的聚集体,并去除聚集体以形成澄清溶液。一旦去除聚集物,剩余的澄清溶液含有基本上不含辅助病毒的aav,然后可以使滤液进行色谱分离以进一步分离aav。含有强阳离子性和活化的吸附基团的各种聚合物可用作本发明的选择性絮凝剂。在一些实施方式中,聚合物是聚二烯丙基二烷基铵盐,例如,聚二烯丙基二烷基氟化铵、聚二烯丙基二烷基氯化铵、或聚二烯丙基二烷基溴化铵。在一些实施方式中,聚合物是聚二烯丙基二甲基铵盐、聚二烯丙基二乙基铵盐、或聚二烯丙基二丙基铵盐,例如,聚二烯丙基二甲基氯化铵、聚二烯丙基二甲基氟化铵、或聚二烯丙基二甲基溴化铵。在一些实施方式中,聚合物是聚二烯丙基二甲基氯化铵。聚二烯丙基二甲基氯化铵(pdadmac)是具有大分子量的水溶性聚阳离子性均聚物。聚合物主体含有强阳离子性和活化的吸附基团,其可使液体中的任何悬浮固体和带负电的水溶性物质不稳定并絮凝,同时使aav的絮凝最小化。虽然不囿于任何特定理论,但当以适当的浓度使用时,聚二烯丙基二烷基铵盐(例如pdadmac)通过离子相互作用原理(电中和和桥接吸附)将带负电的细胞和细胞碎片快速絮凝成更大的颗粒,从而实现高效简单的分离和去除。聚二烯丙基二烷基铵盐(例如pdadmac)之前已经在多个行业(如流出物处理、水处理和造纸行业)中显示出在使液体脱色、以及使无机和有机颗粒(如淤泥、粘土、藻类、细菌和病毒)有效凝聚和絮凝。然而,本发明首次证明了聚二烯丙基二烷基铵盐可选择性地絮凝其它aav辅助病毒,而基本上不絮凝aav,从而提供从aav辅助病毒中选择性纯化aav的方法。根据本发明可以使用各种浓度的聚二烯丙基二烷基铵盐。在一些实施方式中,生物质是细胞裂解物,并且以约0.01%至约0.5%或约0.025%至约0.1%(w/v)的浓度将聚二丙烯基二烷基铵盐(例如,pdadmac)添加到生物质中。在一些实施方式中,聚二丙烯基二烷基铵盐(例如,pdadmac)的浓度为0.025%、0.03%、0.035%、0.04%、0.05%、0.07%、0.08%、0.09%、0.1%、0.2%、0.3%、0.4%、或0.5%(w/v)。腺相关病毒(aav)包括依赖病毒属(dependoparvovirus)的小的、复制缺陷的、无包膜的病毒,其进而属于细小病毒科(parovoviridae)。在一些实施方式中,aav是重组aav(raav)。在本申请中,术语aav可以用raav替代(如何合适)。在一些实施方式中,raav包含转基因。aav依赖aav辅助病毒来繁殖。在一些实施方式中,aav是有活性的。术语“活性”是指aav在接种时形成效价的能力。自首次报道使用aav作为转导载体以来,aav生产已经进化,但基本要求仍保持不变。所有当前的aav生产方法都需要相对于载体基因组以反式起作用的一组共同因子。在一些实施方式中,这些组分由aav非结构蛋白、aav结构蛋白、一组辅助病毒基因产物和大分子合成所必需的细胞因子组成,包括用于载体基因组复制的dna聚合酶组分。aav基因组和载体基因组都是具有中断末端回文的线性单链dna,通常称为反向末端重复(itr)。itr是从双链形式拯救aavdna和随后的复制、包装以及可能用于稳定转导细胞中的vg所需的唯一顺式元件。aav辅助病毒提供了在哺乳动物细胞中生产性aav感染所需的其它反式作用因子。在一些实施方式中,aav辅助病毒选自:腺病毒、单纯疱疹病毒和杆状病毒。aav感染所必需的同一组腺病毒基因产物也是产生高效重组aav(raav)所必需的。提供aav辅助病毒的腺病毒基因可以提供e1a、e1b55k、e4orf6、e2a和varna。除了增强其他细胞基因的启动子激活外,e1a还在调节转录活化物/阻遏物蛋白yy1中具有明确作用。aav生产中可以使用各种细胞。例如,在一些实施方式中,aav可以在哺乳动物细胞中产生。在一些实施方式中,aav可以在昆虫细胞中产生。在一些实施方式中,aav可以在hela细胞中产生。在一些实施方式中,用于aav生产的细胞(即“生产细胞”)是hela细胞、人胚肾细胞(例如hek293)、和昆虫细胞(例如草地贪夜蛾(spodopterafrugiperda)(sf9)细胞)。在一些实施方式中,生产细胞是hek293细胞。在一些实施方式中,生产细胞是sf9细胞。在一些实施方式中,细胞可以是任意类型的哺乳动物细胞,包括cho、per.c6。在一些实施方式中,需要辅助病毒。在一些实施方式中,使用与编码必要的病毒蛋白和病毒基因组的质粒进行化学共转染的hek293细胞来产生aav。然而,缺乏细胞间传递使得aav生产限制在最初用质粒dna转染的细胞中,并且可能在子细胞中保留足够的拷贝数。因为质粒通常不能在哺乳动物细胞中复制,所以rep和cap基因的拷贝数没有几何级增加。类似地,在一些实施方式中,将腺病毒辅助基因作为非感染性质粒引入hek293细胞,辅助基因剂量在生产期间保持恒定。扩大的aav生产基本上需要以与上游生产方法兼容的方式来增加细胞数量。aav生产通常在贴壁细胞或悬浮培养物中进行。对于基于化学转染的方法,贴壁细胞通常在塑料细胞培养板或滚瓶中以单层生长。可用的表面积决定了细胞的最大数量,因此决定了所产生的aav的量。或者,悬浮培养物允许细胞基于体积而不是面积扩增。取决于任一形式的细胞密度,贴壁细胞数与悬浮细胞数的转化因子可以是约10–50cm2=1cm3。使用无机化合物(例如,磷酸钙)、或有机化合物(例如聚乙烯亚胺(pei))、或非化学品(例如,电穿孔)产生aav的转染方法已经使用贴壁细胞进行了广泛描述。然而,对于悬浮细胞,最常用的是使用磷酸钙或pei的转染。经常使用pei,大概是由于使用市售购得的单一试剂的可重复性和可靠性,而不是更复杂(和异质)的磷酸钙转染程序。在一些实施方式中,aav辅助病毒是杆状病毒表达载体,用于在草地贪夜蛾(sf9)细胞中产生aav。首先,重组杆状病毒引发生产性感染,随后子代杆状病毒可以二次感染培养物中的其它细胞。在每个细胞释放约100个感染性杆状病毒颗粒的情况下,根据初始感染复数,整个细胞培养群在一个或两个感染周期内被感染。在一些实施方式中,sf9宿主细胞比hek293细胞更有效地复制载体dna。此外,杆状病毒可以为昆虫细胞提供产生aav结构蛋白、病毒装配和转基因包装所需的序列。在一些实施方式中,sf9细胞产生的aav的物理、生物化学和生物学特征表明在sf9细胞中产生的aav与在hek293细胞中产生的aav相当。载体衍生的基因组的分析表明高效包装了高达4.7kb的线性单链dna。从广义上讲,从水性细胞培养物生物质中回收aav涉及:(i)从细胞中释放aav(如果需要),(ii)将aav与其他细胞碎片和培养基组分分离,以及(iii)对aav进行浓缩和纯化。aav衣壳具有回弹性和坚固性;因此,下游工艺可以利用原本避免的条件,例如长时间暴露于高温、重复的冷冻和解冻循环、酸性条件和暴露于有机溶剂。然而,在回收aav时,必须注意不要共同分离其它病毒,例如aav辅助病毒。下游处理的初始步骤部分地由细胞培养形式确定。贴壁细胞可以在原位裂解,或者从生长基质上分离,并通过冻融裂解、机械均质化或通过使用表面活性剂通过化学方式在小的一次性容器中进行裂解。大体积悬浮培养物可以用表面活性剂(如曲通x-100、吐温20)处理,或用机械装置均质化。可以在裂解后结合核酸酶处理,例如全能核酸酶(benzonase)处理,以减少dna污染物并有助于随后的过滤和色谱步骤。在一些实施方式中,当使用ad辅助病毒产生aav时,在细胞裂解后,通过加入聚二烯丙基二烷基铵盐(例如pdadmac)可以使裂解的细胞生物质絮凝。可以通过过滤(对于大体积来说方便)或离心来去除细胞组分的聚集物,基本将aav留在澄清的生物质溶液中。在一些实施方式中,使用具有逐渐减小的孔径的一系列过滤器以防止被细胞组分堵塞。在一些实施方式中,使用切向流过滤(tff)。在一些实施方式中,通过生物质絮凝形成的聚集物通过过滤去除,例如,使用克拉利瑟(clarisolve)过滤。通过过滤去除大部分絮凝剂(floccullent)和聚集物,并且可以在随后的色谱步骤中去除残留的絮凝剂。在一些实施方式中,病毒清除过滤器如viresolve与本发明的方法组合使用以分离aav。在一些实施方式中,可以使用分析技术(如,hplc、pcr和/或生物测定)以验证澄清生物质裂解物基本不含aav辅助病毒。可以使用其它实验(例如,质谱)以确定絮凝剂的去除。在去除聚集物后,可以使用本领域熟知的技术(例如色谱纯化)进一步分离、浓缩和/或纯化剩余生物质(例如,澄清溶液)中的aav。通过离子交换色谱法(阳离子和阴离子交换介质),可以从澄清的细胞裂解物中回收衣壳。已知用重组单链抗体产生的免疫亲和色谱介质结合多种aav衣壳血清型,包括aav1、aav2、aav6和aav8。抗体可以高特异性和亲和性结合衣壳。包括但不限于尺寸排阻、iex、或其他色谱法的“抛光”步骤产生接近均质的最终aav产物。在tff浓缩和无菌过滤之后,通过这些方法产生的aav可以用于临床前研究,以及用于临床研究中符合cgmp的实践。在一些实施方式中,聚乙二醇可以用于使得aav从澄清溶液中沉淀。在低速离心后,可以将含有aav的沉淀重新悬浮在缓冲液中并进一步浓缩,并且通过密度梯度离心纯化,例如,氯化铯等密度梯度或碘克沙醇不连续梯度。在一些实施方式中,使用具有逐渐减小的孔径的一系列过滤器以防止堵塞,并提高aav的回收。切向流过滤(tff)是用于浓缩aav的常规技术,并且也能够进行缓冲液交换。在一些实施方式中,本发明涉及一种分离含靶转基因的腺相关病毒(aav)的方法,所述方法包括:(a)为aav生产细胞提供所需的dna元件(如aav结构/复制元件、转基因和aav辅助病毒),以产生生产细胞;(b)对所述转染的生产细胞进行培养;(c)使得所述转染的生产细胞裂解以产生水性生物质;(d)将聚二烯丙基二烷基铵盐引入所述生物质中以产生包含所述aav-辅助病毒的聚集物和包含aav的澄清溶液;以及(e)用纯化柱处理所述澄清溶液以产生分离的aav。在一些实施方式中,本发明涉及一种分离含靶转基因的腺相关病毒(aav)的方法,所述方法包括:(a)用aav和aav辅助病毒转染生产细胞以产生转染的生产细胞;(b)对所述转染的生产细胞进行培养以产生水性生物质;(c)对所述转染的生产细胞进行裂解以产生细胞裂解物,其中,细胞裂解物形成了包含aav辅助病毒的聚集物和包含aav的澄清溶液;(d)将聚二烯丙基二烷基铵盐引入所述生物质;以及(e)使所述澄清溶液与纯化柱接触以产生分离的aav。通过下文实施例进一步描述本发明。提供这些实施例是为了帮助理解本发明,而不应解释为对本发明的限制。实施例下文中,通过实施例详细地描述本发明。然而,提供以下实施例用于更具体地描述本发明,而且不应解释为对本发明范围的限制。实施例1实施例1从包含含有aav、aav-辅助病毒(ad5)和细胞组分的细胞裂解物的水性生物质中分离纯化的aav描述如下。为了避免多个操作步骤和使产物损失最小化,使用pdadmac使生产反应器细胞培养物悬浮液受控絮凝用于优化收获/上游过程以及增强下游色谱。用0.025%的pdadmac(emd密理博公司(emdmillipore),目录号137069.0100)处理含有aav和ad5病毒的细胞裂解物。然后使用克拉利瑟(clarisolve)60过滤器来过滤细胞裂解物。图2显示出向细胞裂解物中加入pdadmac导致hpcl显著降低ad5效价,即,与对照物相比,pdadmac处理的澄清溶液中没有可检测的ad5(图1和2)。表1:过滤测试的数据总结这些数据显示pdadmac从需要ad5病毒清除的细胞裂解物中有效去除了ad5辅助病毒,例如,在使用生产细胞系产生aav中。实施例2为了进一步证明在辅助病毒存在下在aav回收过程中使用pdadmac(对效价没有负面影响)的可行性,通过掺有已知量的aav来测试含有和不含pdadmac的含ad5的细胞裂解物。来自各种条件的细胞裂解物通过离心进行澄清,随后无菌过滤,然后针对ad5(qpcr和hplc)和aav(qpcr)进行测试。数据显示出aav效价没有受到0.01至0.1%浓度的pdadmac影响。对于ad5,虽然hplc结果表明没有可检测的ad5,但该实验不如qpcr敏感。qpcr结果显示出ad5效价降低,约低2-3个对数。此外,基于所用pdadmac的量,在ad5降低中也观察到差异。hplc和qpcr结果均显示出与0.05%和0.1%的pdadmac相比,在0.01%和0.025%的pdadmac下ad5清除率更高。结果总结在表2中。表2:显示在细胞裂解澄清后用pdadmac处理的生产细胞培养物中的aav和ad5效价的数据实施例3为了确认pdadmac通常不影响aav病毒并且可以用于从其他过程收获aav,对使用基于杆状病毒的系统所产生的aav测试絮凝过程。在该情况下,在昆虫细胞中产生aav,并将pdadmac以0、0.025%、0.050%和0.1%加入培养物裂解物中。各样品中的aav通过qpcr进行分析(表3)。如所预期的,在对照样品和使用pdadmac收获的样品之间未观察到aav效价的差异。表3:当使用基于杆状病毒的aav生产时pdadmac对aavqpcr效价的影响实施例4还在具有重组杆状病毒(rbv)的杆状病毒系统中测试了pdadmac。测试了含0、0.025%和0.1%pdadmac的培养裂解物。使用感染效价测定法(bacpak)在用pdadmac处理和未经处理(使用标准过滤器收获——对照)的样品中测试各样品中的重组杆状病毒(rbv),结果总结于表4中。在该实验中获得的数据显示出与标准过程相比,当pdadmac用于收获时rbv感染效价不受影响。表4:pdadmac对杆状病毒效价的影响测试样品絮凝剂浓度(pdadmac)bacpak效价(ifu/ml)对照无7.73e7试验10.025%6.32e7试验20.1%7.77e7总之,看来使用pdadmac作为絮凝剂能够安全地去除生产细胞系过程中使用的ad5辅助病毒(至低于hplc的lod)而不影响目标aav效价(表3)。类似地,在基于rbv系统中产生的aab效价也没有受到使用pdadmac絮凝剂影响(表4)。结论本文描述的所有各种实施方式或选项可以在任何和所有变型中组合。虽然参照一些实施方式对本发明进行了具体展示和描述,但本领域技术人员应理解,其仅以示例的方式呈现,而不是限制,可在形式和细节上做出各种改变而不偏离所附权利要求书所包含的本发明范围。因此,本发明的宽度和范围不应受限于任何上述示例性实施方式,而应仅根据所附权利要求书及其等同项来定义。本文应用的所有参考文献,包括杂志文章或摘要、已经公布的或相应的美国或国外专利申请、已经颁发或国外的专利、或任何其他参考文献,都通过引用全文纳入本文,包括所引用参考文献中的所有数据、表格、附图和文本。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1