用于从水溶液去除去垢剂的组合物、系统和方法与流程
本申请要求于2016年5月31日提交的美国专利申请序列号62/343,293的优先权,其全部内容通过引用并入本文。
本申请涉及用于从水溶液中去除去垢剂的组合物、系统、方法和试剂盒。本申请的组合物、系统、方法和试剂盒也可用于从水溶液中去除与去垢剂相关的和/或去垢剂结合的分子。
发明背景
十二烷基硫酸钠(sds)是一种阴离子去垢剂,用于许多清洁和个人卫生用品。它也常用于分子生物学应用,例如sds-page(sds-聚丙烯酰胺凝胶电泳),用于研究蛋白质、核酸纯化程序以及核酸稳定化组合物。
当使用寻求核酸释放的生物样品时,在裂解缓冲液中利用由于其两亲性质而溶解细胞膜和颗粒膜的能力。另外,sds与蛋白质紧密结合并用于在提取过程中破坏蛋白质-核酸相互作用。例如,sds破坏了带正电荷的组蛋白与核酸主链中带负电荷的磷酸盐之间的离子相互作用,从而有助于将核酸与蛋白质分离。许多用于纯化脱氧核糖核酸(dna)的常用实验室方案利用sds,例如dna的常规乙醇沉淀(sambrook,molecularcloning:alaboratorymanual(第三版)),氯化锂沉淀(sambrook,molecularcloning:alaboratorymanual(第三版))或用于获得质粒dna的sds-碱性变性方法(birnboim,hc(1983)arapidalkalineextractionmethodfortheisolationofplasmiddna,methodsenzymol.100,243-55)。
sds通过与蛋白质紧密结合并破坏其结构而使蛋白质变性的能力导致大多数酶(包括核酸酶)的失活。如birnboim等人在us7482116、us2010099149和us2009123976中所教导的,该性质被用于稳定和保存生物样品中的核酸的目的。然而,如果没有彻底去除sds,这种性质在使用核酸的后续应用中具有抑制酶依赖性反应的不希望的效果。
sds的能力和特征对于那些实践生物化学和分子生物学的人来说是众所周知的。大多数提取和纯化核酸的方法是通过从溶液中去除核酸,留下抑制剂和杂质来实现的。例如,向水溶液中加入1至2体积的乙醇导致核酸沉淀,在离心步骤后可以从沉淀中回收它们。或者,核酸可以与固体基质结合,例如二氧化硅颗粒,随后可以从中洗脱它们。得到的纯化核酸可用于下游应用,例如聚合酶链式反应(pcr)、逆转录酶-pcr(rt-pcr)、测序文库制备或测序。
在过去的50或60年中已经进行了许多尝试来简化和改进核酸的提取和纯化方法。通常,这些方法中使用的试剂会抑制利用纯化的核酸的下游应用。因此,必须完全去除在加工过程中添加到初始样品中的试剂。例如,低浓度的sds对pcr反应中使用的taqdna聚合酶具有抑制作用。如weyant等1990、rossen等1992、saunders等1999所报道的,最终pcr中仅0.01%w/v的sds就是抑制性的。这已在下面得到确认。市场上存在几种从样品中去除sds的产品(例如,sdsawaytm[proteabiosciences];detergent-outtm[millipore];sds-outtm[piercebiotechnologyinc.]为三个例子),但这些产品经过优化和配制以去除与蛋白质紧密结合的sds而不是核酸溶液中存在的sds。
目前有3种主要类别的市售核酸纯化试剂盒:(i)基于酚的提取方法(例如,trizoltm[invitrogen]和trireagenttm[molecularresearchcenter,inc.]),(ii)核酸与固体基质基于胍基的结合(例如,在磁珠和柱上的二氧化硅表面)和(iii)基于sds的方法。一些基于sds的化学物质与基于胍盐的化学物质不相容,因为混合两种试剂导致sds沉淀为不溶的胍盐。已经观察到在苯酚/氯仿提取过程中存在sds会导致形成乳状沉淀物。然而,已经观察到,只要sds事先基本上被事先去除,含sds的样品可以在基于苯酚/氯仿或基于胍的化学物质中就能够进行加工。降低sds浓度的一个简单方法是将样品稀释到sds不再沉淀的水平,但这将导致需要在稍后的步骤中需要浓缩样品。从含水样品中简单快速地去除sds是生物化学和分子生物学领域中仍未满足的需求。
因此,仍然需要一种组合物和方法,当在含有阴离子去垢剂的任何水溶液上使用时,可以容易、快速和高效的方式将去垢剂有效地去除至几乎不可检测的水平(小于0.01%w/v)。
提供该背景信息是为了使申请人相信能够与本发明可能相关的已知信息。不允许也不应解释为任何前述信息构成对抗本发明的现有技术。
技术实现要素:
本申请的目的是提供用于从水溶液中去除去垢剂的组合物、系统、方法和试剂盒。组合物、系统、方法和试剂盒也可用于从水溶液中去除与去垢剂相关的或去垢剂结合的分子,包括蛋白质。
根据一个方面,提供了一种去垢剂去除系统,包括:(a)盐;(b)与水不混溶的式i的醇
r1–oh(式i)
其中r1是任选取代的、直链、支链或环状的c4-c12烷基;和(c)与水不混溶的卤代烃,其中该卤代烃可与醇混溶。任选地,该盐是季铵盐或碱金属盐。在某些实施方案中,该去垢剂是阴离子去垢剂。在某些实施方案中,该系统还可用于去除可能存在于水溶液中的与去垢剂相关的和/或去垢剂结合的分子。
根据另一方面,提供了一种从包含前述去垢剂的水溶液中去除去垢剂的方法,该方法包括将水溶液与以下物质混合的步骤:盐;与水不混溶的式i的醇
r1–oh(式i)
其中r1是任选取代的、直链、支链或环状的c4-c12烷基;与水不混溶的卤代烃,其中该卤代烃可与醇混溶以形成两相混合物,其中基本上所有的去垢剂都在非水相中。在某些实施方案中,去垢剂是阴离子去垢剂。在某些实施方案中,该方法还可用于去除可能存在于水溶液中的与去垢剂相关的和/或去垢剂结合的分子。
根据另一方面,提供了一种双相组合物,其形成来自于混合:盐;与水不混溶的式i的醇
r1–oh(式i)
其中r1是任选取代的、直链、支链或环状的c4-c12烷基;和与水不混溶的卤代烃;和含有去垢剂的水溶液,其中基本上所有的去垢剂都在非水相中。在某些实施方案中,去垢剂是阴离子去垢剂。在某些实施方案中,双相组合物的非水相还可包含与去垢剂相关的和/或去垢剂结合的分子。
根据另一方面,提供了一种用于从包含前述去垢剂的水溶液中去除去垢剂的试剂盒,该试剂盒包含:盐;与水不混溶的式i的醇
r1–oh(式i)
其中r1是任选取代的、直链、支链或环状的c4-c12烷基;与水不混溶的卤代烃,其中所述卤代烃可与所述式i的醇混溶;至少一个试剂容器;以及可选的使用说明。在某些实施方案中,去垢剂是阴离子去垢剂。在某些实施方案中,试剂盒还可用于从可能存在的水溶液中去除与去垢剂相关的和/或去垢剂结合的分子。
因此,本发明的组合物、系统、方法和试剂盒可以理想地用于从水溶液中去除抑制剂,即抑制反应的抑制剂,该反应例如下游应用,包括但不限于pcr(包括rt-pcr)、文库制备和核苷酸测序。例如,抑制剂可包括酶抑制剂,如后续应用中酶依赖性反应的抑制剂。
在某些实施方案中,至少一部分水相(即,基本上不含去垢剂和去垢剂相关的或去垢剂结合的分子的相,如果存在的话)可以直接用于下游应用,包括但不限于,pcr(包括rt-pcr)、文库制备和核苷酸测序。
附图说明
为了更好地理解本发明以及其它方面和其进一步的特征,结合附图参考以下描述,其中:
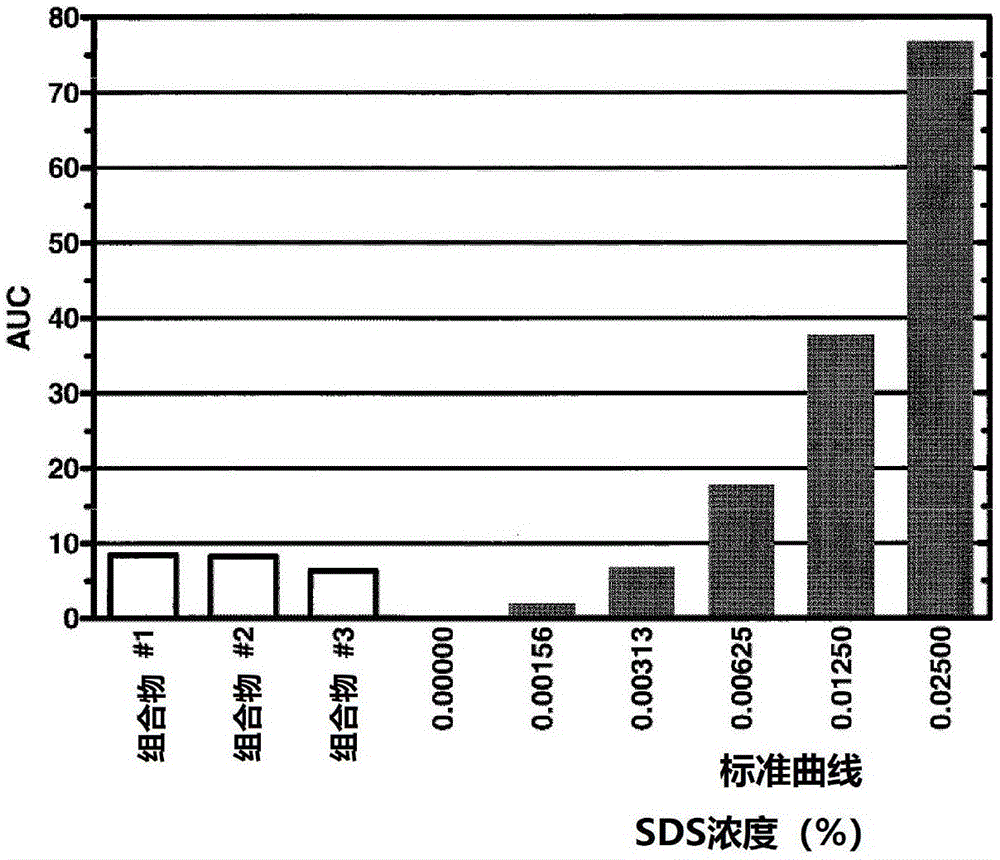
图1描述了用去垢剂去除组合物处理1%sds的水溶液;组合物1包含1-戊醇和溴二氯甲烷(bdcm)的1:1混合物以及150mm氯化铵(nh4cl);组合物2包含1-戊醇和氯仿的1:1混合物以及150mmnh4cl;组合物3包含1-戊醇和2-碘丙烷的1:1混合物以及150mmnh4cl;
图2描述了用去垢剂去除组合物处理4%sds的水溶液;所研究的所有组合物包含1-戊醇和bdcm的1:1混合物与下列盐:组合物4:175mm的nh4cl;组合物5:200mm的nh4cl;组合物6:125mm的甲基三正丁基氯化铵;组合物7:150mm的甲基三正丁基氯化铵;组合物8:150mm的三乙胺盐酸盐;组合物9:175mm的三乙胺盐酸盐;组合物10:175mm的乙酸四正丁基铵;组合物11:200mm的四正丙基氯化铵;
图3描述了用去垢剂去除组合物处理10%sds的水溶液;所研究的所有组合物包含1-戊醇和bdcm的1:1混合物以及以下具有不同浓度的nh4cl:组合物12:275mm;组合物13:300mm;和组合物14:325mm,并且所得数据表明,即使在10%的起始浓度下,sds也可以在1/5体积的组合物的一步中降低至<0.00625%;
图4描述了将收集的唾液样品在含有2%的sds和去垢剂去除组合物的水溶液中的处理;所用组合物包含1-戊醇和bdcm的1:1混合物与125mm的氯化铵,证明即使在该生物样品存在下也能有效去除sds;
图5描述了将收集的血液样品在含有2.5%sds和去垢剂去除组合物的水溶液中的处理。所用组合物包含1-戊醇和bdcm的1:1混合物与175mm的氯化铵,结果显示即使在该复杂生物样品存在下也能有效去除sds;
图6描述了对已知sds浓度的水溶液进行qpcr的结果:测试并比较不含sds的对照,和0.001%sds、0.005%sds、0.01%sds、0.05%sds、0.1%sds和1%sds的溶液,结果表明在0.005%sds存在下发生qpcr的部分抑制,当sds存在0.01%时发生qpcr的完全抑制;
图7是在将收集至去垢剂溶液并用本文所描述的去垢剂去除组合物处理后的唾液样品中等分试样水相的电泳后用sybrgoldtm(invitrogen)染色的琼脂糖凝胶的照片。在1kb+dna梯旁边的样品泳道中可以看到高分子量dna,表明去垢剂去除组合物不会引起dna降解;
图8显示了对来自唾液样品的等分试样水相的qpcr结果,所述唾液样品被收集至去垢剂溶液中并用去垢剂去除组合物以及已知量的dna的两个标准对照物处理;结果表明去垢剂去除处理后残留在水相中的dna适用于qpcr;
图9是在将收集至去垢剂溶液中并用去垢剂去除组合物处理的血液样品中等分的水相电泳后用sybrgoldtm(invitrogen)染色的琼脂糖凝胶的照片。在1kb+dna梯旁边的样品泳道中可以看到高分子量dna,表明去垢剂去除组合物不会引起dna降解;
图10显示了对来自收集到去垢剂溶液中并用去垢剂去除组合物处理的血液样品的两个不同大小的水相等分试样以及来自含有已知量dna的对照的等分试样进行的qpcr结果,结果表明,去垢剂去除处理后残留在水相中的dna适用于qpcr;
图11是用收集至去垢剂溶液中并用去垢剂去除组合物处理的唾液样品等分试样的水相电泳后用sybrgoldtm(invitrogen)染色的琼脂糖凝胶的照片。可以在凝胶上看到源自唾液中细菌细胞的细菌16s和23s核糖体rna条带,这表明细菌rna没有被去垢剂去除处理降解;
图12显示了从收集至去垢剂溶液中并用去垢剂去除组合物处理的唾液样品中取出的1μl等分试样的水相制备的逆转录酶产物的qpcr结果。
图13显示了从收集至去垢剂溶液中并用去垢剂去除组合物处理的唾液样品中取出的3μl等分试样的水相制备的逆转录酶产物的qpcr结果。
图14是从收集至去垢剂溶液中并用去垢剂去除组合物处理的血液样品中等分的水相电泳后用sybrgoldtm(invitrogen)染色的琼脂糖凝胶的照片。可以看到人18s和28s核糖体rna条带,表明人类rna没有降解;
图15显示了从收集至去垢剂溶液中并用去垢剂去除组合物处理的1μl等分试样的血液样品水相制备的逆转录酶产物的qpcr结果;
图16是用考马斯蓝染色的聚丙烯酰胺凝胶照片,显示sds-page后的蛋白质条带。移除收集至标准edta管中的相同血液样品的等分试样并用本文所述的去垢剂去除组合物的各种组分处理:泳道1含有蛋白质分子量标记。泳道2是空的。泳道3含有在去除去垢剂之前的0.5μl裂解的血液样品。泳道4是空的。泳道5含有在去除去垢剂之前的1μl裂解的血液样品。泳道6是空的。泳道7含有7.5μl在仅用bdcm处理裂解的血液样品后的水相。泳道8是空的。泳道9含有7.5μl在用1-戊醇:bdcm为3:7(体积/体积)的混合物处理裂解的血液样品后的水相。泳道10含有7.5μl在用1-戊醇:bdcm为1:1(体积/体积)的混合物处理裂解的血液样品后的水相。泳道11含有7.5μl在用1-戊醇:bdcm为7:3(体积/体积)的混合物处理裂解的血液样品后的水相。泳道12含有7.5μl在仅用1-戊醇处理裂解的血液样品后的水相。
图17描述了收集至含有2%十二烷基肌氨酸钠(sarkosyl)和去垢剂组合物的水溶液中的唾液样品的处理;所用的去垢剂组合物包含1-戊醇和(聚)三氟氯乙烯的1:0.8的混合物与200mm氯化铵,结果表明即使在该生物样品存在下也能有效地去除十二烷基肌氨酸钠。
图18描述了来自供体a(图18a)和供体b(图18b)的stat-和prepit-l2p-处理的唾液样品的生物分析仪凝胶图像。
图19描述了由2个供体的唾液样品构建的文库制备物的bioanalyzer凝胶轨迹。图19a描述了由用oragene/prepit·l2p纯化的供体a的唾液样品构建的文库制备物的轨迹;图19b描述了由用oragene/stat处理的供体a的唾液样品构建的文库制备物的轨迹;图19c描述了由用oragene/prepit·l2p纯化的供体b的唾液样品构建的文库制备物的轨迹;图19d描述了由用oragene/stat处理的供体b的唾液样品构建的文库制备物的生物分析仪凝胶轨迹。
具体实施方式
除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。
如说明书和权利要求书中所使用的,单数形式“一”,“一个”和“该”包括复数指代,除非上下文另有明确说明。
这里使用的术语“包括”将被理解为表示以下列出的是非穷举的并且可以包括或不包括任何其他附加的合适的项目,例如一个或多个其他特征,组件和/或或适当的成分。
本申请提供了用于从水溶液中去除去垢剂(例如阴离子去垢剂或阴离子表面活性剂)的系统、方法、组合物和试剂盒。该系统、方法、组合物和试剂盒也可用于从水溶液中去除去垢剂相关的和/或去垢剂结合的分子(如果存在的话)。本系统和方法通过将去垢剂和去垢剂相关的/去垢剂结合的分子(例如蛋白质)隔离到有机层中,有效地去除去垢剂和任何存在的去垢剂相关的/去垢剂结合的分子至几乎不可检测的水平。将水溶液与组合物混合的结果是两相混合物,其包含基本上不含去垢剂和可能存在的任何与去垢剂相关的/去垢剂结合的分子的上部水相,以及包含去垢剂和可能存在的任何与去垢剂相关的/去垢剂结合的分子的密度更高的下层有机相。去垢剂去除组合物由以下组分组成:1)盐;2)与水不混溶的醇;3)卤代烃。
如本文所用,去垢剂去除组合物、去垢剂去除系统、去垢剂去除方法和去垢剂去除试剂盒是指用于从水溶液中去除去垢剂和去垢剂相关和/或去垢剂结合的分子(如果存在的话)的组合物、系统、方法和试剂盒。在某些实施方案中,去垢剂是阴离子去垢剂。
如本领域技术人员所理解的,当本文将去垢剂和去垢剂相关的/去垢剂结合的分子描述为从水溶液中“去除”时,可能仍有某些低浓度的去垢剂或去垢剂相关的/去垢剂结合的分子保留在水溶液中。然而,为了被认为是“去除”,水溶液中的去垢剂和去垢剂相关/去垢剂结合的分子浓度将降至低于基于水溶液的最终应用选择的去垢剂浓度阈值。在一个实施方案中,在使用本系统、组合物、方法和试剂盒“去除”去垢剂(和去垢剂相关/去垢剂结合的分子,如果存在的话)之后,在水溶液中去垢剂(和去垢剂相关/去垢剂结合的分子,如果存在的话)的浓度则低于使用实施例1中描述的stains-all测定法可检测的浓度。
在某些实施方案中,如本文所用的“去垢剂”包括但不限于例如阴离子去垢剂。可使用本发明的去垢剂去除系统、方法、组合物和试剂盒从水溶液中去除的阴离子去垢剂的非限制性的实例是十二烷基硫酸钠(sds)和十二烷基肌氨酸钠(sarkosyl)。
去垢剂去除组合物和系统
如上所述,本文所述的去垢剂去除组合物和体系含有至少三种组分:盐;水不混溶的醇;和卤代烃。这些组分可以单独保持,直到它们与水溶液混合以去除去垢剂,或者它们可以在用于从水溶液中去除去垢剂(和去垢剂相关的/去垢剂结合的分子,如果存在的话)之前组合并作为所有三种组分或三种组分中的任何两种的混合物一起储存。因此,本去垢剂去除系统可进一步包括一个或多个容器,用于在使用前储存盐,水不混溶的醇,和卤代烃组分。
因此,本发明的组合物和体系可理想地用于从水溶液中去除抑制剂,即抑制反应的抑制剂,该反应为例如下游应用,包括但不限于pcr(包括rt-pcr)、文库制备和核苷酸测序。抑制剂可包括例如酶抑制剂,即后续应用中酶依赖性反应的抑制剂。
在某些实施方案中,至少一部分水相(即,基本上不含去垢剂和与去垢剂相关的或去垢剂结合的分子(如果存在的话)的相)可以直接用于下游应用,包括但不限于,pcr(包括rt-pcr)、文库制备和核苷酸测序。
盐组分
可用于本系统、组合物和方法的盐是季铵盐或碱金属盐。可用于本系统、组合物和方法的盐的具体实例包括但不限于乙酸铵、氯化铵、硫酸铵、甜菜碱盐、氯化胆碱、二乙胺盐酸盐、二甲基乙醇胺、乙醇胺、乙基氯化铵、甲基氯化铵、四正丁基乙酸铵、一水合四乙基氯化铵、四甲基氯化铵、四正丙基氯化铵、甲基三正丁基氯化铵、三乙胺盐酸盐、三乙基甲基氯化铵、三甲胺盐酸盐、1-丁胺的酸式盐、1-戊胺的酸式盐、1-己胺的酸式盐、1-十二烷基胺的酸式盐、氯化锂;氯化钠、氯化钾或其组合。
醇组分
当包含去垢剂的水溶液与本发明的去垢剂去除组合物混合时,本系统和方法利用去垢剂(例如阴离子去垢剂)的溶解度性质的变化。为了促进两相混合物的形成,醇组分必须是在水中不混溶的或仅略微混溶的。与水不混溶的醇具有式i的结构
r1–oh(式i)
其中r1是任选取代的、直链、支链或环状的c4-c12烷基。
可用于本系统、方法和组合物以去除去垢剂的与水不混溶的醇的实例包括但不限于1-丁醇、3-甲基-1-丁醇、2-丁醇、1-庚醇、1,2-己二醇、1-己醇、2-壬醇、1-戊醇、4-甲基-2-戊醇、环戊醇、1-丙醇、1-十一烷醇或其组合。
卤代烃组分
卤代烃组分的一个功能是增加在将水溶液与本发明的去垢剂去除组合物混合时形成的两相混合物中的有机相的密度,使得有机相是底相,水相是上层相。此外,为了确保两相的良好分离,卤代烃必须是与水不混溶或仅轻微混溶的并且必须与醇组分混溶的。
可用于本发明系统、方法和组合物以去除去垢剂的卤代烃的实例包括但不限于1-溴-3-氯丙烷、1-溴-6-氯己烷、溴二氯甲烷(bdcm)、氯二溴甲烷、氯仿、2-碘丙烷、聚(三氟氯乙烯)(-(cf2cfcl)n-,n=2to10;特别是从halocarbonproductscorporation,riveredge,nj获得的卤代烃油6.3(halocarbonoil6.3)),或其组合。全氟壬烷是在本发明的去垢剂去除组合物中不能很好地起作用的卤代烃的实例。不希望受理论束缚,这可能是因为全氟壬烷与醇组分不混溶。
可选组分
本发明的系统和组合物可任选地含有其它组分,这取决于例如含有待去除的去垢剂的水溶液的性质,或去除去垢剂(和去除去垢剂相关的或去垢剂结合分子,如果存在)后的水溶液的最终应用。
在一个实施方案中,去垢剂去除系统另外包含玻璃珠,其可用于改善和/或加速水性样品中存在的细胞的裂解或改善包含去垢剂的水溶液与盐,醇和卤代烃组分的混合。不受理论的限制,据信当原始样品(例如唾液)与sds和本发明的组合物同时剧烈混合时,玻璃珠有助于使样品均质化,裂解细胞并使sds与蛋白质结合的dna接触。然后sds从dna中剥除蛋白质,组合物将sds和与sds相关/sds结合的分子分离到有机相中。
在另一个实施方案中,去垢剂去除系统另外包含还原剂。在与本发明的去垢剂去除组合物混合之前,还原剂也可以存在于或加入到含有待去除的去垢剂的水溶液中。这种还原剂可以是例如二硫苏糖醇(dtt)、巯基己醇、巯基十一烷醇、二巯基丙醇或巯基丁醇。
在又一个实施方案中,去垢剂去除系统另外包含螯合剂和/或缓冲剂。在与本发明的去垢剂去除组合物混合之前,螯合剂和/或缓冲剂也可以存在于或加入到含有待去除的去垢剂的水溶液中。这种螯合剂可以是,例如,乙二醇四乙酸(egta)、(2-羟乙基)乙二胺三乙酸(hedta)、二亚乙基三胺五乙酸(dtpa)、次氮基三乙酸(nta)、乙二胺三乙酸(edta)、环己烷二胺四乙酸(cdta)、无水柠檬酸盐、柠檬酸钠、柠檬酸钙、柠檬酸铵、二柠檬酸铵、柠檬酸、柠檬酸二铵、柠檬酸铁铵、柠檬酸锂或其任意组合。可以使用任何合适且本领域技术人员公知的缓冲液。
在另一个实施方案中,去垢剂去除系统另外包含亲脂性染色剂,例如尼罗红。尼罗红染色细胞内脂质、细胞膜和疏水蛋白表面。当与生物样品和本发明组合物混合时,着色剂专有地分配到下部有机相,使上部水相澄清无色。这种亲脂性染色剂可以是例如根据权利要求35所述的系统,其中所述亲脂性染色剂是尼罗红、9-蒽基重氮甲烷、荧光黄088、n,n,n-三甲基-4-(6-苯基-1,3,5-己三烯-1-基)苯基铵对甲苯磺酸盐(tma-dph)、3,3’-二-十八烷基氧代羰花青高氯酸盐、1,6-二苯基-1,3,5-己三烯、苏丹iii、苏丹橙g、尼罗蓝氯化物或溶剂蓝37。
去除去垢剂的方法
本申请提供了从水溶液中去除去垢剂的方法。在某些实施方案中,去垢剂是阴离子去垢剂。在某些实施方案中,阴离子去垢剂是sds或十二烷基肌氨酸钠。本方法还可用于去除可能存在于水溶液中的与去垢剂相关的或去垢剂结合的分子。因此,本方法可理想地用于从水溶液中去除抑制剂,即抑制反应的抑制剂,该反应例如下游应用,包括但不限于pcr(包括rt-pcr)、文库制备和核苷酸测序。例如,抑制剂可包括酶抑制剂,例如后续应用中酶依赖性反应的抑制剂。
简单地说,该方法包括将包含待去除的去垢剂的水溶液与盐、与水不混溶的醇和卤代烃混合。三种组分可以在一步或多步中与水溶液混合。添加顺序并不重要;相反,重要的是去垢剂去除组合物的组分与水溶液充分混合。该混合步骤可包括机械搅拌,例如涡旋,以改善或促进混合。
水溶液可以是含有待去除的去垢剂的任何水溶液。在某些实施方案中,去垢剂是阴离子去垢剂。在某些实施方案中,去垢剂是sds或十二烷基肌氨酸钠。水溶液还可含有去垢剂相关的和/或去垢剂结合的分子。这种溶液可以是,例如,生物样品,如唾液、痰、口腔拭子、血清、血浆、血液、咽、鼻/鼻咽或鼻窦拭子或分泌物、喉拭子或刮屑、漱口水样品、尿液、粘液、粪便、食糜、呕吐物、胃液、胰液、精液/精子、脑脊髓液、哺乳期或月经产物、蛋黄、羊水、房水、玻璃体液、宫颈分泌物或拭子、阴道液/分泌物/拭子或刮屑、骨髓抽吸物、胸膜液、汗液、脓液、泪液、淋巴液、支气管、气管或肺灌洗液或抽吸物、细胞培养物、细胞悬液、结缔组织、上皮、粘膜、肌肉组织、胎盘组织、器官组织、神经组织、头发、皮肤、指甲、植物、植物提取物、藻类、微生物、土壤样品、污水、废水、食品等。
当样品包括细胞或组织时,确保与去垢剂去除组合物的良好混合是有益的,以便最大程度地去除去垢剂。在一个实施方案中,在混合之前或期间加入玻璃珠或其他机械方法以促进样品分散和细胞裂解。或者,组织样品可以在与sds和去垢剂去除组合物混合之前或之后通过机械或化学方法均质化或用酶(例如,蛋白酶k)消化。或者,单独的sds可能能够裂解覆盖固体组织片表面的足够数量的细胞(例如肌肉活组织检查或肿瘤活组织检查),将核酸释放到溶液中,随后用去垢剂去除组合物处理并用于下游应用。
生物样品可以含有或不含有微生物,例如病毒、细菌、酵母、真菌、古细菌和原生生物。
在水溶液与去垢剂去除组合物充分混合后,使得到的混合物沉降或短暂离心以形成两相。去垢剂(和任何与去垢剂相关的或去垢剂结合的分子)将分配至下部有机相,使上部水相基本上不含去垢剂。顶部水相可以通过标准方法容易地分离,例如倾析或移液,用于下游分析,而没有来自下部有机相的污染。
该方法不仅有效地从水溶液中去除去垢剂,例如阴离子去垢剂,而且还有效地去除去垢剂相关的或结合的分子和大分子。在一个具体实施方案中,去垢剂相关或结合的分子是蛋白质。已知阴离子去垢剂如sds通过破坏膜脂质双层和变性蛋白质来裂解生物样品中的细胞。由于sds有效地溶解并紧密结合蛋白质,因此认为本发明的去垢剂去除方法和系统可以容易地将去垢剂和去垢剂相关/结合的蛋白质去除并分离到下部有机相中。相应地,本申请进一步提供了从水溶液(例如生物样品)中提取蛋白质的方法。因此,本文所述的方法、组合物、系统和试剂盒可理想地用于从水溶液中去除抑制剂,即抑制反应的抑制剂,该反应例如下游应用,包括但不限于pcr(包括rt-pcr)、文库制备和核苷酸测序。例如,抑制剂可包括酶抑制剂,例如后续应用中酶依赖性反应的抑制剂。
至少一部分水相(即,基本上不含去垢剂和与去垢剂相关的或去垢剂结合的分子(如果存在的话)的相)可以直接用于下游应用,包括但不限于pcr(包括rt-pcr)、文库制备和核苷酸测序。
本文还提供了用于去除去垢剂的试剂盒。试剂盒包括在单个容器中或在两个或三个单独的容器中的去垢剂去除组合物的盐、醇和卤代烃组分。任选地,该试剂盒还包括用于进行本发明的去垢剂去除方法的说明书和/或样品收集容器和/或含有去垢剂溶液的样品收集容器。如上所述,在一些实施方案中,该试剂盒还可用于从可能存在的水溶液中去除与去垢剂相关的和/或去垢剂结合的分子。
为了更好地理解本文所述的发明,阐述了以下实施例。应该理解,这些实施例仅用于说明目的。因此,它们不应以任何方式限制本发明的范围。
实施例
实施例1:用于检测低浓度sds的敏感测定系统
开发了敏感测定系统以量化样品中非常微量(<0.01%w/v)的sds。该测定中sds的定量基于使用3,3′-二乙基-9-甲基-4,5,4′,5′-二苯并硫碳菁染料,也称为stains-all。这是一种紫红色染料,在sds存在下变黄。该测定允许在样品中精确检测和定量低至0.003%sds。
该试验改编自rusconi等人描述于“quantificationofsodiumdodecylsulfateinmicroliter-volumebiochemicalsamplesbyvisiblelightspectroscopy.”analyticalbiochemistry.2001.295,31-37的试验。
设备
-tecaninfinite200读板器(platereader)
-grenier96孔平底透明polystyrol板
试剂
-stains-all[sigma-aldrich,cat.no.e9379-1g]
-异丙醇[emd,cat.no.px1834-6]
-dmso[bdh,cat.no.b10323]
-10%sds(w/v)[emd.cat.no.dx2490-2]
○在进行测定之前,在h2o中稀释至1%
溶液的制备
-在50%(v/v)异丙醇中含有1mg/ml的stains-all储备溶液(1.8mm)。
该储备溶液在4℃下在黑暗中稳定1个月。
-stains-all中间溶液(90μm):
通过将1mlstains-all储备溶液(1.8mm)与1mldmso和18mlh2o混合来制备中间溶液。当在室温下在黑暗中储存时,该stains-all中间溶液可稳定3天。
制作sds标准曲线:使用以下标准溶液制作标准曲线:
a.0.05%sds=5μl1%sds+95μlh2o
b.0.025%sds=50μl(a)+50μlh2o
c.0.0125%sds=50μl(b)+50μlh2o
d.0.00625%sds=50μl(c)+50μlh2o
e.0.003125%sds=50μl(d)+50μlh2o
f.0.0015625%sds=50μl(e)+50μlh2o
g.0.00078125%sds=50μl(f)+50μlh2o
h.0%sds=h2o
程序
1.将5μlsds标准溶液或样品转移至96孔板的孔中。
2.在读取吸光度之前立即向每个样品中加入195μlstains-all中间溶液(注意:stains-all是光敏感的)。
3.使用标准读板器读取420nm-480nm的吸光度。
4.使用graphpadprism5软件计算吸光度“曲线下面积”(auc)(420-480nm)。
通过将auc与已知sds浓度作图来制作标准曲线(由图中的暗条表示)。然后使用计算的auc和标准曲线可容易地获得未知样品中sds的浓度。除非另有说明,否则该方法用于确定以下实施例中的sds浓度。
实施例2:去垢剂去除组合物的比较
使用本发明的各种去垢剂去除组合物从含有已知量sds的水溶液中去除sds。制备100微升含有不同浓度sds的含水组合物的等分试样。通过添加盐和20μl如下所述的高级醇和卤代烃的1:1(体积/体积)混合物进行sds去除。将管剧烈涡旋2分钟并以13,000rpm离心2分钟。去除顶部(含水)相,并使用实施例1中描述的改进的stains-all测定定量水相中的残留sds。结果显示在图1至3中。深色条代表sds标准溶液,而白色条代表测试的去垢剂去除组合物的结果。
图1中所示的曲线图描述了实验结果,其中用各种去垢剂去除组合物处理包含1%sds的水溶液。组合物1包含1-戊醇和溴二氯甲烷(bdcm)与150mm氯化铵(nh4cl)的1:1混合物。组合物2包含1-戊醇和氯仿与150mmnh4cl的1:1混合物。组合物3包含1-戊醇和2-碘丙烷与150mmnh4cl的1:1混合物。在每种情况下,处理后在水相中检测到的sds量小于0.00625%,并且当使用的卤代烃是2-碘丙烷时,去除去垢剂后检测到的sds量小于0.003125%。这证明了仅使用五分之一体积的去垢剂去除组合物的单次处理中从水相中提出sds非常有效(>99.7%)。
图2中所示的曲线图描述了实验结果,其中用各种去垢剂去除组合物处理包含4%sds的水溶液。在该研究中,所有组合物包含1:1的1-戊醇和bdcm与如下盐的1:1混合物:组合物4:175mm的nh4cl;组合物5:200mm的nh4cl;组合物6:125mm甲基三正丁基氯化铵;组合物7:150mm甲基三正丁基氯化铵;组合物8:150mm三乙胺盐酸盐;组合物9:175mm三乙胺盐酸盐;组合物10:175mm的乙酸四正丁基铵;组合物11:200mm的四正丙基氯化铵。在每种情况下,处理后在水相中检测到的sds量小于0.00625%。同样,结果表明,仅使用五分之一体积的去垢剂去除组合物的单次处理中从水相中提出sds非常有效(高达>99.9%)。
图3中所示的曲线图描述了实验结果,其中用各种去垢剂去除组合物处理包含10%sds的水溶液。在该研究中,所有组合物包含1:1的1-戊醇和bdcm的混合物和具有不同浓度的nh4cl:组合物12:275mm;组合物13:300mm;和组合物14:325mm。在每种情况下,处理后在水相中检测到的sds量小于0.00625%。再次,结果证明,即使在非常高的初始sds浓度下(10%w/v),仅使用五分之一体积的去垢剂去除剂在单次处理中从含水组分中提出sds非常高效(高达>99.9%)。
实施例3:从含唾液的样品中去除sds
为了证明本发明在含有生物样品的含水组合物中的有效性,将新鲜的人唾液样品收集在15ml锥形管中。用等体积的含有4%sds和250mmlicl的裂解缓冲液处理1毫升唾液,并用蛋白酶k(“pk”)在60℃消化15分钟。通过在90℃加热15分钟使pk失活,并将裂解缓冲液中93.75μl等分试样的经处理的唾液与6.25μl的2m氯化铵溶液混合。
通过向100μl经处理的唾液样品中添加20μl的1-戊醇和bdcm的1:1混合物来进行去垢剂去除。将管剧烈涡旋2分钟并以13,000rpm离心2分钟。去除顶部(水相)并使用实施例1中描述的改进的stains-all测定定量sds。结果如图4所示。这些结果证明使用本文所述的组合物和方法从含唾液的含水样品中成功去除>99.7%的sds。
实施例4:从静脉血液衍生的样品中去除sds
为了证明本发明在含有复合生物样品的含水组合物中的有效性,将人静脉血收集在edta管中。将1毫升血液在三倍体积的含有sds和氯化铵的裂解缓冲液中于70℃裂解15分钟。溶解的血液样品中sds和氯化铵的最终浓度分别为2.5%和175mm。
通过添加20μl戊醇和bdcm的1:1混合物对100μl裂解的血液样品进行去垢剂去除。将管剧烈涡旋2分钟并以13,000rpm离心2分钟。去除顶部(水相)并使用实施例1中描述的改进的stains-all测定定量sds。结果如图5所示,证明sds甚至可以从复杂的生物样品如静脉血中成功去除(>99%)。
实施例5:通过各种浓度的sds抑制pcr
使用以下主混合物进行多个qpcr反应:2.5μl1mg/ml牛血清白蛋白(bsa),2.5μl10xpcr缓冲液,1.5μl50mmmgcl2,0.5μl10mmdntp,0.5μl10pmol正向引物,0.5μl10pmol反向引物(人18s-165正向5’gtggagcgatttgtctggtt和人18s-165反向5’ggacatctaagggcatcacag),0.5μl0.5μmsyto9,0.2μl5u/μltaq聚合酶,12.3μl的水。
使用18srrna基因,57.4℃引物退火温度和30个循环进行与已知量的对照dna和不同浓度的sds(范围为1%至0.001%wt/vol)的qpcr反应。
结果显示在图6中,表明qpcr在sds浓度低至0.01%时被完全抑制,在0.005%时可观察到部分抑制。这些范围与上面提到的公布数据一致。
实施例6:去除去垢剂后使用生物样品中的dna用于qpcr
唾液衍生的样本
如实施例3中所述,在用去垢剂去除组合物处理后获得裂解的唾液样品的水相。将12μl等分试样的水相与1kb+dna梯(ladder)一起在1%琼脂糖凝胶中电泳;然后用sybrgoldtm(invitrogen,cat#s11494)染色凝胶。结果显示在图7中,其中可以看到高分子量dna(>23kb),因此证明用本发明的组合物处理可使dna保持完整并且保留在水相中。
根据上文实施例5中所述的方法,在去除去垢剂后,使用等分的水相进行qpcr。直接添加到总共25μlqpcr反应中的4μl唾液衍生的水相的数据显示在图8中。为了比较,还对5ng和50ng纯化的dna进行qpcr以获得18srrna基因。
这些结果进一步证明,在上述去垢剂去除步骤之后,可以从唾液衍生的含水样品中有效且快速地去除sds。图8中获得的数据显示出成功的qpcr,意味着唾液衍生的水相仅含有非常少量的残留pcr抑制剂。可能地,在较大体积的qpcr混合物中使用较小的等分试样可以得到类似的结果。事实上,稀释是处理血液样品中天然存在的抑制剂的常用方法。然而,这种方法会导致样品中可获得的总dna损失,并会导致实验方法中更多的错误来源。能够使用更大和更浓缩的样品总是优选的。目前描述的方法和组合物允许使用样品而无需使用高稀释方法。
血液来源的样本
如实施例4中所述,在从裂解的血液样品中去除去垢剂后获得该实施例的水相。去除去垢剂后,将8μl等分的水相在0.8%琼脂糖凝胶中与1kb+dna梯一起进行电泳,然后用溴化乙锭染色凝胶。结果显示在图9中,其中可以看到高分子量dna(>23kb),因此证明用本发明的组合物处理使dna保持完整并且保留在水相中。
如上述实施例5中所述的qpcr是在去除去垢剂后使用等分的水相进行的。直接添加的2μl和4μl血液衍生的水相的数据均得到总共25μl的qpcr反应,如图10所示。
这些结果进一步证明,在上述去垢剂去除程序之后,有效地从血液衍生的含水样品中去除sds。由于已知血液含有大量的pcr抑制剂,因此图10的数据非常显著,因为一旦含有sds的血液样品用实施例4中所述的去垢剂去除组合物处理,则不需要高度稀释的样品。如下所示,不仅从样品中去除了sds,而且还去除了任何sds相关蛋白,可能解释这一显著结果。
实施例7:去除去垢剂后使用来自生物样品的rna用于反向转录酶(rt)-pcr
唾液
将2ml新鲜唾液样品收集在15ml锥形管中,并与等体积的裂解缓冲液(4%sds,250mmlicl)混合。
将200μl等分的裂解的唾液与pk混合,并在60℃下孵育15分钟。然后通过在90℃加热15分钟使pk失活。加入10μl2m氯化铵和40μl1:0.8(体积/体积)的1-戊醇和0.1%戊醇和(聚)三氟氯乙烯的混合物。将管剧烈涡旋2分钟并以13,000rpm离心2分钟。去除顶部(水相)并在1%琼脂糖凝胶中电泳。用sybrgold处理凝胶以染色核酸(图11)。观察到细菌16s和23s核糖体rna条带证明本文所述的去垢剂去除组合物在水相中保持rna完整。没有观察到人28s和18s核糖体rna条带,因为它们在唾液中以非常少的量存在,太低而不能通过用sybrgold染色检测到。然而,可以通过rt-pcr检测人核糖体rna,如下一部分所示。
如上所述处理来自唾液样品的水相,不同之处在于使用bdcm和1-戊醇的1:1(体积/体积)混合物作为去垢剂去除组合物。将1μl唾液水相直接加入20μlrt反应混合物(4μl5x第一链缓冲液(invitrogen),2μl100mmdtt,2μl10mmdntp,2μl50mmmgcl2,1μlrna酶抑制剂(10u/μl)中。),1μl随机引物(125ng/μl,invitrogen),2μlm-mlv逆转录酶(invitrogen),剩余体积的水)。然后将1μlrt产物加入到24μlqpcr反应中,并如上文实施例5中所述进行处理,探测人18s核糖体rnacdna。阴性对照管(不含rt酶)标记为-rt。结果如图12所示。
完全如上所述处理单独的新鲜唾液样品。去除顶部水相,将3μl直接加入到18μlrt反应混合物中(如上所述)。然后将2μlrt产物加入到23μlqpcr反应中,并如上文实施例5中所述进行处理,探测人18s核糖体rnacdna。阴性对照管(无逆转录酶)标记为-rt。结果如图11所示。在两种情况下(图12和13),结果显示可以在用去垢剂去除组合物处理的裂解唾液样品的水相中检测到人18s核糖体rna。如所预期的,在rt反应中使用3μl,在qpcr反应中使用2μl(图13),而并非分别1μl和1μl(图12),在rt反应中产生更多的18s核糖体rnacdna,如pcr反应中较低的ct值所证明的。具有较大体积水相的rt产物和因此的qpcr产物的显著增加证明了去垢剂去除组合物在分离抑制剂至下层有机相中的显著效果。-rt信号是由于人类基因组dna的存在,这些研究中未将其去除。
血液
将人静脉血收集在标准edta管中。将一体积的血液与9体积的裂解缓冲液(4%sds,250mmlicl)混合。将裂解的血液用pk在60℃消化15分钟;然后将pk在90℃下灭活15分钟。通过混合5μl2m氯化铵和20μl1:0.8(体积/体积)的1-戊醇和(聚)三氟氯乙烯混合物从100μl等分的裂解血液中去除sds。将管剧烈涡旋2分钟并以13,000rpm离心2分钟。去除顶部(水相)并将等分试样在1%琼脂糖凝胶中执行(图14)。用sybrgold染色核酸。可以看到对应于人18s和28s核糖体rna的条带。将1μl血液水相加入20μlrt反应混合物(4μl5x第一链缓冲(invitrogen))中,2μl100mmdtt,2μl10mmdntp,2μl50mmmgcl2,1μlrna酶抑制剂(10u/μl),1μl随机引物(125ng/μl,invitrogen),1.5μlm-mlv逆转录酶(invitrogen),剩余体积为水)。然后将1μlrt产物加入到24μlqpcr反应中,并如上文实施例5中所述进行处理。没有逆转录酶的阴性对照管标记为-rt。结果如图15所示,清楚地证明了一旦通过去垢剂去除组合物去除与sds结合的潜在额外抑制剂的sds,可通过rt-pcr检测人18s核糖体rna。
实施例8:醇的比较
研究了几种代表性醇在去垢剂去除组合物中的性能。测试伯醇、仲醇、环醇、二醇以及固体和液体醇(在室温下)。在原始生物样品和/或“模型系统”中测试醇,由此使用简单的水和sds(4%w/v)混合物。为了进行有效的相分离,醇必须在水中基本上不混溶,但可与卤代烃混溶。结果总结如下:
从上面获得的观察结果可以推断,水不混溶的醇可以是具有式i结构的任何醇
r1–oh(式i)
其中r1是任选取代的、直链、支链或环状的c4-c12烷基
实施例9:从含水样品中去除蛋白质
将人静脉血收集在标准edta管中。将1体积的血液与3体积的含有4%sds和30mmdtt的裂解缓冲液充分混合。去垢剂和蛋白质的去除如下进行。加入nh4cl(终浓度为100mm)至100μl等分试样的裂解血液样品。向每等分的裂解血液中加入20μl含有不同量的1-戊醇和bdcm的去垢剂去除组合物(参见下面的详述)。将管剧烈涡旋2分钟并以13,000rpm离心2分钟。通过sds-page分析初始裂解的血液样品(即,去除去垢剂之前)以及去除去垢剂后的水相。用考马斯蓝染色聚丙烯酰胺凝胶以显示蛋白质条带。结果如图16所示。泳道1含有蛋白质分子量标记。泳道2是空的。泳道3含有在去除去垢剂之前的0.5μl裂解的血液样品。泳道4是空的。泳道5含有在去除去垢剂之前的1μl裂解的血液样品。泳道6是空的。泳道7含有7.5μl在仅用bdcm处理裂解的血液样品后的水相。泳道8是空的。泳道9含有7.5μl在用1-戊醇:bdcm为3:7(体积/体积)的混合物处理裂解的血液样品后的水相。泳道10含有7.5μl在用1-戊醇:bdcm为1:1(体积/体积)的混合物处理裂解的血液样品后的水相。泳道11含有7.5μl在用1-戊醇:bdcm为7:3(体积/体积)的混合物处理裂解的血液样品后的水相。泳道12含有7.5μl在仅用1-戊醇处理裂解的血液样品后的水相。
结果表明在用去垢剂去除组合物处理的泳道9、10和11中很少或没有蛋白质存在。这种非常有效的蛋白质提出是非常令人惊讶的。它表明,仅1/5体积的去垢剂去除组合物(即,20μl加入到100μl裂解的血液样品中)可以非常有效地从血液中去除绝大部分蛋白质。观察到的血红蛋白的深红色的去除(数据未显示)是对于含有sds的样品的去垢剂去除组合物意外强大的脱蛋白能力的另一个迹象。在泳道3、5、7和12中可见的蛋白质条带,其中未使用本申请的去垢剂去除组合物(泳道3和5)或遗漏了一些组分(泳道7和12),表明所有三种组分对于取得好的结果至关重要。
实施例10:从生物样品中去除十二烷基肌氨酸钠(sarkosyl)和在qpcr中使用dna
为了证明本方法和组合物在含有生物样品的含水组合物中去除去垢剂的有效性,将新鲜的人唾液样品收集在15ml锥形管中。用等体积的含有4%sarkosyl的裂解缓冲液处理1毫升唾液,并用蛋白酶k(“pk”)在60℃消化15分钟。通过在90℃加热15分钟使pk失活,并将裂解缓冲液中90μl等分试样的经处理的唾液与10.00μl的2m氯化铵溶液混合。
通过向100μl经处理的唾液样品中添加20μl1:0.8的1-戊醇和(聚)三氟氯乙烯的混合物来进行去垢剂去除。将管剧烈涡旋2分钟并以13,000rpm离心2分钟。去除顶部(含水)相,并根据上文实施例5中所述的方法将4μl加入到人18s-165bppcr反应中。直接添加到总共25μlqpcr反应中的4μl唾液衍生的水相的数据显示在图17中。
实施例11:生物样品中的dna在去除去垢剂后用于构建文库制备(preps)的用途。
下一代测序(ngs)的关键要素是高质量的文库制备。大多数高通量ngs文库构建工作流程依赖于一系列共同的步骤,其中一些步骤(dna片段化、末端修复、a-加尾,衔接子连接和pcr扩增)是通过酶促实现的。输入dna质量也是文库构建成功的重要决定因素。在生物样品的纯化过程中携带的酶抑制剂(例如去垢剂)可导致生物信息学分析时最终产量降低,文库制备失败,或低的和不均匀覆盖。理想情况下,应优化提取方案或系统以纯化无抑制剂的核酸。
在该实施例中,通过两种不同的方法从生物样品中纯化dna,并将分离的dna直接用于构建ngs的文库制备。测序文库制备的质量与通过测试的dna纯化方法去除抑制剂的有效性直接相关。在一种方法中,将唾液从2个供体收集到等体积的
从用本发明组合物(“stat”)处理的oragene/唾液样品和用oragene/prepit·l2p提取的纯化dna制备测序文库。使用agilenthighsensitivitydnakit在agilent2100生物分析仪上分析制备的文库。生物分析仪凝胶图像(图18a-b)和轨迹(trace)(图19a-d)显示,使用stat去除去垢剂和其他抑制剂的唾液样品制备的文库具有相同的平均片段大小和片段长度分布,以及相似的浓度作为由纯化的dna制备的文库。因此,stat处理的生物样品的上清液可以直接用于构建ngs的文库制剂,节省了相当多的时间和费用。
本说明书中提及的所有出版物、专利和专利申请表示本发明所属领域的技术人员的技术水平,并且通过引用并入本文,其程度如同每个单独的出版物、专利、或专利申请被明确地和单独地指出通过引用并入。
如此描述了本发明,显然可以以许多方式改变本发明。这些变化不应视为脱离本发明的精神和范围,并且对于本领域技术人员显而易见的所有这些修改旨在包括在所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!