LMP1-表达细胞及其使用方法与流程
本申请要求2016年8月2日递交的美国临时申请62/370,011;2017年5月15日递交的美国临时申请62/506,281号和2017年7月14日递交的美国临时专利申请第62/532,622号的优先权,其所有内容通过引证在此全部并入本文。
本发明总体上涉及用于治疗癌症的免疫治疗策略的方法,更具体地说,采用细胞转移治疗策略和疫苗接种策略治疗癌症的方法。本发明还涉及使用被工程表达lmp1的分离细胞以简单和快速的方式激活和扩增具有不同tcr谱系的细胞毒性t细胞对抗广泛阵列的肿瘤相关抗原(taa)和新抗原的方法。
背景技术:
临床前和临床发展已经表明,癌症免疫治疗是抵抗甚至治愈这种疾病的有力手段。然而,大多数癌症类型的患者中只有一小部分能从当前的免疫疗法中受益。这包括三种主要方法:1)提取患者的免疫系统t细胞,并向其添加天然或修饰形式的选定的t细胞受体(tcr),以识别癌细胞上的蛋白质标记(称为抗原)并杀死它们,这种策略称为过继细胞转移疗法(act)的策略;2)用一种已知在癌细胞上表达的蛋白抗原预致敏免疫系统,这种方法称为免疫接种;3)通过免疫共刺激和/或免疫检查点阻断恢复抗肿瘤免疫。当前过继细胞转移疗法(act)和免疫接种方法的效果的一个主要障碍限制是仅针对单个或少数肿瘤抗原,这通常允许抗原阴性/丢失的肿瘤变体逃逸。检查点阻断疗法需要预先存在肿瘤抗原特异性t细胞,缺乏这种肿瘤抗原-特异性t细胞可能导致这种方法在许多患者中的失效。显然,更好的癌症免疫治疗的关键任务是找到提高t细胞对抗广谱肿瘤抗原的方法。
埃-巴二氏病毒(ebv),又名人疱疹病毒4(hhv-4),是一种有效的肿瘤病毒。埃-巴二氏病毒(ebv)特异性感染和转化人b细胞,以及一些上皮细胞。埃-巴二氏病毒(ebv)感染的b细胞被t细胞飞快地清除,但是埃-巴二氏病毒(ebv)在在b细胞的极小部分中就处于休眠状态,在90%以上的人中建立了终生潜伏感染。在免疫抑制的条件下,埃-巴二氏病毒(ebv)可以从这些少量的细胞中传播,导致受感染b细胞的爆炸性扩张及其恶性转化。埃-巴二氏病毒(ebv)编码的潜伏膜蛋白1(lmp1)的表达对于埃-巴二氏病毒(ebv)转化人b细胞是必不可少的,并且本身可以诱导啮齿动物成纤维细胞的致癌转化。据报道,在转基因小鼠模型中,潜伏膜蛋白1(lmp1)阳性的b细胞淋巴瘤在老年小鼠中偶尔发生,然而潜伏膜蛋白1(lmp1)的表达在青年时几乎不能检测到,这一现象尚不清楚。因此,建立b细胞特异性lmp1转基因小鼠模型是十分必要的,所述模型适合于埃-巴二氏病毒(ebv)诱导的免疫监视和淋巴发生研究。
技术实现要素:
这里公开的内容提供了用于治疗癌症的免疫治疗策略的方法,更具体地说,采用细胞转移治疗策略和疫苗接种策略治疗癌症的方法。
在一个方面,这里公开的内容提供一种包含核酸的载体,其中所述核酸编码多肽,该多肽包含一种序列,所述序列与seqidno:1至少有90%同源性,其中至少50%的埃-巴二氏病毒(ebv)基因组从该载体中缺失。
在一些实施方案中,所述载体包括一种启动子,所述启动子可操作地连接到编码与seqidno:1具有至少90%一致性的多肽的核酸上。在一些实施例中,所述载体是表达载体。在一些实施方案中,所述载体是一非病毒载体。在一些实施方案中,所述载体是一非病毒载体。在一些实施方案中,所述病毒载体选自由腺病毒载体、腺相关病毒载体和逆转录病毒载体组成的组中。在一些实施方案中,所述逆转录病毒载体是一种慢病毒载体。在一些实施方案中,所述逆转录病毒载体是一种鼠的干细胞病毒(mscv)载体。
在另一个方面,这里公开的内容提供了一种病毒颗粒,所述病毒颗粒包括如这里所描述的病毒载体。
在另一个方面,这里公开的内容提供了一种产生免疫原性细胞的方法,该方法包括使分离的细胞与这里所描述的载体接触,从而产生免疫原性细胞。
在一些实施方案中,所述分离的细胞是b细胞。在一些实施方案中,所述b细胞是天然b细胞。在一些实施方案中,所述b细胞是瘤形成的b细胞。在一些实施方案中,所述b细胞是b细胞淋巴瘤细胞或者b细胞白血病细胞。在一些实施方案中,所述b细胞是从患有一种疾病的患者中分离出来的,所述疾病选自由霍奇金淋巴瘤、伯基特氏淋巴瘤和艾滋病相关b细胞淋巴瘤、中枢神经系统淋巴瘤、移植后淋巴增生性疾病(ptld)和弥漫性大b细胞淋巴瘤所组成的组中。在一些实施方案中,所述b细胞是a20淋巴瘤细胞。在一些实施方案中,所述免疫原性的细胞在表面上包括至少一个抗原。在一些实施方案中,所述抗原是一肿瘤相关的抗原(taa)。
在一些实施方案中,所述分离的细胞是非-b细胞。在一些实施方案中,所述非-b细胞是癌细胞。在一些实施方案中,所述癌症选自由黑素瘤、胃癌和鼻咽癌所组成的组中。在一些实施方案中,所述癌细胞是实体肿瘤细胞。在一些实施方案中,所述实体肿瘤细胞是b16黑素瘤细胞。在一些实施方案中,所述免疫原性的细胞在表面上包括至少一个抗原。在一些实施方案中,所述抗原选自由基团肿瘤相关的抗原(taa)和新抗原所组成的组中。在一些实施方案中,所述肿瘤相关的抗原(taa)选自由cdkn1a(p21),birc5(存活素),epha2,kif20a所组成的组中。在一些实施方案中,所述肿瘤相关的抗原(taa)是一种肽,所述肽包括选自由seqidno:2-5所组成的组的序列的至少8个连续的氨基酸。
在一些实施方案中,所述抗原与mhc共轭。在一些实施方案中、所述mhc选自由mhci、mhcii、hla-a、hla-b、hla-c、hla-dpa1、hla-dpb1、hla-dqa1、hla-dqb1、hla-drα和hla-drβ所组成的组中。在一些实施方案中,所述mhc是mhc-i。在一些实施方案中,所述mhc-i是h-2db和h-2kb。在一些实施方案中,所述mhc是mhc-ii。在一些实施方案中,mhc-ii是i-ab。
在一些实施方案中,所述分离细胞具有减少的增殖能力。在一些实施方案中,所述分离细胞增殖是停止的。在一些实施方案中,所述分离细胞是经过照射的。
在一些实施方案中,所述免疫原性的细胞具有减少的增殖能力。在一些实施方案中,所述免疫原性的细胞增殖是停止的。在一些实施方案中,所述免疫原性细胞是照射的。
在一些实施方案中,潜伏膜蛋白1(lmp1)信号活化内原性抗原处理和在b细胞中呈递该功能。在一些实施方案中,免疫原性细胞相对于未接触载体或病毒颗粒的分离细胞表达增强水平的共刺激分子和/或粘附分子。在一些实施方案中,所述共刺激性分子选自由cd80、cd86、cd70、ox40配位体和4-1bb配位体所组成的组中。在一些实施方案中,所述附着分子是cd54(icam)。在一些实施方案中,潜伏膜蛋白1(lmp1)信号增加细胞表面cd95/fas的数量。
在另一个方面,这里公开的内容提供了一种免疫原性细胞,该免疫原性细胞是通过这里描述的产生免疫原性细胞的方法所产生的。在另一个方面,这里公开的内容提供了一种分离的细胞,该分离的细胞包括如这里所描述的病毒载体。在另一个方面,这里公开的内容提供了一种分离的细胞,该分离的细胞包括如这里所描述的病毒颗粒。
在某些实施方案中,所述细胞是b细胞。在一些实施方案中,所述b细胞是天然b细胞。在一些实施方案中,所述b细胞是瘤形成的b细胞。在一些实施方案中,所述b细胞是分离自患有b细胞淋巴瘤的患者中的b细胞淋巴瘤细胞,或者是分离自患有b细胞白血病患者中的b细胞。在在一些实施方案中,所述b细胞是从患有一种疾病的患者中分离出来的,所述疾病选自由霍奇金淋巴瘤、伯基特氏淋巴瘤和艾滋病相关b细胞淋巴瘤、中枢神经系统淋巴瘤、移植后淋巴增生性疾病(ptld)和弥漫性大b细胞淋巴瘤所组成的组中。在一些实施方案中,所述b细胞是a20淋巴瘤细胞。在一些实施方案中,所述细胞在表面上包括至少一个抗原。在一些实施方案中,所述抗原是肿瘤相关的抗原(taa)。
在一些实施方案中,所述b细胞是非b细胞。在一些实施方案中,所述非-b细胞是癌细胞。在一些实施方案中,所述癌症选自由黑素瘤、胃癌和鼻咽癌所组成的组中。在一些实施方案中,所述癌细胞是实体肿瘤细胞。在一些实施方案中,所述实体肿瘤细胞是b16黑素瘤细胞。在一些实施方案中,所述细胞在表面上包括至少一个抗原。在一些实施方案中,所述抗原选自由基团肿瘤相关的抗原(taa)和新抗原所组成的组中。在一些实施方案中,所述肿瘤相关的抗原(taa)选自由cdkn1a(p21)、birc5(存活素)、epha2、kif20a所组成的组中。在一些实施方案中,所述肿瘤相关的抗原(taa)是一种肽,所述肽包括选自由seqidno:2-5所组成的组的序列的至少8个连续的氨基酸。
在一些实施方案中,所述抗原与mhc共轭。在一些实施方案中、所述mhc选自由mhci、mhcii、hla-a、hla-b,hla-c、hla-dpa1、hla-dpb1、hla-dqa1、hla-dqb1、hla-drα和hla-drβ所组成的组中。在一些实施方案中,所述mhc是mhc-i。在一些实施方案中,所述mhc-i是h-2db和h-2kb。在一些实施方案中,所述mhc是mhc-ii。在一些实施方案中,mhc-ii是i-ab。
在一些实施方案中,所述细胞具有减少的增殖能力。在一些实施方案中,停止细胞增殖。在一些实施方案中,所述细胞是照射的。
在一些实施方案中,潜伏膜蛋白1(lmp1)信号活化内原性抗原处理和在b细胞中呈递该功能。在一些实施方案中,所述分离的细胞相对于不包括载体或病毒颗粒的分离细胞表达增强水平的共刺激分子和/或粘附分子。在一些实施方案中,所述共刺激性分子选自由cd80、cd86、cd70、cd27、ox40配位体、ox40、4-1bb配位体、4-1bb和gitr所组成的组中。在一些实施方案中,所述附着分子是cd54(icam)。在一些实施方案中,潜伏膜蛋白1(lmp1)信号增加细胞表面cd95/fas的数量。
在另一个方面,这里公开的内容提供了一种疫苗,该疫苗包括如这里描述的细胞(例如,分离的细胞、免疫原性细胞)。在一些实施方案中,所述疫苗进一步地包括一辅料。
在另一个方面,这里公开的内容提供一种活化t细胞的方法,该方法包括将所述t细胞与(a)一个或者一个以上如这里所描述的分离的细胞相接触,或者(b)如这里所描述的疫苗相接触。
在一些实施方案中,所述t细胞被活化并且变成细胞毒性t细胞。在一些实施方案中,所述活化t细胞表达一t细胞受体(tcr),所述t细胞受体(tcr)结合肿瘤相关的抗原(taa)和/或新抗原。在一些实施方案中,所述t细胞是cd4+t细胞。在一些实施方案中,所述t细胞是cd8+t细胞。在一些实施方案中,所述细胞毒性t细胞在允许所述细胞毒性t细胞增殖的适宜条件下培养。在一些实施方案中,所述细胞毒性t细胞被培养3-14天。
在一些实施方案中,所述t细胞体外接触所述分离细胞。在一些实施方案中,该方法进一步包括将t细胞对需要的患者施药。在一些实施方案中,所述主体患有癌症。在一些实施方案中,所述癌症是淋巴瘤。在一些实施方案中,所述t细胞与所述主体自体同源。在一些实施方案中,所述t细胞来自于主体mhc相配的供体。在一些实施方案中,所述分离的细胞与所述主体自体同源。在一些实施方案中,所述分离的细胞来自于主体mhc相配的供体。在一些实施方案中,所述主体是人。.
在另一个方面,这里公开的内容提供了通过这里所描述的t细胞活化方法活化的t细胞。
在另一个方面,这里公开的内容提供一种治疗需要的主体的方法,该方法包括将对所述主体施用(a)一个或者一个以上如这里所描述的分离的细胞,或者(b)如这里所描述的疫苗。
在一些实施方案中,所述方法进一步地包括照射所述分离的细胞。在一些实施方案中,所述主体患有癌症。在一些实施方案中,所述癌症是淋巴瘤。在一些实施方案中,所述分离的细胞与所述主体自体同源。在一些实施方案中,所述分离的细胞来自于主体mhc相配的供体。在一些实施方案中,主体是人。在一些实施方案中,所述方法进一步地包括对主体施用辅料。在一些实施方案中,所述方法进一步地包括对主体施用免疫共同刺激疗法。在某些实施方案中,免疫共刺激疗法选自由cd27激动剂(例如,特异性结合cd27的激动性抗体)、ox40激动剂(例如,特异性结合ox40的激动性抗体)和4-1bb激动剂(例如,特异性结合4-1bb的激动性抗体)组成的组。在某些实施方案中,所述方法进一步地包括对主体施用免疫检验点靶疗法。在某些实施方案中,所述方法进一步地包括对主体施用treg调节疗法。
附图简要说明
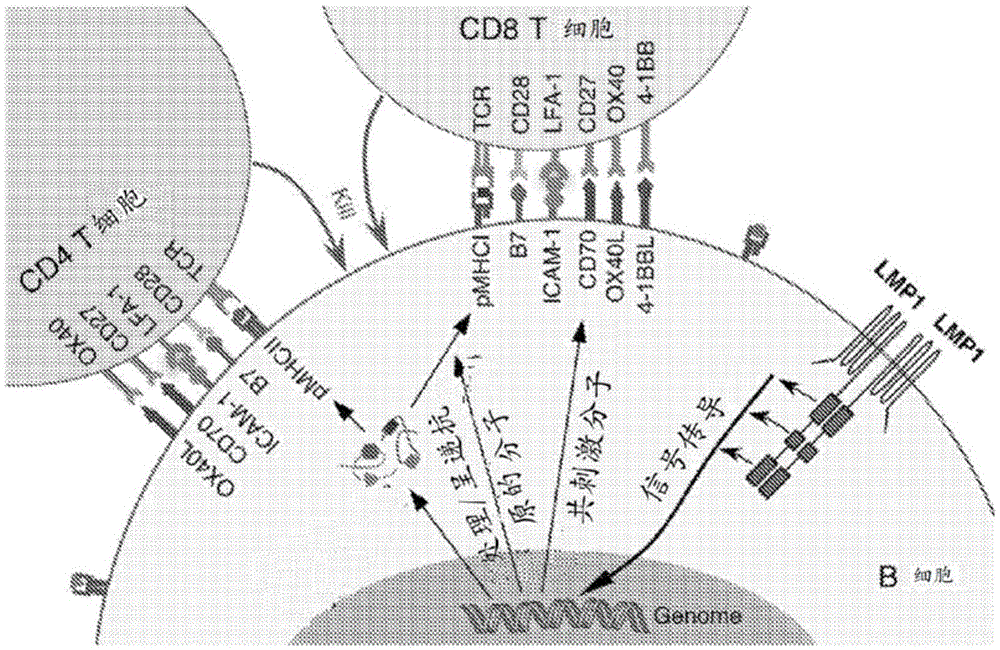
图1a是示意图,显示潜伏膜蛋白1(lmp1)信号在b细胞(例如,主要b细胞)中诱导细胞抗原(包括许多taa)的表达和呈递,并增强共刺激功能,从而引发有效的多克隆细胞毒性t细胞反应。在b细胞中,结构性的潜伏膜蛋白1(lmp1)信号诱导大块的细胞基因表达。这导致涉及抗原处理和呈递(例如,mhc)的细胞机制的上调、强共刺激信号(b7-1、b7-2、icam-1,特别是cd70、ox40l和4-1bbl)的诱导,并且诱导和/或加强某些细胞抗原(包括各种各样的taa)的表达。潜伏膜蛋白1(lmp1)信号诱导的细胞抗原和同时共刺激的呈递驱动这些抗原特异性的cd4+和cd8+t细胞的活化和细胞毒性分化因此,潜伏膜蛋白1(lmp1)信号转导使b细胞产生超免疫原性抗原呈递细胞(apc)。
图1b是示意图,显示淋巴瘤b细胞中的潜伏膜蛋白1(lmp1)信号转导增强淋巴瘤固有taa和新抗原的呈递。其中一些淋巴瘤固有taa是潜伏膜蛋白1(lmp1)信号诱导的taa,其表达通过lmp1信号传导增强,而其他淋巴瘤固有taa则不是。随着增强的共刺激信号增加的抗原呈递导致针对这些肿瘤抗原的细胞毒性t细胞反应。因此,潜伏膜蛋白1(lmp1)信号转导使淋巴瘤b细胞转入超免疫原性抗原呈递细胞(apc)中。
图2a是一种示意图,显示了用于产生cd19-cre;lmp1flstop(cl)转基因小鼠的潜伏膜蛋白1(lmp1)表达暗盒。
图2b是说明潜伏膜蛋白1(lmp1)在监测和转化潜伏膜蛋白1(lmp1)表达(埃-巴二氏病毒(ebv)病毒感染)b细胞中的作用的示意图。
图3a是显示潜伏膜蛋白1(lmp1)表达b细胞(cd19+fas+;fas由lmp1信号转导诱导,因此用作潜伏膜蛋白1(lmp1)在b细胞中的表达的报道子)和活化的(cd69+)cd4和cd8t细胞(通过facs分析)与cd19-cre/+对照(“c”)小鼠脾脏中的动态变化的图。在每个时间点绘制每个基因型的至少三只小鼠的相应平均值。.
图3b是通过facs分析显示cl小鼠骨髓(bm)中表达潜伏膜蛋白1(lmp1)的b细胞和活化的(cd69+)cd4和cd8t细胞与cd19-cre/+对照(“c”)小鼠相比的动态图。在每个时间点绘制每个基因型的至少三只小鼠的相应平均值。
图4是一种图表,显示了cd4+和cd8+t细胞对潜伏膜蛋白1(lmp1)-表达的b细胞的溶细胞活性。在共培养4小时后,来自6-8cl小鼠的cd4和cd8t细胞杀死潜伏膜蛋白1(lmp1)-表达淋巴瘤细胞。e:t比例表示效应因子到靶细胞比例。
图5a显示了从第6-8天cl小鼠脾脏中分离的主要cd4t细胞中的指示效应分子的facs分析,与来自成人cl脾脏的主要cd4t细胞相比,表明肿瘤杀伤t细胞表达关键的细胞毒分子。
图5b显示了如图5a中facs分析中检测到的指示效应分子的平均荧光强度(mfi)。
图5c显示了从第6-8天cl小鼠脾脏中分离的主要cd8t细胞中的指示效应分子的facs分析,与来自成人cl脾脏的主要cd8t细胞相比,表明肿瘤杀伤t细胞表达关键的细胞毒分子。
图5d显示了如图5c中的facs分析中检测到的指示效应分子的平均荧光强度(mfi)。
图6a是一个图表,显示了以潜伏膜蛋白1(lmp1)表达的淋巴瘤细胞为靶点测定的指示t细胞的细胞毒性。cd4和cd8t细胞来自成年(第42-84天)cl小鼠bm,过继cd4t细胞是从成年cl小鼠bm中分离出来的,过继转移(连同表达潜伏膜蛋白1(lmp1)的淋巴瘤细胞)到rag2–/–c–受体中,然后从后者中恢复。给出了三个独立实验的代表性数据。这里使用的所有小鼠都在(c57bl/6xbalb/c)f1(cb6f1)背景上,而淋巴瘤细胞在c57bl/6xbalb/c混合背景上。
图6b是一系列具有代表性的图表,显示了与来自成年cl小鼠bm(慢性状态)和脾脏(阴性对照)的原代cd4细胞相比,在过继cd4细胞中所指示的效应分子的流式细胞计分析。
图6c是一组存活曲线,显示了在携带侵袭性lmp1驱动的原发性淋巴瘤的小鼠中,采用cd4和cd8细胞结合放射治疗(rt)的治疗效果。用500rad照射8周龄c57bl/6xbalb/c混合背景的tcrβ-/-δ-/-cl小鼠。一天后,一些小鼠在cb6f1背景下用从cl小鼠分离的指示性t细胞进一步治疗(通过静脉注射),剂量为1×106细胞/受体。使用log-rank检验比较存活曲线。
图7a是条形图,显示来自指示小鼠的cd8t细胞中tcrv_链,所述t细胞用指示tcrv_链的一组单克隆抗体染色。这些v_特异性抗体在所有样本中共同检测出85-95%的tcr。对照d8,第8天龄cd19-cre/+小鼠。数据显示平均值±sem。
图7b是条形图,显示来自指示小鼠的cd4t细胞(不包括cd25+foxp3+tregs)中的tcrv_链,其中,所述t细胞用指示的tcrv_链的一组单克隆抗体染色。这些v_特异性抗体在所有样本中共同检测出85-95%的tcr。对照d8,第8天龄cd19-cre/+小鼠;过继性cd4t细胞最初是从成年cl小鼠bm中分离出来的,过继性转移(连同表达lmp1的淋巴瘤细胞)到rag2-/-c-/-受体,然后从后者中恢复。数据显示平均值±sem。
图7c是显示来自第6-8天cl小鼠的指示cd4t细胞的体外杀伤活性的图,在lmp1表达的淋巴瘤细胞上测定。数据显示为平均±sem副本。显示了来自两个独立实验的代表性数据。cl和对照小鼠使用的cb6f1背景。
图8显示了来自野生型(wt)小鼠的天然b细胞、cd40激活的b细胞、来自用tat-cre处理能够体外表达lmp1的lmp1flstop小鼠的lmp1-表达淋巴瘤b细胞和b细胞(lmp1表达b细胞)的facs分析。
图9a显示了分别表达lmp1-gfp融合、lmp1tm1m-gfp融合或gfp的b细胞的荧光显微镜成像。注意,野生型lmp1在细胞膜上聚集成大复合物,而突变型lmp1tm1m失去其聚集能力。
图9b是一对图表,显示了来自第6-8天cl小鼠的cd4t细胞(左图)和cd8t细胞(右图),用于检测用表达野生型lmp1或信号死亡突变体lmp1tm1m逆转录病毒载体转导的b细胞(来自wtb6小鼠)的杀伤活性。b细胞未被处理或者用空载体转导用作参照。
图10a是一对图表,显示第6-8天cl小鼠的cd4和cd8t细胞裂解表达lmp1的b细胞/淋巴瘤细胞以及经抗cd40预处理的wtb细胞,但不裂解天然b细胞。
图10b是图表,显示在fas-fc(阻断fasl介导的杀伤)和/或mhcii阻断抗体存在下,用来自第6-8天的cl小鼠的cd4t细胞对cd40激活的wtb细胞(来自b6小鼠)进行体外杀伤试验的结果。
图11显示了来自foxp3gfp的cd4+效应子/记忆t细胞(不包括tregs)的facs分析;cl雄性小鼠识别cd40激活的wtb细胞并以mhc-ii受限方式增殖。
图12a显示了来自6日龄cl小鼠的lmp1表达b细胞上cd40表达的facs分析,与来自同窝幼崽对照(cd19cre/+)的b细胞相比。注意,b细胞中的lmp1信号上调cd40。
图12b显示了6周龄小鼠的b细胞cd40表达的facs分析。注意,cl和cd40-/-;cl小鼠中的b细胞代表在表达lmp1表达b细胞后的残留b细胞(不表达lmp1)。
图12c显示6周龄的小鼠脾脏中b细胞和t细胞的facs分析。
图12d显示6周龄小鼠的bmcd4和cd8t细胞活化标记cd69的facs分析。数据(a-d)代表2-3个小鼠分析每种基因型。
图13a是热图,显示了与对照组b细胞相比,表达lmp1的b细胞中共刺激分子和共抑制分子的表达。用tat-cre处理lmp1flstop/yfpflstop和yfpflstop/+小鼠脾脏b细胞(都在cb6f1的背景上)产生lmp1-表达b细胞和yfp参照b细胞。所有处理后的b细胞在治疗后第2天收集进行阵列分析。
图13b显示了第6-8天cl小鼠表达lmp1的b细胞中的指定的共刺激配体的facs图(上图)和平均荧光强度(mfi;下图),与wt对照(ctr)小鼠的脾b细胞相比。数据代表每组2-6只小鼠的分析。小鼠(cl和对照组)处于cb6f1背景。每个符号表示单个鼠;条形图显示各自的平均值;****,p<0.0001;***,p<0.001(未配对的双尾学生t检验)。
图13c是显示与对照组b细胞相比,表达lmp1的b细胞中表达的细胞因子基因的热图。用tat-cre处理lmp1flstop/yfpflstop和yfpflstop/+小鼠(均为cb6f1背景小鼠)的脾b细胞,产生lmp1-表达b细胞和yfp对照b细胞。在治疗后第2天收集所有处理的b细胞进行阵列分析。以颜色刻度描述了以平均为中心的log2基因表达比率。
图14a显示了来自第6-8天cl小鼠和wt对照(ctr)小鼠的cd4t细胞中eomes和gzmb表达的facs分析。将cl小鼠的eomes+cd4细胞中的gzmb水平与对照组小鼠的总cd4细胞中的gzmb水平进行比较,并显示在右侧。
图14b显示了来自第6-8天cl小鼠和wt对照(ctr)小鼠的cd4t细胞中eomes对t-bet(上图)和gzmb对ifn-γ(下图)的facs分析。门内显示指定种群的频率(平均±sem)。
图14c显示了来自第6-8天cl小鼠和wt对照(ctr)小鼠的cd8细胞中eomes对t-bet(上图)和gzmb对ifn-γ(下图)的facs分析。(a-c)中的数据代表每组3-4只小鼠(全部在cb6f1背景上),在两个独立的实验中进行分析。
图15a显示了第6-8天cl小鼠和wt对照(ctr)小鼠cd4细胞中eomes与gata-3的facs分析。数据代表每组3-4只小鼠(全部在cb6f1背景上),在两个独立的实验中分析。
图15b显示了来自第6-8天cl小鼠和wt对照(ctr)小鼠的cd4细胞中eomes与rorγt的facs分析。数据代表每组3-4只小鼠(全部在cb6f1背景上),在两个独立的实验中分析。
图16a是一种图,显示了与表达lmp1或lmp1tm1m的b细胞共培养7天后回收的t细胞的数量(平均±sem)的图。细胞培养以1:1的比例在12孔板的三层孔中用1.5×106纯化的cd4t细胞连同指示的b细胞(共培养前以500rad照射)开始。未添加外源性细胞因子。***,p<0.001(未配对双尾学生t检验)。b细胞和t细胞来自2-3月龄幼稚wtb6小鼠脾脏。
图16b显示了在与所指定的b细胞共培养的cd4细胞中eomes和t-bet表达的facs分析(如(a)所示)。
图16c是显示cd4细胞在lmp1-b细胞(如(a)中)上扩增对用mscv-lmp1-ires-gfp逆转录病毒转导的b细胞的细胞毒性的图,该病毒含有gfp+(lmp1-b细胞)和gfp-细胞(未成功转导的细胞,因此代表lps激活的b细胞,参见材料和方法;这些细胞用作对照;)
图16d显示了在wt或ciita-/-小鼠的cd40活化的b细胞上扩增的lmp1-b细胞(如(a))上的cd4t细胞的增殖。(a-d)中的数据代表了2-4个独立的实验,使用2-3个月大的天然wtb6小鼠的脾脏b细胞和t细胞。
图16e显示了在cd4细胞中eomes表达的facs分析,这些细胞要么是新近从天然b6小鼠(离体)分离的,要么是在所指定的阻断抗体或相应的同型对照存在下与lmp1-b细胞共培养7天后获得的。显示了来自三分之一的代表性数据,其中门中显示了eomes+细胞的频率。
图16f显示了从用指定的阻断抗体处理的培养孔中回收的eomes+cd4细胞的数量(平均±sem),与从相应的同种型对照处理井中回收的eomes+cd4细胞相比。
图16g显示了cd4细胞与lmp1+b细胞共培养7天后,在存在指定的阻断抗体或相应同型对照的情况下,回收的cd4细胞的数量(平均±sem)。用1×106纯化的cd4t细胞在24孔板中进行细胞培养,重复三次。
图16h显示了在cd8细胞中eomes表达的facs分析,这些细胞或刚从天然b6小鼠中分离出来,或在所指定的阻断抗体或相应的同型对照存在下与lmp1-b细胞共培养3天后获得。显示了来自重复三次实验所得的代表性数据,其中门中显示了eomes+细胞的频率。
图16i显示了从用指示的阻断抗体处理的培养孔中回收的eomes+cd8细胞的数量(平均±sem),与从相应的同种型对照处理孔中回收的eomes+cd8细胞相比。
图16j显示了cd8细胞与lmp1+b细胞共培养3天后,在存在指示的阻断抗体或相应的同型对照的情况下,恢复的cd8细胞的数量(平均±sem)。用0.5×106纯化的cd8t细胞在24孔板中进行细胞培养,重复三次。
图17是代表性的流式细胞术分析,显示对表达lmp1的b细胞表达的taa的特异性t细胞应答的检测。用携带存活素20-28表位肽的mhc-ih-2db四聚体检测在三苯氧胺治疗后第5天cd19-creert2;lmp1flstop(cert2l)和cd19-creert2(cert2)对照小鼠体内cd8t细胞对存货素-衍生表位的反应(使lmp1最初在小部分b细胞中表达)。存活素-四聚体+cd8t细胞的频率显示在门内。所有的老鼠都生活在cb6f1的背景下。
图18a显示了对8天龄cl和对照组(cd19-cre/+)小鼠cd4t细胞室中cd4tregs(cd25+foxp3+)频率的分析。cd4+t细胞中cd4tregs的百分比(平均±sem)显示在门上方。
图18b显示成年(第42-84天)cl小鼠bm(左板)或移植有成年cl小鼠bmcd4+t细胞和lmp1+淋巴瘤细胞(右板)的受体小鼠cd4+t细胞中cd4+t细胞的频率分析。移植后第10天从受体中回收cd4+t细胞用于facs分析。
图18c显示了从成年foxp3dtr/gfp;cl雄性小鼠(在cb6f1背景上)分离的指示性t细胞的直接杀伤活性,使用lmp1+淋巴瘤细胞作为靶标进行测定。cd4耗尽tregs,cd4t细胞耗尽tregs。
图18d显示了从成年foxp3dtr/gfp;cl雄性小鼠(在cb6f1背景上)分离的cd8t细胞的直接杀伤活性,同时或不添加(以1∶1比率)来自相同小鼠的cd4tregs,使用cd40激活的wtb细胞(在b6背景上)作为靶标进行测定。
图19a显示了一个方案,描述了使用lmp1表达细胞激活/扩增t细胞用于癌症的过继细胞转移(act)治疗。
图19b显示了act方案,其中由lmp1表达b细胞启动的cd8和/或cd4t细胞用于治疗患有肿瘤的小鼠。在肿瘤植入前,小鼠接受600rad全身照射,以建立有利于过继性t细胞扩增的淋巴细胞减少条件。
图19c是显示由表达lmp1的b细胞启动的cd8t细胞的act延缓肿瘤(a20)生长的图。对照组小鼠不接受act。误差条表示平均值±sem。
图19d是显示由表达lmp1的b细胞启动的cd4t细胞的act延缓肿瘤(a20)生长的图。对照组小鼠不接受act。误差条表示平均值±sem。
图20a显示了用表达lmp1的b细胞或肿瘤细胞治疗癌症的疫苗接种策略。
图20b显示了一种疫苗接种方案,其中淋巴瘤细胞被转导以表达lmp1并用作疫苗来治疗未修饰的(亲本)b细胞淋巴瘤。
图20c是显示用表达lmp1的a20淋巴瘤细胞接种明显延迟肿瘤(a20)生长的图。表达信号死亡突变lmp1tm1m的a20淋巴瘤细胞作为对照疫苗。
图20d显示了一种疫苗接种方案,其中转导肿瘤细胞(b16-f10)以表达lmp1,并用作疫苗治疗未修饰的(亲本)肿瘤(黑色素瘤)。
图20e是显示用表达lmp1的b16-f10黑色素瘤细胞接种显著延迟肿瘤(黑色素瘤)生长的图。表达信号转导突变体lmp1tm1m或用空载体转导的b16-f10细胞作为对照疫苗。
具体实施方式
在本发明的组合物和方法被描述之前,应当被理解的是这里公开的内容并不局限于这里描述的具体的组合物、方法和实验条件上,因此,这些组合物、方法和条件是可以变化的。还可以被理解的是这里所用的术语只起到描述具体实施方案的目的,并不起到限制作用,这里所公开内容的范围只由所附权利要求书来限定。本领域普通技术人员显而易见的是在不离开本发明范围和精神的情况下,本申请所公开的内容可以进行各种实施方案和修饰。
在一个方面,这里公开的内容提供了一种载体,该载体包括编码潜伏膜蛋白1(lmp1)的核酸。在某些实施方案中,所述潜伏膜蛋白1(lmp1)的氨基酸序列与seqidno:1具有至少70%、80%、90%、95%或者99%的一致性。在某些实施方案中,所述载体与埃-巴二氏病毒(ebv)基因组具有至少50%、60%、70%、80%、90%、95%或者99%的一致性。在某些实施方案中,至少50%的埃-巴二氏病毒(ebv)基因组从所述表达载体中缺失。
在某些实施方案中,所述载体是表达载体。在某些实施方案中,所述载体包括转录调节成分(例如,启动子和/或一增强因子)可操作的与编码所述多肽的核酸连接。
在某些实施方案中,所述载体是病毒载体。在某些实施方案中,所述载体是不可复制的病毒载体。在某些实施方案中,用一个或者一个以上壳体蛋白质将所述病毒载体包裹入病毒颗粒。在某些实施方案中,所述载体或者所述病毒颗粒进一步的包括一种多聚核苷酸,所述多聚核苷酸能够编码诱导细胞死亡的多肽。在某些实施方案中,所述多肽是一种嵌合多肽,该嵌合多肽包括多聚作用(例如,二聚作用或者低聚反应)区域和细胞凋亡诱导区域,其中所述细胞凋亡诱导区域可以被多聚作用活化。在某些实施方案中,所述细胞凋亡-诱导区域包括具有蛋白酶活性的半胱天冬酶(例如,半胱天冬酶-9)序列。在某些实施方案中,所述细胞凋亡诱导区域包括所述全长人半胱天冬酶9多肽。在某些实施方案中,所述细胞凋亡诱导区域包括截断的人半胱天冬酶9多肽(例如,其中所述半胱天冬酶9的card结构域是删除的)。
在另一个方面,这里公开的内容提供了一种产生免疫原性细胞的方法,该方法包括使分离的细胞与这里所描述的载体(例如,表达载体)接触,从而产生免疫原性细胞。在另一个方面,这里公开的内容提供了一种分离的细胞,该分离的细胞包括这里所描述的载体(例如,表达载体)。这种细胞显示出优秀的抗原呈递效率,这是由于潜伏膜蛋白1(lmp1)信号传导增加抗原处理和呈递过程中涉及的细胞机制的表达。而且,这些细胞是超免疫原性的,由于潜伏膜蛋白1(lmp1)信号增加细胞表面上的共同刺激信号(例如,cd70,ox40l,和4-1bbl)。
在这里所描述的分离细胞中潜伏膜蛋白1(lmp1)的表达导致在细胞表面表达和/或呈递一种或者更多种抗原。通过与分离的细胞相接触可以产生细胞毒性t细胞。所述抗原包括但不局限于(1)潜伏膜蛋白1(lmp1)信号诱导细胞抗原,包括许多taas;(2)肿瘤(例如,淋巴瘤)固有的taas;和(3)新抗原,这是来源于表达的蛋白质中肿瘤特异性突变的突变-衍生肿瘤抗原组。
在主要的b细胞中,潜伏膜蛋白1(lmp1)信号诱导和/或加强所述潜伏膜蛋白1(lmp1)信号诱导细胞抗原(包括多种taas)的表达。因此,相对于未修饰(潜伏膜蛋白1(lmp1)阴性)的非免疫原性主要b细胞,表达潜伏膜蛋白1(lmp1)的主要b细胞在其表面上越来越多地表达和呈递潜伏膜蛋白1(lmp1)信号诱导的细胞抗原,并且有助于激活表达与这些抗原结合的tcr的t细胞(图1a)。
在淋巴瘤b细胞中,潜伏膜蛋白1(lmp1)信号传导增加所述潜伏膜蛋白1(lmp1)信号诱导的taas(包括多种taas)的表达,所述ttas是淋巴瘤固有的taas的亚群。另一个淋巴瘤固有taas以及新抗原的表达不是被诱导或者加强的。然而,不管表达水平如何,相对于未改性的(潜伏膜蛋白1(lmp1)-阴性的)淋巴瘤b细胞,这些抗原更多的呈递在表达潜伏膜蛋白1(lmp1)的淋巴瘤b细胞上。因此,表达潜伏膜蛋白1(lmp1)的淋巴瘤b细胞可用于活化能够表达tcrs的t细胞,所述tcr与这些淋巴瘤的固有抗原和taa结合(图1b)。
因此,在另一个方面,这里公开的内容提供了一种活化t细胞的方法,该方法包括将t细胞与一个或者一个以上这里所描述的分离的细胞相结合。在某些实施方案中,该方法可以用于癌症免疫治疗。
在某些实施方案中,所述分离的细胞是b细胞。如这里所述,当表示为早期发展时开始的转基因时,潜伏膜蛋白1(lmp1)代表能够中断免疫耐受性的第一异种蛋白。b细胞中构成性潜伏膜蛋白1(lmp1)信号传导能够诱导大块的细胞基因,导致抗原呈递功能(mhc)上调,增强共刺激信号(b7-1、b7-2、icam-1,并且尤其是cd70、ox40配位体和4-1bb配位体),并诱导和/或增强某些细胞抗原(这里叫做潜伏膜蛋白1(lmp1)信号诱导的细胞抗原)的表达。潜伏膜蛋白1(lmp1)信号诱导的细胞抗原在mhcs(人体内hlas)上的呈递以及通过cd70、ox40配位体和4-1bb配位体的同时共刺激作用可以驱动对这些抗原具有特异性的cd4和cd8t细胞的活化作用和细胞毒素分化作用。由于潜伏膜蛋白1(lmp1)是埃-巴二氏病毒(ebv)驱动的肿瘤发生的关键癌蛋白,因此t细胞靶向的潜伏膜蛋白1(lmp1)信号诱导的细胞抗原是多种肿瘤相关抗原(taa,某些肿瘤中t细胞可识别的一组非突变的细胞抗原)。
这里所描述的分离细胞表达抗原(例如,taa和新抗原),这些抗原可以由mhc(例如,hla)呈现。因此,在一些实施方案中,分离的细胞可以用来以简单和快速的方式产生具有多种tcr谱系的细胞毒性t细胞,以对抗范围广泛的taa和新抗原,而无需识别此类taa和与特定mhc(例如,hla)配对。在某些实施方案中,分离的细胞是患者衍生的b细胞或淋巴瘤细胞。这里所描述的治疗策略的独特优势在于,它们还可以与免疫共刺激疗法和/或免疫检查点靶向疗法相结合。免疫共刺激疗法和免疫检查点靶向疗法依赖于预先存在的肿瘤抗原特异性t细胞,缺乏t细胞可能导致许多癌症患者这种疗法的失败。因此,使用潜伏膜蛋白1(lmp1)表达细胞激活t细胞可以给那些否则将无法单独进行免疫共刺激治疗或免疫检查点靶向治疗的人带来更有效的治疗。
表达潜伏膜蛋白1(lmp1)的细胞(例如,b细胞)对t细胞的活化作用可能依赖于cd70、ox40l和4-1bbl分别与cd27、ox40和4-1bb在t细胞上结合。在某些癌症患者中,这些刺激性蛋白可能是下调的或有缺陷的。因此,在一些实施方案中,cd27、ox40或4-1bb的激动剂可以作为一种补充疗法,补充使用表达潜伏膜蛋白1(lmp1)的细胞(例如,b细胞或肿瘤细胞)的疫苗治疗或使用由表达潜伏膜蛋白1(lmp1)的细胞(例如,b细胞或肿瘤细胞)激活的t细胞的过继细胞转移治疗(act)。在一些实施方案中,所述激动剂是特异性结合cd27、ox40或4-1bb的激动性抗体。激动抗体可以是任何形式(例如,包括两个重链和两个轻链的四聚体抗体、单链fv、fab片段、f(ab′)2片段、双特异性抗体)。在一个实施方案中,激动性抗cd27抗体是伐利单抗。在一个实施方案中,激动性抗ox40抗体选自由moxr0916(genentech公司)、medi6383(medimmune公司)和incagn1949(agenus公司)组成的组中。在一个实施方案中,激动性抗4-1bb抗体选自尿嘧啶单抗/bms-663513(bms公司)和pf-05082566(辉瑞)所组成的组中。在一些实施例中,这些激动剂中的一个、两个或三个被给予有需要的患者。
在其它实施方案中,免疫检查点靶向治疗选自由pd-1抗体拮抗剂、抗pd-l1抗体拮抗剂、抗pd-l2抗体拮抗剂、抗ctla-4抗体拮抗剂、抗tim-3抗体拮抗剂、抗lag-3抗体拮抗剂、抗ceacam1抗体拮抗剂以及ido抑制剂所组成的组中,所述ido抑制剂即抑制ido(吲哚胺-(2,3)-双加氧酶)和/或tdo(色氨酸2,3-双加氧酶)的酶活性的试剂。
在其他实施例中,免疫检查点靶向治疗是抗pd-1抗体,可选地,其中抗pd-1抗体是派姆单抗、纳武单抗、加利妥昔单抗、medi0680、pdr001、regn2810、pf-06801591、bgb-a317、tsr-042或shr-1210。在一些实施方案中,免疫检查点靶向治疗是抗pd-l1抗体,可选地,其中抗pd-l1抗体是阿替唑单抗、杜伐单抗、阿魏单抗(msb0010718c)、mdx-1105或amp-224。在一些实施方案中,免疫检查点靶向治疗是抗ctla-4抗体,可选地,其中抗ctla-4抗体是易普利姆玛(ipilimumab)。在一些实施方案中,免疫检查点靶向治疗是ido抑制剂,可选地,其中ido抑制剂是依帕卡多司特、f001287、indoximod或nlg919。
表达潜伏膜蛋白1(lmp1)的细胞(如b细胞)对t细胞的活化作用可由tregs(如cd4tregs)控制,特别是在免疫反应的后期慢性阶段,以实现免疫体内平衡。在某些癌症患者中,tregs的数量和活性可能高于健康个体,并且可能在早期急性期被触发,这可能限制使用表达潜伏膜蛋白1(lmp1)的细胞(例如,b细胞)的疫苗治疗或使用由表达潜伏膜蛋白1(lmp1)的细胞激活的t细胞(例如,b细胞)。因此,在一些实施方案中,正在接受或接受疫苗接种或act治疗的受试者可进一步接受treg调节疗法的给药,以抑制或减少treg的数量和活性。treg调节疗法在本领域是已知的,并且包括但不限于特异性结合ctla-4、gitr、ccr4、pd-1、lag3、cd25或cd15的抗体(例如,全抗体及其抗原结合片段)。在接种疫苗或进行act治疗之前、同时(例如,在相同的问诊期间)、或之后施用treg调节治疗。如果所述treg调节治疗在接种疫苗或进行act治疗之后进行,则可以检查患者对接种疫苗或act治疗的反应,以确定treg调节治疗的必要性和剂量。
在一些实施方案中,分离的细胞或与其接触的t细胞与辅料联合给药。可以使用多种辅料,包括,比如说系统性辅料和粘膜辅料。系统性辅料是可以通过肠外给药的辅料。系统性辅料包括产生贮存效应的辅料、刺激免疫系统的辅料和两者兼有的辅料。产生贮存效应的辅料是导致抗原在体内缓慢释放的辅料,从而延长免疫细胞接触抗原的时间。在一些实施方案中,所述辅料刺激免疫系统,例如,引起免疫细胞产生和分泌细胞因子或igg。这些辅料的种类包括免疫刺激性核酸,如cpg寡核苷酸;从皂荚树皮中提纯的皂苷,如qs-21;聚[二(羧基化苯氧基)膦(pcpp聚合物;病毒研究所,美国);rna模拟物,如聚肌苷酸:多胞苷酸(polyi:c)或用聚赖氨酸稳定的聚i:c(聚iclc(
在一些实施方案中,辅料在给药分离的细胞或t细胞之前、大约同时,或之后给药。在一些实施方案中,在相同问诊期间与分离的细胞或t细胞同时给药辅料。在一些实施方案中,以与分离的细胞或t细胞相同的组合物(例如,疫苗)中施用辅料。在一些实施例中,在与分离的细胞或t细胞不同的组合物中施用辅料。
在一个实施方案中,本发明涉及通过复制缺陷病毒载体或转染来自患者的b细胞或淋巴瘤细胞来表达潜伏膜蛋白1(lmp1),并使用它们激活/扩增t细胞自体同源物或来源于供体的t细胞,进行过继细胞转移(act)治疗。在一些实施方案中,过继细胞转移疗法(act)用于患有埃-巴二氏病毒(ebv)相关b细胞淋巴瘤的患者。在一些实施方案中,过继细胞转移疗法(act)用于免疫抑制患者,例如移植后和艾滋病患者。在一些实施方案中,受试者具有表达潜伏膜蛋白1(lmp1)的埃-巴二氏病毒(ebv)相关b细胞淋巴瘤细胞,所述潜伏膜蛋白1(lmp1)可在其表面呈现相同的抗原阵列。在一些实施方案中,由于潜伏膜蛋白1(lmp1)是一种有效的癌基因,因此照射细胞使其增殖能力降低。在某些实施方案中,细胞的增殖能力通过照射而降低。
这里所描述的过继细胞转移疗法(act)策略同样可应用于免疫活性宿主中的埃-巴二氏病毒(ebv)相关b细胞淋巴瘤,如burkitt淋巴瘤和hodgkin淋巴瘤,或埃-巴二氏病毒(ebv)无关的b细胞淋巴瘤。这些淋巴瘤细胞与表达潜伏膜蛋白1(lmp1)的自体b细胞/淋巴瘤细胞共享一些taa,用于t细胞活化/扩增。如这里所描述的,过继细胞转移疗法(act)策略使用表达潜伏膜蛋白1(lmp1)的淋巴瘤细胞来产生治疗性t细胞和用于治疗埃-巴二氏病毒(ebv)无关的b细胞淋巴瘤,这种act策略可以针对淋巴瘤固有taa和新抗原阵列产生抗肿瘤t细胞(图1b),从而不需要识别它们并将其与特定的mhc(例如,hla)配对。这种过继细胞转移疗法(act)策略适合于产生针对这些淋巴瘤固有抗原的治疗性t细胞,因为潜伏膜蛋白1(lmp1)信号转导将增强细胞内源性抗原的呈现和共同刺激,即将淋巴瘤细胞转变为超免疫原性的抗原呈递细胞(apc)。
过继细胞转移疗法(act)利用体外产生的肿瘤抗原反应性t细胞治疗癌症。过继细胞转移疗法(act)产品的策略随着时间推移而发展,但在本公开之前总是涉及复杂的体外操作。这些操作包括,例如,从患者中分离肿瘤反应性细胞毒性t淋巴细胞(ctl)并使其经受广泛的体外扩增/分化;通过基因转移将肿瘤反应性tcr引入自体t细胞;或工程化t细胞以表达肿瘤抗原特异性的嵌合抗原受体。用t细胞受体(tcr)靶向单个肿瘤相关的抗原(taa)的过继细胞转移疗法(act)疗效有限,但具有丰富的自身免疫毒性。至于car-t治疗,迄今为止最成功的靶向肿瘤是那些源自b细胞的肿瘤,因为它们具有cd19抗原的独特表达(这些car-t细胞还消除了患者的正常b细胞,一种有害但可控的毒性)。然而,相当一部分患者由于表位丢失变异体的逃逸而未能接受这种治疗。car-t治疗实体肿瘤目前尚无成功。尽管已经尝试了同时针对单个taa或两个taa的car-t疗法,但是肿瘤逃逸和目标/非肿瘤毒性仍然是主要问题。因此,实体肿瘤的car-t治疗主要受限于识别特异性表达于肿瘤细胞表面但不在正常细胞中表达的抗原(理想情况下是多重抗原)的能力。新抗原,这个术语可以与“突变衍生抗原”互换使用,对于这个目的来说是理想的;然而,癌症中的绝大多数新抗原是“私人”事件,即很少在多个患者中共享的事件。因此,鉴定这种新抗原并产生针对这些抗原的car是不切实际的。
埃-巴二氏病毒(ebv)转化的b细胞,通常称为淋巴母细胞样细胞系(lcl),以增强抗原呈递能力而闻名,并且会呈现埃-巴二氏病毒(ebv)潜伏抗原(病毒抗原),这些潜伏抗原也表达于埃-巴二氏病毒(ebv)相关的肿瘤细胞中。用埃-巴二氏病毒(ebv)-淋巴母细胞样细胞系(lcl)重复刺激自体或供体来源的t细胞体外产生埃-巴二氏病毒(ebv)特异性ctl,这种ctl已用于临床治疗埃-巴二氏病毒(ebv)相关b细胞淋巴瘤,并在约50%的患者中有效。这种t细胞制备过程通常需要2-3个月,而肿瘤通常具有侵袭性,因此需要紧急治疗。有时,埃-巴二氏病毒(ebv)转化的b细胞被另外转导以增加埃-巴二氏病毒(ebv)潜伏抗原的表达/呈递,包括截短和信号死亡形式的潜伏膜蛋白1(lmp1)。在该方法中使用潜伏膜蛋白1(lmp1)突变体是基于以下基本原理:当在淋巴瘤细胞或其他肿瘤细胞中表达潜伏膜蛋白1(lmp1)时,已经证明能够激活/增强转导的模型抗原的呈现,但除非其信号功能被禁用,否则限制其自身表位的呈现。与此原理相反,本发明表明这是因为潜伏膜蛋白1(lmp1)信号诱导的大量细胞抗原稀释或掩盖潜伏膜蛋白1(lmp1)衍生的表位。
与淋巴母细胞样细胞系(lcl)相比,表达潜伏膜蛋白1(lmp1)的b细胞在简化t细胞生产方案方面具有优势。由表达潜伏膜蛋白1(lmp1)的b细胞产生细胞毒性t细胞只需要大约11天(包括制备表达潜伏膜蛋白1(lmp1)的b细胞以及随后产生抗原特异性t细胞的时间),这与淋巴母细胞系(lcl)为基础的方案所需的2-3个月形成鲜明对比。
在某些实施方案中,该方法可进一步包括在适当条件下用b细胞或疫苗(例如,这里所公开的b细胞或疫苗)培养t细胞,以允许t细胞增殖。适宜的条件可以包括促进或增强t细胞存活、增殖或分化的某些因素。典型的因素包括细胞因子(例如,il-2、il-1、il-6、il-12或il-18)、抗cd3抗体、抗cd28抗体、植物血凝素、钙离子载体、细胞死亡抑制剂(例如,fasl/fas中和抗体)以及能够促进t细胞活化的细胞(例如,巨噬细胞或树突状细胞)。与通常使用lcl激活t细胞的传统方法(通常需要2-3个月)相比,这里所公开的方法可以花费大约11天制备潜伏膜蛋白1(lmp1)-b细胞以及随后产生抗原特异性t细胞。因此,在某些实施方案中,将t细胞培养一段合适的时间(例如,大约3-5天、5-7天、3-7天或7-14天;等于或少于3、5、7或10天;或等于或少于1、2、3或4周)。t细胞可以在整个时间段或部分时间段内与b细胞共培养。在某些实施方案中,与t细胞接触的b细胞被补充(例如,每2-3天、3-4天或4-5天)。这些因素在培养过程中随时可以添加和撤回。例如,可以从第3天开始添加il-2。
在另一个实施方案中,这里公开的内容涉及用于治疗癌症的疫苗接种策略。表达潜伏膜蛋白1(lmp1)的自体b细胞/淋巴瘤细胞在照射后用作“潜伏膜蛋白1(lmp1)-细胞疫苗”,在体内激活/扩增t细胞以治疗这些淋巴瘤患者。在本公开之前,主要针对单个taa的疫苗接种方案产生了罕见的临床益处,部分原因是由于抗原/表位丢失变异体的逃逸。另一种已知的靶向多taa的策略是用肿瘤细胞裂解物负载树突状细胞(dc)。这一策略目前正在进行临床试验,但也可能遇到一些障碍。虽然肿瘤新抗原疫苗的临床疗效有待进一步报道,但肿瘤新抗原的鉴定是一个艰巨的过程,并且这些新抗原的绝大部分都是“私人”事件(很少在多个患者中共享)。
这里所描述的疫苗接种策略利用潜伏膜蛋白1(lmp1)信号诱导的细胞抗原表达、呈递和共同刺激以简单和快速的方式激活针对广谱taa和新抗原的t细胞免疫性。如这里所描述的,使用表达潜伏膜蛋白1(lmp1)的初级b细胞的疫苗接种策略的目标抗原是潜伏膜蛋白1(lmp1)信号诱导的细胞抗原(包括许多taa)(图1a)。相比之下,如本文所述,使用表达潜伏膜蛋白1(lmp1)的淋巴瘤细胞的疫苗接种策略可以产生抗淋巴瘤固有taa和新抗原的抗肿瘤t细胞(图1b)。使用表达潜伏膜蛋白1(lmp1)的原发性和淋巴瘤细胞进行疫苗接种,消除了识别特异性抗原并将其与特定的mhc(例如,hla)配对的需要。因此,本文描述的免疫策略产生针对淋巴瘤固有taa和新抗原的多克隆细胞毒性t细胞。这种疫苗接种策略适合于诱导t细胞对淋巴瘤固有抗原的反应,因为潜伏膜蛋白1(lmp1)信号转导可增强细胞内源性抗原的呈递和共同刺激,即将淋巴瘤细胞转化为高免疫原性抗原呈递细胞(apc)。
在另一个实施方案中,其他细胞系(非b细胞)中的潜伏膜蛋白1(lmp1)信号转导可用于增强细胞内源性抗原呈递和共刺激,因此表达潜伏膜蛋白1(lmp1)的来源于患者的肿瘤细胞可用于在体外过继细胞转移疗法(act)策略和体内疫苗策略中激活/扩增t细胞,以治疗相应的肿瘤。如本文所述,过继细胞转移疗法(act)的靶抗原和使用表达潜伏膜蛋白1(lmp1)的非b系肿瘤细胞的疫苗接种策略包括肿瘤固有taa和新抗原。
在某些实施方案中,这里所描述的使用表达潜伏膜蛋白1(lmp1)b细胞的过继细胞转移疗法(act)和疫苗接种策略可应用于非埃-巴二氏病毒(ebv)相关的癌症,所述非埃-巴二氏病毒(ebv)相关的癌症与表达潜伏膜蛋白1(lmp1)b细胞共享一个或多个taa。在一些实施方案中,非埃-巴二氏病毒(ebv)相关癌症可表达一种或多种肿瘤相关抗原(taa),所述肿瘤相关抗原也由表达潜伏膜蛋白1(lmp1)的b细胞或表达潜伏膜蛋白1(lmp1)的非b细胞表达。
对于过继细胞转移疗法(act)和疫苗接种策略,使用表达潜伏膜蛋白1(lmp1)的淋巴瘤细胞可以提供一些优势,由于潜伏膜蛋白1(lmp1)信号可以增强细胞内源性抗原呈递和共同刺激,即将淋巴瘤细胞转变为超免疫原性的(参见图1b),因此可以产生针对淋巴瘤固有taa和新抗原的抗肿瘤t细胞。然而,一些淋巴瘤在共刺激功能上可能不是最佳的,并且不容易获得,而自体b细胞(非肿瘤)在这种功能上是完整的,并且容易从外周血获得。因此,对于淋巴瘤患者,可以根据患者的具体情况而定制选择表达潜伏膜蛋白1(lmp1)的自体b细胞或表达潜伏膜蛋白1(lmp1)的淋巴瘤细胞。对于实体肿瘤,来源于患者的癌细胞比同系的正常细胞更容易获得和生长,因此是优选的。
这里所描述的过继细胞转移疗法(act)和疫苗策略都实现了有效癌症免疫治疗的几个最期望的特征:(1)诱导细胞毒性cd4和细胞毒性cd8t细胞反应;(2)当使用表达潜伏膜蛋白1(lmp1)的肿瘤细胞时,靶向大量taa和新抗原;(3)简单快速。值得进一步注意的是,高效地产生细胞毒性抗肿瘤cd4细胞代表了本文所述的act和疫苗接种策略的独特特征,考虑到(i)我们和其他人最近的工作显示出细胞毒性cd4细胞在治疗各种癌症方面的巨大潜力;(ii)这些细胞在抗击逃避cd8致死的癌症时尤其有效;(iii)在本发明之前没有用于快速生成肿瘤抗原特异性细胞毒性cd4细胞的一般方法。
在某些实施方案中,使用体外致死试验检测t细胞的细胞毒性。以cb6f1背景上的cd19-cre;lmp1flstop小鼠中,采用荧光激活细胞分离(facs)法分离cd4+和cd8+t细胞。t细胞与4×103靶细胞以不同效应物与靶细胞比例在96孔板中共培养4小时,然后进行活性半胱天冬酶-3染色(bd公司)(heetal.j.immunol.methods304:43-59(2005)).在所有的致死实验中,将u底96孔板中的效应物-靶混合物以200rpm旋转2分钟后移至培养箱,用抗cd19、抗cd4和抗cd8染色培养物以鉴定靶细胞(b细胞或淋巴瘤细胞)和效应细胞。活性半胱天冬酶-3阳性cd19+细胞代表凋亡靶细胞。%特异性杀伤=%具有效应物和靶点的培养物的凋亡靶细胞-%单独具有靶点的培养物的凋亡靶细胞。如本文所使用的,体外致死试验的效应子包括但不限于细胞毒性cd4+和/或cd8+t细胞,并且体外杀伤试验的目标包括但不限于表达潜伏膜蛋白1(lmp1)的b细胞。
在某些实施方案中,用cd19-cre使b细胞特异性潜伏膜蛋白1(lmp1)转基因表达成为可能。cd19启动子在早期(从前b状态开始)特异性地引导cre表达,并在整个b淋巴细胞发育过程中持续。一个cre盒插入cd19外显子2,在功能上破坏基因。纯合子小鼠cd19缺乏,而杂合子小鼠表型正常,可用于从条件等位基因中特异性删除有丝分裂盒,导致b淋巴细胞中靶基因的激活或失活。在另一个实施方案中,b细胞包括修饰或衍生自b淋巴细胞的细胞。还有一个实施例,非b细胞包括但不限于经修饰或衍生自实体肿瘤细胞的细胞。
对表达潜伏膜蛋白1(lmp1)b细胞或者非b细胞呈递的taas具有特异性的t细胞的检测方法包括,但是不局限于,如下所述使用cert2l和cl小鼠中的肿瘤相关的抗原(taa)-四聚物(或者五聚物)。在一些实施方案中,四聚物(或者五聚物)是用h-2db、h-2kb和i-ab做成的。装载在b6脾细胞或者cpg-活化的b细胞(作为抗原呈递细胞)中的预计的肽可以用来通过增殖作用或者细胞因子实验检测t细胞反应。在定性/最优化“lmpi-细胞疫苗”和过继细胞转移疗法(act)的研究中,确定的四聚物被用于监控小鼠体内相应的抗原特异性t细胞。
在一些实施方案中,使用下述方法比较lmp1-a20淋巴瘤细胞疫苗和lmp1-b细胞疫苗治疗患有a20淋巴瘤的小鼠的效力。然而,在另一个实施方案中,可以比较具有或不具有抗体介导的cd4+和cd8+t细胞预耗竭的免疫效果,以证明cd4+和cd8+t细胞在肿瘤控制中的贡献。在一些实施方案中,可以用免疫原性差的肿瘤细胞测试疫苗接种效果。免疫原性差的肿瘤细胞包括但不限于a20淋巴瘤细胞和b16黑色素瘤细胞。
在另一个实施方案中,这里所描述的过继细胞转移疗法(act)或疫苗接种策略可与免疫共刺激疗法和/或免疫检查点靶向疗法一起施用,可作为联合疗法的一部分。免疫检查点靶向疗法包括但不限于抗程序性细胞死亡蛋白质1(pd1)和/或抗-细胞毒性t-淋巴细胞-相关的抗原4(ctla4)。
在一些实施方案中,t细胞可以在适当的条件下在表达潜伏膜蛋白1(lmp1)的细胞上扩增。与表达潜伏膜蛋白1(lmp1)的b细胞体外共培养时,野生型小鼠的天然t细胞(cd4+或cd8+)活化,分化为细胞毒效应因子,并很好地扩增(从第3天开始加入il-2可增强cd8+t细胞的扩增)。这些扩大的t细胞可用于治疗患有淋巴瘤的小鼠,在照射预处理小鼠之后。
在一些实施方案中,表达潜伏膜蛋白1(lmp1)的细胞可以被照射来废除他们的增殖能力。可以使用任何有效的照射方法。根据其他实施方案,可以使用任何有效的预防这些细胞增殖的方法。
在依旧另一个实施方案中,这里所描述的过继细胞转移疗法(act)和疫苗接种策略均在临床前癌症模型中被确认是有效的,并且进行了优化。临床前的癌症模型包括,但是不局限于,淋巴瘤和黑素瘤模型。在一些实施方案中,这里所描述的过继细胞转移疗法(act)和疫苗接种策略均在临床前癌症模型与检验点阻断剂相结合的方法中被确认是有效的,并且进行了优化。
在一些实施方案中,人类t细胞可以用表达潜伏膜蛋白1(lmp1)的自体细胞来启动。表达潜伏膜蛋白1(lmp1)的自体细胞包括但不限于表达潜伏膜蛋白1(lmp1)的b细胞、表达潜伏膜蛋白1(lmp1)的淋巴瘤细胞和表达潜伏膜蛋白1(lmp1)的黑素瘤细胞。
lmp1的ncbi基因id编号是3783750。鼠d40的ncbi基因id编号是21939.人类cd40的ncbi基因id编号是958。
在本发明的说明书和权利要求书部分中使用了下列术语,其含义如下所述。
如这里所使用的,词“一个”或者“一种”与术语“包括”在权利要求书或者说明书中结合使用时指的是“一个”,但是还包括“一个或者多个”、“至少一个”和“一个或者一个以上”的含义。更进一步,术语“具有”、“包括”、“包含”和“含有”是可互换的,并且本发明所属领域普通技术人员已知这些术语是开放式术语。
如这里所使用的,术语“抗原”指的是能够激起免疫反应的分子。这里的免疫反应既包括抗体产生,又包括特异性免疫活性细胞的活化,或者二者皆包括。抗原来源于有机体、蛋白/抗原的亚基、致死的或者失活的全细胞或者溶解产物。示范性的有机体包括但是不局限于埃-巴二氏病毒(ebv)和埃-巴二氏病毒(ebv)感染的细胞。任何大分子,事实上包括所有蛋白质或者肽都可以用作抗原。而且,抗原可以起源于重组或者基因组dna。在某些实施方案中,抗原包括引起免疫反应的蛋白质片段。
如这里所使用的,术语“lmp1”指埃-巴二氏病毒(ebv)潜伏的膜蛋白质1。在一具体的实施方案中,潜伏膜蛋白1(lmp1)与之前已知的多肽序列具有100%的同源性(genbank登记号yp_401722).在另一个实施方案中,潜伏膜蛋白1(lmp1)具有seqidno:1的氨基酸序列。在进一步地实施方案中,潜伏膜蛋白1(lmp1)是一种多肽,该多肽与seqidno.1具有70%到80%、81%到85%、86%到90%、91%到95%、96%到100%、或者100%的序列一致性。在其他实施方案中,潜伏膜蛋白1(lmp1)是一种多肽,该多肽与seqidno:1具有至少75%、80%、85%、90%、95%、96%、97%、98%、或者99%的序列一致性。
seqidno:1(来自genbank登记号yp_401722的潜伏膜蛋白1(lmp1)多肽序列
mehdlergppgprrpprgpplssslglallllllallfwlyivmsdwtggallvlysfalmliiiiliififrrdllcplgalcilllmitlllialwnlhgqalflgivlfifgcllvlgiwiyllemlwrlgatiwqllafflaffldlilliialylqqnwwtllvdllwlllflailiwmyyhgqrhsdehhhddslphpqqatddsghesdsnsnegrhhllvsgagdgpplcsqnlgapgggpdngpqdpdntddngpqdpdntddngphdplpqdpdntddngpqdpdntddngphdplphspsdsagndggppqlteevenkggdqgpplmtdgggghshdsghgggdphlptlllgssgsggddddphgpvqlsyyd.
在这里术语“lmp1信号诱导的细胞抗原”指的是一种细胞抗原,其表达被lmp1信号诱导和/或增强,并且所述细胞抗原包含但不限于肿瘤相关抗原(taa),即某些肿瘤中的t细胞可识别的一组非突变细胞抗原。示例性潜伏膜蛋白1(lmp1)信号诱导的细胞抗原包括但不限于cdkn1a/p21(genbank登录号:np_001104569)、birc5/存活素(genbank登录号:np_033819)、epha2(genbank登录号:np_034269)和kif20a(genbank登录号:np_001159878)。
seqidno:2(来自genbank登记号:np_001104569的cdkn1a/p21多肽序列)
msnpgdvrpvphrskvcrclfgpvdseqlrrdcdalmagclqearerwnfdfvtetplegnfvwervrslglpkvylspgsrsrddlggdkrpstssallqgpapedhvalslsctlvserpedspggpgtsqgrkrrqtsltdfyhskrrlvfckrkp
seqidno:3(来自genbank登记号:np_033819的birc5/存活素多肽序列)
mgapalpqiwqlylknyriatfknwpfledcactpermaeagfihcptenepdlaqcffcfkelegwepddnpieehrkhspgcafltvkkqmeeltvseflkldrqraknkiaketnnkqkefeetakttrqsieqlaa
seqidno:4(来自genbank登记号:np_034269的epha2多肽序列)
melravgfclallwgcalaaaaaqgkevvlldfaamkgelgwlthpygkgwdlmqnimddmpiymysvcnvvsgdqdnwlrtnwvyreeaerifielkftvrdcnsfpggasscketfnlyyaesdvdygtnfqkrqftkidtiapdeitvssdfearnvklnveermvgpltrkgfylafqdigacvallsvrvyykkcpemlqslarfpetiavavsdtqplatvagtcvdhavvpyggegplmhctvdgewlvpigqclcqegyekvedacracspgffkseasespclecpehtlpstegatscqceegyfrapedplsmsctrppsapnyltaigmgakvelrwtapkdtggrqdivysvtceqcwpesgecgpceasvrysepphaltrtsvtvsdlephmnytfavearngvsglvtsrsfrtasvsinqteppkvrledrsttslsvtwsipvsqqsrvwkyevtyrkkgdansynvrrtegfsvtlddlapdttylvqvqaltqegqgagskvhefqtlstegsanmaviggvavgvvlllvlagvglfihrrrrnlrarqssedvrfskseqlkplktyvdphtyedpnqavlkftteihpscvarqkvigagefgevykgtlkassgkkeipvaiktlkagytekqrvdflseasimgqfshhniirlegvvskykpmmiiteymengaldkflrekdgefsvlqlvgmlrgiasgmkylanmnyvhrdlaarnilvnsnlvckvsdfglsrvleddpeatyttsggkipirwtapeaisyrkftsasdvwsygivmwevmtygerpywelsnhevmkaindgfrlptpmdcpsaiyqlmmqcwqqersrrpkfadivsildklirapdslktladfdprvsirlpstsgsegvpfrtvsewlesikmqqytehfmvagytaiekvvqmsnedikrigvrlpghqkriaysllglkdqvntvgipi
seqidno:5(来自genbank登记号np_001159878的kif20a多肽序列)
mshrilsppagllsdedvvdspilestaadlrsvvrkdllsdcsvisasledkqalledtsekvkvylrirpfltseldrqedqgcvcientetlvlqapkdsfalksnergvgqathkftfsqifgpevgqvaffnltmkemvkdvlkgqnwliytygvtnsgktytiqgtskdagilpqslalifnslqgqlhptpdlkpllsneviwldskqirqeemkklslligglqeeelstsvkkrvhtesrigasnsfdsgvaglsstsqftsssqldetsqlwaqpdtvpvsvpadirfsvwisffeiynellydlleppshqhkrqtlrlcedqngnpyvkdlnwihvrdveeawkllkvgrknqsfasthmnqqssrshsifsirilhlqgegdivpkiselslcdlagserckhqksgerlkeagnintslhtlgrciaalrqnqqnrskqnlipfrdskltrvfqgfftgrgrscmivnvnpcastydetlhaakfsalasqlvhappvhlgipslhsfikkhspqvgpglekedkadsdledspedeadvsvygkeellqvveamkalllkerqeklqleiqlreeicnemveqmqqreqwcserldnqkelmeelyeeklkilkeslttfyqeqiqerdekieeletllqeakqqpaaqqsgglsllrrsqrlaasastqqfqevkaeleqcktelssttaelhkyqqvlkppppakpftidvdkkleegqknirllrtelqklgqslqsaeracchstgagklrqaltncddilikqnqtlaelqnnmvlvkldlqkkaaciaeqyhtvlklqgqasakkrlganqenqqpnhqppgkkpflrnllprtptcqsstdsspyarilrsrhspllkspfgkky
在一些实施方案中,在cert2l和cl小鼠中,在(但是不局限于)cb6f1背景下,用肿瘤相关的抗原(taa)-四聚体可以识别表达潜伏膜蛋白1(lmp1)的细胞上呈递的特异于taa的t细胞。在另一个实施方案中,负载在b6脾细胞或cpg激活的b细胞上的taa可用于通过增殖和细胞因子测定来测试t细胞反应。
这里所描述的术语“lmp1-细胞疫苗”的定义为一种细胞,随着潜伏膜蛋白1(lmp1)表达,该细胞能够处理和呈现潜伏膜蛋白1(lmp1)信号诱导的细胞抗原/taa,以及个体肿瘤特异性taa和新抗原。lmp1细胞疫苗可诱导针对上述抗原的细胞毒性t细胞反应。
术语“抗原呈递细胞”是能够显示、获取和/或在其细胞表面呈递至少一种抗原或抗原片段的各种细胞中的任何一种。通常,抗原呈递细胞(apc)可以是诱导和/或增强针对抗原或抗原组合物的免疫应答的任何细胞。根据某些实施方案,正常地或优先地显示或呈现具有ii类主要组织相容性(mhc-ii)分子或复合物的抗原的细胞是专业apc。在某些情况下,apc显示或提供抗原的免疫细胞是cd4+或cd8+t细胞。以与mhc结合的肽形式存在的并通过apc显示的抗原(提供了对反应的特异性)、和共刺激信号(抗原非特异性并且促进适应性免疫有效免疫反应的发展)可以实现天然t细胞的完全活化作用。t细胞共刺激作用可促进t细胞增殖、分化和存活。没有共刺激作用的t细胞激活可能导致t细胞无能、t细胞缺失或免疫耐受的发展。由apc或可能帮助或增强免疫应答的其他免疫细胞表达的其他分子包括分泌分子,例如细胞因子和细胞毒性分子。
术语“mhc”指的是“主要组织相容性抗原”。在人体内,mhc基因被称为hla("人类白细胞抗原")基因。虽然并不存在持续遵守的惯例,但一些文献使用hla表示hla蛋白质分子,并且mhc表示编码hla蛋白质的基因。因此,在这里术语“mhc”和“hla”可互换使用。人体内的hla系统在小鼠中具有相同的等价物,即,h2系统。研究最多的hla基因是九个所谓的经典mhc基因:hla-a、hla-b、hla-c、hla-dpa1、hla-dpb1、hla-dqa1、hla-dqb1、hla-dra和hla-drb1。在人体中,mhc至少包括三个区域:ⅰ、ⅱ、ⅲ类。a、b、c基因属于mhcⅰ类,而6个d基因属于ⅱ类。mhcⅰ类分子由包含3个结构域(α1、2和3)的单链多态链组成,并与细胞表面的β2微球蛋白结合。ii类分子由2个多态链组成,每个链包含2个结构域(α1和2以及β1和2)。i类mhc分子几乎在所有有核细胞上都有表达。在i类mhc分子中出现的肽片段被cd8+t淋巴细胞(传统上称为细胞毒性t淋巴细胞或ctl)识别。cd8+t淋巴细胞经常成熟为细胞毒素效应因子,可裂解携带刺激性抗原的细胞。ii类mhc分子主要表达在活化的淋巴细胞和专业apc上。cd4+t淋巴细胞(传统上称为辅助性t淋巴细胞或htl)通过识别ii类mhc分子呈现的独特肽片段而被激活,该肽片段通常在apc上发现,如巨噬细胞、树突状细胞或b细胞。cd4+t淋巴细胞增殖和分泌细胞因子,这些细胞因子要么通过产生il-4支持抗体介导的应答,要么通过产生il-2和ifn-γ支持细胞介导的应答,要么获得直接杀伤活性(细胞毒性)。
术语“免疫共刺激分子”是指在抗原呈递细胞(apc)或t细胞上为t细胞增殖和功能分化提供非抗原特异性信号的分子。代表性的免疫共刺激分子包括但不限于cd80/b7-1、cd86/b7-2、cd70、cd27、ox40配体、ox40、4-1bb配体、4-1bb和gitr。因此,“免疫共刺激疗法”包括但不限于特异性结合免疫共刺激分子的激动性抗体。
如这里所使用的,术语“细胞因子”被定义为由免疫或其他细胞分泌的生长、分化或趋化因子,其作用是作用于免疫系统的细胞,例如但不限于t细胞、b细胞、nk细胞和巨噬细胞或其他细胞类型,例如内皮细胞、造血细胞等。代表性的细胞因子包括但不限于由ifn-γ、tnf-α、il-2和il-17组成的组。
本文中使用的术语:两个序列的“序列一致性”或“序列同源性”指的是当两个序列对齐时,具有相同核苷酸或氨基酸的位置的数目除以序列中较短的核苷酸或氨基酸的数目。在特定实施方案中,序列一致性从70%到80%,从81%到85%,从86%到90%,从91%到95%,从96%到100%,或者100%。在某些实施方案中,序列一致性至少是80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或99%。
如这里所使用的术语“癌症”的定义为细胞的过度增殖,其独特的特征-失去正常的控制-导致生长失调、缺乏分化、局部组织浸润和转移。实施例包括但不限于黑色素瘤、肝癌、白血病、淋巴瘤、视网膜母细胞瘤、星形细胞瘤、胶质母细胞瘤、神经母细胞瘤、肉瘤、肺癌、乳腺癌、子宫癌、胰腺癌、前列腺癌、肾癌、骨癌、睾丸癌、子宫癌、卵巢癌、宫颈癌、胃肠道癌、脑癌、结肠癌或膀胱癌。
在癌症治疗中,免疫治疗通常依靠免疫效应细胞和分子来靶向和破坏癌细胞。例如,免疫效应因子可以是肿瘤细胞表面某些标记物特异性的抗体。抗体本身可以作为治疗的效应因子,或者它可以招募其他细胞来实际影响细胞致死。抗体也可与药物或毒素(化疗毒素、放射性核素、蓖麻毒素a链、霍乱毒素、百日咳毒素等)偶联,并且仅作为靶向剂。或者,所述效应因子可以是一种淋巴细胞,所述淋巴细胞携带一种表面分子,这种表面分子与肿瘤细胞靶点(例如,潜伏膜蛋白1(lmp1)信号诱导的细胞抗原、淋巴瘤固有taa或肿瘤新抗原)发生直接或间接相互作用。各种效应细胞包括cd8+t细胞、cd4+t细胞和nk细胞。治疗癌症的免疫疗法的一个方面是如本文所述的act。治疗癌症的免疫疗法的另一个方面是如本文所述的疫苗接种策略。
如这里所使用的术语“细胞毒性t细胞(ctl)”指的是一种t淋巴细胞,这种t淋巴细胞可以杀死表达mhc呈递抗原的细胞,例如,病毒感染或者癌症细胞转化的细胞。在这里,细胞毒性t细胞包括cd8+t细胞(传统意义上的ctls或者cd8+ctl)和cd4+t细胞亚群(cd4+ctl),如本发明所述,其具有直接的致死活性。ctl对肽抗原具有特异性,所述肽抗原的存在与mhc基因编码的蛋白质有关,并且在细胞表面上表达。ctl裂解感染微生物(例如,比如病毒)的细胞,诱导并促进细胞内微生物的破坏。在某些实施方案中,ctl裂解癌细胞。
在一些实施方案中,t细胞可以在适当的条件下在表达潜伏膜蛋白1(lmp1)的细胞上扩增。这里使用的术语“适宜条件”包括t细胞与表达潜伏膜蛋白1(lmp1)的细胞共培养,可以每4-5天补充一次。il-2可以从第3天开始添加。
本文所使用的术语“细胞”、“细胞系”和“细胞培养”包括后代,这些后代是任何后代和所有后代。可以理解,由于有意或无意的突变,所有后代可能不完全相同。
术语“b细胞”是指在骨髓中发育的一种淋巴细胞,在血液和淋巴中循环。当遇到特定的外源抗原时,b细胞分化为一种浆细胞克隆体和一种记忆细胞克隆体,这种浆细胞分泌特异性抗体,并且所述记忆细胞克隆体在再次遇到该抗原时分化成制备抗体的浆细胞。
术语“天然b细胞”指的是没有暴露在外源抗原中的b细胞,因此该b细胞没有进行分化作用分化成记忆细胞或者浆细胞克隆体。
术语“赘生b细胞”指的是经历异常生长方式的b细胞。
“载体”是物质的组成,它包含分离的核酸,并且可以用于将分离的核酸输送到细胞内部。本领域已知许多载体,包括但不限于线性多核苷酸、与离子或两亲化合物相关的多核苷酸、质粒和病毒。因此,术语“载体”包括自主复制的质粒或病毒。该术语还应解释为包括促进核酸向细胞中转移的非质粒和非病毒化合物,例如多聚赖氨酸化合物、脂质体等。病毒载体的实施例包括但不限于腺病毒载体、腺病毒相关病毒载体、逆转录病毒载体、慢病毒载体等等。
如本文所使用的,术语“表达载体”是指包括重组多核苷酸的外源载体,所述重组多核苷酸包括与待表达的核苷酸序列可操作地连接的表达控制序列。表达载体包括足够的适合于表达的顺式作用成分,其它适合于表达的成分可以由宿主细胞或在体外表达系统中提供。表达载体包括本领域已知的所有那些,例如结合重组多聚核苷酸的装配型质粒、质粒(例如,裸露的或包含在脂质体中的)和病毒(例如,慢病毒、逆转录病毒、腺病毒和腺相关病毒)。本文所使用的表达载体缺乏至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的埃-巴二氏病毒(ebv)基因组,因此不能复制埃-巴二氏病毒(ebv)病毒基因组。
术语“宿主细胞”是指对用核酸构建物或者包括多聚核苷酸的表达载体进行的转化、转染、转导敏感的任何细胞类型。术语“宿主细胞”包括母代细胞的任何后代,由于复制期间发生的突变,这些后代可能不与母代细胞相同。
如这里所使用的,术语“病毒载体”包括载体dna/rna以及其产生的病毒颗粒。病毒载体可以具有复制能力,或者可以具有遗传残缺以至于是不能复制的或者复制能力很弱的。术语“病毒颗粒”指的是病毒基因组以及所述病毒基因组外周的蛋白质包覆层,在这里也叫做“壳体”。在某些实施方案中,所述病毒颗粒还包括蛋白质包覆层周围的脂质包裹。病毒基因组包括位于用于生产病毒载体颗粒的表达载体中的ltr之间的核苷酸序列。本领域已知的各种病毒载体,例如腺病毒载体、腺相关病毒载体、慢病毒载体和逆转录病毒载体可以被修饰以表达或携带核苷酸序列。
非病毒载体包括但不限于脂质体和脂复合物、聚合物和多肽、合成颗粒等。在某些方面,脂质体或脂复合物具有中性、阴性或阳性电荷,并且可以包括卡多脂、茴香酰胺共轭聚乙二醇、二烯酰基磷脂酰胆碱、或各种其它中性、阴离子型或阳离子型脂质或脂质共轭物。载体可以与阳离子聚合物(例如,聚乙烯亚胺(pei))、可生物降解的阳离子多糖(例如,壳聚糖)或阳离子多肽(例如,阿替洛拉胶、聚赖氨酸和鱼精蛋白)复合。
如这里所使用的“转染”或“转导”是指将外源核酸转移或导入宿主细胞的过程。“转染的”或“转导的”细胞是用外源核酸转染或转导的细胞。该细胞包括初级目标细胞及其后代。
术语“许多”指两种或两种以上的物质,如细胞或抗原。就本申请而言,术语“一个”、“一种”或“所述”指任何东西中的一个或多个,例如一个细胞或所述细胞、一个抗原或所述抗原。就本申请而言,许多东西可以是同源的或异源的。就本申请而言,“同源”一词指许多相同的东西,如细胞或抗原。就本申请而言,“异源”一词指至少有两种不同类型的任何东西,例如细胞或抗原。
如这里所使用的“外源性”一词当涉及核酸和特定细胞时,是指任何并非来源于自然界中天然存在的特定细胞的核酸。因此,非天然存在的核酸一旦被引入细胞,就被认为是外源性的。自然产生的核酸对于特定的细胞也可能是外源性的。例如,从主体x的细胞中分离的整个染色体一旦被引入主体y的细胞,则相对于此主体y的细胞,主体x的染色体就是外源核酸。
术语“核酸”或者“多聚核苷酸”指的是脱氧核糖核酸或者核糖核酸及其单链或者双链形式的聚合物。除非另有明确说明,该术语包括含有已知天然核苷酸类似物的核酸,所述已知的天然核酸类似物与参考核酸具有类似的性质并且与天然存在的核苷酸以类似的方式代谢。除非另有描述,具体的核酸序列还隐含包括其保守性的修饰变体(例如,简并密码子取代)、等位基因、直系同源物单核苷酸多态性(snps)和互补序列以及其他明确指出的序列。具体地说,用混合基和/或脱氧肌酐残基取代第三位置上一个或者一个以上选定的(或者全部)密码子可以产生序列,使用这些序列可以完成简并密码子取代作用(batzeretal.,nucleicacidres.19:5081(1991);ohtsukaetal.,j.biol.chem.260:2605-2608(1985);和rossolinietal.,mol.cell.probes8:91-98(1994))
术语“启动子”指的是核酸序列,通常位于编码序列的上游(5’),该序列将核酸序列转录为mrna。启动子或启动子区域通常为rna聚合酶和正确启动转录所必需的其他因素提供识别位点。如本文所预计的,启动子或启动子区域包括通过插入或删除调节区域、使启动子经历随机或定点突变等衍生的启动子的变异。可根据相对于其转录活性已被预先评估的启动子,待测启动子产生的rna量或在细胞或者组织中积累的蛋白质的量,来计算启动子的活性或者浓度。
术语“表达盒”特别指的是核酸分子和核酸分子的区域,包含分别位于编码区、编码区域和开放阅读框域前面的调节因子或启动子,以及位于编码区域后面的转录终止因子。分别位于编码区域前面的调节因子和启动子可以是组成性的,即永久激活转录的启动子(例如,鼠的干细胞病毒(mscv)启动子),或可调节的启动子,即可被开启和/或关闭的启动子。表达盒的编码区域可以是连续的开放阅读框,如cdna在5’端具有起始密码子,在3’端具有终止密码子的情况。编码区可以包括基因组或编码外显子和散布的非编码内含子的新组合排列。然而,表达盒的编码区域可以包括几个开发式阅读框,由所谓的ires(内部核糖体入口站点)分开。特别地,如本文所使用的,表达盒包括编码多肽的核酸序列,该多肽与seqidno:1具有70%至80%、81%至85%、86%至90%、91%至95%、96%至100%或100%的序列一致性。
短语“可操作连接”是指两个或更多个核酸区域或核酸序列的功能性空间排列。例如,启动子区域可以相对于核酸序列定位,使得核酸序列的转录由启动子区域引导。因此,启动子区域与核酸序列“可操作地连接”。
如本文所使用的,术语“自体同源”是指任何来源于同一主体的材料,其稍后将重新引入该主体。
如这里所使用的,术语“多肽”被定义为氨基酸残基链,通常具有确定的序列。如这里所使用的,术语多肽可与术语“肽”和“蛋白质”互换。
如这里所使用的,术语“治疗”包括预防特定疾病或病症,或减轻与特定疾病或病症相关的一个或多个症状和/或预防或消除这些症状。如这里所使用的,药物的“有效”量或“治疗有效量”是指无毒但足以提供所需效果的药物量。例如,一个理想的效果是预防或治疗乳腺癌。“有效”的量将根据个体的年龄、一般情况、给药方式等因素依主体而变化。因此,并不总是可能指定准确的“有效量”。然而,在任何个别情况下,适当的“有效”量可以由本领域普通技术人员使用常规实验来确定。
如这里所使用的,术语“体内”指的是发生在活体内部的过程。术语“体外”指的是发生在活体外部的过程。
术语“增殖能力”是指细胞经历细胞分裂的能力。可通过本领域已知的任何方法测量细胞的增殖能力,所述方法包括但不限于,用合适的生长因子刺激前后细胞的计数、荧光染料测定、将brdu掺入增殖细胞的dna、将放射性标记的类似物如3h-胸腺嘧啶掺入the增殖细胞的dna和/或检测细胞增殖的细胞标志物。
“主体”包括但不限于哺乳动物,例如人类、驯养动物或家畜,包括猫、狗、牛和马。如这里所使用的术语“患者”,在没有进一步指定的情况下,指的是包括任何温血脊椎动物驯养的动物(例如,包括但不限于家畜、马、猫、狗和其他宠物)和人。
“外科切除”包括但不限于切除异常组织的外科手术,其中可以同时切除正常的周围组织。异常组织包括但不限于肿瘤。
术语“联合疗法”是指施用两种或更多种治疗剂来治疗本公开中所述的治疗状况或紊乱。这种给药包括以基本同时的方式共同给药这些治疗剂,例如以具有固定活性成分比例的单个胶囊或以针对每个活性成分的多个单独的胶囊。此外,这种给药还包括按顺序使用每种治疗剂。无论哪种情况,治疗方案都将提供治疗组合在治疗本文所述的条件或障碍方面的有益效果。
术语“实体肿瘤”是指异常组织块。在某些实施方案中,组织块不包含囊肿或液体区域。实体肿瘤可以是良性的或恶性的。实体肿瘤的实施例是肉瘤、癌。白血病和淋巴瘤一般不形成实体肿瘤。在某些实施方案中,黑色素瘤、胃癌和鼻咽癌形成实体肿瘤。
本领域普通技术人员可以理解,术语“免疫检查点”是指cd4和cd8t细胞或其他细胞(如肿瘤细胞或其他免疫调节细胞)的细胞表面的一组分子。这些分子有效地起到“刹车”作用,降低或抑制抗肿瘤免疫应答。免疫检查点分子包括但不限于直接抑制免疫细胞的程序性死亡1(pd-1)、细胞毒性t淋巴细胞抗原4(ctla-4)、b7-h1(也称为程序性细胞死亡蛋白质1配位体(pdl1))和淋巴细胞活化基因3(lag3)。在本申请的方法中可用作免疫检查点抑制剂的免疫治疗剂包括但不限于抗pd1、抗b7-h1、抗ctla-4(易普利姆玛(ipilimumab))和抗lag3。
此外,根据本公开,在本领域技术范围内,可以使用传统的分子生物学、微生物学和重组dna技术。这些技术在文献中得到了充分的解释。参见,例如,sambrook,fritsch&maniatis,分子克隆:《实验室手册》,第二版(1989)冷泉港实验室出版社,纽约,冷泉港(在这里写作“sambrooketal.,1989”);dna克隆:《实用方法》,第一卷和第二卷(d.n.glovered.1985);寡核苷酸合成(m.j.gait.1984);核酸杂交[b.d.hames&s.j.higginseds.(1985)];转录与翻译[b.d.hames&s.j.higgins,eds.(1984)];动物细胞培养[r.i.freshney,ed.(1986)];固定化细胞和酶[irl出版社,(1986)];b.per.,分子克隆实用指南(1984);f.m.ausubel等。(编辑),《分子生物学中的当前协议》,johnwiley&sons,inc.(1994)。
提供以下实施例以进一步解释本申请的优势和特点,但是不作为对本申请范围的限制。这些实施例只起到说明目的。
实施例
材料和方法
鼠
c57bl/6j(b6),cd19-cre,ciita–/–,cd40–/–,foxp3dtr/gfp和yfpflstop(全部在b6背景上)来自jackson实验室。rag2–/–常见γ链–/–(rag2–/–γc–/–)小鼠在我们的小鼠群体中繁殖或从taconic购买的。在balb/c背景上的lmp1flstop等位基因之前已经被描述过(b.zhangetal.,immunesurveillanceandtherapyoflymphomasdrivenbyepstein-barrvirusproteinlmp1inamousemodel.cell148,739(feb17,2012))。通过使cd19-cre;foxp3dtr/gfp与lmp1flstop小鼠杂交产生在(c57bl/6xbalb/c)f1(cb6f1)背景上的foxp3dtr/gfp;cd19-cre;lmp1flstop(foxp3dtr/gfp;cl)小鼠。在实验中仅适用雄性foxp3dtr/gfp;cl小鼠。cd40+/–;cd19-cre小鼠与cd40+/–;lmp1flstop小鼠交配产生cd40–/–;cl小鼠及其相应的参照。所有小鼠在特定的无病原体条件下在动物设施中繁殖和饲养。所有动物实验均按照dfci机构动物护理和使用委员会批准的程序进行。
流式细胞术
淋巴细胞单细胞悬浮液用对下列来自bd生物科技公司、biolegend或者ebioscience公司的cd3e(145-2c11),cd4(l3t4),cd8(53-6.7),cd19(1d3),cd25(pc61.5),cd40(3/23),cd43(s7),cd69(h1.2f3),cd70(fr70),cd80(16-10a1),cd86(gl1),4-1bbl(tks-1),ox40l(rm134l),fas(jo2),h-2kb(af6-88.5),i-ab(af6-120.1),icam-1(3e2),tcrb(h57-597),tcrvb5(mr9-4),tcrvb11(rr3-15),tcrvb12(mr11-1),ifn-g(xmg1.2),颗粒酶b(gzmb,ngzb),穿孔素(ebioomak-d),cd107a(1d4b),fasl(mfl3),trail(n2b2),foxp3(fjk-16s),eomes(dan11mag),t-bet(4b10),gata-3(twaj)和rorgt(q31-378)具有特异性单克隆抗体染色。topro3(invitrogen公司)或efluor506(ebioscience公司)被用于排除死细胞。用foxp3染色缓冲液(ebioscience公司)进行gzmb、穿孔素、foxp3、eomes、t-bet、gata-3和rorgt的细胞内染色。用ic固定/渗透缓冲液(ebioscience公司)对gzmb和ifn-g进行细胞内染色。根据制造商的使用说明书,用小鼠vβtcr筛选面板(bdbiosciences公司)分析tcrvβ储备。所有样品均在facscantoii(bd生物科学公司)上采集,并用flowjo软件(treestar)进行分析。使用facsariaii(bd生物科学公司)进行荧光激活细胞分选(facs分选)。在所有的t细胞分选实验中,cd1d四聚体(nih四聚体设施)被用来排除自然杀伤性t细胞。
逆转录病毒的构建与转导
将lmp1cdna克隆到mscv-ires-gfp或mscv-puro逆转录病毒载体上,产生mscv-lmp1-ires-gfp或mscv-lmp1-puro。为了产生表达信号缺陷型lmp1突变体lmp1tm1m的逆转录病毒,通过quikchange位点定向诱变(stratagene公司)将lmp1跨膜结构域1(tm1)的氨基酸fwly(38-41)改变为aala,并将其克隆到mscv-ires-gfp或mscv-puro逆转录病毒载体中。用20微克/毫升脂多糖(lps,sigma)体外激活cd43耗竭的脾脏b细胞,感染逆转录病毒,在lps存在下连续培养。对于用携带gfp的逆转录病毒转导的b细胞,在感染后48或72小时,细胞被彻底洗涤,然后用于下游实验(gfp+表明转导细胞成功)。对于用携带puro逆转录病毒转导的b细胞,在感染后24小时用puromycin(6微克/毫升;sigma公司)选择细胞18小时,然后在新鲜培养基中彻底洗涤和回收1天,然后用于下游实验。
体外致死实验
在使用前,用celltraceviolet(invitrogen公司)标记各种靶细胞。采用流式细胞术从小鼠骨髓(bm)或脾脏中分离纯化cd4或cd8t细胞。然后以2×103靶细胞以不同的效应物:靶细胞比例在96孔圆底板中共培养4小时(在lmp1表达的b细胞/淋巴瘤细胞和相应的对照细胞上)或6小时(在cd40激活的b细胞和静止的b细胞上),然后进行活性caspase-3染色(bdbiosciences公司)(b.zhangetal.,immunesurveillanceandtherapyoflymphomasdrivenbyepstein-barrvirusproteinlmp1inamousemodel.cell148,739(feb17,2012);l.heetal.,asensitiveflowcytometry-basedcytotoxict-lymphocyteassaythroughdetectionofcleavedcaspase3intargetcells.journalofimmunologicalmethods304,43(sep,2005))。为了进行阻断实验,用抗ia/ie(m5/114.15.2)阻断抗体或同型对照大鼠igg2b(均为10μg/ml;biolegend)在37℃预孵育20分钟,而在相同条件下用fas配体中和融合蛋白rmfas-fc或同型对照人igg1(均为10微克/毫升;r&d系统)对cd4t细胞进行预培养。在所有的致死实验中,将96孔板中的效应物-靶混合物以200rpm旋转2分钟,然后于37℃下培养,并对培养物进行cd4或cd8染色以排除效应细胞,并分析细胞痕迹标记的靶细胞中的活性caspase-3水平。活性caspase-3+celltrace+细胞代表凋亡靶细胞。%特异性致死=%具有效应物和靶点的培养物的凋亡靶细胞-%具有靶点的培养物的凋亡靶细胞。
抑制mhc的t细胞增殖试验
从野生型(wt)或ciita–/–小鼠(均在c57bl6背景上)中分离cd43耗竭的脾脏b细胞,用抗cd40抗体(hm40-3,ebioscience公司)以1μg/ml激活48小时。从成年foxp3dtr/gfp;cl小鼠骨髓中分离出cd4效应t细胞(不包括gfp+调节性t细胞(tregs))或经lmp1表达b细胞体外预处理的cd4t细胞被分类并用celltrace(invitrogen公司)进行染色,然后在新鲜rpmi培养基中培养6小时,以确保t细胞在与靶细胞共培养之前处于静止状态。cd4t细胞(1×105细胞)随后与靶细胞、cd40激活的wt或ciita–/–b细胞(1×105细胞)在96孔u底板中共培养4天,然后用topro3、抗-tcr、-cd4和-cd19染色,并用流式细胞仪分析cd4细胞中的细胞痕迹稀释度。
lmp1定位分析
将lmp1或lmp1tm1mcdna分别亚克隆到pcag-gfp载体(addgene,#11150)中,获得c端gfp标记的构建物。然后将质粒(pcag-lmp1-gfp、pcag-lmp1tm1m-gfp或载体对照pcag-gfp)电穿孔到小鼠淋巴瘤b细胞(系775)中(b.zhangetal.,anoncogenicroleforalternativenf-kappabsignalingindlbclrevealeduponderegulatedbcl6expression.cellreports11,715(may5,2015))。电穿孔24小时后,用dna特异性荧光染料hoechst33342(蓝色,西格玛公司)反染细胞,并用荧光显微镜成像。
基因表达曲线
用磁激活细胞分选(miltenyi生物技术公司)从yfpflstop/+和lmp1flstop/yfpflstop小鼠的脾脏中分离出b细胞,并如之前的描述用tat-cre处理(s.b.koralovetal.,dicerablationaffectsantibodydiversityandcellsurvivalintheblymphocytelineage.cell132,860(mar7,2008))。治疗后第2天,根据制造商的规格用三唑试剂(invitrogen)从细胞中提取总rna,然后在dfci的分子生物学核心设施用基因芯片小鼠基因2.0st阵列(affymetrix)进行微阵列分析。
表达lmp1的b细胞体外产生细胞毒性cd4t细胞
从幼年b6小鼠脾脏中分离的cd4t细胞以每孔1.5x106的比例接种在12孔板中,照射(500rad)的lmp1+或lmp1tm1m+b细胞以1:1的比例接种。5天后,用0.75x106相同的靶b细胞再次刺激cd4t细胞,持续2天。所有细胞在添加10%胎牛血清(sigma公司)、100iu/ml青霉素(gibco公司)、10mmhepes(corning公司)、1x非必需氨基酸(corning公司)、1mm丙酮酸钠(gibco公司)和50_m-巯基乙醇(sigma公司)的rpmi1640培养基中培养,不添加任何生长因子或细胞因子.
lmp1+b细胞介导的细胞毒性t细胞产生过程中共刺激配体的阻断
用cd70(fr70,大鼠igg2b)、ox40l(rm134l,大鼠igg2b)和/或4-1bbl(tks-1,大鼠igg2a)或相应同型对照(均为10μg/ml;biolegend)的阻断抗体,在37℃预培养50min。在24孔板中以1:1的比例与靶b细胞共培养。共培养3天后,收集cd8t细胞用于facs分析,而第5天用0.5×106的相同靶b细胞再次刺激cd4t细胞2天,然后进行facs分析
统计分析
使用非配对双尾学生t检验统计学显著性,除有特别指出外,p<0.05为显著性(ns,不显著;*p<0.05,***p<0.01,***p<0.001,******p<0.0001)。
实施例1.b细胞特异性lmp1转基因小鼠模型的建立与鉴定
将衍生自ebvb95-8株的lmp1编码序列放入rosa26位点,然后放入loxp侧翼的neor-stop盒中,以生成条件性lmp1敲入等位基因,lmp1flstop,该等位基因允许通过cre/loxp介导的重组切除转录/翻译stop盒表达lmp1(图2a)。lmp1flstop菌株是从balb/c来源的胚胎干细胞(es)中生成的。从lmp1flstop小鼠中分离的脾脏b细胞经tat-cre处理后表达lmp1并在细胞培养中增殖,而经tat-cre处理后的野生型b细胞随时间而死亡。lmp1的诱导伴随着cd95/fas的上调。随后,fas被用作报告lmp1在b细胞中的表达。
为了建立b细胞特异性lmp1转基因小鼠模型,用cd19-cre(c57bl/6)菌株与lmp1flstop(balb/c)菌株杂交。将纯合的cd19-cre小鼠与纯合的或杂合的lmp1flstop或balb/c小鼠杂交以产生cd19-cre;lmp1flstop小鼠(以下称为“cl”)或cd19-cre/+对照小鼠(以下称为“c”),均以cb6f1为背景(c57bl/6×balb/c杂交的f1后代)。cl小鼠在b细胞中特异表达lmp1转基因。cl小鼠的分析显示,表达lmp1的b细胞被t细胞清除,与人类ebv病毒感染的b细胞相似;t细胞耗竭导致小鼠体内快速致命的b细胞增殖和淋巴形成,类似于免疫抑制患者的ebv病毒驱动的恶性肿瘤(图2b)。这些实验表明lmp1在体内监测和转化ebv病毒感染的b细胞方面起中心作用.
实施例2.cd4和cd8t细胞都对表达lmp1的b细胞产生细胞毒性反应
对cl小鼠免疫监测的详细时间进程和性质进行了研究。对表达lmp1的b细胞动力学和t细胞反应的分析表明,在出生后6-8天,针对表达lmp1的b细胞的t细胞反应达到高峰,随后迅速消除表达lmp1的b细胞(图3a和3b)。t细胞随后收缩,但长期记忆形成并持续,并继续消除骨髓中新出现的表达lmp1的b细胞(bm,b细胞发育的主要器官)。因此,在成年小鼠的bm中检测到少量表达lmp1的b细胞,但在脾脏中没有检测到(图3a和3b)。
特别引人注目的是cd4细胞的高水平的细胞毒性活性,这些细胞具有与cd8细胞相似的细胞毒性功能。6-8天cl小鼠骨髓和脾脏中的cd4和cd8细胞在体外对lmp1表达淋巴瘤细胞(来源于t细胞缺陷cl小鼠)显示出强大的致死活性(图4)。值得注意的是,从6-8天cl小鼠中分离的cd4细胞表达穿孔素、颗粒酶b(gzmb)和cd107a,其水平与cd8细胞的水平相似(图5a-d)。此外,这些细胞表达高水平的fas配体(fasl),但不表达trail(图5a-d和数据未显示),表明它们通过穿孔颗粒酶以及fasl介导的途径杀死表达lmp1的b细胞。然而,鉴于lmp1表达的b细胞在缺乏fas的小鼠中仍然受到控制,而在缺乏穿孔素的小鼠中则不受控制,穿孔素-颗粒酶途径似乎是这些细胞毒性t细胞的主要致死机制。总之,我们的数据表明,由b细胞表达的lmp1诱导有效的细胞毒性cd4和cd8t细胞介导的免疫。
尽管成年cl小鼠骨髓中的cd4和cd8细胞保持活化状态(cd69+),但是这些cd4细胞显示出很少的细胞毒性,而来自相同小鼠的cd8细胞则相反(图6a)。然而,当cd4细胞与表达lmp1的淋巴瘤细胞共转染到淋巴细胞减少宿主时,它们表现出比cd8细胞更高的抗肿瘤活性,并且在存在阻断ifnγ和tnfα的抗体时,它们的抗肿瘤活性保持不变。值得注意的是,从过继宿主中回收的cd4细胞在体外显示出强大的杀伤活性(图6a),与细胞毒性分子—穿孔素、颗粒酶b、cd107a和fasl的表达相关,与移植前的供体细胞形成鲜明对比(图6b)
通过与lmp1表达的淋巴瘤细胞共转移,慢性cd4细胞恢复了细胞毒性,并介导了比cd8细胞更好的抗肿瘤活性,这一发现促使我们测试和比较这些cd4和cd8细胞在lmp1驱动的原发性淋巴瘤中的治疗效果。考虑到这些小鼠的肿瘤负担过重,可能建立免疫抑制环境,从而阻碍过继性t细胞的扩增和功能,我们用放射治疗(rt)对小鼠进行预处理,以降低肿瘤负担并创造有利于过继性t细胞扩增和功能的淋巴细胞减少条件,随后进行t单剂量(1x106/受体)cd4或cd8细胞的转移。我们发现,单用rt可以中等程度地提高荷瘤小鼠的存活率。与过继cd8细胞的结合进一步延长了小鼠的存活,并且cd4细胞显示出比cd8细胞更强的抗肿瘤活性(图6c)。因此,当cd4细胞发展成细胞毒性效应物时,在肿瘤控制方面可以优于cd8细胞,如在这个原发性淋巴瘤模型中所证明的。
实施例3.cd4和cd8t细胞对lmp1表达的b细胞产生多克隆反应
为了评估参与免疫应答的t细胞的多样性,我们评估了来自6-8天cl小鼠的cd4(不包括cd25+foxp3+tregs)和cd8细胞(这些细胞具有高的杀伤活性和表达效应记忆标记cd44)上的tcrvβ库,并与来自对照小鼠(cd19-cre/+)的细胞进行比较。我们还检测了成年cl小鼠骨髓中的t细胞,其中cd4细胞显示出最小的杀伤活性,而cd8细胞保持着良好的杀伤活性(这些cd4和cd8细胞大多数是抗原特异性的)。第6-8天和成年cl小鼠的cd8细胞显示多克隆vβs(第6-8天cl小鼠显示vβ13轻度增加,而成年cl小鼠的vβ13水平与对照组小鼠相似;图7a)。第6-8天cl小鼠的cd4细胞也显示出明显的多克隆反应,尽管一些vβtcr(vβ5,-11和-12)显示出与对照小鼠相比不同程度的富集(图7b)。通过体外致死试验,携带vβ5、-11和-12tcr的cd4细胞显示出与携带其他tcr的细胞类似的致死活性(图7c),表明cl小鼠中cd4细胞的致死活性与受限的tcrvβ链无关,并且使得该反应不太可能由超抗原介导。在成年cl小鼠的bm中,vβ5、-11和-12tcr的频率已经降低到与对照小鼠相当的水平,而vβ8.1/8.2tcr在这个慢性阶段是偏斜的(图7b)。通过转移,成年cl小鼠bm的cd4细胞携带了广泛的tcr库(图7b),但它们已经恢复了致死活性(图6)。vβ8.1/8.2tcr的进一步倾斜可能是由于它们在供体细胞中占优势(图7b)。这些观察重申,t细胞的致死活性与受限的tcrvβ链无关。总的来说,这些数据表明cd4和cd8t细胞都对表达lmp1的b细胞产生多克隆反应。
实施例4.t细胞识别缺乏lmp1表达的cd40激活的b细胞
lmp1是组成活性cd40的功能类似物,它是抗原呈递细胞(apc)功能成熟的主要共刺激受体。我们发现,与cd40的激活类似,lmp1在b细胞中的表达导致对诱导产生生产性t细胞应答至关重要的关键蛋白的上调,包括mhc-i、mhc-ii、cd80/b7-1、cd86/b7-2和icam-1(其中许多分子甚至高于cd40激活的b细胞中(图8)。这些可能导致增强的抗原呈递和共同刺激,包括内源性抗原呈递(roweetal.,1995;schultzeetal.,1995;schultzeetal.,1997;smithetal.,2009).
为了确定lmp1信号诱导的b细胞高免疫原性是否是t细胞应答所必需的,我们构建了lmp1突变体,其中跨膜结构域1(tm1)的氨基酸fwly(38-41)被改变为aala(称为lmp1tm1m):这消除了lmp1聚集和信号传导(yasuietal.,2004)(图9a),并推测其免疫刺激功能(smithetal.,2009)。在体外致死试验中,来自第6-8天cl小鼠的细胞毒性cd4和cd8t细胞有效地识别并杀死表达野生型lmp1的b细胞,但不能杀死表达信号死亡突变体lmp1tm1m的b细胞,或载体转导或未转导的对照b细胞(后者实际上是lps激活的b细胞)(图9b)。因此,t细胞识别lmp1表达的b细胞需要lmp1信号,这使得b细胞具有高度免疫原性
因为lmp1是组成活性cd40的功能类似物,并且因为lmp1和cd40都激活b细胞的免疫原性,并且可能增强内源性抗原呈递(见上文),所以我们测试来自cl小鼠的引物t细胞是否通过它们与表达lmp1的b细胞共有的细胞抗原识别cd40激活的野生型(wt)b细胞。我们发现,来自第6-8天cl小鼠的细胞毒性cd4和cd8t细胞裂解了用抗cd40预激活的wtb细胞,但不是静止的(天然的)b细胞(图10a)。这些数据提示,具有lmp1信号传导的b细胞提供内源性抗原,该抗原被溶细胞性t细胞所靶向。cd40激活的wtb细胞的cd4t细胞致死活性通过阻断对mhcii类的识别而被抑制(图10b)。通过阻断fasl-fas凋亡通路(cd40激活的b细胞表达fas,lmp1表达b细胞(图8))和阻断mhc-ii和fasl均导致杀伤活性显著降低,也可以减少杀伤(图10b)。这些数据表明,细胞毒性t细胞通过识别自身肽/mhc复合物来靶向lmp1表达的b细胞,并通过穿孔素-颗粒酶和fasl-fas依赖途径发挥其溶细胞活性。
通过分析cd4效应子/记忆t细胞(不包括已知具有自反应性的foxp3+tregs)对来自wt和ciita–/–(缺乏mhc-ii表达)小鼠的cd40活化b细胞的增殖反应,获得了cl小鼠中的t细胞识别自肽/mhc复合物的明确证据。相当一部分效应子/记忆cd4细胞以mhc-ii限制性方式在cd40激活的wtb细胞上剧烈增殖(图11)。
总之,我们的数据表明,t细胞通过细胞抗原识别和裂解表达lmp1的b细胞,其中一些还出现在通过类似cd40途径激活的wtb细胞上(图10-11)。由于cl小鼠的细胞毒性t细胞既不裂解静止的b细胞(图10a)又不裂解lps激活的wtb细胞(通过与lmp1信号转导无关的通路;图9b),所以看起来由lmp1信号转导诱导的细胞抗原而不是普通的b细胞抗原是t细胞的主要目标。考虑到在免疫应答的急性期tcr储备非常多样化(类似于幼稚小鼠),并且之后没有任何vβtcr的克隆性缺失(图7a-c),可以推断t细胞靶向大量的lmp1信号诱导的细胞抗原,而不是超抗原。目前,我们不能排除lmp1衍生肽参与cl小鼠t细胞应答。然而,这种反应可能太小,无法用我们先前的肽筛选试验检测到。
实施例5.lmp1诱导独立于cd40信号传导的免疫监视
虽然lmp1信号转导和组成性cd40活化作用在一定程度上增强细胞抗原呈递以及共刺激作用,但免疫监视仅见于b细胞表达lmp1的小鼠,而不见于b细胞表达lmp1-cd40融合蛋白(与细胞内信号转导融合的lmp1跨膜区)的小鼠。以cd40为主,使cd40通路构成性活跃;两个小鼠模型使用相同的基因表达策略,即敲入rosa26位点)(homig-holzeletal.,2008;zhangetal.,2012).这些结果提示,lmp1信号转导区与cd40信号转导区不同,它具有诱导免疫监视的能力。然而,考虑到b细胞中lmp1信号转导上调cd40的表达(图12a),我们通过将cl小鼠培育成cd40–/-背景,通过有效放大cd40信号转导来阐明lmp1诱导免疫监视的可能性。比较cl小鼠的cd40-null和-wt背景表明lmp1表达的b细胞被激活的cd4和cd8t细胞有效地清除,而不管cd40状态如何(图12b-d)。换句话说,lmp1诱导独立于cd40信号传导的免疫监视。
实施例6.通过cd70、ox40l和4-1bbl的共刺激作用lmp1-b细胞驱动细胞毒性t细胞
接下来,我们试图揭示lmp1信号传导诱导潜在的细胞毒性t细胞反应的分子机制。尽管cd8t细胞在被抗原和各种共刺激信号启动时本能地发展细胞毒性能力,但cd4t细胞是我们系统中多潜能且唯一地朝向细胞毒性表型极化的细胞,因此我们专注于鉴定一种共刺激分子,这种共刺激分子在表达lmp1的b细胞上表达并能诱导cd4细胞的细胞毒性分化作用。cd4细胞的毒性分化。最近,已经描述了类似的颗粒酶/穿孔素特征的细胞毒性cd4t细胞,其分化完全依赖于t-box转录因子脱中胚蛋白(eomesodermin(eomes)),但不依赖于th1极化的t-bet(curran等人,2013;qui等人,2011;swain等人,2012)。此外,4-1bb的系统活化作用和/或ox40共刺激途径(通过激动剂抗体)诱导抗原启动的cd4细胞中高水平的eomes,从而驱动其细胞毒性分化(curran等人,2013;qui等人,2011)。系统cd27活化作用还诱导eomes在cd4细胞中的表达(curran等人,2013)。我们的数据表明,与对照组b细胞相比,表达lmp1的b细胞表达显著增强的4-1bb配体(4-1bbl)、ox40配体(ox40l)和cd70(cd27配体)水平。促炎症性细胞因子,包括il27和il15,也可以在细胞毒性cd4细胞生成中发挥支持作用(curran等人,2013)。然而,除了il27亚基β的基因外,其他细胞因子基因在lmp1-b细胞中仅被少量诱导(如果完全被诱导)(图13c)
与4-1bb和ox40(以及cd27)途径在诱导t细胞eomes-颗粒酶程序方面的可能作用相一致,在6-8天cl小鼠中主要cd4细胞群中能够表达高水平的eomes和gzmb(图14a)。已知系统性4-1bb活化作用会导致eomes的选择性表达,而没有t-bet表达(curran等人,2013),而4-1bb和ox40的刺激性活化作用在cd4细胞中诱导eomes和t-bet(qui等人,2011)。因为lmp1-b细胞表达两种途径的配体,我们还检测了t-bet在cd4细胞中的表达:对来自cl小鼠的cd4细胞进行eomes和t-bet表达的分析表明eomes+t-bet-细胞、eomes+t-bet+和eomes-t-bet+是三种效应细胞,这一结果与对照幼稚小鼠的cd4细胞成鲜明对比(图14b)。此外,来自cl小鼠的cd4细胞表达gzmb和/或ifn-γ,这与来自对照幼稚小鼠的cd4细胞表达结果相反(图14b)。gzmb表达依赖于eomes(但不是t-bet)(curran等人,2013;qui等人,2011),而ifn-γ主要由t-bet驱动(swain等人,2012);因此,我们的facs分析揭示了cl小鼠中效应cd4细胞的三种亚型:(i)eomes/gzmb特征性的细胞毒性细胞(类似于(curran等人,2013)中所描述的那些细胞;(ii)t-bet/ifn-γ特征特化的th1细胞(swain等人,2012);(iii)显示出(i)和(ii)中描述的两种细胞的特征的群体(这些细胞类似于(qui等人,2011)中描述的“细胞毒性cd4th1细胞”)。来自cl小鼠的cd4细胞没有显示gata3或rorγt的表达(图15a-b),表明没有对th2或th17亚群的承诺。共刺激途径可能同样影响cd8细胞(curran等人,2013;qui等人,2011),但与cd4对应物相比,第6-8天cl小鼠的cd8细胞发展成单一、几乎一致的群体,即eomes+t-bet+gzmb+ifn-γ+(图14c)。
据发现,lmp1+b细胞有效地呈递细胞抗原,同时提供高水平的共刺激配体(4-1bbl、ox40l和cd70),这些配体与细胞毒性t细胞编程有关,这表明这些b细胞可能作为apc系统足以诱导ctl对细胞抗原的反应。的确,我们发现,在体外与lmp1+b细胞共培养较短时间(7天)(不添加任何外源性细胞因子)后,来自幼稚的wt小鼠的cd4t细胞的相当一部分被激活/扩增;这种效应依赖于b细胞中的lmp1信号传导,因为cd4细胞未能在表达lmp1tm1m的b细胞上扩增(图16a)。由lmp1-b细胞激活/扩增的大部分cd4细胞启动eomes和/或t-bet程序(图16b),产生细胞毒性(图16c),并以mhc-ii依赖的方式识别cd40激活的wtb细胞(图16d)。
该体外系统为评估4-1bbl、ox40l和cd70在lmp1+b细胞驱动的细胞毒性t细胞生成中的作用提供了独特的机会。在该系统中,我们观察到,当与lmp1+b细胞共培养时,cd4细胞在第7天产生最佳的eomes+群体,而cd8细胞在第3天就容易分化为eomes+。在培养中使用抗体介导的阻断,我们发现4-1bbl阻断没有改变具有eomes+表型的cd4细胞的比例(图16e),或eomes+cd4细胞的绝对数量(图16f);ox40l阻断导致eomes+细胞的比例略有减少,但数量显著减少;以及cd70阻断导致eomes+cd4细胞比例和总数的更显著的减少(图16e、16f和16g)。对于它们的cd8对应物,阻断ox40l和cd70各自降低了eomes+种群的频率和数量,其降低程度与cd4细胞相似;然而,4-1bbl阻断也降低了频率,并显著减少了eomes+cd8细胞的数量(图16h、16i和16j),这与缺乏相关作用的cd4细胞中观察到的情况形成鲜明对比。此外,阻断所有三种共刺激配体几乎完全消除了eomes+cd8细胞的产生(图16h、16i和16j)。总之,这些结果表明表达lmp1的b细胞通过cd70和ox40l介导的共刺激作用来驱动cd4ctl的分化和扩增,以及通过cd70、ox40l和4-1bbl来驱动cd8ctl的分化和扩增。cd70在两种类型的ctl的生成中具有更显著的作用。
总之,我们的发现表明,lmp1信号传导通过增强内源性抗原呈递和强有力的共同刺激(通过cd70、ox40l和4-1bbl),将b细胞转变为高度免疫原性apc,并驱动细胞毒性cd4和cd8t细胞反应。目标抗原似乎包括大量lmp1信号诱导的细胞抗原(参见图1a中的示意图)
实施例7:一个新的概念:lmp1信号转导诱导cd4+和cd8+细胞毒性t细胞对多种taa的强力肿瘤免疫
在这里,我们的研究结果表明,lmp1信号传导激活b细胞呈递细胞抗原,同时通过cd70、ox40配体和4-1bb配体提供共刺激信号,诱导细胞毒性cd4和cd8t细胞杀伤lmp1表达的b细胞。这项工作提供了一种机制,在此机制中,t细胞通过细胞和病毒抗原识别和消除ebv感染或转化细胞。
cl小鼠中反应性t细胞上的多克隆tcr表明多种细胞抗原被靶向。这就提出了一个问题,为什么病毒会进化出一种策略,诱导宿主免疫监视,靶向广泛的细胞抗原。也许,这对于长期的病毒-宿主共存是有利的。ebv快速驱动b细胞增殖和转化,在此过程中,lmp1开启多个细胞致癌途径。同时,lmp1信号转导通过有效呈递病毒抗原和lmp1信号诱导的细胞抗原,以及通过针对细胞毒性cd8和cd4细胞(以及th1型cd4细胞)分化强有力的刺激作用,使受感染细胞具有高度免疫原性。因此,在免疫应答中招募了更大的tcr库和多个效应细胞臂,这能够快速消除表达ebv/lmp1的b细胞,并防止致命的淋巴细胞增殖和淋巴形成。携带休眠病毒的b细胞得以幸免,允许病毒在宿主中持续存在,并在人群中有效地传播。
细胞毒性t细胞通过多种细胞抗原识别lmp1+b细胞(和lmp1驱动的淋巴瘤细胞),这些细胞抗原主要由lmp1信号传导诱导产生。因为lmp1是ebv驱动肿瘤发生的关键癌蛋白(kaye,etal.(1993)procnatlacadsciusa.90(19):9150–54),lmp1诱导t细胞识别的细胞抗原为taa,这种taa属于“过表达抗原”亚群(coulieetal.(2014)natrevcancer14(2):135–46)。我们这里描述的研究使我们提出了一个新的概念:埃-巴二氏病毒
6262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262626262毒lmp1蛋白通过信号转导诱导cd4+和cd8+细胞毒性t细胞对多种taa的有效肿瘤免疫。基本的分子过程在图1a中的示意性模型中说明:在b细胞中,组成性lmp1信号传导诱导大量细胞基因表达。这导致抗原处理、呈现功能(mhc)、强共刺激信号(b7-1、b7-2、icam-1,特别是cd70、ox40l和4-1bbl)上调,并诱导和/或增强某些细胞抗原(包括广泛的taa)的表达。这些抗原的呈递和同时共同刺激驱动这些抗原特异性的cd4+和cd8+t细胞的活化和细胞毒性分化。
实施例8.对示例性taa的t细胞反应
表达lmp1的b细胞所呈现的一些t细胞靶点在正常b细胞中也被诱导形成cd40信号。通过基因芯片分析,表达lmp1的b细胞中~2120个基因表达上调>2倍,cd40激活的b细胞中~50%的基因表达上调。这些异常表达的lmp1信号诱导的细胞抗原包括许多已知的taa。选择一些这样的taa来证明lmp1信号诱导的细胞抗原,特别是taa,确实是t细胞靶抗原(表1)。它们与mhc-ih-2db结合的潜在表位要么从文献(对于存活素)中已知,要么通过iedb(www.immuneepitope.org)预测。载有存活素表位肽(atfknwpfl)的四聚体或五聚体分别从nih四聚体设施或proimmune有限公司获得。
表1.已知作为免疫原性taa的lmp1信号诱导细胞基因的实施例
为了检测taa特异性t细胞反应,我们使用cd19-creert2;lmp1flstop(cert2l)模型系统。诱导cert2l系统以允许在三苯氧胺治疗时最初在小部分b细胞中激活lmp1表达,从而模拟原发性ebv感染(yasudaetal.,2013)。用存活素-四聚体(或五聚体)进行的流式细胞术分析清楚地鉴定了cert2l小鼠中cd8t细胞的群体,该群体在三苯氧胺治疗后第5天达到高峰,但在经治疗的对照小鼠中未达到高峰(图17和数据未示出)。值得注意的是,这些t细胞对存活素肽/mhc复合物具有低/中等亲和力,正如对taa特异性t细胞的预期(blankensteinetal.,2012);检测识别单个存活素表位的少量t细胞与发现表达lmp1的b细胞引起多克隆t细胞应答并进一步加强了我们的预测,即大范围的lmp1信号诱导的细胞抗原/taa被t细胞靶向。
实施例9.cd4tregs对细胞抗原特异性t细胞的调控导致免疫稳定状态
广泛的自身反应性细胞毒性t细胞确保lmp1表达b细胞的快速消除,但也可能损害其他宿主组织。重要的是,在清除了第一波表达lmp1的b细胞后,免疫系统恢复到稳定状态,正如在成年cl小鼠中观察到的,新生的lmp1表达的b细胞在不断受到监视。为了了解如何达到/维持体内稳态,我们询问了cd4tregs的作用,它是外周耐受的关键因素。我们发现cd4tregs的频率与cl小鼠的体细胞cd4杀伤活性成反比:在免疫应答的急性期(第6-8天),cd4细胞显示出高的杀伤活性(图4)和tregs的低频率(~7%)(图18a),而在慢性期(成年cl小鼠bm),cd4细胞显示出最小的致死活性(图6)和明显高频率(~50%)的tregs(图18b,左图),此外,当与表达lmp1的淋巴瘤细胞共同转移到淋巴细胞宿主时,慢性期cd4细胞恢复了致死活性(图6),并且还显示出cd4tregs的急剧下降(图18b,右图)。体外研究提供了直接证据,表明cd4tregs在慢性状态下控制cd4和cd8效应子的细胞毒性:成年cl小鼠骨髓的cd4细胞对表达lmp1的b细胞表现出明显的细胞毒性,但只有在去除cd4tregs后才表现出明显的细胞毒性(图18c),而通过将cd4tregs添加到细胞培养物中,cd8细胞对cd40激活的wtb细胞的致死作用受到抑制(图18d)。因此,慢性状态cd4tregs控制自身反应性效应t细胞,允许效应细胞持续消除新生的lmp1表达b细胞,但防止自身组织的破坏。
实施例10.表达lmp1的细胞在适应性细胞传导(act)疗法中的应用
基于lmp1在原发性或淋巴瘤b细胞中的表达诱导细胞抗原表达和呈递,并引发针对lmp1信号诱导的细胞抗原(包括许多taa)、淋巴瘤固有taa和新抗原(图1a和1b)的细胞毒性t细胞反应这一概念,来源于患者的原发性或淋巴瘤b细胞随着lmp1的表达,可用于(照射后)激活和扩增自体或供体来源的t细胞,进行适应性细胞传导(act)疗法,以治疗免疫活性宿主和免疫抑制宿主(例如,移植后和艾滋病患者)中的ebv相关b细胞淋巴瘤。ebv感染的淋巴瘤细胞表达lmp1,因此其表面呈现与输注t细胞识别的抗原相同的抗原阵列。本文描述的act策略可以类似地应用于ebv无关的b细胞淋巴瘤,通过产生靶向共享lmp1信号诱导的taa、淋巴瘤固有taa和新抗原的t细胞,从而引发抗肿瘤细胞免疫。表达lmp1的细胞(例如,肿瘤细胞)的其他谱系(即,非b谱系)也可以用于本文所述的act策略(图19a)。
为了证明表达lmp1的细胞在act中的应用,同基因野生型balb/c小鼠接受单剂量照射(在600rad的红外辐射;创造有利于过继t细胞扩增的淋巴细胞生成条件),然后同日移植a20淋巴瘤细胞(3x105细胞)。一天后,将由表达lmp1的b细胞启动的3x106cd8t细胞在培养基中培养3天,或由表达lmp1的b细胞启动的3x106cd4t细胞在培养基中培养7天,静脉注射给小鼠(图19b)。单剂量cd8t细胞(含有~50%的eomes+细胞毒效应因子)可降低a20淋巴瘤的生长(图19c)。类似地,单剂量cd4t细胞(包含~10%的eomes+细胞毒性效应因子)可减少a20淋巴瘤的生长(图19d)。这些结果表明,在b细胞中表达lmp1可以产生针对a20肿瘤的治疗性t细胞(通过共享taa)。
实施例11.适合于癌症治疗的“lmp1细胞疫苗”
基于潜伏膜蛋白1(lmp1)在原发性或淋巴瘤b细胞中的表达诱导细胞抗原表达、呈递并诱导细胞毒性t细胞对潜伏膜蛋白1(lmp1)信号诱导的细胞抗原(包括许多taa)、淋巴瘤固有taa和新抗原(图1a和1b)的反应这一概念,可以使用表达潜伏膜蛋白1(lmp1)自体原发性或淋巴瘤b细胞作为潜伏膜蛋白1(lmp1)细胞疫苗,用于体内原代t细胞治疗免疫活性宿主埃-巴二氏病毒(ebv)相关b细胞淋巴瘤。感染埃-巴二氏病毒(ebv)的淋巴瘤细胞表达潜伏膜蛋白1(lmp1),因此在表面呈现与lmp1细胞疫苗呈现的抗原相同的抗原阵列。因此,疫苗激活的t细胞对感染埃-巴二氏病毒(ebv)的淋巴瘤细胞具有细胞毒性。这里所描述的疫苗策略可以类似地应用于埃-巴二氏病毒(ebv)无关的b细胞淋巴瘤,通过诱导抗肿瘤t细胞免疫来体内对抗共享的lmp1信号诱导的taa、淋巴瘤固有taa和新抗原。表达lmp1的细胞(例如,肿瘤细胞)的其它谱系(即,非b谱系)也可用于产生本文所述的lmp1细胞疫苗(图20a)。
为了说明使用“lmp1-细胞疫苗”体内治疗癌症,选择免疫原性较差的a20淋巴瘤和b16-f10黑素瘤细胞系。
用野生型潜伏膜蛋白1(lmp1)或信号转导突变体lmp1tm1m转导a20淋巴瘤细胞(作为对照)。同源的balb/c小鼠皮下移植4×105活a20淋巴瘤细胞。移植后,用表达潜伏膜蛋白1(lmp1)或lmp1tm1m的a20细胞在不同时间点(1×106照射细胞/s.c.)接种小鼠(图20b)。用表达广泛型lmp1的a20淋巴瘤细胞接种显著延迟了a20淋巴瘤的生长(图20c)。
用潜伏膜蛋白1(lmp1)、lmp1tm1m或载体对照转染b16-f10黑色素瘤细胞。用1×105的活b16-f10黑色素瘤细胞皮下移植c57bl6小鼠。移植后,用表达潜伏膜蛋白1(lmp1)、lmp1tm1m的b16-f10细胞或载体对照在不同时间点(1×106照射细胞/s.c.)接种小鼠(图20d)。用表达野生型lmp1的b16-f10细胞接种可以显著延迟或消除b16-f10黑色素瘤肿瘤生长(图20e)。
这些结果表明,在原本免疫原性差的a20和b16肿瘤细胞中表达潜伏膜蛋白1(lmp1),可以把它们变成针对各自未修饰的(亲本)肿瘤的强有力的治疗性疫苗。
序列表
<110>达纳-法伯癌症研究院有限公司
<120>表达lmp1的细胞及其使用方法
<130>590020:dfc-010pc
<150>62/370,011
<151>2016-08-02
<150>62/506,281
<151>2017-05-15
<150>62/532,622
<151>2017-07-14
<160>5
<170>patentin第3.5版
<210>1
<211>386
<212>prt
<213>人类疱疹病毒4
<400>1
metgluhisaspleugluargglyproproglyproargargpropro
151015
argglyproproleuserserserleuglyleualaleuleuleuleu
202530
leuleualaleuleuphetrpleutyrilevalmetserasptrpthr
354045
glyglyalaleuleuvalleutyrserphealaleumetleuileile
505560
ileileleuileilepheilepheargargaspleuleucysproleu
65707580
glyalaleucysileleuleuleumetilethrleuleuleuileala
859095
leutrpasnleuhisglyglnalaleupheleuglyilevalleuphe
100105110
ilepheglycysleuleuvalleuglyiletrpiletyrleuleuglu
115120125
metleutrpargleuglyalathriletrpglnleuleualaphephe
130135140
leualaphepheleuaspleuileleuleuileilealaleutyrleu
145150155160
glnglnasntrptrpthrleuleuvalaspleuleutrpleuleuleu
165170175
pheleualaileleuiletrpmettyrtyrhisglyglnarghisser
180185190
aspgluhishishisaspaspserleuprohisproglnglnalathr
195200205
aspaspserglyhisgluseraspserasnserasngluglyarghis
210215220
hisleuleuvalserglyalaglyaspglyproproleucyssergln
225230235240
asnleuglyalaproglyglyglyproaspasnglyproglnasppro
245250255
aspasnthraspaspasnglyproglnaspproaspasnthraspasp
260265270
asnglyprohisaspproleuproglnaspproaspasnthraspasp
275280285
asnglyproglnaspproaspasnthraspaspasnglyprohisasp
290295300
proleuprohisserproseraspseralaglyasnaspglyglypro
305310315320
proglnleuthrglugluvalgluasnlysglyglyaspglnglypro
325330335
proleumetthraspglyglyglyglyhisserhisaspserglyhis
340345350
glyglyglyaspprohisleuprothrleuleuleuglysersergly
355360365
serglyglyaspaspaspaspprohisglyprovalglnleusertyr
370375380
tyrasp
385
<210>2
<211>159
<212>prt
<213>小家鼠
<400>2
metserasnproglyaspvalargprovalprohisargserlysval
151015
cysargcysleupheglyprovalaspsergluglnleuargargasp
202530
cysaspalaleumetalaglycysleuglnglualaarggluargtrp
354045
asnpheaspphevalthrgluthrproleugluglyasnphevaltrp
505560
gluargvalargserleuglyleuprolysvaltyrleuserprogly
65707580
serargserargaspaspleuglyglyasplysargproserthrser
859095
seralaleuleuglnglyproalaprogluasphisvalalaleuser
100105110
leusercysthrleuvalsergluargprogluaspserproglygly
115120125
proglythrserglnglyarglysargargglnthrserleuthrasp
130135140
phetyrhisserlysargargleuvalphecyslysarglyspro
145150155
<210>3
<211>140
<212>prt
<213>小家鼠
<400>3
metglyalaproalaleuproglniletrpglnleutyrleulysasn
151015
tyrargilealathrphelysasntrppropheleugluaspcysala
202530
cysthrprogluargmetalaglualaglypheilehiscysprothr
354045
gluasngluproaspleualaglncysphephecysphelysgluleu
505560
gluglytrpgluproaspaspasnproileglugluhisarglyshis
65707580
serproglycysalapheleuthrvallyslysglnmetglugluleu
859095
thrvalserglupheleulysleuaspargglnargalalysasnlys
100105110
ilealalysgluthrasnasnlysglnlysglupheglugluthrala
115120125
lysthrthrargglnserilegluglnleualaala
130135140
<210>4
<211>977
<212>prt
<213>小家鼠
<400>4
metgluleuargalavalglyphecysleualaleuleutrpglycys
151015
alaleualaalaalaalaalaglnglylysgluvalvalleuleuasp
202530
phealaalametlysglygluleuglytrpleuthrhisprotyrgly
354045
lysglytrpaspleumetglnasnilemetaspaspmetproiletyr
505560
mettyrservalcysasnvalvalserglyaspglnaspasntrpleu
65707580
argthrasntrpvaltyrarggluglualagluargilepheileglu
859095
leulysphethrvalargaspcysasnserpheproglyglyalaser
100105110
sercyslysgluthrpheasnleutyrtyralagluseraspvalasp
115120125
tyrglythrasnpheglnlysargglnphethrlysileaspthrile
130135140
alaproaspgluilethrvalserserasppheglualaargasnval
145150155160
lysleuasnvalglugluargmetvalglyproleuthrarglysgly
165170175
phetyrleualapheglnaspileglyalacysvalalaleuleuser
180185190
valargvaltyrtyrlyslyscysproglumetleuglnserleuala
195200205
argpheprogluthrilealavalalavalseraspthrglnproleu
210215220
alathrvalalaglythrcysvalasphisalavalvalprotyrgly
225230235240
glygluglyproleumethiscysthrvalaspglyglutrpleuval
245250255
proileglyglncysleucysglngluglytyrglulysvalgluasp
260265270
alacysargalacysserproglyphephelysserglualaserglu
275280285
serprocysleuglucysprogluhisthrleuproserthrglugly
290295300
alathrsercysglncysglugluglytyrpheargalaprogluasp
305310315320
proleusermetsercysthrargproproseralaproasntyrleu
325330335
thralaileglymetglyalalysvalgluleuargtrpthralapro
340345350
lysaspthrglyglyargglnaspilevaltyrservalthrcysglu
355360365
glncystrpprogluserglyglucysglyprocysglualaserval
370375380
argtyrsergluproprohisalaleuthrargthrservalthrval
385390395400
seraspleugluprohismetasntyrthrphealavalglualaarg
405410415
asnglyvalserglyleuvalthrserargserpheargthralaser
420425430
valserileasnglnthrgluproprolysvalargleugluasparg
435440445
serthrthrserleuservalthrtrpserileprovalserglngln
450455460
serargvaltrplystyrgluvalthrtyrarglyslysglyaspala
465470475480
asnsertyrasnvalargargthrgluglypheservalthrleuasp
485490495
aspleualaproaspthrthrtyrleuvalglnvalglnalaleuthr
500505510
glngluglyglnglyalaglyserlysvalhisglupheglnthrleu
515520525
serthrgluglyseralaasnmetalavalileglyglyvalalaval
530535540
glyvalvalleuleuleuvalleualaglyvalglyleupheilehis
545550555560
argargargargasnleuargalaargglnsersergluaspvalarg
565570575
pheserlyssergluglnleulysproleulysthrtyrvalasppro
580585590
histhrtyrgluaspproasnglnalavalleulysphethrthrglu
595600605
ilehisprosercysvalalaargglnlysvalileglyalaglyglu
610615620
pheglygluvaltyrlysglythrleulysalaserserglylyslys
625630635640
gluileprovalalailelysthrleulysalaglytyrthrglulys
645650655
glnargvalasppheleuserglualaserilemetglyglnpheser
660665670
hishisasnileileargleugluglyvalvalserlystyrlyspro
675680685
metmetileilethrglutyrmetgluasnglyalaleuasplysphe
690695700
leuargglulysaspglyglupheservalleuglnleuvalglymet
705710715720
leuargglyilealaserglymetlystyrleualaasnmetasntyr
725730735
valhisargaspleualaalaargasnileleuvalasnserasnleu
740745750
valcyslysvalserasppheglyleuserargvalleugluaspasp
755760765
proglualathrtyrthrthrserglyglylysileproileargtrp
770775780
thralaproglualailesertyrarglysphethrseralaserasp
785790795800
valtrpsertyrglyilevalmettrpgluvalmetthrtyrglyglu
805810815
argprotyrtrpgluleuserasnhisgluvalmetlysalaileasn
820825830
aspglypheargleuprothrprometaspcysproseralailetyr
835840845
glnleumetmetglncystrpglnglngluargserargargprolys
850855860
phealaaspilevalserileleuasplysleuileargalaproasp
865870875880
serleulysthrleualaasppheaspproargvalserileargleu
885890895
proserthrserglysergluglyvalpropheargthrvalserglu
900905910
trpleugluserilelysmetglnglntyrthrgluhisphemetval
915920925
alaglytyrthralaileglulysvalvalglnmetserasngluasp
930935940
ilelysargileglyvalargleuproglyhisglnlysargileala
945950955960
tyrserleuleuglyleulysaspglnvalasnthrvalglyilepro
965970975
ile
<210>5
<211>887
<212>prt
<213>小家鼠
<400>5
metserhisargileleuserproproalaglyleuleuseraspglu
151015
aspvalvalaspserproileleugluserthralaalaaspleuarg
202530
servalvalarglysaspleuleuseraspcysservalileserala
354045
serleugluasplysglnalaleuleugluaspthrserglulysval
505560
lysvaltyrleuargileargpropheleuthrsergluleuasparg
65707580
glngluaspglnglycysvalcysilegluasnthrgluthrleuval
859095
leuglnalaprolysaspserphealaleulysserasngluarggly
100105110
valglyglnalathrhislysphethrpheserglnilepheglypro
115120125
gluvalglyglnvalalaphepheasnleuthrmetlysglumetval
130135140
lysaspvalleulysglyglnasntrpleuiletyrthrtyrglyval
145150155160
thrasnserglylysthrtyrthrileglnglythrserlysaspala
165170175
glyileleuproglnserleualaleuilepheasnserleuglngly
180185190
glnleuhisprothrproaspleulysproleuleuserasngluval
195200205
iletrpleuaspserlysglnileargglngluglumetlyslysleu
210215220
serleuleuileglyglyleuglngluglugluleuserthrserval
225230235240
lyslysargvalhisthrgluserargileglyalaserasnserphe
245250255
aspserglyvalalaglyleuserserthrserglnphethrserser
260265270
serglnleuaspgluthrserglnleutrpalaglnproaspthrval
275280285
provalservalproalaaspileargpheservaltrpileserphe
290295300
phegluiletyrasngluleuleutyraspleuleugluproproser
305310315320
hisglnhislysargglnthrleuargleucysgluaspglnasngly
325330335
asnprotyrvallysaspleuasntrpilehisvalargaspvalglu
340345350
glualatrplysleuleulysvalglyarglysasnglnserpheala
355360365
serthrhismetasnglnglnserserargserhisserilepheser
370375380
ileargileleuhisleuglnglygluglyaspilevalprolysile
385390395400
sergluleuserleucysaspleualaglysergluargcyslyshis
405410415
glnlysserglygluargleulysglualaglyasnileasnthrser
420425430
leuhisthrleuglyargcysilealaalaleuargglnasnglngln
435440445
asnargserlysglnasnleuilepropheargaspserlysleuthr
450455460
argvalpheglnglyphephethrglyargglyargsercysmetile
465470475480
valasnvalasnprocysalaserthrtyraspgluthrleuhisala
485490495
alalyspheseralaleualaserglnleuvalhisalaproproval
500505510
hisleuglyileproserleuhisserpheilelyslyshisserpro
515520525
glnvalglyproglyleuglulysgluasplysalaaspseraspleu
530535540
gluaspserprogluaspglualaaspvalservaltyrglylysglu
545550555560
gluleuleuglnvalvalglualametlysalaleuleuleulysglu
565570575
argglnglulysleuglnleugluileglnleuargglugluilecys
580585590
asnglumetvalgluglnmetglnglnarggluglntrpcysserglu
595600605
argleuaspasnglnlysgluleumetglugluleutyrgluglulys
610615620
leulysileleulysgluserleuthrthrphetyrglngluglnile
625630635640
glngluargaspglulysileglugluleugluthrleuleuglnglu
645650655
alalysglnglnproalaalaglnglnserglyglyleuserleuleu
660665670
argargserglnargleualaalaseralaserthrglnglnphegln
675680685
gluvallysalagluleugluglncyslysthrgluleuserserthr
690695700
thralagluleuhislystyrglnglnvalleulyspropropropro
705710715720
alalysprophethrileaspvalasplyslysleuglugluglygln
725730735
lysasnileargleuleuargthrgluleuglnlysleuglyglnser
740745750
leuglnseralagluargalacyscyshisserthrglyalaglylys
755760765
leuargglnalaleuthrasncysaspaspileleuilelysglnasn
770775780
glnthrleualagluleuglnasnasnmetvalleuvallysleuasp
785790795800
leuglnlyslysalaalacysilealagluglntyrhisthrvalleu
805810815
lysleuglnglyglnalaseralalyslysargleuglyalaasngln
820825830
gluasnglnglnproasnhisglnproproglylyslyspropheleu
835840845
argasnleuleuproargthrprothrcysglnserserthraspser
850855860
serprotyralaargileleuargserarghisserproleuleulys
865870875880
serpropheglylyslystyr
885
- 还没有人留言评论。精彩留言会获得点赞!