用于危重患者的死亡预后的生物标志物的制作方法
本申请要求2016年6月26日提交的美国临时申请第62/354,789号的权益,所述申请通过引用的方式并入本文中。
关于联邦政府资助的研究或研发的声明
本发明是在美国国立卫生研究院(nationalinstitutesofhealth)授予的合约ai057229、ai089859、ai109662和ai117925的政府支持下完成的。政府拥有发明的某些权利。
本发明一般涉及危重患者死亡风险的预后的方法。具体来说,本发明涉及生物标志物的用途,所述生物标志物可用于患有脓毒症、严重创伤或烧伤的危重患者的死亡风险的预后。
背景技术:
脓毒症,新定义由对感染的全身性反应引起的器官衰竭1,在美国造成所有院内死亡的一半,并且也是美国医疗系统的之一总成本。2,3尽管脓毒症的结果在过去十年中已经随着标准化脓毒症护理的改善而改善,但死亡率仍然很高(10-35%)4。脓毒症治疗仍由来源控制、抗生素和支持性护理组成。尽管对于免疫调节干预有许多临床试验,但没有成功地将对脓毒症有特异性的治疗引入市场5。两个共识的文件已经指出,临床试验的失败是由于脓毒症综合征患者的巨大异质性,并且我们缺乏精确分子分析的工具5,6。目前的工具,主要是临床严重程度评分,例如apache和sofa,以及血乳酸含量,不是脓毒症中潜在炎症的读数,而是对患者疾病的整体程度的粗略观察。
几个小组已经假设,通过全血分析的免疫系统的转录(全基因组表达)分布可以是使脓毒症患者分层的有效方式7。从这些研究中重要的见解包括中性粒细胞蛋白酶的过表达、在适应性免疫中崩溃和脓毒症总体深入的免疫失调7-12。一些免疫分析技术已前瞻性地证实展示结果差异13,14,但是还没有临床工具被翻译成临床实践。尽管如此,大多数这些研究已经存放在公共数据库中,以便进一步重新分析和重复使用。
因此,需要新的分子分布分析工具,既可以改善患者护理和资源分层,但也可以作为脓毒症更好的临床试验的研究工具。
技术实现要素:
本发明涉及生物标志物用于辅助危重患者的诊断、预后和治疗的用途。具体来说,本发明涉及生物标志物用于患有脓毒症、严重创伤或烧伤的危重患者的死亡预后的用途。
可以在本发明的实践中使用的生物标志物包括多核苷酸,其包含来自基因或基因的rna转录物的核苷酸序列,包括但不限于defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2。
在某些实施例中,将一组生物标志物用于死亡的预后。任何尺寸的生物标志物组可用于本发明的实践中。用于死亡预后的生物标志物组通常包含至少3种生物标志物和至多30种生物标志物,包括其间的任何数量的生物标志物,例如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30种生物标志物。在某些实施例中,本发明包括生物标志物组,其包含至少3种、至少4种、或至少5种、或至少6种、或至少7种、或至少8种、或至少9种、或至少10种、或至少11种或更多种生物标志物。尽管较小的生物标志物组通常更经济,但较大的生物标志物组(即,大于30种生物标志物)具有提供更详细信息的优点,并且还可以用于本发明的实践中。
在一个实施例中,生物标志物组包含多种用于死亡预后的生物标志物,其中多种生物标志物包含一种或多种多核苷酸,其包含一种或多种来自基因或基因的rna转录物的核苷酸序列,所述生物标志物选自由以下组成的群组:defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2。在一个实施例中,生物标志物组包含defa4多核苷酸、cd163多核苷酸、per1多核苷酸、rgs1多核苷酸、hif1a多核苷酸、sepp1多核苷酸、c11orf74多核苷酸、cit多核苷酸、ly86多核苷酸、tst多核苷酸、or52r1多核苷酸和kcnj2多核苷酸。
在一个方面,本发明包括一种确定死亡率风险和治疗疑似患有危及生命的病况的患者的方法。所述方法包含a)从患者中获得生物样品;b)测量生物样品中defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2生物标志物的表达水平;和c)结合生物标志物的相应参考值范围分析每一种生物标志物的表达水平,其中与对照受试者的生物标志物的参考值范围相比,defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74和cit生物标志物的表达水平升高和ly86、tst、or52r1和kcnj2生物标志物的表达水平降低指示患者在30天内处于死亡的高风险下;并且d)如果患者在30天内处于死亡的高风险下,那么向患者施用重病监护室(icu)治疗。在某些实施例中,危及生命的病况是脓毒症、创伤或烧伤。
参考值范围可以表示在没有重大疾病的一个或多个受试者(例如,健康受试者或没有感染或损伤的受试者)的一个或多个样品中发现的一种或多种生物标志物的水平。或者,参考值可以表示在患有重大疾病(例如,脓毒症/感染、严重创伤或烧伤)的一个或多个受试者的一个或多个样品中发现的一种或多种生物标志物的水平。在某些实施例中,将生物标志物的水平与未感染和感染/脓毒症受试者或受伤(例如,严重创伤或烧伤)和未受伤受试者的时间匹配的参考值范围进行比较。
在某些实施例中,所述方法在进入重症监护室之前或一进入重症监护室就进行。所述方法可在入院后14天内,例如在24小时、48小时、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天或14天内进行。在另一个实施例中,所述方法在诊断出患者的脓毒症后的3到7天进行。在另一个实施例中,所述方法在患者烧伤后的3到14天进行。在又一实施例中,所述方法在患者受伤后的3到14天进行。
生物样品可包含例如血液、血沉棕黄层、杆状核细胞或晚幼粒细胞。
生物标志物多核苷酸(例如编码转录物)可例如通过微阵列分析、聚合酶链式反应(pcr)、逆转录酶聚合酶链式反应(rt-pcr)、northern印迹或基因表达系列分析(sage)检测。
在另一方面,本发明包括一种确定疑似患有危及生命的病况的受试者的死亡基因评分的方法,所述方法包含:a)从受试者中收集生物样品;b)测量生物样品中多种本文所描述的生物标志物的水平;以及c)通过将与生物标志物的对照参考值相比过度表达的所有生物标志物的表达水平的几何平均值减去与所述生物标志物的对照参考值相比表达不足的所有生物标志物的表达水平的几何平均值,并且将差值乘以与所述生物标志物的对照参考值相比过度表达的生物标志物的数目与表达不足的生物标志物的数目的比率,来确定所述生物标志物的死亡基因评分。
在另一个实施例中,所述方法进一步包含基于所述生物标志物的水平计算患者的死亡基因评分,其中与对照受试者相比患者较高的死亡基因评分指示患者在30天内处于死亡的高风险下。
在某些实施例中,死亡基因评分由包含一种或多种包含来自基因或基因的rna转录物的核苷酸序列的多核苷酸的多种生物标志物的表达水平计算,所述生物标志物选自由以下组成的群组:defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2。在一个实施例中,多种生物标志物包含defa4多核苷酸、cd163多核苷酸、per1多核苷酸、rgs1多核苷酸、hif1a多核苷酸、sepp1多核苷酸、c11orf74多核苷酸、cit多核苷酸、ly86多核苷酸、tst多核苷酸、or52r1多核苷酸和kcnj2多核苷酸。
在另一个实施例中,本发明包括一种确定死亡风险和治疗患有脓毒症的患者的方法,所述方法包含:a)从所述患者中获得生物样品;b)测量生物样品中defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2生物标志物的表达水平;以及c)基于所述生物标志物的水平计算患者的死亡基因评分,其中与对照受试者相比患者较高的死亡基因评分指示患者在30天内处于死亡的高风险下;并且d)如果患者在30天内处于死亡的高风险下,那么向患者施用重症监护室治疗。
在其它实施例中,本发明包括一种诊断和治疗患有感染的患者的方法,所述方法包含:a)从患者中获得生物样品;b)测量生物样品中defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2生物标志物的表达水平,其中与对照受试者的生物标志物的参考值范围相比defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74和cit生物标志物的表达水平升高和ly86、tst、or52r1和kcnj2生物标志物的表达水平降低指示患者患有脓毒症;并且c)如果患者被诊断患有脓毒症,那么施用包含抗微生物疗法、支持性护理或免疫调节疗法的脓毒症治疗。在另一个实施例中,所述方法进一步包含基于所述生物标志物的水平计算患者的死亡基因评分,其中与对照受试者相比患者较高的死亡基因评分指示所述患者在30天内处于死亡的高风险下;并且如果患者在30天内处于死亡的高风险下,那么向患者施用重症监护室治疗。
在另一方面,本发明包括一种治疗疑似患有危及生命的病况的患者的方法,所述方法包含:a)根据本文所描述的方法接收关于患者的预后信息;并且b)如果患者在30天内处于死亡的高风险下,那么向患者施用重症监护室治疗。
在某些实施例中,患者数据通过一种或多种方法分析,所述方法包括但不限于多变量线性判别分析(lda)、接受者工作特征(roc)分析、主成分分析(pca)、集合数据挖掘方法、微阵列的细胞特异性显著性分析(cssam)和多维蛋白质鉴定技术(mudpit)分析。
另一方面,本发明包括用于受试者的死亡预后的试剂盒。所述试剂盒可包括用于盛放从疑似患有危及生命的病况的人类受试者中分离的生物样品的容器、至少一种特异性检测生物标志物的药剂;以及用于使所述药剂与所述生物样品或一部分所述生物样品反应以检测所述生物样品中至少一种生物标志物的存在或量的印刷说明书。所述药剂可以包装在单独的容器中。试剂盒可以进一步包含一种或多种对照参考样品和用于进行pcr或微阵列分析以检测如本文所描述的生物标志物的试剂。
在某些实施例中,所述试剂盒包括用于检测包含多种用于死亡预后的生物标志物的生物标志物组的多核苷酸的药剂,其中一种或多种生物标志物选自由以下组成的群组:defa4多核苷酸、cd163多核苷酸、per1多核苷酸、rgs1多核苷酸、hif1a多核苷酸、sepp1多核苷酸、c11orf74多核苷酸、cit多核苷酸、ly86多核苷酸、tst多核苷酸、or52r1多核苷酸和kcnj2多核苷酸。在一个实施例中,所述试剂盒包括用于检测包含以下的生物标志物组的生物标志物的药剂:defa4多核苷酸、cd163多核苷酸、per1多核苷酸、rgs1多核苷酸、hif1a多核苷酸、sepp1多核苷酸、c11orf74多核苷酸、cit多核苷酸、ly86多核苷酸、tst多核苷酸、or52r1多核苷酸和kcnj2多核苷酸。
在某些实施例中,试剂盒包含用于分析多种生物标志物多核苷酸的微阵列。在一个实施例中,所述试剂盒包含包括以下的微阵列:与defa4多核苷酸杂交的寡核苷酸、与cd163多核苷酸杂交的寡核苷酸、与per1多核苷酸杂交的寡核苷酸、与rgs1多核苷酸杂交的寡核苷酸、与hif1a多核苷酸杂交的寡核苷酸、与sepp1多核苷酸杂交的寡核苷酸、与c11orf74多核苷酸杂交的寡核苷酸、与cit多核苷酸杂交的寡核苷酸、与ly86多核苷酸杂交的寡核苷酸、与tst多核苷酸杂交的寡核苷酸、与or52r1多核苷酸杂交的寡核苷酸和与kcnj2多核苷酸杂交的寡核苷酸。
在另一个方面,本发明包括一种诊断系统,其包含用于存储数据的存储组件(即,存储器),其中所述存储组件具有存储在其中的用于确定受试者诊断的指令;用于处理数据的计算机处理器,其中所述计算机处理器被耦合到所述存储组件上并且被配置成执行存储在所述存储组件中的指令以便接收患者数据并且根据算法分析患者数据;以及用于显示关于患者的诊断的信息的显示器组件。如本文所描述(参见实例1),存储组件可包括用于确定受试者的死亡风险的指令。另外,存储组件可进一步包括用于计算死亡基因评分的指令。
在某些实施例中,本发明包括用于确定疑似患有危及生命的病况的患者的死亡风险,所述计算机执行包含以下的步骤:a)接收输入的患者数据,所述数据包含来自所述患者的生物样品中defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2生物标志物的表达水平的数值;b)分析每一种生物标志物的水平,并且与每一种生物标志物的相应参考值范围进行比较;c)基于所述生物标志物的水平计算所述患者的死亡基因评分,其中与对照受试者相比所述患者较高的死亡基因评分指示所述患者在30天内处于死亡的高风险下;并且d)显示关于所述患者的死亡风险的信息。
在某些实施例中,输入的患者数据包含来自患者的生物样品中至少12种生物标志物水平的值。举例来说,输入的患者数据可包含以下水平的值:defa4多核苷酸、cd163多核苷酸、per1多核苷酸、rgs1多核苷酸、hif1a多核苷酸、sepp1多核苷酸、c11orf74多核苷酸、cit多核苷酸、ly86多核苷酸、tst多核苷酸、or52r1多核苷酸和kcnj2多核苷酸。
在另一个实施例中,本发明包括一种包含多种体外复合物的组合物,其中多种体外复合物包含与包含生物标志物defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2基因序列的核酸杂交的经标记探针,所述经标记探针与所述生物标志物基因序列或其互补序列杂交,其中所述核酸是从患有危及生命的病况(例如,脓毒症、严重创伤或烧伤)的患者中提取的,或者是从患有所述危及生命的病况的患者中提取的所述核酸的扩增产物。探针可以用任何类型的标记可检测地标记,包括但不限于荧光标记、生物发光标记、化学发光标记、比色标记或同位素标记(例如,稳定的痕量同位素或放射性同位素)。在某些实施例中,组合物在检测装置中(即,能够检测经标记探针的装置)。
所属领域的技术人员鉴于本文的公开内容将易于想到本发明的这些和其它实施例。
附图说明
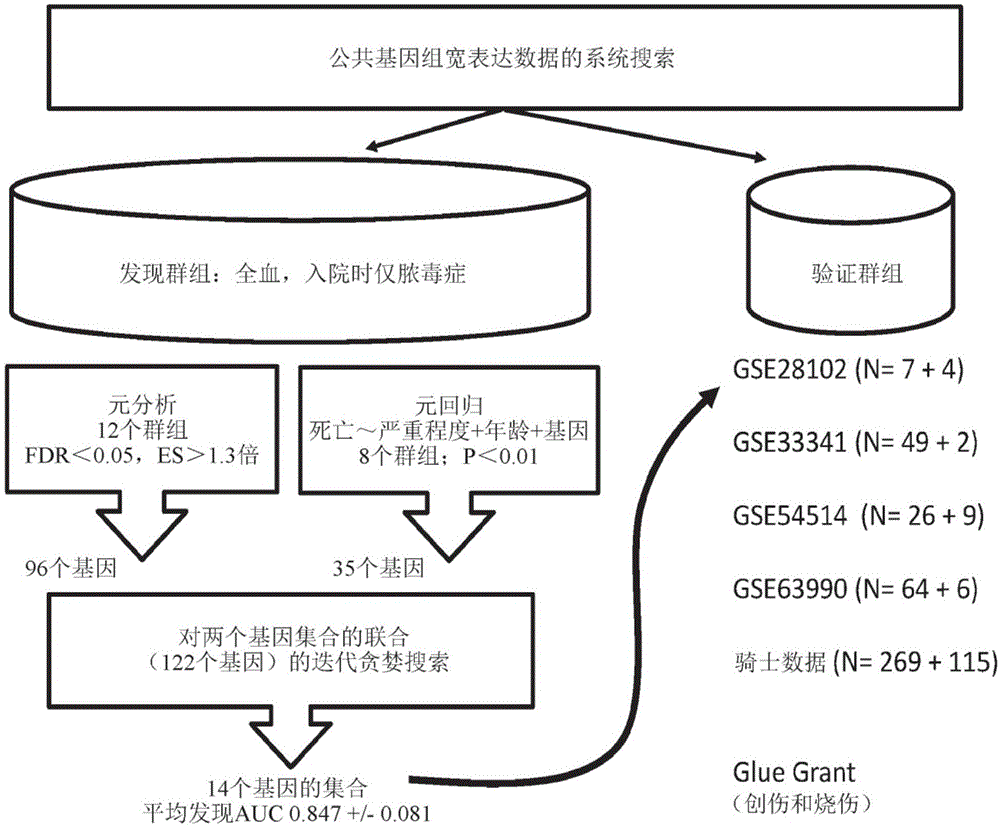
图1展示整体研究示意图。
图2展示来自发现数据集的汇总roc曲线。展示12个基因的集合预测脓毒症患者入院时死亡的预后能力。
图3展示来自图2的发现数据集中的汇总roc曲线的α和β参数的森林图。
图4-6展示发现群组中个体患者的12个基因的评分的小提琴图,由幸存者状态分开。内条展示平均值和四分位数范围。
图7展示来自验证数据集的汇总roc曲线。展示12个基因的集合预测脓毒症患者入院时死亡的预后能力。
图8展示来自图7的验证数据集中的汇总roc曲线的α和β参数的森林图。
图9展示验证群组中个体患者的12个基因的评分的小提琴图,由幸存者状态分开。内条展示平均值和四分位数范围。
图10a和10b展示来自验证数据集gse21802的纵向数据。图10a展示自入院以来分成时间段的死亡率预测的roc曲线图。图10b展示由幸存者状态分开的个体患者轨迹。
图11a和11b展示来自验证数据集gse54514的纵向数据。图11a展示自入院以来分成时间段的死亡率预测的roc曲线图。图11b展示由幸存者状态分开的个体患者轨迹。
图12a和12b展示来自gluegrant创伤-血沉棕黄层群组的纵向数据。图12a展示由幸存者状态分开的12个基因的评分的个体患者轨迹。图12b展示由幸存者状态分开的mods评分的个体患者轨迹。
图13a和13b展示在gluegrant创伤-血沉棕黄层群组中入院后分成时间段的死亡率预测的roc曲线图。图13a展示在诊断时第6天-第10天时间窗口中的脓毒症患者(n=12名幸存者,1名非tbi死亡)。图13b展示所有患者基于自入院以来分成时间段;展示的是所有死因预测。第0天n=179名幸存者和8名非幸存者;后来的时间点展示相同的患者。
图14a和14b展示来自gluegrant烧伤-全血群组的纵向数据。图14a展示由幸存者状态分开的12个基因的评分的个体患者轨迹。图14b展示由幸存者状态分开的丹佛评分(denverscore)的个体患者轨迹。
图15a和15b展示在gluegrant烧伤-全血群组中入院后分成时间段的死亡率预测的roc曲线图。图15a展示在诊断时第1天-第3天(n=63名幸存者,3名非幸存者)和第3天-第7天(n=15名幸存者,5名非幸存者)时间窗口的脓毒症患者。图15b展示所有患者基于自入院以来分成时间段;展示的是所有死因预测。第0天n=212名幸存者和22名非幸存者;后来的时间点展示相同的患者。
图16a和16b展示122个基因的集合(图16a)和12个基因的集合(图16b)的细胞类型富集曲线图。所示为展示的所有体外分选细胞类型中每个基因集合富集的z评分。
具体实施方式
除非另外指示,否则本发明的实践将采用所属领域技能内的药理学、化学、生物化学、重组dna技术和免疫学的常规方法。这类技术充分解释于文献中。参见例如j.r.brown《脓毒症:症状、诊断和治疗(sepsis:symptoms,diagnosisandtreatment)》(《21世纪系列的公共卫生(publichealthinthe21stcenturyseries)》,novasciencepublishers公司,2013);《脓毒症和非感染性全身炎症:从生物学到危急监护(sepsisandnon-infectioussystemicinflammation:frombiologytocriticalcare)》(j.cavaillon,c.adrie编,wiley-blackwell,2008);《脓毒症:诊断、管理和健康结果(sepsis:diagnosis,managementandhealthoutcomes)》(《过敏症和感染性疾病(allergiesandinfectiousdiseases)》,n.khardori编,novasciencepub公司,2014);《实验免疫学手册(handbookofexperimentalimmunology)》,第i-iv卷(d.m.weir和c.c.blackwell编,布莱克威尔出版公司(blackwellscientificpublications));a.l.lehninger,《生物化学(biochemistry)》(worthpublishers公司,现行版);sambrook等人,《分子克隆:实验室手册(molecularcloning:alaboratorymanual)》(第3版,2001);《酶学方法(methodsinenzymology)》(s.colowick和n.kaplan编,学术出版公司(academicpress,inc.))。
本文中(不论上文或下文)所列举的所有出版物、专利和专利申请都以其全文引用的方式并入本文。
i.定义
在描述本发明时,以下术语将被采用并且打算如下文所指示定义。
还应了解,除非上内容另外明确规定,否则如本说明书和所附权利要求书中所用,单数形式“一(a/an)”和“所述(the)”包括单数和复数指示物。因此,举例来说,提及“生物标志物”包括两种或更多种生物标志物的混合物以及其类似物。
术语“约”,特别是关于给定数量,意欲涵盖加上或减去5%的偏差。
术语“存活”意指使用如本文所描述的生物标志物确定受试者的死亡风险的时间到死亡的时间。
如本文所用的术语“幸存者”是指将生存至少超过30天的受试者。
如本文所用的术语“非幸存者”是指将在30天内死亡的受试者。
在本发明的上下文中“生物标志物”是指相比于从重大疾病或病况(例如,脓毒症、严重创伤或烧伤)的幸存者获取的可比较样品,在从幸存者获取的样品中差异表达的生物化合物,例如多核苷酸。生物标志物可为可检测到和/或定量的核酸、核酸片段、多核苷酸或寡核苷酸。生物标志物包括多核苷酸,其包含来自基因或基因的rna转录物的核苷酸序列,包括但不限于defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2。
术语“多肽”和“蛋白质”是指氨基酸残基的聚合物,并且不限于最小长度。因此,肽、寡肽、二聚体、多聚体以及其类似物都包括在所述定义内。所述定义涵盖全长蛋白质和其片段。所述术语还包括多肽的表达后修饰,例如糖基化、乙酰化、磷酸化、羟基化、氧化以及其类似物。
术语“多核苷酸、”“寡核苷酸、”“核酸”和“核酸分子”在本文中用于包括任何长度的核苷酸的聚合形式、核糖核苷酸或脱氧核糖核苷酸。这一术语仅指分子的一级结构。因此,所述术语包括三链、双链和单链dna以及三链、双链和单链rna。它还包括修饰,例如通过甲基化和/或通过盖帽,和未修饰形式的多核苷酸。更具体地,术语“多核苷酸、”“寡核苷酸、”“核酸”和“核酸分子”包括多脱氧核糖核苷酸(含有2-脱氧-d-核糖)、多核糖核苷酸(d-核糖)和为嘌呤或嘧啶碱基的n-或c-糖苷的任何其它类型的多核苷酸在术语“多核苷酸、”“寡核苷酸、”“核酸”与“核酸分子”之间的长度没有预期的区分,并且这些术语互换地使用。
短语“差异表达”是指与在30天内处于死亡的低风险下的对照受试者相比(即幸存者),从在30天内处于死亡的高风险下的患有危及生命的病况(例如脓毒症、严重创伤或烧伤)的患者(即非幸存者)中获得的样品中存在的生物标志物的数量和/或频率的差异。举例来说,生物标志物可为与对照受试者的样品相比以升高水平或降低水平存在于患有脓毒症的患者的样品中的多核苷酸。或者,生物标志物可为与对照受试者的样品相比在30天内处于死亡的高风险下的患者(即,非幸存者)的样品中以较高频率或以较低频率检测到的多核苷酸。生物标志物可在数量、频率或这两方面存在差异。
如果一个样品中多核苷酸的量在统计学上显著不同于另一个样品中多核苷酸的量,那么多核苷酸在两个样品之间是差异表达的。举例来说,如果多核苷酸存在量比其在另一个样品中的存在量大至少约120%、至少约130%、至少约150%、至少约180%、至少约200%、至少约300%、至少约500%、至少约700%、至少约900%或至少约1000%,或如果其在一个样品中可检测到并且在另一个样品中无法检测到,那么多核苷酸在两个样品中是差异表达的。
如果在30天内处于死亡的高风险下的患者(即,非幸存者)的样品中检测多核苷酸的频率比对照样品中的统计上显著更高或更低,那么多核苷酸在两组样品中是差异表达的。举例来说,如果检测到多核苷酸一组样品中比在另一组样品中至少约120%、至少约130%、至少约150%、至少约180%、至少约200%、至少约300%、至少约500%、至少约700%、至少约900%或至少约1000%较频繁或较不频繁地观察到,那么多核苷酸在两组样品中是差异表达的。
“相似度值”是表示在所比较的两个事物之间的相似度的数值。举例来说,相似度值可为指示在使用特异性表型相关生物标志物的患者的表达谱与一个或多个对照样品中生物标志物的参考值范围或参考表达谱之间的整体相似度(例如与“幸存者”表达谱或“非幸存者”表达谱的相似度)的数值。在患者样品和对照样品中的生物标志物的水平或参考表达谱之间,相似度值可表示为相似性度量(如相关系数),或可简单地表示为表达水平差异或合计的表达水平差异。
术语“受试者”、“个体”和“患者”在本文中可互换使用并且是指需要诊断、预后、治疗或疗法的任何哺乳动物受试者,尤其人类。其它受试者可包括牛、犬、猫、天竺鼠、兔、大鼠、小鼠、马等等。在一些情况下,本发明的方法应用于实验动物、兽医学应用和动物疾病模型(包括但不限于啮齿动物,包括小鼠、大鼠和仓鼠;以及灵长类动物)的开发中。
如本文所用,“生物样品”是指从受试者分离的组织、细胞或流体的样品,包括但不限于例如血液、血沉棕黄层、血浆、血清、血细胞(例如外周血单核细胞(pbmc)、杆状核细胞、中性粒细胞、晚幼粒细胞、单核细胞或t细胞)、粪便物、尿液、骨髓、胆汁、脊髓液、淋巴液、皮肤样品、皮肤、呼吸道、肠道和泌尿生殖道的外部分泌物、泪液、唾液、乳汁、器官、活检体以及体外细胞培养物成分的样品,包括但不限于由细胞和组织在培养基中生长产生的条件培养基,例如重组细胞和细胞组分。
生物标志物的“测试量”是指所测试的样品中所存在的生物标志物的量。测试量可以是绝对量(例如μg/ml)或相对量(例如,信号的相对强度)。
生物标志物的“诊断量”是指受试者的样品中生物标志物的量,其与脓毒症的诊断或死亡的预后一致。诊断量可以是绝对量(例如μg/ml)或相对量(例如,信号的相对强度)。
生物标志物的“对照量”可以是与生物标志物的测试量进行比较的任何量或量的范围。举例来说,生物标志物的对照量可为没有危及生命的病况的个人(例如,没有脓毒症、严重创伤或烧伤的个人)、健康个人或幸存者的生物标志物的量。对照量可以是绝对量(例如μg/ml)或相对量(例如,信号的相对强度)。
术语“抗体”涵盖多克隆和单克隆抗体制剂,以及包括杂交抗体、改变的抗体、嵌合抗体和人源化抗体的制剂,以及:杂交(嵌合)抗体分子(参见例如winter等人(1991)《自然(nature)》349:293-299;和美国专利第4,816,567号);f(ab′)2和f(ab)片段;fv分子(非共价异二聚体,参见例如inbar等人(1972)《美国国家科学院院刊》69:2659-2662;和ehrlich等人(1980)《生物化学》19:4091-4096);单链fv分子(sfv)(参见例如huston等人(1988)《美国国家科学院院刊》85:5879-5883);二聚和三聚抗体片段构建体;微型抗体(参见例如pack等人(1992)《生物化学》31:1579-1584;cumber等人(1992)《免疫学杂志(jimmunology)》149b:120-126);人源化抗体分子(参见例如riechmann等人(1988)《自然》332:323-327;verhoeyan等人(1988)《科学(science)》239:1534-1536;和1994年9月21日公开的英国专利公开第gb2,276,169号);以及从这类分子获得的任何功能片段,其中这类片段保留亲本抗体分子的特异性结合特性。
预期用于本发明的“可检测部分”或“可检测标记”包括但不限于放射性同位素、荧光染料,例如荧光素、藻红蛋白、cy-3、cy-5、别藻蓝蛋白、dapi、德克萨斯红(texasred)、罗丹明(rhodamine)、俄勒冈绿(oregongreen)、荧光黄(luciferyellow)以及其类似物、绿色荧光蛋白(gfp)、红色荧光蛋白(dsred)、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)、角海葵橙色荧光蛋白(cofp)、碱性磷酸酶(ap)、β-内酰胺酶、氯霉素乙酰转移酶(cat)、腺苷脱氨酶(ada)、氨基糖苷磷酸转移酶(neor、g418r)二氢叶酸还原酶(dhfr)、潮霉素b磷酸转移酶(hph)、胸苷激酶(tk)、lacz(编码
如本文所用,“诊断”大体上包括关于受试者是否可能罹患给定疾病、病症或功能障碍的判定。所属领域的技术人员通常基于一个或多个诊断指标(即,生物标志物)进行诊断,诊断指标的存在、不存在或量指示疾病、病症或功能障碍存在或不存在。
如本文所用,“预后”大体上是指临床病况或疾病的可能病程和结果的预测。患者的预后通常是通过评估疾病的因素或症状而进行,疾病的因素或症状指示疾病的有利或不利的病程或结果。应理解,术语“预后”未必是指以100%准确度预测病况的病程或结果的能力。实际上,所属领域的技术人员应理解,术语“预后”是指特定病程或结果将发生的概率增加;也就是说,当与未展现给定病况的那些个体相比较时,病程或结果更可能发生于展现所述病况的患者中。
“基本上纯化的”是指核酸分子或蛋白质从其天然环境移出并且经分离,且至少约60%、优选地约75%、并且最优选地约90%不含与其天然相关联的其它组分。
ii.执行本发明的模式
在详细描述本发明之前,应理解,本发明不限于特定配制品或程序参数,因此当然可变化。还应理解,本文所用的术语仅出于描述本发明的具体实施例的目的,并且不打算是限制性的。
尽管在本发明的实践中可使用与本文所描述的方法和材料类似或等效的许多方法和材料,但是本文描述了优选的材料和方法。
本发明涉及单独或与临床参数组合的生物标志物用于辅助危重患者的诊断、预后和治疗的用途。具体来说,本发明人已经发现生物标志物,其表达谱可用于患有脓毒症、严重创伤或烧伤的危重患者的死亡的预后(参见实例1)。
为了进一步理解本发明,下面提供了关于所鉴定的生物标志物和在危重患者的诊断、预后和治疗中使用其的方法的更详细的讨论。
a.生物标志物
可以在本发明的实践中使用的生物标志物包括多核苷酸,其包含来自基因或基因的rna转录物的核苷酸序列,包括但不限于defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2。这些生物标志物的差异表达与死亡的高风险(在30天内)相关,并且因此,这些生物标志物的表达谱适用于在危重患者的死亡的预后。
因此,在一个方面,本发明提供了一种确定受试者的死亡风险的方法,所述方法包含测量衍生自疑似患有危及生命的病况的受试者的生物样品中的多种生物标志物的水平,并且分析生物标志物的水平,并且与生物标志物的相应参考值范围进行比较,其中与一种或多种对照样品的生物标志物相比一种或多种生物样品的生物标志物的差异表达指示受试者在30天内处于死亡的高风险下。
当分析生物样品中生物标志物的水平时,参考值范围可以代表在一个或多个没有重大疾病的受试者(例如,幸存者、健康受试者或没有感染或损伤的受试者)的一个或多个样品中发现的一种或多种生物标志物的水平。或者,参考值可以代表在一个或多个患有重大疾病的受试者(例如,非幸存者、患有脓毒症/感染、严重创伤或烧伤的受试者)的一个或多个样品中发现的一种或多种生物标志物的水平。在某些实施例中,将生物标志物的水平与未感染和感染/脓毒症受试者或受伤(例如,严重创伤或烧伤)和未受伤受试者的时间匹配的参考值范围进行比较。
从待诊断的受试者中获得的生物样品通常为全血、血沉棕黄层、血浆、血清、或血细胞(例如、外周血单核细胞(pbmc)、杆状核细胞、晚幼粒细胞、中性粒细胞、单核细胞或t细胞),但可以是来自含有表达的生物标志物的体液、组织或细胞的任何样品。如本文所用,“对照”样品是指未发生病变的生物样品,例如体液、组织或细胞。也就是说,对照样品从未患脓毒症、严重创伤或烧伤的个人的正常受试者(例如,已知不患有危及生命的病况的个体)或者幸存者中获得。可以通过常规技术从受试者中获得生物样品。举例来说,可通过静脉穿刺获得血液,并且可根据所属领域中众所周知的方法通过手术技术获得实体组织样品。
在某些实施例中,一组生物标志物用于死亡风险的预后。任何尺寸的生物标志物组可用于本发明的实践中。用于死亡预后的生物标志物组通常包含至少3种生物标志物和至多30种生物标志物,包括其间的任何数量的生物标志物,例如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30种生物标志物。在某些实施例中,本发明包括一种生物标志物组,其包含至少3种、至少4种、或至少5种、或至少6种、或至少7种、或至少8种、或至少9种、或至少10种、或至少11种或更多种生物标志物。尽管较小的生物标志物组通常更经济,但较大的生物标志物组(即,大于30种生物标志物)具有提供更详细信息的优点,并且还可以用于本发明的实践中。
在某些实施例中,本发明包括包含一种或多种多核苷酸的用于死亡风险的预后的一组生物标志物,其包含一种或多种来自基因或基因的rna转录物的核苷酸序列,所述生物标志物选自由以下组成的群组:defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2。在一个实施例中,生物标志物组包含defa4多核苷酸、cd163多核苷酸、per1多核苷酸、rgs1多核苷酸、hif1a多核苷酸、sepp1多核苷酸、c11orf74多核苷酸、cit多核苷酸、ly86多核苷酸、tst多核苷酸、or52r1多核苷酸和kcnj2多核苷酸。
在某些实施例中,死亡基因评分用于的死亡风险的预后。死亡基因评分是通过将与生物标志物的对照参考值相比过度表达的所有测量的生物标志物的表达水平的几何平均值减去与生物标志物的对照参考值相比表达不足的所有测量的生物标志物的表达水平的几何平均值,并且将差值乘以与生物标志物的对照参考值相比过度表达的生物标志物的数目与表达不足的生物标志物的数目的比率而计算得到。与对照受试者的参考值范围相比,受试者较高的死亡基因评分指示受试者在30天内处于死亡的高风险下(参见实例1)。
本文所描述的方法可用于鉴定处于应立即接受重症监护的死亡的高风险下的患者。举例来说,可将通过本文所描述的方法在30天内鉴定为具有死亡的高风险的患者立即送到icu进行治疗,而可进一步在常规医院病房监测和/或治疗在30天内鉴定为具有死亡的低风险的患者。患者和临床医生都可以从更好的死亡风险估计中受益,这可以及时讨论患者的偏好以及他们对挽救生命措施的选择。更好的患者分子表型也可能改善临床试验,在1)药物和干预的患者选择和2)观察到预期的受试者死亡率的评估中。
在30天内鉴定为具有死亡的高风险的患者的icu治疗可以包含持续监测身体机能并且提供生命支持设备和/或药物以恢复正常的身体机能。icu治疗可包括例如使用机械呼吸机来辅助呼吸、用于监测身体机能(例如,心脏和脉搏率、到肺部的气流、血压和血流、中心静脉压、血液中的氧气量和体温)的设备、起搏器、除颤器、透析设备、静脉内管线、喂食管、抽吸泵、排出设备和/或导管和/或为治疗危及生命的病况(例如,脓毒症、严重创伤或烧伤)而施用各种药物。icu治疗可进一步包含施用一种或多种镇痛药以减轻疼痛和/或镇静剂以诱导睡眠或缓解焦虑和/或巴比妥酸盐(例如,戊巴比妥或硫喷妥)以在医学上诱导昏迷。
在某些实施例中,进一步向诊断患有病毒感染的危重患者施用治疗有效剂量的抗病毒剂,例如广泛范围的抗病毒剂、抗病毒疫苗、神经氨酸酶抑制剂(例如,扎那米韦(zanamivir)(瑞乐沙(relenza)和奥司他韦(oseltamivir)(特敏福(tamiflu))、核苷类似物(例如,阿昔洛韦(acyclovir)、齐多夫定(zidovudine)(azt)和拉米夫定(lamivudine))、反义抗病毒剂(例如,硫代磷酸酯反义抗病毒剂(例如,用于巨细胞病毒视网膜炎的福米韦生(fomivirsen)(vitravene))、吗啉基反义抗病毒药剂)、病毒脱壳抑制剂(例如,用于流感的金刚胺(amantadine)和金刚乙胺(rimantadine)、用于鼻病毒的普可那利(pleconaril))、病毒进入抑制剂(例如,用于hiv的恩夫韦肽(fuzeon))、病毒装配抑制剂(例如,利福平(rifampicin)或刺激免疫系统的抗病毒剂(例如,干扰素)。示例性抗病毒剂包括阿巴卡韦(abacavir)、阿昔洛韦、阿昔洛韦、阿德福韦(adefovir)、三环癸胺(amantadine)、安普那韦(amprenavir)、阿普林津(ampligen)、阿比朵尔(arbidol)、阿扎那韦(atazanavir)、阿托伐他汀钙(atripla)(固定剂量药物)、巴拉弗(balavir)、西多福韦(cidofovir)、卡贝滋(combivir)(固定剂量药物)、度鲁特韦(dolutegravir)、地瑞那韦(darunavir)、地拉韦啶(delavirdine)、地达诺新(didanosine)、多可沙诺(docosanol)、依度尿苷(edoxudine)、依法韦仑(efavirenz)、恩曲他滨(emtricitabine)、恩夫韦地(enfuvirtide)、因提弗(entecavir)、艾柯立韦(ecoliever)、泛昔洛韦(famciclovir)、固定剂量组合(抗反转录病毒)、福米韦生、夫沙那韦(fosamprenavir)、膦甲酸(foscamet)、膦乙醇(fosfonet)、融合抑制剂、苷昔洛韦(ganciclovir)、伊巴他滨(ibacitabine)、异丙肌苷(imunovir)、碘苷(idoxuridine)、咪喹莫特(imiquimod)、茚地那韦(indinavir)、肌核苷(inosine)、整合酶抑制剂、iii型干扰素、ii型干扰素、i型干扰素、干扰素、拉米夫定、洛匹那韦(lopinavir)、洛韦胺(loviride)、马拉维若(maraviroc)、吗啉胍(moroxydine)、美替沙腙(methisazone)、奈非那韦(nelfinavir)、奈韦拉平(nevirapine)、多吉美(nexavir)、硝唑尼特(nitazoxanide)、核苷类似物、novir、奥司他韦(特敏福)、聚乙二醇化干扰素α-2a(peginterferonalfa-2a)、喷昔洛韦(penciclovir)、帕拉米韦(peramivir)、普可那利(pleconaril)、鬼臼毒素(podophyllotoxin)、蛋白酶抑制剂、雷特格韦(raltegravir)、逆转录酶抑制剂、利巴韦林(ribavirin)、金刚乙胺、利托那韦(ritonavir)、嘧啶、沙奎那韦(saquinavir)、索非布韦(sofosbuvir)、司他夫定(stavudine)、协同增强剂(抗反转录病毒)、特拉普韦(telaprevir)、替诺福韦(tenofovir)、替诺福韦酯(tenofovirdisoproxil)、替拉那韦(tipranavir)、曲氟尿苷(trifluridine)、曲利志韦(trizivir)、曲金刚胺(tromantadine)、特鲁瓦达(truvada)、伐昔洛韦(valaciclovir)(valtrex)、缬更昔洛韦(valganciclovir)、维克维罗(vicriviroc)、阿糖腺苷(vidarabine)、伟拉咪定(viramidine)、扎西他滨(zalcitabine)、扎那米韦(瑞乐沙)和齐多夫定。
在某些实施例中,进一步向诊断患有细菌感染的危重患者施用治疗有效剂量的抗生素。抗生素可包括广泛范围的杀菌或抑菌抗生素。示例性抗生素包括氨基糖苷,例如阿米卡星(amikacin)、阿米金(amikin)、庆大霉素(gentamicin)、加拉霉素(garamycin)、卡那霉素(kanamycin)、坎曲克斯(kantrex)、新霉素(neomycin)、新福拉丁(neo-fradin)、奈替米星(netilmicin)、立克菌星(netromycin)、托普霉素(tobramycin)、耐布新(nebcin)、巴龙霉素、胡梅廷(humatin)、链霉素(streptomycin)、大观霉素(spectinomycin;bs)和曲必星(trobicin);袢霉素,例如格尔德霉素(geldanamycin)、除莠霉素(herbimycin)、利福昔明(rifaximin)和西法仙(xifaxan);碳头孢烯(carbacephem),例如氯碳头孢(loracarbef)和罗拉比得(lorabid);碳青霉烯,例如厄他培南(ertapenem)、因凡兹(invanz)、多尼培南(doripenem)、多利巴克斯(doribax)、亚胺培南/西司他汀(imipenem/cilastatin)、普利马新(primaxin)、美罗培南(meropenem)和美莱姆(merrem);头孢菌素(cephalosporin),例如头孢羟氨苄(cefadroxil)、杜西赛弗(duricef)、头孢唑林(cefazolin)、安赛弗(ancef)、头孢噻吩(cefalotin)或头孢噻吩(cefalothin)、可弗林(keflin)、头孢氨苄(cefalexin)、可弗莱(keflex)、头孢克洛(cefaclor)、迪斯塔克(distaclor)、头孢孟多(cefamandole)、曼多尔(mandol)、头孢西丁(cefoxitin)、美福仙(mefoxin)、头孢丙烯(cefprozil)、赛弗齐(cefzil)、头孢呋辛(cefuroxime)、赛弗亭(ceftin)、秦纳特(zinnat)、头孢克肟(cefixime)、头孢地尼(cefdinir)、头孢托仑(cefditoren)、头孢哌酮(cefoperazone)、头孢噻肟(cefotaxime)、头孢泊肟(cefpodoxime)、头孢他啶(ceftazidime)、赛弗布腾(ceftibuten)、头孢唑肟(ceftizoxime)、头孢曲松(ceftriaxone)、头孢吡肟(cefepime)、马西皮姆(maxipime)、头孢洛林(ceftarolinefosamil)、特福拉罗(teflaro)、头孢吡普(ceftobiprole)和泽福特拉(zeftera);糖肽,诸如替考拉宁(teicoplanin)、塔格西德(targocid)、万古霉素(vancomycin)、万古辛(vancocin)、特拉万星(telavancin)、维巴提夫(vibativ)、达马万星(dalbavancin)、达尔文斯(dalvance)、奥利万星(oritavancin)和奥巴提夫(orbactiv);林可酰胺(lincosamide),诸如克林达霉素(clindamycin)、克莱奥辛(cleocin)、林可霉素(lincomycin)和林克辛(lincocin);脂肽(lipopeptide),诸如达托霉素(daptomycin)和库比辛(cubicin);大环内酯,诸如阿奇霉素(azithromycin)、希舒美(zithromax)、舒美特(sumamed)、西施龙(xithrone)、克拉霉素(clarithromycin)、比阿辛(biaxin)、地红霉素(dirithromycin)、戴那巴克(dynabac)、红霉素(红霉素)、艾利罗辛(erythocin)、艾利培得(erythroped)、罗红霉素(roxithromycin)、醋竹桃霉素(troleandomycin)、tao、泰利霉素(telithromycin)、科泰克(ketek)、螺旋霉素(spiramycin)和罗伐霉素(rovamycine);单环β-内酰胺类,诸如氨曲南(aztreonam)和氨曲南(azactam);硝基呋喃(nitrofuran),诸如呋喃唑酮(furazolidone)、弗洛酮(furoxone)、呋喃妥因(nitrofurantoin)、马克丹亭(macrodantin)和马克比得(macrobid);恶唑烷酮类(oxazolidinone),诸如利奈唑胺(linezolid)、齐沃克斯(zyvox)、vrsa、泊斯唑胺(泊斯唑胺)、雷德唑胺(radezolid)和特地佐利;青霉素(penicillin),诸如青霉素v、韦替得(veetid)(青霉素-vee-k)、哌拉西林(piperacillin)、哌拉西林钠(pipracil)、青霉素g、辉泽彭(pfizerpen)、替莫西林(temocillin)、耐加班(negaban)、替卡西林(ticarcillin)和替卡(ticar);青霉素组合,诸如阿莫西林(amoxicillin)/棒酸盐、安美汀(augmentin)、氨苄青霉素(ampicillin)/舒巴坦(sulbactam)、优立新(unasyn)、哌拉西林(piperacillin)/三唑巴坦(tazobactam)、佐辛(zosyn)、替卡西林(ticarcillin)/棒酸盐和特美汀(timentin);多肽,诸如杆菌肽(bacitracin)、黏菌素(colistin)、coly-mycin-s和多粘菌素b;喹诺酮(quinolone)/氟喹诺酮,诸如环丙沙星、环丙沙星、速博新(ciproxin)、西普乐(ciprobay)、依诺沙星(enoxacin)、盘那曲可(penetrex)、加替沙星(gatifloxacin)、加替沙星(tequin)、吉米沙星(gemifloxacin)、法克替福(factive)、左氧氟沙星(levofloxacin)、左氧氟沙星(levaquin)、洛美沙星(lomefloxacin)、美西肯(maxaquin)、莫西沙星(moxifloxacin)、阿维洛克(avelox)、萘啶酸酸、neggram、诺氟沙星(norfloxacin)、诺氟沙星(noroxin)、氧氟沙星(ofloxacin)、氧氟沙星(floxin)、奥库弗洛(ocuflox)、曲伐沙星(trovafloxacin)、特罗凡(trovan)、格帕沙星(grepafloxacin)、拉克撒(raxar)、司帕沙星(sparfloxacin)、扎咖姆(zagam)、替马沙星(temafloxacin)和奥米弗洛(omniflox);磺酰胺,例如阿莫西林、诺瓦默克(novamox)、阿莫西(amoxil)、氨苄青霉素、普林西彭(principen)、阿洛西林(azlocillin)、卡本西林(carbenicillin)、吉奥西林(geocillin)、氯唑西林(cloxacillin)、特格彭(tegopen)、双氯西林、戴那彭(dynapen)、氟氯西林、弗洛撒彭(floxapen)、美洛西林、美兹林(mezlin)、二甲氧苯青霉素、斯塔西林(staphcillin)、萘夫西林、尤尼彭(unipen)、苯唑西林、苯甲异噁唑青霉素钠(prostaphlin)、青霉素g、青霉素钾(pentids)、磺胺米隆(mafenide)、磺胺米隆(sulfamylon)、磺胺醋酰胺、sulamyd(磺乙酰胺)、bleph-10、磺胺嘧啶(sulfadiazine)、迈克萨冯(micro-sulfon)、磺胺嘧啶银(silversulfadiazine)、磺胺嘧啶银(silvadene)、磺胺地托辛二-麦索克斯(sulfadimethoxinedi-methox)、albon、磺胺甲二唑(sulfamethizole)、硫代萨非福特(thiosulfilforte)、磺胺甲基异恶唑(sulfamethoxazole)、新明磺(gantanol)、磺胺、柳氮磺胺吡啶、水杨酰偶氮磺胺砒啶(azulfidine)、磺胺异恶唑、甘特里辛(gantrisin)、甲氧苄啶-磺胺甲基异恶唑(trimethoprim-sulfamethoxazole)(复方新诺明(co-trimoxazole))(tmp-smx)、巴克曲姆(bactrim)、赛普它(septra)、磺酰胺克里索定(sulfonamidochrysoidine)和百浪多息(prontosil);四环素,诸如地美环素(demeclocycline)、去甲基四环素(declomycin)、强力霉素(doxycycline)、伟霸霉素(vibramycin)、米诺环素(minocycline)、米诺辛(minocin)、土霉素(oxytetracycline)、地霉素(terramycin)、四环素和萨米辛(sumycin)、安可霉素v(achromycinv)和斯特克林(steclin);针对分枝杆菌的药物,诸如氯苯吩嗪、兰普林(lamprene)、氨苯砜、阿福罗萨芬(avlosulfon)、卷曲霉素(capreomycin)、卡帕斯塔(capastat)、环丝氨酸(cycloserine)、丝氨霉素(seromycin)、乙胺丁醇、米阿布妥(myambutol)、乙硫异烟胺、曲卡托(trecator)、异烟肼、i.n.h.、吡嗪酰胺、阿迪酰胺(aldinamide)、利福平、利福定(rifadin)、利马克坦(rimactane)、利福布汀(rifabutin)、利福布丁(mycobutin)、利福喷丁(rifapentine)、普利福汀(priftin)和链霉素;其它抗生素,诸如胂凡纳明(arsphenamine)、洒尔佛散(salvarsan)、氯霉素(chloramphenicol)、氯胺苯醇(chloromycetin)、磷霉素(fosfomycin)、美乐罗(monurol)、美乐力(monuril)、夫西地酸(fusidicacid)、夫西丁(fucidin)、甲硝哒唑(metronidazole)、甲硝哒唑(flagyl)、莫匹罗星(mupirocin)、百多邦(bactroban)、平板霉素(platensimycin)、喹奴普丁(quinupristin)/达福普汀(dalfopristin)、达福普丁(synercid)、甲砜霉素、泰格环霉素(tigecycline)、替加环素(tigacyl)、替硝唑(tinidazole)、替达马克(tindamax)、服净(fasigyn)、甲氧苄啶(trimethoprim)、普罗普利姆(proloprim)和曲姆佩克(trimpex)。
在另一个实施例中,本发明包括一种诊断和治疗患有感染的患者的方法,所述方法包含:a)从患者中获得生物样品;b)测量生物样品中defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2生物标志物的表达水平,其中与对照受试者的生物标志物的参考值范围相比defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74和cit生物标志物的表达水平升高和ly86、tst、or52r1和kcnj2生物标志物的表达水平降低指示患者患有脓毒症;并且c)如果患者被诊断患有脓毒症,那么施用脓毒症治疗。在一些实施例中,所述方法进一步包含基于所述生物标志物的水平计算患者的死亡基因评分,其中与对照受试者相比患者较高的死亡基因评分指示所述患者在30天内处于死亡的高风险下;并且如果患者在30天内处于死亡的高风险下,那么向患者施用重症监护室治疗。
脓毒症治疗可包含例如施用抗微生物疗法、支持性护理或免疫调节疗法或其组合。抗微生物疗法可包括施用一种或多种针对患者可能感染的所有病原体(例如,细菌和/或真菌和/或病毒)的药物,优选使用抗微生物剂的组合进行广泛范围的覆盖。组合抗微生物疗法可包括至少两种不同类别的抗生素(例如,具有大环内酯、氟喹诺酮或氨基糖苷的β-内酰胺剂)。广泛范围的抗生素可以与抗真菌剂和/或抗病毒剂组合施用。脓毒症的支持疗法可包括施用氧气、输血、机械通气、液体疗法(例如,持续使用晶体和/或白蛋白的流体施用直到患者显示血液动力学改善)、营养(例如,口服或肠内进料)、血糖管理、血管加压剂疗法(例如,施用去甲肾上腺素、肾上腺素和/或血管加压素以维持足够的血压)、收缩性疗法(例如,多巴酚丁胺)、肾脏替代治疗(例如透析)、碳酸氢盐疗法、针对静脉血栓栓塞的药物预防(例如,用肝素或间歇性气动加压装置治疗)、应激性溃疡预防、镇静、镇痛、神经肌肉阻滞、胰岛素(例如,维持稳定的血糖水平)或皮质类固醇(例如氢皮质酮)或其任何组合。免疫调节疗法可包括施用活化蛋白c、免疫球蛋白疗法、抗血小板疗法、细胞因子阻断疗法、病原性蛋白或用抗生素筒的透析或其任何组合。
b.检测和测量生物标志物
应理解,样品中的生物标志物可通过所述领域中已知的任何合适方法测量。生物标志物的表达水平的测量可以是直接的或间接的。举例来说,可以直接定量rna或蛋白质的丰度水平。或者,可通过测量cdna、经扩增的rna或dna的丰度水平或通过测量rna、蛋白质或指示生物标志物的表达水平的其它分子(例如代谢物)的数量或活性间接测定生物标志物的量。用于测量样品中的生物标志物的方法具有许多应用。举例来说,可测量一种或多种生物标志物以辅助死亡风险的预后、确定适于受试者的治疗、监测受试者对治疗的反应或鉴定调节生物标志物在体内或体外的表达的治疗性化合物。
检测生物标志物多核苷酸
在一个实施例中,生物标志物的表达水平是通过测量生物标志物的多核苷酸水平来测定。特异性生物标志物基因的转录物水平可由生物样品中所存在的mrna或来源于其的多核苷酸的量来测定。多核苷酸可通过多种方法检测和定量,所述方法包括但不限于微阵列分析、聚合酶链式反应(pcr)、逆转录酶聚合酶链式反应(rt-pcr)、northern印迹和基因表达系列分析(sage)。参见例如draghici《dna微阵列的数据分析工具(dataanalysistoolsfordnamicroarrays)》,chapman和hall/crc,2003;simon等人《dna微阵列研究的设计和分析(designandanalysisofdnamicroarrayinvestigations)》,斯普林格出版社(springer),2004;《实时pcr:当前技术和应用(real-timepcr:currenttechnologyandapplications)》,logan,edwards和saunders编,凯斯特学术出版社(caisteracademicpress),2009;bustin《定量pcr的a-z(a-zofquantitativepcr)》(iul生物技术(iulbiotechnology),第5期),internationaluniversityline,2004;velculescu等人(1995)《科学(science)》270:484-487;matsumura等人(2005)《细胞微生物学(cell.microbiol.)》7:11-18;《基因表达系列分析(sage):方法和方案(分子生物学方法)(serialanalysisofgeneexpression(sage):methodsandprotocols(methodsinmolecularbiology))》,胡马纳出版社(humanapress),2008;其以全文引用的方式并入本文中。
在一个实施例中,将微阵列用于测量生物标志物的水平。微阵列分析的优点在于可同时测量每一个生物标志物的表达,并且微阵列可特异性设计成提供特定疾病或病况(例如脓毒症)的诊断表达谱。
微阵列是通过选择包含多核苷酸序列的探针并随后将这类探针固定于固体支撑物或表面而制备。举例来说,探针可包含dna序列、rna序列或dna和rna的共聚物序列。探针的多核苷酸序列还可包含dna和/或rna类似物或其组合。举例来说,探针的多核苷酸序列可以是基因组dna的完全或部分片段。探针的多核苷酸序列还可为合成的核苷酸序列,如合成寡核苷酸序列。探针序列可以酶促方式在体内、以酶促方式在体外(例如通过pcr)或以未酶促方式在体外合成。
本发明方法中所用的探针优选固定在固体支撑物上,所述固体支撑物可以是多孔的或无孔的。举例来说,探针可为多核苷酸序列,其在多核苷酸的3′或5′端共价连接到硝化纤维素或尼龙膜或过滤器。实这类杂交探针在所属领域中是众所周知的(参见例如sambrook等人,《分子克隆:实验室手册(molecularcloning:alaboratorymanual)》(第3版,2001)。或者,固体支撑物或表面可以是玻璃或塑料表面。在一个实施例中,测量由固定一群多核苷酸(例如一群dna或dna模拟物或替代地,一群rna或rna模拟物)的表面上的固相组成的探针微阵列的杂交水平。固相可为无孔的或任选地可为多孔材料,例如凝胶。
在一个实施例中,微阵列包含具有有序阵列的结合(例如杂交)位点或各自表示本文所描述的一种生物标志物的“探针”的支撑物或表面。优选地,微阵列是可寻址的阵列,并且更优选地是可定位寻址的阵列。更具体地,阵列的每一个探针优选地位于固体支撑物上的已知预定位置处,使得每一个探针的同一性(即,序列)可以从其在阵列中的位置(即,在支持物或表面上)测定。每一个探针优选在单个位点处共价连接到固体支撑物上。
微阵列可以多种方式制造,下文描述其中数种。无论它们是如何生产的,微阵列享有某些特征。阵列是可再现的,从而允许生产具有给定阵列的多个拷贝并且彼此易于进行比较。优选地,微阵列由在结合(例如,核酸杂交)条件下稳定的材料制成。微阵列一般较小,例如在1cm2与25cm2之间;然而,还可使用较大阵列,例如在筛选阵列中。优选地,微阵列中的给定结合位点或特有的一组结合位点将特异性结合(例如杂交)到细胞中单个基因的产物(例如特异性mrna或来源于其的特异性cdna)。然而,一般来说,其它相关或类似序列将与给定结合位点交叉杂交。
如上文所指出,与特定多核苷酸分子特异性杂交的“探针”含有互补多核苷酸序列。微阵列的探针通常由不超过1,000个核苷酸的核苷酸序列组成。在一些实施例中,阵列的探针由具有10至1,000个核苷酸的核苷酸序列组成。在一个实施例中,探针的核苷酸序列在10-200个核苷酸的长度范围内并且是一种生物体的基因组序列,因此存在多种不同探针,其序列与这种生物体的基因组互补并因此能够杂交,循序平铺覆盖所有或一部分基因组。在其它实施例中,探针在10-30个核苷酸的长度范围内、在10-40个核苷酸的长度范围内、在20-50个核苷酸的长度范围内、在40-80个核苷酸的长度范围内、在50-150个核苷酸的长度范围内、在80-120个核苷酸的长度范围内或是60个核苷酸的长度。
探针可包含与一部分生物体基因组对应的dna或dna“模拟物”(例如衍生物和类似物)。在另一个实施例中,微阵列的探针是互补rna或rna模拟物。dna模拟物是由能够与dna特异性沃森-克里克样杂交(watson-crick-likehybridization)或能与rna特异性杂交的亚单位构成的聚合物。核酸可在碱基部分、糖部分或磷酸酯主链(例如硫代磷酸酯)处被修饰。
dna可例如通过基因组dna或克隆序列的聚合酶链式反应(pcr)扩增而获得。pcr引物优选地基于基因组的已知序列而选择,将使得基因组dna的特异性片段扩增。在所属领域中众所周知的计算机程序可用于设计具有所需特异性和最优扩增特性的引物,如oligo5.0版(nationalbiosciences)。微阵列上每一个探针的长度将通常在10个碱基与50,000个碱基之间,通常在300个碱基与1,000个碱基之间。pcr方法在所属领域中是众所周知的,并且例如描述在innis等人编,《pcr方案:方法和应用指南(pcrprotocols:aguidetomethodsandapplications)》,学术出版社,圣地亚哥(sandiego),加利福尼亚州(calif.)(1990);其以全文引用的方式并入本文中。所属领域的技术人员应清楚,受控的机器人系统可用于分离和扩增核酸。
一种用于生成多核苷酸探针的优选的替代方式是通过合成多核苷酸或寡核苷酸的合成,例如使用n-膦酸酯或亚磷酰胺化学物质(froehler等人,《核酸研究(nucleicacidres.)》14:5399-5407(1986);mcbride等人,《四面体通讯(tetrahedronlett.)》24:246-248(1983))。合成序列的长度通常在约10与约500个碱基之间,更通常在约20与约100个碱基之间并且最优选地在约40与约70个碱基长度之间。在一些实施例中,合成核酸包括非天然碱基,例如但不限于肌苷。如上文所指出,核酸类似物可作为结合位点用于杂交。合适的核酸类似物的实例是肽核酸(参见例如egholm等人,《自然(nature)》363:566-568(1993);美国专利第5,539,083号)。
探针优选地使用考虑结合能、碱基组成、序列复杂性、交叉杂交结合能和二级结构的算法来选择。参见friend等人,国际专利公开wo01/05935,2001年1月25日公开;hughes等人,《自然·生物技术(nat.biotech.)》19:342-7(2001)。
所属领域的技术人员还应了解,阳性对照探针(例如已知与目标多核苷酸分子中的序列互补且可杂交的探针)和阴性对照探针(例如已知不与目标多核苷酸分子中的序列互补且不可杂交的探针)应包括在阵列上。在一个实施例中,沿着阵列的周边合成阳性对照。在另一个实施例中,在跨越阵列的对角条纹中合成阳性对照。在再一个实施例中,紧邻充当阴性对照的探针的位置合成每一个探针的反向互补序列。在又一个实施例中,将来自其它物种生物体的序列用作阴性对照或用作“加标”对照。
探针连接到固体支撑物或表面,所述固体支撑物或表面可例如由玻璃、塑料(例如聚丙烯、尼龙)、聚丙烯酰胺、硝化纤维素、凝胶或其它多孔或无孔材料制造。一种用于将核酸连接到表面的方法是通过印刷在玻璃板上,如由schena等人,《科学》270:467-470(1995)大体上所述。这一方法尤其可用于制备cdna的微阵列(另外参见derisi等人,《自然·遗传学(naturegenetics)》14:457-460(1996);shalon等人,《基因组研究(genomeres.)》6:639-645(1996);和schena等人,《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)》93:10539-11286(1995);其以全文引用的方式并入本文中)。
第二种用于制造微阵列的方法产生高密度寡核苷酸阵列。已知在表面上使用用于原位合成的光刻技术所界定的位置产生含有数千个与定义序列互补的寡核苷酸的阵列的技术(参见fodor等人,1991,《科学》251:767-773;pease等人,1994,《美国国家科学院院刊》91:5022-5026;lockhart等人,1996,《自然·生物技术》14:1675;美国专利第5,578,832号;第5,556,752号;和第5,510,270号;其以全文引用的方式并入本文中)或其它用于快速合成和沉积所定义的寡核苷酸的方法(blanchard等人,《生物传感器与生物电子学(biosensors&bioelectronics)》11:687-690;其以全文引用的方式并入本文中)。当使用这些方法时,在表面(例如衍生化玻璃载片)上直接合成具有已知序列的寡核苷酸(例如60聚体)。通常,所产生的阵列是冗余的,每个rna具有数个寡核苷酸分子。
还可使用其它用于制造微阵列的方法,例如通过掩蔽(maskos和southern,1992,《核酸研究(nuc.acids.res.)》20:1679-1684;其以全文引用的方式并入本文中)。原则上,可使用任何类型的阵列,例如尼龙杂交膜上的斑点印迹(参见sambrook等人,《分子克隆:实验室手册》,第3版,2001)。然而,所属领域的技术人员应认识到,极小阵列将常常是优选的,因为杂交体积将较小。
微阵列也可借助于用于寡核苷酸合成的喷墨印刷装置制造,例如使用由blanchard在美国专利第6,028,189号中;blanchard等人,1996,《生物传感器与生物电子学(biosensorsandbioelectronics)》11:687-690;blanchard,1998,在《基因工程中的合成dna阵列(syntheticdnaarraysingeneticengineering)》中,第20卷,j.k.setlow编,plenumpress,纽约在第111-123页(其以全文引用的方式并入本文中)所述的方法和系统。确切地说,这类微阵列中的寡核苷酸探针是通过在高表面张力溶剂(例如碳酸丙二酯)的“微液滴”中连续沉积个别核苷酸碱基而例如在玻璃载片上以阵列形式合成。微滴具有小体积(例如,100pl或更小,更优选50pl或更小)并且在微阵列上彼此分离(例如,通过疏水域)以形成圆形表面张力井,其限定阵列元件(即不同的探针)的位置。通过此喷墨方法制造的微阵列通常具有高密度,优选地具有每1cm2至少约2,500个不同探针的密度。多核苷酸探针是在多核苷酸的3′端或5′端共价连接到支撑物。
可通过微阵列分析测量的生物标志物多核苷酸可为表达rna或来源于其的核酸(例如cdna或来源于并入rna聚合酶启动子的cdna的扩增rna),包括天然存在的核酸分子以及合成核酸分子。在一个实施例中,目标多核苷酸分子包含rna,包括但决不限于总细胞rna、聚(a)+信使rna(mrna)或其片段、细胞质mrna或由cdna转录的rna(即,crna;参见例如linsley和schelter,1999年10月4日提交的美国专利申请序号09/411,074或美国专利第5,545,522号、第5,891,636号或第5,716,785号)。制备总的和聚(a)+rna的方法在所属领域中是众所周知的,并且通常描述于例如sambrook等人,《分子克隆:实验室手册》(第3版,2001)中。可使用硫氰酸胍溶解随后cscl离心(chirgwin等人,1979,《生物化学(biochemistry)》18:5294-5299)、基于硅胶的柱(例如rneasy(加利福尼亚州巴伦西亚市的凯杰公司(qiagen,valencia,calif.))或strataprep(加利福尼亚州拉荷亚的stratagene公司(stratagene,lajolla,calif.)))或使用苯酚和氯仿从所关注的细胞提取rna,如ausubel等人编,1989,《分子生物学现代方法(currentprotocolsinmolecularbiology)》,第iii卷,greenpublishingassociates公司,约翰·威利父子公司(johnwiley&sons,inc.),纽约,第13.12.1-13.12.5页)中所述。聚(a)+rna可例如通过用寡聚dt纤维素选择或替代地,通过寡聚dt引导的总细胞rna的逆转录而选择。rna可通过所属领域中已知的方法,例如通过与zncl2一起培育而片段化,生成rna片段。
在一个实施例中,总rna、mrna或来源于其的核酸从疑似患有危及生命的病况(例如,脓毒症、严重创伤或烧伤)的患者获得的样品分离。在特定细胞中弱表达的生物标志物多核苷酸可使用正规化技术富集(bonaldo等人,1996,《基因组研究》6:791-806)。
如上所述,生物标志物多核苷酸可在一个或多个核苷酸处被可检测地标记。所属领域中已知的任何方法可用于标记目标多核苷酸。优选地,此标记沿着rna的长度均一地并入标记,并且更优选地,标记是以高度的效率进行。举例来说,可通过寡聚dt引导的逆转录标记多核苷酸。随机引物(例如9聚体)可用于逆转录以便在多核苷酸的全长上均一地并入经标记的核苷酸。或者,随机引物可与pcr方法或基于t7启动子的体外转录方法结合使用以扩增多核苷酸。
可检测标记可为发光标记。举例来说,荧光标记、生物发光标记、化学发光标记和比色标记可用于本发明的实践中。可使用的荧光标记包括但不限于荧光素、磷光体、罗丹明或聚甲炔染料衍生物。此外,可使用可商购的荧光标记,包括但不限于荧光亚磷酰胺,如fluoreprime(amershampharmacia,皮斯卡塔威,新泽西州(piscataway,n.j.))、fluoredite(miilipore,贝德福,马萨诸塞州(bedford,mass.))、fam(abi,福斯特市,加利福尼亚州(fostercity,calif.))和cy3或cy5(amershampharmacia,皮斯卡塔威,新泽西州)。或者,可检测标记可为放射性标记的核苷酸。
在一个实施例中,来自患者样品的生物标志物多核苷酸分子以与参考样品的相应多核苷酸分子有差异的方式进行标记。参考可包含来自正常生物样品(即,对照样品,例如来自未患有脓毒症/感染、烧伤或创伤的幸存者或受试者的血液)或来自参考生物样品(例如,来自患有脓毒症/感染、烧伤或创伤的非幸存者或受试者的血液)的多核苷酸分子。
选择核酸杂交和洗涤条件,使得目标多核苷酸分子特异性结合或特异性杂交于阵列的互补多核苷酸序列、优选地其互补dna所位于的特异性阵列位点。含有双链探针dna定位于上面的阵列优选地经历变性条件以致使dna在与目标多核苷酸分子接触之前单链化。含有单链探针dna(例如合成的寡脱氧核酸)的阵列在与目标多核苷酸分子接触之前可能需要变性,例如以去除由于自身互补序列形成的发夹或二聚体。
最优杂交条件将视探针和靶核酸的长度(例如,相对于多核苷酸多200个碱基的低聚物)和类型(例如,rna或dna)而定。所属领域的技术人员应了解,由于寡核苷酸较短,所以可能必需调节其长度以达到相对均一的解链温度,从而获得令人满意的杂交结果。核酸的特异性(即,严格的)杂交条件的通用参数描述在sambrook等人,《分子克隆:实验室手册》(第3版,2001)和ausubel等人,《分子生物学现代方法》,第2卷,实验室指南出版(currentprotocolspublishing),纽约(1994)。schena等人的用于cdna微阵列的典型杂交条件是在5×ssc+0.2%sds中在65℃下杂交四小时,随后在25℃下在低严格性洗涤缓冲液(1×ssc+0.2%sds)中洗涤,随后在25℃下在较高严格性洗涤缓冲液(0.1×ssc+0.2%sds)中洗涤10分钟(schena等人,《美国国家科学院院刊》93:10614(1993))。有用的杂交条件还提供在例如tijessen,1993,《用核酸探针杂交(hybridizationwithnucleicacidprobes)》,elseviersciencepublishers公司;和kricka,1992,《非同位素dna探针技术(nonisotopicdnaprobetechniques)》,学术出版社,圣地亚哥,加利福尼亚州(sandiego,calif)中。尤其优选的杂交条件包括在1mnacl、50mmmes缓冲液(ph6.5)、0.5%肌氨酸钠和30%甲酰胺中在处于或接近于探针的平均熔融温度的温度(例如,在51℃内,更优选在21℃内)下杂交。
当使用荧光标记的基因产物时,在微阵列的每一个位点处的荧光发射可优选地通过扫描共聚焦激光显微术检测到。在一个实施例中,针对所用两个荧光团中的每一个使用适当激发光线进行单独扫描。或者,可使用允许在特异性针对两个荧光团的波长下同时进行试样照射的激光器,并且可同时分析来自两个荧光团的发射(参见shalon等人,1996,“使用双色荧光探针杂交分析复杂dna样品的dna微阵列系统(adnamicroarraysystemforanalyzingcomplexdnasamplesusingtwo-colorfluorescentprobehybridization),”《基因组研究》6:639-645,其出于所有目的以全文引用的方式并入)。可使用具有计算机控制的x-y工作台和显微镜物镜的激光荧光扫描仪扫描阵列。使用多线路混合气体激光器实现两个荧光团的依次激发,并且发射光由波长分开并用两个光电倍增管检测到。荧光激光扫描装置描述在schena等人,《基因组研究》6:639-645(1996)本文中所列举的其它参考文献中。或者,由ferguson等人,《自然·生物技术》14:1681-1684(1996)所描述的光纤束可用于同时监测大量位点的mrna丰度水平。
在一个实施例中,本发明包括包含以下的微阵列:与defa4多核苷酸杂交的寡核苷酸、与cd163多核苷酸杂交的寡核苷酸、与per1多核苷酸杂交的寡核苷酸、与rgs1多核苷酸杂交的寡核苷酸、与hif1a多核苷酸杂交的寡核苷酸、与sepp1多核苷酸杂交的寡核苷酸、与c11orf74多核苷酸杂交的寡核苷酸、与cit多核苷酸杂交的寡核苷酸、与ly86多核苷酸杂交的寡核苷酸、与tst多核苷酸杂交的寡核苷酸、与or52r1多核苷酸杂交的寡核苷酸和与kcnj2多核苷酸杂交的寡核苷酸。
多核苷酸也可通过其它方法分析,包括但不限于northern印迹、核酸酶保护分析、rna指纹分析、聚合酶链式反应、连接酶链式反应、qβ复制酶、等温扩增方法、链置换扩增、基于转录的扩增系统、核酸酶保护(s1核酸酶或rna酶保护分析)、sage以及国际公开第wo88/10315号和第wo89/06700号和国际申请第pct/us87/00880号和第pct/us89/01025号中所公开的方法;其以全文引用的方式并入本文中。
根据所属领域的一般技术人员已知的常规northern杂交技术,标准northern印迹分析可用于确定rna转录物大小、鉴定交替剪接的rna转录物和样品中mrna的相对量。在northern印迹中,rna样品首先在变性条件下通过琼脂糖凝胶电泳按大小分离。随后将rna转移到膜,交联并且与标记探针杂交。可使用非同位素或高放射性比度放射性标记的探针,包括随机引导、切口翻译或pcr生成的dna探针、体外转录的rna探针和寡核苷酸。此外,可使用仅具有部分同源性的序列(例如来自不同物种的cdna或可能含有外显子的基因组dna片段)作为探针。含有全长单链dna或dna序列片段的标记探针(例如放射性标记的cdna)可为至少20个、至少30个、至少50个或至少100个连续核苷酸的长度。探针可通过所属领域的技术人员已知的许多不同方法中的任一种而被标记。最常用于这些研究的标记是放射性元素、酶、当曝露于紫外线时发荧光的化学物质等。多种荧光材料是已知的并且可用作标记。这些荧光材料包括但不限于荧光素、罗丹明、金胺、德克萨斯红、amca蓝和荧光黄。特定检测材料是在山羊体内制备并且经由异硫氰酸酯与荧光素结合的抗兔抗体。蛋白质也可用放射性元素或酶标记。放射性标记可通过目前可用的计数程序中的任一个检测到。可以使用的同位素包括但不限于3h、14c、32p、35s、36cl、35cr、57co、58co、59fe、90y、125i、131i和186re。酶标记同样有用,并且可通过目前采用的比色、分光光度、荧光分光光度、电流测定或气体测定技术中的任一个检测到。酶是通过与如碳化二亚胺、二异氰酸酯、戊二醛等桥连分子反应结合到所选粒子。可采用所属领域的技术人员已知的任何酶。这类酶的实例包括但不限于过氧化物酶、β-d-半乳糖苷酶、尿素酶、葡萄糖氧化酶加过氧化物酶和碱性磷酸酶。举例来说,参考美国专利第3,654,090号、第3,850,752号和第4,016,043号的关于替代性标记材料和方法的公开内容。
核酸酶保护分析(包括核糖核酸酶保护分析和s1核酸酶分析)可用于检测和定量特异性mrna。在核酸酶保护分析中,反义探针(经例如放射性标记或非同位素标记)在溶液中与rna样品杂交。在杂交后,利用核酸酶降解未杂交的单链探针和rna。使用丙烯酰胺凝胶分离其余受保护的片段。通常,溶液杂交比基于膜的杂交更有效,并且其与最大20-30μg的印迹交杂相比可容纳至多100μg样品rna。
核糖核酸酶保护分析,是最常见类型的核酸酶保护分析,需要使用rna探针。寡核苷酸和其它单链dna探针仅可用于含有s1核酸酶的分析。单链反义探针必须通常与靶rna完全同源以防止核酸酶裂解探针:目标杂交。
基因表达系列分析(sage)也可用于测定细胞样品中的rna丰度。参见例如velculescu等人,1995,《科学》270:484-7;carulli等人,1998,《细胞生物化学杂志(journalofcellularbiochemistry)》增刊30/31:286-96;其以全文引用的方式并入本文中。sage分析不需要特殊检测装置,并且是用于同时检测大量转录产物表达的优选分析方法之一。首先,从细胞提取聚a+rna。接着,使用生物素化寡聚(dt)引物将rna转化成cdna,并且用四碱基识别限制酶(锚定酶:ae)处理,产生在3′端含有生物素基团的经ae处理的片段。接下来,为结合将经ae处理的片段与抗生蛋白链菌素一起培育。将结合的cdna分成两份,并且每一份随后连接到不同双链寡核苷酸接头(连接子)a或b。这些连接子是由以下构成:(1)具有与通过锚定酶作用形成的突出部分的序列互补的序列的突出单链部分,(2)充当标签酶(te)的iis型限制酶(在远离识别位点不超过20bp的预定位置处裂解)的5′核苷酸识别序列,和(3)用于构建pcr特异性引物的具有足够长度的额外序列。使用标签酶裂解连接子连接的cdna,并且仅保留以短链序列标签形式存在的连接子连接的cdna序列部分。接着,将来自两种不同类型连接子的短链序列标签池彼此连接,随后使用特异性针对连接子a和b的引物进行pcr扩增。因此,扩增产物是以包含结合到连接子a和b的两种邻近序列标签(双标签)的多种序列的混合物形式获得。用锚定酶处理扩增产物,并且在标准键联反应中将游离双标签部分连接成链。随后克隆扩增产物。测定克隆的核苷酸序列可用于获得恒定长度的连续双标签的读出序列。可随后从克隆的核苷酸序列和关于序列标签的信息鉴别与每一个标签对应的mrna的存在。
定量逆转录酶pcr(qrt-pcr)也可用于测定生物标志物的表达谱(参见例如美国专利申请公开案第2005/0048542a1号;其以全文引用的方式并入本文中)。通过rt-pcr的基因表达谱分析的第一步是使rna模板逆转录成cdna,随后使其在pcr反应中进行指数扩增。两种最常用的逆转录酶是禽类成髓细胞瘤病毒逆转录酶(avilomyeloblastosisvirusreversetranscriptase,amv-rt)和莫洛尼鼠白血病病毒逆转录酶(moloneymurineleukemiavirusreversetranscriptase,mlv-rt)。逆转录步骤通常使用特异性引物、随机六聚体或寡聚dt引物引导,根据表达谱分析的环境和目标而定。举例来说,提取的rna可按照制造商说明书使用geneamprnapcr试剂盒(珀金埃尔默公司(perkinelmer),加利福尼亚州,美国)逆转录。所得到的cdna可随后作为模板用于后续pcr反应。
虽然pcr步骤可使用多种热稳定的dna依赖性dna聚合酶,但是其通常采用taqdna聚合酶,其具有5′-3′核酸酶活性但不具有3′-5′校正核酸内切酶活性。因此,taqmanpcr通常利用taq或tth聚合酶的5′-核酸酶活性水解与其目标扩增子结合的杂交探针,但是仍可使用任何具有等效5′核酸酶活性的酶。使用两种寡核苷酸引物生成pcr反应典型的扩增子。将第三寡核苷酸或探针设计成检测定位于两个pcr引物之间的核苷酸序列。探针无法通过taqdna聚合酶延伸,并且用报道荧光染料和淬灭荧光染料标记。当两种染料如它们在探针上一样紧密定位在一起时,任何激光诱导的来自报道染料的发射是由淬灭染料淬灭。在扩增反应期间,taqdna聚合酶以模板依赖性方式裂解探针。所得探针片段在溶液中解离,并且来自所释放的报道染料的信号没有第二荧光团的淬灭效应。新合成的每一分子释放一分子的报道染料,并且检测未淬灭的报道染料提供用于定量解释数据的基础。
taqmanrt-pcr可使用可商购的设备进行,如abiprism7700序列检测系统(珀金埃尔默应用生物系统公司,福斯特市,加利福尼亚州,美国)或lightcycler(rochemolecularbiochemicals,曼海姆,德国(mannheim,germany))。在一优选实施例中,5′核酸酶程序是在如abiprism7700序列检测系统的实时定量pcr装置上运行。所述系统由热循环仪、激光器、电荷耦合装置(ccd)、照相机和计算机组成。所述系统包括用于运行仪器和用于分析数据的软件。5′-核酸酶分析数据首先表示为ct或阈值循环。在每一循环期间记录荧光值并且其表示在扩增反应中扩增到那一点的产物量。当荧光信号最先记录为统计学上显著时的点是阈值循环(ct)。
为了使错误和样品间变化的效应最小,通常使用内标进行rt-pcr。理想内标在不同组织当中以恒定水平表达并且不受实验治疗影响。最经常用于将基因表达图谱正规化的rna是管家基因甘油醛-3-磷酸脱氢酶(gapdh)和β-肌动蛋白的mrna。
更新的rt-pcr技术变化形式是实时定量pcr,其经由双重标记的荧光生成探针(即,taqman探针)测量pcr产物的累积。实时pcr与使用每一目标序列的内部竞争者进行正规化的定量竞争性pcr和使用样品内含有的正规化基因或用于rt-pcr的管家基因的定量比较pcr都相容。关于更多细节,参见例如held等人,《基因组研究》6:986-994(1996)。
生物标志物数据的分析
可以通过多种方法分析生物标志物数据以鉴定生物标志物并且确定测试与参考表达谱之间观察到的生物标志物水平的差异的统计学显著性,以评估患者是否在30天内处于死亡风险下。在某些实施例中,患者数据是通过一种或多种方法分析,所述方法包括但不限于多变量线性判别分析(lda)、接受者工作特征(roc)分析、主成分分析(pca)、集合数据挖掘方法、微阵列的显著性分析(sam)、微阵列的细胞特异性显著性分析(cssam)、密度归一化事件的生成树级数分析(spade)和多维蛋白质鉴定技术(mudpit)分析。(参见例如hilbe(2009)《逻辑回归模型(logisticregressionmodels)》,chapman&hall/crcpress;mclachlan(2004)《判别分析和统计模式识别(discriminantanalysisandstatisticalpatternrecognition)》.wileyinterscience;zweig等人(1993)《临床化学(clin.chem.)》39:561-577;pepe(2003)《用于分类和预测的医学检验的统计评估(thestatisticalevaluationofmedicaltestsforclassificationandprediction)》,纽约,ny:oxford;sing等人(2005)《生物信息学(bioinformatics)》21:3940-3941;tusher等人(2001)《美国国家科学院院刊》98:5116-5121;oza(2006)《集合数据挖掘(ensembledatamining)》,nasaames研究中心,莫菲特菲尔德(moffettfield),加利福尼亚州,美国;english等人(2009)《生物医学信息学杂志(j.biomed.inform.)》42(2):287-295;zhang(2007)《生物信息学》8:230;shen-orr等人(2010)《免疫学杂志》184:144-130;qiu等人(2011)《自然·生物技术》29(10):886-891;ru等人(2006)《色谱杂志a(j.chromatogr.a.)》1111(2):166-174,jolliffe主成分分析(《springer系列丛书--统计(springerseriesinstatistics)》,第2版,springer,纽约州,2002),koren等人(2004)《ieee可视化与计算机图形学学报(ieeetransviscomputgraph)》10:459-470;其以全文引用的方式并入本文中。)
c.试剂盒
在又一方面中,本发明提供用于受试者的死亡预后的试剂盒,其中试剂盒可用于检测本发明的生物标志物。举例来说,试剂盒可用于检测本文所描述的生物标志物中的任何一个或多个,其在来自危重患者中的幸存者和非幸存者的样品中差异表达。试剂盒可包括一种或多种用于检测生物标志物的药剂、用于盛放从疑似患有危及生命的病况的人类受试者分离的生物样品的容器;以及用于使药剂与生物样品或一部分生物样品反应以检测生物样品中至少一种生物标志物的存在或量的印刷说明书。所述药剂可以包装在单独的容器中。试剂盒可另外包含一种或多种对照参考样品和用于进行免疫分析或微阵列分析的试剂。
在某些实施例中,试剂盒包含用于测量所关注的至少十二种生物标志物的水平的药剂。举例来说,试剂盒可包括检测包含以下的一组生物标志物的药剂:defa4多核苷酸、cd163多核苷酸、per1多核苷酸、rgs1多核苷酸、hif1a多核苷酸、sepp1多核苷酸、c11orf74多核苷酸、cit多核苷酸、ly86多核苷酸、tst多核苷酸、or52r1多核苷酸和kcnj2多核苷酸。
在某些实施例中,试剂盒包含用于分析多种生物标志物多核苷酸的微阵列。包括于试剂盒中的示例性微阵列包含与defa4多核苷酸杂交的寡核苷酸、与cd163多核苷酸杂交的寡核苷酸、与per1多核苷酸杂交的寡核苷酸、与rgs1多核苷酸杂交的寡核苷酸、与hif1a多核苷酸杂交的寡核苷酸、与sepp1多核苷酸杂交的寡核苷酸、与c11orf74多核苷酸杂交的寡核苷酸、与cit多核苷酸杂交的寡核苷酸、与ly86多核苷酸杂交的寡核苷酸、与tst多核苷酸杂交的寡核苷酸、与or52r1多核苷酸杂交的寡核苷酸、与kcnj2多核苷酸杂交的寡核苷酸。
试剂盒可包含一个或多个试剂盒中所含组合物的容器。组合物可呈液体形式或可冻干。用于组合物的合适容器包括例如瓶子、小瓶、注射器和试管。容器可由多种材料(包括玻璃或塑料)形成。试剂盒还可包含药品说明书,其含有诊断脓毒症方法的书面说明。
本发明的试剂盒具有多种应用。举例来说,试剂盒可用于测定疑似患有危及生命的病况的受试者的死亡风险。可将通过本文所描述的方法鉴定为在30天内具有死亡的高风险的受试者送到icu以治疗,而可在常规医院病房中进一步监测和/或治疗鉴定为在30天内具有死亡的低风险的患者。患者和临床医生都可以从更好的死亡风险估计中受益,这可以及时讨论患者的偏好以及他们对挽救生命措施的选择。更好的患者分子表型也可能改善临床试验,在1)药物和干预的患者选择和2)观察到预期的受试者死亡率的评估中。
d.确定死亡风险的诊断系统和计算机化方法
在另一方面,本发明包括一种用于确定疑似患有危及生命的病况的患者的死亡风险的计算机实施的方法。计算机执行包含以下的步骤:接收输入的患者数据,所述数据包含来自所述患者的生物样品中一种或多种生物标志物的水平的数值;分析一种或多种生物标志物的水平,并且与所述生物标志物的相应参考值范围进行比较;基于所述生物标志物的水平计算所述患者的死亡基因评分,其中与对照受试者相比所述患者较高的死亡基因评分指示所述患者在30天内处于死亡的高风险下;并且显示关于所述患者的死亡风险的信息。在某些实施例中,输入的患者数据包含来自患者的生物样品中多种生物标志物的水平的值。在一个实施例中,输入的患者数据包含defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74、cit、ly86、tst、or52r1和kcnj2多核苷酸的水平的值。
在另一个方面,本发明包括一种用于执行计算机实施的方法的诊断系统,如所描述。诊断系统可包括含有处理器、存储组件(即,存储器)、显示器组件和通常存在于一般目的计算机中的其它组件的计算机。存储组件存储可由处理器访问的信息,包括可由处理器执行的指令和可由处理器检索、操纵或存储的数据。
存储组件包括用于确定受试者的死亡风险的指令。举例来说,存储组件包括用于如本文所述(参见实例1)基于生物标志物表达水平计算受试者的死亡基因评分的指令。此外,存储组件可进一步包含用于进行多变量线性判别分析(lda)、接受者工作特征(roc)分析、主成分分析(pca)、集合数据挖掘方法、微阵列的细胞特异性显著性分析(cssam)和多维蛋白质鉴定技术(mudpit)分析的指令。将计算机处理器被耦合到存储组件上并且被配置成执行存储在存储组件中的指令以便接收患者数据并且根据一种或多种算法分析患者数据。显示器组件显示关于所述患者的诊断和/或预后(例如,死亡风险)信息。
存储组件可属于任何能够存储可由处理器访问的信息的类型,例如硬盘驱动器、存储卡、rom、ram、dvd、cd-rom、usb快闪驱动器、写入存储器和只读存储器。处理器可为任何熟知的处理器,例如来自因特尔公司(intelcorporation)的处理器。或者,处理器可为专用控制器,例如asic。
指令可为有待由处理器直接(例如机器代码)或间接(例如脚本)执行的任何指令集合。为此,术语“指令”、“步骤”和“程序”在本文中可互换使用。指令可以由处理器直接处理的目标代码形式或以任何其它计算机语言形式存储,所述其它计算机语言包括按需求解译或提前编译的脚本或无关的源代码模块的集合。
数据可根据指令由处理器检索、存储或修改。举例来说,虽然诊断系统不受任何特定数据结构限制,但是数据可存储在计算机寄存器中、以具有多种不同字段或记录的表格、xml文档或平面文件形式存储在关系型数据库中。数据还可以任何计算机可读格式来格式化,计算机可读格式例如但不限于二进制值、ascii或统一码。此外,数据可包含足以鉴定相关信息的任何信息,例如编号、描述性文本、专有代码、指针、对存储在其它存储器(包括其它网络位置)中的数据的引用或由计算相关数据的函数所使用的信息。
在某些实施例中,处理器和存储组件可包含能够或不能存储在同一物理外壳内的多个处理器和存储组件。举例来说,一些指令和数据可存储在可移动cd-rom上并且其它指令和数据存储在只读计算机芯片内。一些或全部指令和数据可存储在物理上远离处理器但仍可由处理器访问的位置中。类似地,处理器可实际包含能够或不能并行操作的处理器集合。
在一个方面,计算机为与一种或多种客户端计算机通信的服务器。每一个客户端计算机可与服务器类似地配置,具有处理器、存储组件和指令。每一个客户端计算机可为专供个人使用的个人计算机,具有个人计算机中通常所见的所有内部组件,例如中央处理单元(cpu)、显示器(例如显示由处理器处理的信息的监测器)、cd-rom、硬盘驱动器、用户输入装置(例如鼠标、键盘、触摸屏或麦克风)、扬声器、调制解调器和/或网络接口装置(电话、电缆或其它)以及用于将这些要素彼此连接并且允许其彼此(直接或间接)通信的所有组件。此外,根据本文所述的系统和方法的计算机可包含任何能够处理指令并且传输去往和来自人类和其它计算机(包括不具有本地存储能力的网络计算机)的数据的装置。
虽然客户端计算机和可包含全尺寸个人计算机,但是所述系统和方法的许多方面在与能够经网络(例如互联网)与服务器无线交换数据的移动装置结合使用时特别有利。举例来说,客户端计算机可为启用无线的pda,例如黑莓手机、苹果iphone或其它具有互联网功能的蜂窝电话。在这些方面中,用户可使用小键盘、键区、触摸屏或任何其它用户输入方式输入信息。计算机可具有天线用于接收无线信号。
服务器和客户端计算机能够直接和间接连通,例如在网络上。尽管可使用很少的计算机,但应了解,典型系统可包括许多在不同网络节点下与每种不同计算机连接的计算机。网络和介入节点可包含装置和通信协议的各种组合,包括互联网、万维网、内联网、虚拟专用网络、广域网、局域网、蜂窝电话网络、使用一个或多个公司专用的通信协议的专用网络、以太网、wifi和http。这类通信可通过能够将资料传输到其它计算机并且从其它计算机传输资料的任何装置,诸如调制解调器(例如,拨号或电缆)、网络和无线接口促进。服务器可为web服务器。
虽然当如上文所指出传输或接受信息时获得某些优势,但是所述系统和方法的其它方面不限于任何特定的信息传输方式。举例来说,在一些方面,信息可经由如磁盘、磁带、闪存驱动器、dvd或cd-rom等媒体传送。在其它方面,信息可以非电子格式传输并且手动输入到系统中。再有,虽然一些功能被指示为在服务器上进行并且其它功能在客户端上进行,但是所述系统和方法的各个方面可由具有单个处理器的单个计算机实施。
iii.实验
以下为执行本发明的特定实施例的实例。实例仅出于说明性目的提供,并且不打算以任何方式限制本发明的范围。
已经努力确保关于所用数字(例如数量、温度等)的准确度,但当然应该允许一些实验误差和偏差。
实例1
危重患者的死亡预后的方法
引言
我们以前已经展示,多群组分析是一种在脓毒症15和其它疾病(包括器官移植排斥、病毒感染和肺结核)中发现保守基因表达信号的有效方法16-18。因此,我们假设在患有脓毒症的患者中检查结果的多群组分析将产生保守基因集合,所述基因集合能够稳健地预测脓毒症结果,并且潜在地用作疾病预后的临床工具。
材料和方法
研究设计
这项研究的目的是使用综合多群组元分析框架分析多个基因表达数据集,以鉴定可在入院时预测患有脓毒症的患者的死亡的基因集合。先前已描述这种框架15,16,18。
搜索
搜索两个公开的基因表达微阵列存储库(nihgeo、arrayexpress)有关匹配任何以下搜索术语的所有人类数据集:脓毒症、sirs、创伤、休克、手术、感染、肺炎、危重、icu、发炎、医院内。保留比较健康对照或具有非感染性炎症(sirs、创伤、手术、自身免疫性)的患者与具有急性感染和/或脓毒症的患者的数据集用于进一步研究。不包括采用内毒素注射作为sirs或脓毒症模型的数据集。排除在分选的细胞(pbmc、中性粒细胞等)中完成的数据集。
在许多情况下,公共数据中没有死亡和严重程度表型;联系这些作者以获取进一步数据。这包括数据集e-mtab-154812、gse1047419、gse2180220、gse3270721、gse3334122、gse6304211、gse6399023、gse6609910,15,24,25和gse6689026。在所有情况下,基因表达数据是公开可获得的。提供这些数据的研究人员未参与下文所描述的数据分析。
两个群组e-mtab-4421和e-mtab-4451由相同的研究(gains)14得出,具有相同的纳入/排除标准,并且在相同的微阵列上处理。因此,在从原始数据重新正规化之后,我们使用combat正规化将这两个群组共同正规化为单个群组,我们将其称为e-mtab-4421.51。
gluegrant数据
除了公开可获得的数据集之外,我们还使用对损伤程序(gluegrant)创伤数据集的炎症和宿主反应27-29。gluegrant数据集含有两个群组:严重创伤患者和严重烧伤患者。创伤群组进一步包括两个亚群组,一个取样血沉棕黄层,并且另一个取样分选细胞;分选细胞群组从进一步研究中排除。纳入标准在别处描述30。入院后在以下天数对创伤患者进行取样:0.5、1、4、7、14、21、28天;烧伤患者在入院时进行取样,并且然后在其烧伤手术时进行取样。gluegrant患者如果具有医院内感染(肺炎、泌尿道感染、导管相关血流感染等)、手术感染(排除浅表伤口感染)或经历内脏穿孔手术,那么他们被归类为‘感染’;感染定义可见于gluegrant.org/commonlyreferencedpubs.htm。在诊断感染当天+/-24小时内抽取的样品被认为是感染时间。gluegrant的使用是由gluegrant联盟和斯坦福大学(stanforduniversity)irb共同批准(协议29798)。
基因表达正规化
所有affymetrix数据集以cel文件形式下载并使用gcrma(raffy包)再归一化。从其它阵列的输出进行正常指数背景校正,并且然后对阵列之间的量化进行归一化(r包装limma)。对于所有基因分析,将针对常见基因的探针平均值设置为基因表达水平。所有针对基因的探针的映射都是从来自最新soft文件的geo下载的。
多群组分析
比较在30天内死亡的患者与在30天内未死亡的患者,我们在入院48小时内进行脓毒症患者的基因表达的多群组分析15,16,18。在极少数情况下,我们获得了30天后患者死亡的信息,这些患者被排除在外。在选择输入数据集之后,我们组合在使用hedges′g的群组内的效果大小,然后利用desimonian-laird元分析来评价汇总效果。显著性阈值被设置为0.05的错误发现率(fdr),其汇总效果大小大于1.3倍(在非对数空间中)。
我们接下来在供应临床严重程度和年龄的表型数据的群组中进行元回归分析。对于每个群组,对于每个基因,模型是作为临床严重程度加上年龄加上基因表达水平的函数的死亡(相关)的回归。为了保持数据集之间的比例相似,(1)基于其描述文章中的模型,将所有临床严重程度评分转换为对数-几率死亡,和(2)在元分析之前,将所有数据集一起combat标准化(这一方法重置每个基因的位置和比例,但保留群组内的差异)。使用becker和wu(2007)32描述的斜率合成回归方法的矩随机效果模型变化31的闭合形式方法进行元回归。因此,在这种情况下,如果基因在所有群组中具有统计学上保守的回归系数(β)以预测与临床严重程度和年龄无关的死亡,那么认为所述基因是显著的。未校正的p值<0.01被认为是显著的。
在分析的最后步骤中,我们通过标准的多群组分析和通过元回归将被认为是显著的基因集合的联合视为显著的。然后在贪婪迭代搜索模型中使用这些基因,其中允许贪婪前向搜索完成,接着是贪婪反向搜索,并且然后是另一个贪婪前向搜索。这种方法迭代进行,直到达到稳定的基因集合。在搜索中只使用发现数据集,并且函数最大化加权auc,所述加权auc是每个发现数据集的auc乘以其样品大小的总和。
基因评分
在贪婪搜索和最终基因集合中,基因评分定义为所有阳性基因的基因表达水平的几何平均值减去所有阴性基因的基因表达水平的几何平均值乘以阳性与阴性基因的计数比。这分别针对数据集中的每个样品计算。排除完整数据集中不存在的基因;将个别样品的基因缺失设定成一。
roc曲线
检查类别区分能力,比较每一个所检查的数据集中所关注类别的基因评分。在数据集中构建基因评分的roc曲线,并且使用梯形方法计算曲线下面积(auc)。汇总roc曲线通过kester和buntinx的方法计算,如先前所描述18,33。概述曲线仅用于总结来自相似比较(即,入院时的脓毒患者)的数据。
与严重性评分的比较
我们将基因评分的预后能力与含有这一信息的所有群组中的临床严重程度评分的预后能力进行比较。为了进行这些计算,我们首先对临床严重程度评分或基因评分进行逻辑回归以预测死亡。然后我们测试组合模型(作为临床严重程度和基因评分的函数的死亡,没有相互作用项)并且测量组合模型的auc。
验证
如每个研究的原始研究人员所确定的,将幸存者与最终的非幸存者进行比较,主要的验证检查入院的患有脓毒症的患者。在具有纵向数据的数据集的情况下,仅将在自入院后24-48小时内的患者用于总roc分析。roc曲线图是在稍后的时间点分别为患者构建的,从入院开始每天分为几部分,这取决于每个研究的取样方案。
使用定制分析来研究gluegrant数据集中基因集合的性能。首先,从受伤开始针对基因评分和每天严重程度评分对每个数据集(创伤和烧伤)中的所有患者每天作图(对于创伤患者,这是mods评分;对于烧伤患者,这是丹佛评分)。按照最初的定义,用gluegrant作者列举死亡类型:(1)脓毒病死亡,(2)创伤性脑损伤(tbi)/脑死亡,或(3)其它死亡。我们分离出tbi/脑死亡,因为这些死亡通常主要是最初损伤的直接后遗症,而不是由宿主反应引起的。在烧伤组中,注意到几个患者在研究期间但在30天后死亡;排除这些患者。然后我们进行两种类型的roc分析。首先,我们检查最终死亡的感染脓毒症的患者,并且将其与感染脓毒症但未死亡的患者进行比较,仅包括那些在相同时间窗口内感染脓毒症的患者。这类似于仅检查社区获得的脓毒症群组中的入院日。在第二次roc分析中,我们检查所有患者,比较因任何原因死亡的患者和未死亡的患者。在此,我们从入院起按时间将组划分为几段;然而,一些患者在这些组之间重复,并且因此对于所有原因的死亡分析,不同的时间段不是独立的。
细胞类型富集测试
如先前所描述,在先前检查的体外免疫细胞谱中评估基因集合的富集15。简单来说,搜索geo有关相关免疫细胞类型的临床样品的基因表达谱。对于全部对应于相同细胞类型的多个样品,将所述样品的平均值视为最终值,由此形成每一个细胞类型的单个向量。如上文所描述,在所得细胞类型载体中计算每个基因集合的基因评分。随后将所有细胞类型的这些评分标准化,以使得评分表示远离组平均值的标准差的数目。这因此表示给定基因集合在给定细胞类型中相对于其它测试细胞类型的富集程度。
两个基因集合是以这种方式测试:在多群组/元回归分析之后发现两个完整基因集合都是显著的,并且在迭代贪婪搜索之后发现基因子集最具诊断性。所得曲线图显示每个细胞亚型(黑点)中的z评分(给定基因集合的富集),以及z评分的总体分布的方框图(以红色显示)。
统计和r
以用于统计学计算的r语言(版本3.2.0)进行所有计算和运算。除非另外规定,否则将p值的显著性水平设置在0.05并且进行双尾分析。
结果
分析概述
我们的系统搜索发现匹配纳入/排除标准的19个群组9,11,12,14,15,19-23,26,34-38。其中,我们前瞻性地鉴定两个数据集作为验证群组:gse54514和e-mtab-4421.51。其它验证数据集(gse21802、gse33341、gse63990)仅在分析完成后才能使得表型数据可用。因此,在剩余的数据集中,我们取所有那些在入院或进入icu时对脓毒病患者进行专门检查的数据集,其产生12个群组,总共490个幸存者和160个非幸存者(表1)。我们应用两种分析方法来发现与死亡显著相关的基因(图1)。首先,我们在入院时对幸存者与非幸存者之间的差异基因表达进行了多群组元分析,产生96个在fdr<0.05和效应大小>1.3倍时显著的基因。在第二次分析中,我们进行了随临床严重程度、年龄和基因表达的逻辑函数的死亡的斜率合成随机效应元回归。这产生35个在p<0.01时显著的基因。值得注意的是,元回归中最重要的三个基因都来自同一途径,即中性粒细胞嗜天青颗粒:defa4、ctsg和mpo。元分析和元回归基因集合的联合是122个基因,我们将其作为我们的“重要”基因列表。
12个基因的集合的发现
我们接下来使用122个基因列表对12个发现数据集执行迭代贪婪搜索,试图找到如加权auc测量的最大化诊断性能的基因列表。简单来说,所述算法在前向与后向贪婪搜索之间迭代,直到其收敛于基因列表。这种算法经设计以寻找比简单的前向搜索更接近整体最大值的最大值。算法运行完成,产生12个基因的集合。在死亡患者中上调的基因是:defa4、cd163、per1、rgs1、hif1a、sepp1、c11orf74和cit,并且下调的基因是:ly86、tst、or52r1和kcnj2。这12个基因的集合的平均发现auc为0.847+/-0.081,总auc为0.85(图2-6)。另外,在将发现群组中的死亡基因评分与临床严重程度评分进行比较时,我们显示在所有情况下,基因评分在单独使用临床严重程度预测死亡时都得到改善(除了在临床严重程度完全分离死亡的两种情况下;表2)。最后,只有一个群组(gse63042)含有血乳酸水平;在这组中,血乳酸auc为0.72,而12个基因的评分auc为0.78。
入院时脓毒症患者的直接验证
我们接下来检查了在入院时检查脓毒症患者的5个验证数据集中12个基因的评分的预后能力(表3)。对于具有纵向样品的两组(gse21802和gse54514),我们分别仅在入院后的最初48或24小时进行检查,而在分析中不重复任何患者。因此,这共产生415名幸存者和136名非幸存者。在这五个群组中,12个基因的评分显示总auc为0.84(95%ci0.58-0.96;图7-9)。值得注意的是,auc在e-mtab-4421.51中最低;这个群组允许患者在入院后第5天在窗口中登记,可能偏离结果。在具有纵向取样的两个验证群组(gse21802,gse54514)的分析中,我们发现了相似的趋势,即,随时间粗略保存的auc,直到在晚期时间点的幸存者偏差引起auc的下降(图10-11)。另外,在两个群组中,12个基因的评分显示随时间下降的总体趋势,这意味着在脓毒症诊断后5天抽取的样品将具有比在第1天抽取的样品更低的预期评分。由于e-mtab-4421.51中的取样技术,这类发现可能支持向下偏差。另外,gse21802和gse54514均包括入院严重程度评分;我们再次比较了单独和与12个基因的评分的组合的预后能力,显示在两种情况下的小升力(0.02-0.05)。
gluegrant的验证
我们接下来检查gluegrant创伤(血沉棕黄层)和烧伤(全血)患者(表3)。对于创伤群组,我们首先绘制了所有患者的12个基因的评分和临床严重程度评分的轨迹(图12),显示死亡病例中更高基因评分的明显趋势。在这一群组中的一个所定义的脓毒症死亡中,患者的12个基因的评分高于四个时间点的三个的所有其它评分。我们还使用roc曲线检查诊断时脓毒病患者和入院后随时间变化的所有患者的预后能力。与诊断时间相匹配的脓毒症患者仅表现出一次死亡,但是与其他12名患者相比,这被完全预测到(图13a)。在所有患者中,随时间的变化,12个基因的评分对所有病因死亡也显示中等预后能力(auc0.75-0.86,图13b)。在gluegrant烧伤群组中,我们进行相同类型的分析,结果相似。死亡患者的基因评分轨迹通常可与存活的患者分开,尽管临床严重程度轨迹同样是鉴定这些患者的良好工作(图14)。检查与时间匹配的患有脓毒症的患者,预测诊断,12个基因的评分在入院后第1-3天(auc0.63)能力差,但在第3-7天(auc0.85)能力高得多;这两个时间段不含重叠的患者(图15a)。纵向检查所有死因的预测,烧伤数据显示auc的范围(0.63-0.82),显示自入院以来随时间增加,在自烧伤开始的最初24小时中性能尤其差(图15b)。
细胞类型特异性表达
最后,为了增加一些对这些基因的生物学的深刻理解,我们对所有122个重要基因以及预后12个基因的集合进行了计算机细胞类型表达分析,如先前描述(图16)。这里的假设是在特异性免疫细胞类型中信号的增加可以表明这些基因在全血中表达的变化实际上可以指示检测到细胞类型的变化,而不是(或除了)细胞内转录水平的变化。令人感兴趣的是,122个基因的集合表现出杆状核细胞和晚幼粒细胞的显著富集,这指示未成熟的中性粒细胞可能与脓毒病死亡有特异性关联,这与其它组的一些先前建议相一致。然而,在任何细胞类型中,12个基因的集合没有显示出任何显著的过度富集。对于中心细胞发现的负相信号不可能是生物学相关的,因为这些细胞类型在血液中不存在有意义的数量。
讨论
脓毒病是一种难以置信的异种综合征,包括广泛可能的患者病况、并存病、急性严重程度、感染后的时间和潜在的免疫状态。许多人先前曾假设免疫系统的分子谱可能能够预测脓毒症的结果。然而,预测结果的最佳临床工具仍然是血乳酸和临床严重程度评分,这两者都有一些局限性。在这里,我们结合了大量数据(12个群组,650名患者)来界定一组仅能够预测脓毒症患者死亡的12个基因。我们直接在5个群组中对551名患者进行了这一评分验证,总rocauc为0.84。此外,我们在另外421名具有严重创伤或烧伤的患者中表明,12个基因的评分保留了患有脓毒症的患者死亡的预测能力,以及一些预测非常广泛群组中所有死因的能力。
由于几个原因,脓毒症中宿主反应严重程度的这种分子定义很重要。首先,通过正确地将患者与资源进行匹配,更好的脓毒症预后可以改善临床护理:通过最大干预,可以将更虚弱的患者转移到icu,而不可能死亡的患者可以在医院病房中安全地观察。其次,患者和临床医生都可以从更准确的预后估计中受益,从而可以更好地讨论患者的偏好和干预的选择。最后,脓毒症患者更好的分子分型可以允许在临床试验中很大的改善,通过两个(1)患者的选择和对药物和干预的预后富集,和(2)对观察到预期的死亡率的更好的评估5,6。
我们已经鉴定为与脓毒症死亡相关的基因也可能表示重要的潜在生物学。举例来说,与临床严重程度无关的死亡相关的前三个基因是嗜天青颗粒蛋白酶,指示血液中存在非常不成熟的中性粒细胞(晚幼粒细胞)。这些蛋白酶本身是否有害,或是否有害细胞类型转变的标志,还有待确认。几个小组已经表明晚期脓毒症死亡主要是由于影响适应性免疫系统的“免疫瘫痪”。因此,本文中所示的转录组学变化可以是通过诱导适应性免疫破坏间接与死亡相关的一系列事件的一部分。因此,这些基因可以是直接治疗性靶标,而不仅仅是脓毒症严重程度的标志物。需要更多的研究。
我们的分析存在一些缺点;最值得注意的是,最大的验证数据集e-mtab-4421.51显示所有数据集的最差性能。对此至少有三种可能的解释:首先,如上所述,这个群组允许包括自入院后第5天,但不包括哪天与公共表型文件中的哪个患者相关。由于在患有脓毒症的患者中评分似乎随时间下降,并且由于可能对以后登记的更虚弱的患者有偏差(因为在入院时常常难以登记病得很重的患者),这可能导致下降的偏差。其次,这个群组可能比其它群组“病情更严重”,尽管18-23的平均apache评分几乎与我们的诊断能力得到证实的gse54514一致。最后,当然,由于其大小或一些未知的其它临床因素,基因集合可能在这个群组中表现不佳。这似乎不太可能,因为在其它16个发现和验证群组中,最低auc为0.72(gse10474,n=33)。在任何情况下,在临床应用之前需要进一步的前瞻性确认。
总之,通过对脓毒症中可获得的转录组数据的综合分析,我们获得了一组12个基因,其水平可用于预测脓毒症患者的短期(30天)死亡,证实来自5个群组的551个独立患者。这些发现表明全血转录组确实携带了最终死亡的早期信号。其也说明在严重脓毒症中用于进一步机制或治疗性研究的一组目标。最后,12个基因的集合可以潜在地直接用作预后测试,尽管需要进一步的前瞻性确认。
参考
1.singerm,deutschmancs,seymourcw,等人.《脓毒症和脓毒性休克的第三国际共同定义(脓毒症-3)(thethirdinternationalconsensusdefinitionsforsepsisandsepticshock(sepsis-3).)》《美国医学会杂志(jama)》2016年2月;315(8):801-810。。
2.torioca,andrewsra.《国家的住院患者:由支付方的最昂贵病况(themostexpensiveconditionsbypayer)》2011.hcup统计简报#160...rockville,md:《医疗研究和品质的机构(agencyforhealthcareresearchandquality)》;2013年8月。
3.liuv,escobargj,greenejd,等人.《来自2个独立群组的患有脓毒症的患者的医院死亡(hospitaldeathsinpatientswithsepsisfrom2independentcohorts)》.《美国医学会杂志》2014年5月。
4.kaukonenkm,baileym,pilcherd,cooperdj,bellomor.《界定严重脓毒症的全身炎症反应综合征标准(systemicinflammatoryresponsesyndromecriteriaindefiningseveresepsis)》.《新英格兰医学杂志(nengljmed.)》2015年4月;372(17):1629-1638。
5.opalsm,dellingerrp,vincentjl,masurh,angusdc.《下一代脓毒症临床试验设计:重组人类活化蛋白c去毒之后是什么?*(thenextgenerationofsepsisclinicaltrialdesigns:whatisnextafterthedemiseofrecombinanthumanactivatedproteinc?*)》.《危重病急救医学(critcaremed.)》2014年7月;42(7):1714-1721。
6.cohenj,vincentjl,adhikarink,等人.《脓毒症:未来研究的路标(sepsis:aroadmapforfutureresearch)》.《刺血针感染期刊(lancetinfectdis.)》2015年5月;15(5):581-614。
7.sweeneyte,wonghr.《脓毒症的风险分层和预后:我们从微阵列中学到了什么?(riskstratificationandprognosisinsepsis:whathavewelearnedfrommicroarrays?)》《所接受的胸腔药物的诊所(clinicsinchestmedicine.accepted)》,2015。
8.parnellg,mcleana,boothd,huangs,nalosm,tangb.《异常细胞循环和凋亡变化表征严重a型流感感染--循环白细胞中的基因组标签的元分析(aberrantcellcycleandapoptoticchangescharacterisesevereinfluenzaainfection--ameta-analysisofgenomicsignaturesincirculatingleukocytes)》.《科学公共图书馆综合卷(plosone)》.2011;6(3):e17186。
9.parnellgp,tangbm,nalosm,等人.《在脓毒性患者的全血中鉴定关键调控基因以监测潜在免疫功能障碍(identifyingkeyregulatorygenesinthewholebloodofsepticpatientstomonitorunderlyingimmunedysfunctions)》.《休克(shock.)》2013年9月;40(3):166-174。
10.wonghr,shanleytp,sakthivelb,等人《儿科脓毒性休克中的基因组水平表达谱指示在不良结果中用于更改锌内稳定的作用(genome-levelexpressionprofilesinpediatricsepticshockindicatearoleforalteredzinchomeostasisinpooroutcome.)》《生理学基因组学(physiolgenomics)》.2007年7月;30(2):146-155。
11.tsalikel,langleyrj,dinwiddiedl,等人《脓毒症存活和死亡的综合转录组和表达变型分析(anintegratedtranscriptomeandexpressedvariantanalysisofsepsissurvivalanddeath)》.《基因组医学(genomemed.)》2014;6(11):111。
12.almansar,heredia-rodriguezm,gomez-sancheze,等人《与脓毒症中器官失效程度相关的转录组学(transcriptomiccorrelatesoforganfailureextentinsepsis.)》《传染病杂志(jinfect)》.2015年5月2015年;70(5):445-456。
13.wonghr,cvijanovichnz,anasn,等人.《开发临床上可实行的个体化用药方法以用于儿科脓毒性休克(developingaclinicallyfeasiblepersonalizedmedicineapproachtopediatricsepticshock.)》《美国呼吸和重症护理医学杂志(amjrespircritcaremed.)》2015年2月;191(3):309-315。
14.davenportee,burnhamkl,radhakrishnanj,等人《脓毒症中宿主反应和后果的基因组概貌:前瞻性群组研究(genomiclandscapeoftheindividualhostresponseandoutcomesinsepsis:aprospectivecohortstudy)》.《刺血针感染期刊(lancetrespirmed.)》2016年2月。
15.sweeneyte,shidhama,wonghr,khatrip.《脓毒症和无菌炎症的基于时程的多群组分析揭示稳定诊断基因集合(acomprehensivetime-course-basedmulticohortanalysisofsepsisandsterileinflammationrevealsarobustdiagnosticgeneset.)》《科学·转化医学(scitranslmed.)》2015年5月;7(287):287ra271。
16.khatrip,roedders,kimuran,等人《在用于器官移植的多个器官鉴定新颖的治疗学中对于急性排斥的常见排斥模块(crm)(acommonrejectionmodule(crm)foracuterejectionacrossmultipleorgansidentifiesnoveltherapeuticsfororgantransplantation.)》《实验医学杂志(jexpmed.)》2013年10月;210(11):2205-222。
17.andres-terrem,mcguirehm,poulioty,等人《综合多群组分析在多种呼吸道病毒中鉴定保守转录标签(integrated,multi-cohortanalysisidentifiesconservedtranscriptionalsignaturesacrossmultiplerespiratoryviruses.)》《免疫(immunity.)》2015年12月;43(6):1199-1211。
18.sweeneyte,braviakl,tatocm,khatrip.《基因组宽表达用于肺结核的诊断:多群组分析(genome-wideexpressionfordiagnosisofpulmonarytuberculosis:amulticohortanalysis.)》《刺血针感染期刊》2016年3月;4(3):213-224。
19.howrylakja,dolinayt,luchtl,等人.《患有脓毒症的患者中急性肺损伤的基因标签的发现(discoveryofthegenesignatureforacutelunginjuryinpatientswithsepsis.)》《生理学基因组学》2009年4月;37(2):133-139。
20.bermejo-martinjf,martin-loechesi,relloj,等人.《严重广泛流行性流感的宿主适应性免疫缺乏症(hostadaptiveimmunitydeficiencyinseverepandemicinfluenza.)》《严重照护(critcare.)》2010;14(5):r167。
21.dolinayt,kimys,howrylakj,等人.《急性肺损伤的严重介体的炎性体调控细胞因子(inflammasome-regulatedcytokinesarecriticalmediatorsofacutelunginjury.)》《美国呼吸和重症护理医学杂志(amjrespircritcaremed.)》2012年6月;185(11):1225-1234。
22.ahnsh,tsalikel,cyrdd,等人《基于基因表达的分类器鉴定小鼠和人类中金黄色酿脓葡萄球菌感染(geneexpression-basedclassifiersidentifystaphylococcusaureusinfectioninmiceandhumans.)》《科学公共图书馆综合卷(plosone.)》2013年;8(1):e48979。
23.tsalikel,henaor,nicholsm,等人.《宿主基因表达分类器诊断急性呼吸道疾病病因(hostgeneexpressionclassifiersdiagnoseacuterespiratoryillnessetiology.)》《科学转化医学》2016年1月;8(322):322ra311。
24.wonghr,cvijanovichn,allengl,等人《在儿科全身炎症反应综合征、脓毒症和脓毒性休克谱中的基因组表达谱(genomicexpressionprofilingacrossthepediatricsystemicinflammatoryresponsesyndrome,sepsis,andsepticshockspectrum.)》《危重病急救医学(critcaremed.)》2009年5月;37(5):1558-1566。
25.wonghr,cvijanovichn,linr,等人《基于基因组宽表达谱的儿科脓毒性休克子类的鉴定(identificationofpediatricsepticshocksubclassesbasedongenome-wideexpressionprofiling.)》《bmc医学(bmcmed.)》2009;7:34。
26.kangelariskn,prakasha,liukd,等人.《患有早期脓毒症诱导的ards的患者的中性粒细胞相关的基因的表达增加(increasedexpressionofneutrophil-relatedgenesinpatientswithearlysepsis-inducedards.)》《美国生理学肺细胞分子生理学期刊(amjphysiollungcellmolphysiol.)》2015年6月;308(11):l1102-1113。
27.seokj,warrenhs,cuencaag,等人.《小鼠模型中的基因组反应不良地模拟人类发炎性疾病(genomicresponsesinmousemodelspoorlymimichumaninflammatorydiseases.)》《美国国家科学院院刊(procnatlacadsciusa.)》2013年2月;110(9):3507-3512。
28.warrenhs,elsoncm,haydendl,等人.《创伤患者的结果的基因组评分预后(agenomicscoreprognosticofoutcomeintraumapatients.)》《分子医学(molmed.)》2009年7月-2009年8月;15(7-8):220-227。
29.xiaow,mindrinosmn,seokj,等人.《严重受伤人类的基因组暴风雨(agenomicstormincriticallyinjuredhumans.)》《实验医学杂志(jexpmed.)》2011年12月;208(13):2581-2590。
30.desaikh,tancs,leekjt,等人.《通过患者内基因表达变化的严重受伤患者的解剖发炎性并发症:纵向临床基因组学研究(dissectinginflammatorycomplicationsincriticallyinjuredpatientsbywithin-patientgeneexpressionchanges:alongitudinalclinicalgenomicsstudy.)》《科学公共图书馆-医学》2011年9月;8(9):e1001093。
31.chenh,manninga,dupuisj.《(一种用于随机效果多变量元分析的矩估测器的方法(amethodofmomentsestimatorforrandomeffectmultivariatemeta-analysis.)》《生物标识技术(biometrics.)》20122012年;68(4):1278-1284。
32.beckerb,wum.《元分析中回归斜率的合成(thesynthesisofregressionslopesinmeta-analysis.)》《统计科学(statisticalscience.)》20072007年8月;22(3):414-429.
33.kesterad,buntinxf.《roc曲线的元分析(meta-analysisofroccurves.)》《医学发现制备(meddecismaking.)》2000年10月-12月2000年;20(4):430-439。
34.irwinad,marriagef,mankhambola,等人《改进马拉维儿童的严重细菌感染的诊断的新颖生物标志物组合(novelbiomarkercombinationimprovesthediagnosisofseriousbacterialinfectionsinmalawianchildren.)》《bmc医学基因组学(bmcmedgenomics.)》2012;5:13.
35.kwana,hubankm,rashida,kleinn,petersmj.《在成为脓毒症期间的转录不稳定性可限制基于生物标志物的风险分层(transcriptionalinstabilityduringevolvingsepsismaylimitbiomarkerbasedriskstratification.)》《科学公共图书馆综合卷》2013;8(3):e60501。
36.panklar,buddhisas,berrym,等人.《基因组转录谱分布鉴定用于诊断脓毒症的类鼻疽病的候选的血液生物标志物标签(genomictranscriptionalprofilingidentifiesacandidatebloodbiomarkersignatureforthediagnosisofsepticemicmelioidosis.)》《基因组生物学》2009;10(11):r127.
37.berdalje,mollneste,
38.lillm,
虽然已说明和描述本发明的优选实施例,但是应了解,可在不脱离本发明的精神和范围的情况下进行各种改变。
- 还没有人留言评论。精彩留言会获得点赞!