组合腺病毒和检查点抑制剂用于治疗癌症的制作方法
本发明涉及医学领域。具体地,本发明涉及使用oncos-102腺病毒与一种或多种检查点抑制剂联合治疗人癌症的新策略。还公开了使用病毒和一种或多种检查点抑制剂的这种联合治疗人癌症的方法。除了病毒和一种或多种检查点抑制剂以外,其他药物也可以包括在所述治疗方案中。
发明背景
免疫系统的一个重要部分是其分辨体内正常细胞和其视为“外来”的那些的能力。这让免疫系统攻击外来细胞,同时单独留下正常细胞。为了做到这一点,其使用“检查点”-某些免疫细胞上需要被活化(或失活)以开始免疫反应的分子。
癌细胞有时找到使用这些检查点以避免被免疫系统攻击的方式。免疫检查点抑制剂是药物–经常由抗体制成–其解除免疫系统对癌细胞的攻击。它们近年来已取得了一些令人印象深刻的成功,特别是在一些具有转移性黑色素瘤或霍奇金淋巴瘤的患者中,并且在涉及具有其他类型癌症的患者的临床试验中显示出前景。
靶向检查点蛋白质快速变为一些癌症(诸如黑色素瘤和非小细胞肺癌)的治疗的重要部分。研究人员也已经发现针对许多其他癌症类型的有希望的早期结果。与大多数其他癌症药物不同,这些检查点抑制剂似乎针对许多不同类型的癌症是有帮助的。
病毒疗法是一种相对新型的治疗方法,其利用了一些病毒杀伤它们在其中增殖的细胞的天然能力和扩散到相邻细胞(从而放大初始输入剂量的治疗效果)的能力。在病毒疗法中,通过病毒基因组的基因工程改造小心控制癌细胞转导和病毒复制,以获得有效和安全的肿瘤根除。安全的肿瘤根除需要将各种遗传修饰引入腺病毒基因组,从而将复制仅限制在肿瘤细胞中,并最终获得肿瘤的选择性根除,而对健康组织没有副作用。
腺病毒关键调控基因的特定缺失可用于产生功能失调的蛋白质或其表达的缺乏,这导致对靶细胞中存在的特定遗传特征的依赖。e1a的部分缺失导致在正常细胞中的复制受限,但允许在靶细胞诸如癌细胞中复制。产生了特征在于cr2(恒定区2)中的24个碱基对缺失的条件性复制病毒,显示其在治疗神经胶质瘤和乳腺癌异种移植物方面是有效的和选择性的(fueyo等人,2000;heise等人2000)。其癌症特异性源于功能失调的e1a不能释放e2f1转录因子,这导致对游离e2f1的需要。e2f1在癌细胞中很丰富,其中prb途径最常被破坏(hanahan和weinberg2000)。
临床和临床前结果已显示,用非武装性溶瘤病毒的治疗的免疫刺激性不足以导致持续的抗肿瘤治疗性免疫反应。在这方面,溶瘤病毒已被武装成更具免疫刺激性。可将病毒工程改造以表达高度免疫原性的蛋白质,诸如粒细胞-巨噬细胞集落刺激因子(gm-csf)。当免疫原性蛋白质在肿瘤微环境内表达时,它们是特异性和长效的抗肿瘤免疫力的强效刺激剂。将免疫治疗性基因引入肿瘤细胞中并进一步将其翻译成蛋白质导致了免疫反应的活化和对肿瘤细胞的更高效破坏。在这方面,最相关的免疫细胞是天然杀伤细胞(nk)和细胞毒性cd8+t细胞。
oncos-102(ad5/3-d24-gm-csf;在wo2010/072900中公开)是血清型5腺病毒,其包含用于增强向癌细胞递送基因的嵌合衣壳和用于癌细胞局限性复制的e1a区域的rb结合部位中的24bp缺失。oncos-102装备有粒细胞-巨噬细胞集落刺激因子(gm-csf)以增强免疫刺激作用。oncos-102的安全性和免疫学活性已在i期临床研究(nct01598129)中得到证明。在本发明人的该i期研究中,用oncos-102局部治疗胸膜间皮瘤诱导了全身性抗肿瘤cd8+t细胞反应,并且cd8+t细胞浸润于最后一线难治性恶性胸膜间皮瘤患者的肿瘤中。
koski等人(2010)公开了用oncos-102治疗总共21名患有标准疗法难治的晚期实体瘤的患者。根据这些研究,oncos-102在治疗癌症患者中似乎是安全的。还看到了令人期待的功效迹象。
已经公开了利用病毒疗法连同检查点抑制剂的联合疗法的一些实例。wo2014/047350设想一种重组溶瘤病毒,其具有插入病毒基因组中的编码抗pd-1抗体的基因。公开wo2014/036412涉及使用单纯疱疹病毒与免疫检查点抑制剂的组合治疗黑色素瘤的方法。目前正在进行一项talimogenelaherparepvec(t-vec,商品名为imlygic)(其为基于单纯疱疹病毒(hsv)-1的溶瘤免疫疗法,其经设计以在肿瘤中选择性复制,产生gm-csf并刺激黑色素瘤中的抗肿瘤免疫反应)和在无法切除的iiib-iv期黑色素瘤中的派姆单抗的1b/3期研究。
公开us20150086541公开了通过使用免疫刺激细胞毒性基因疗法和免疫检查点调节剂的组合以及其他疗法(包括放射疗法、化学疗法、手术和免疫疗法)来减少或延迟局部或转移性肿瘤的尺寸增加的方法。
在治疗黑色素瘤中,已显示联合方法(其中治疗靶向两种不同的检查点抑制剂)比单独使用任一种治疗更好地起作用。然而,该组合伴随严重副作用的增加风险。进一步需要组合疗法以改善涉及诱导针对各种癌症的免疫反应的治疗的功效和安全性。因此,需要额外的癌症治疗,特别是对于晚期黑色素瘤。
发明概述
传统上,已认为病灶中的病毒存在是其功效所需的。现在,本发明人已令人惊讶地发现即使病毒局部施用也由病毒产生的全身效应。同样令人惊讶的是,在用oncos-102的强烈引发期之后,最初pd-1抑制剂难治性肿瘤变得对pd-1抑制剂敏感。
本发明的目的是提供溶瘤腺病毒和一种或多种检查点抑制剂的新型组合,使用溶瘤腺病毒和一种或多种检查点抑制剂治疗患者中的癌症的新型联合疗法,并且还解决与常规癌症疗法相关的问题。
本发明的一个方面是用于治疗人癌症、优选用于治疗人恶性黑色素瘤的oncos-102腺病毒,其中将向有此需要的人患者施用该病毒与施用一种或多种检查点抑制剂联合进行。
本发明的另一个方面是用于治疗患者中的人癌症、优选人恶性黑色素瘤的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤。
本发明的又另一个方面是oncos-102腺病毒在治疗人黑色素瘤中的用途,其中向患者联合施用所述病毒与一种或多种检查点抑制剂。
附图简述
包括以下附图来进一步表明本发明的某些方面和特征。参照这些附图中的一个或多个并结合具体实施方案(包括实施例)的详细描述,可以更好地理解本发明。
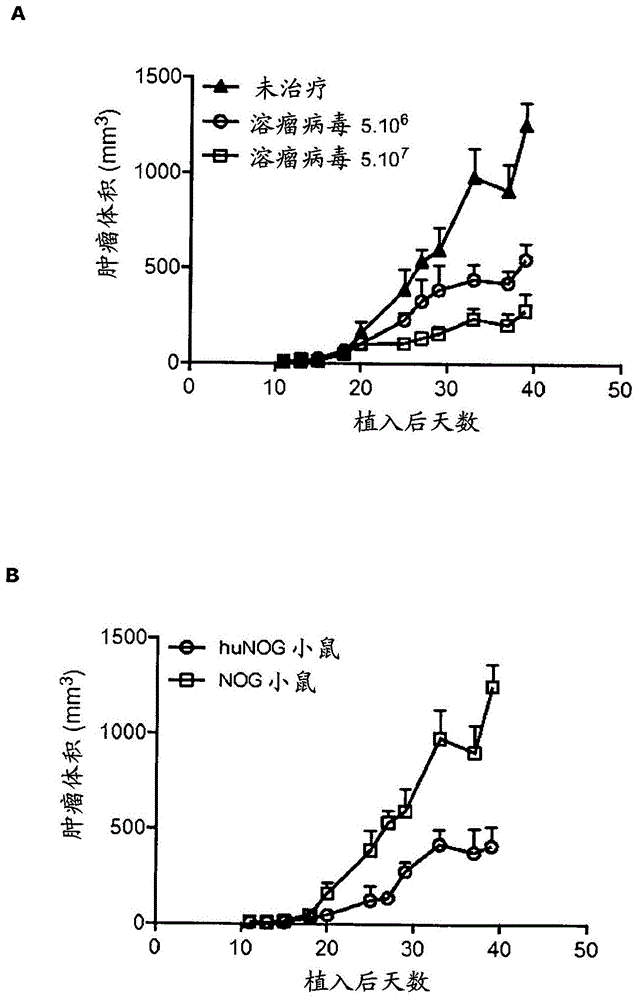
图1.在功效研究中,单独使用oncos-102、单独使用检查点抑制剂或联合使用oncos-102与检查点抑制剂治疗免疫缺陷和人源化小鼠中的基于人黑色素瘤a-375细胞的肿瘤。a)基于a-375细胞的肿瘤在免疫缺陷小鼠中显示病毒剂量依赖性敏感性。b)人免疫系统抑制人源化小鼠中的a-375肿瘤生长,而未治疗的免疫缺陷小鼠中的肿瘤生长不受抑制。c)显示溶瘤病毒与派姆单抗(keytruda)的组合在植入a375肿瘤细胞的人源化nog小鼠中的全身效应。与仅用派姆单抗治疗的肿瘤相比,用oncos-102(5x107个vp)治疗的右侧sk-mel2肿瘤的生长和未用oncos-102治疗的左侧sk-mel2肿瘤的生长同样受到抑制。小鼠中的肿瘤(其中仅派姆单抗作为ip注射(keytruda)施用)显示生长速率没有降低,进一步说明全身效应需要oncos-102的存在。d)与仅用oncos-102、派姆单抗或尼沃单抗(opdivo)治疗小鼠相比,派姆单抗(keytruda)与oncos-102的组合在人源化小鼠中显示对a-375肿瘤的增强的抗肿瘤效应。
图2.肿瘤生长分析。n=6-8(每只动物12-16个肿瘤)。结果被表示为平均值+/-sd,*<0.05。
图3.免疫细胞浸润。定量人cd45白细胞的数量,并表示为左胁(左小图)和右胁(右小图)上每克肿瘤的细胞数。结果表示为平均值+/-sd。n=2-6。*<0.05vsov+keytruda200。
图4.免疫细胞浸润。在左胁(左小图)和右胁(右小图)上定量cd3+白细胞中人cd8+t细胞的%。结果表示为平均值+/-sd。n=2-6.*<0.05**<0.01vs媒介物。§<0.05,§§<0.01vskeytruda400。#<0.05vskeytruda200。
图5.肿瘤上黑色素瘤细胞的表面的pdl1表达。结果表示为黑色素瘤细胞中pdl1阳性细胞的%。结果显示平均值+/-sd。
发明详述
除非另外定义,否则本申请中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。
如本文所用,术语“抗病毒反应”是指细胞对病毒感染的反应,包括例如干扰素的产生、细胞因子释放、趋化因子的产生、淋巴因子的产生或其任何组合。
如本文所用,表述“正常宿主细胞”和“正常组织”是指具有完整抗病毒反应的非癌性、未感染的细胞或组织。
如本文所用,术语“溶瘤剂”是指能够抑制肿瘤细胞生长和/或杀死肿瘤细胞的药剂。
如本文所用,术语“受试者”是指任何活的生物体,包括人和动物、人和动物组织,以及人和动物细胞。
如本文所用,术语“患者”是指患有疾病诸如黑色素瘤的任何受试者(优选人),其可能受益于利用如本文所述的联合疗法的治疗。
腺病毒是具有二十面体衣壳的直径为70-90nm的无包膜病毒。它们的基因组是线性的双链dna,其大小在25-45千碱基之间,两端都有反向末端重复序列(itr),并在5'末端附接有末端蛋白质。
该二十面体衣壳由三种主要蛋白质形成,其中六邻体三聚体最丰富。衣壳的12个顶点中的每一个还包含五聚体蛋白质,即共价附接至纤维的五邻体基底(pentonbase)。所述纤维是三聚体蛋白质,其从五邻体基底突出,是有隆突的棒状结构。其他病毒蛋白质iiia、iva2、vi、viii和ix也与病毒衣壳缔合。蛋白质vii、小肽mu和末端蛋白质(tp)与dna缔合。蛋白质v通过蛋白质vi提供与衣壳的结构连接。
如本文所用,术语“衣壳”是指病毒的蛋白质壳,其包括六邻体、纤维和五邻体基底蛋白质。
所有人腺病毒在其纤维结构上具有相似性。各自都有n末端尾、具有重复序列的柄,以及具有球状结构的c末端隆突结构域。隆突结构域主要负责结合靶细胞受体,并且其球状结构呈现出用于侧向和顶端结合的大表面。来自不同亚组的腺病毒的纤维蛋白质在长度和弯曲能力方面差异最明显。
纤维参与病毒至靶细胞的附着。首先,纤维蛋白质的隆突结构域与靶细胞的受体结合,其次,病毒与整联蛋白分子相互作用,第三,病毒被内吞至靶细胞中。随后,病毒基因组从内体转运到细胞核中,病毒基因组的复制可以开始。
如本文所用,衣壳的“ad5/3嵌合体”是指这样的嵌合体,其中纤维的隆突部分来自ad血清型3,并且纤维的其余部分来自ad血清型5。
腺病毒依靠细胞机制来复制病毒基因组。它们可以感染静止细胞并诱导它们进入细胞周期s期样状态,从而使得能够进行病毒dna复制。腺病毒基因组可分为立即早期(e1a)、早期(e1b、e2、e3、e4)、中期(ix、iva)和晚期(l1-l5)基因。
e3基因产物对于体外病毒复制不是必需的,但专用于控制各种宿主免疫反应。e3-gp19k抑制i类主要组织相容性复合体(mhc)从内质网(er)向质膜的转运,从而阻止mhc向t淋巴细胞呈递肽。
腺病毒e1a蛋白质最初被描述为能够在静止的正常细胞中诱导dna复制的prb结合蛋白质。e1a蛋白质的关键功能之一是破坏prb-e2f相互作用,从而释放e2f转录因子以活化e2f应答启动子和它们控制的基因诸如腺病毒e2a的转录。e1a蛋白质中的保守区域2(cr2)与prb的口袋结合结构域形成强相互作用,并且cr1介导prb的e2f结合的实际破坏。已产生了特征在于cr2中的24个碱基对缺失的条件性复制病毒,显示其在治疗神经胶质瘤和乳腺癌异种移植物方面是有效的并且具有选择性。它们的癌症特异性源于功能失调的e1a不能释放e2f1转录因子,这导致需要游离e2f1。
oncos-102腺病毒早已公开在公开文本wo2010/072900中。oncos-102是血清型5腺病毒(ad5),显示出与ad5基因组不同的以下修饰:
1.e1a基因恒定区2(cr2)中的24个碱基对(bp)的缺失。功能失调的e1a蛋白质不能结合e2f1转录因子并将其从视网膜母细胞瘤蛋白质(rb)上释放,导致需要游离的e2f1用于腺病毒基因转录。游离e2f1在癌细胞中很丰富,其中prb途径最常被破坏。因此,在e1a中具有该24bp缺失的病毒能够在癌细胞中高效复制。e1a基因转录成mrna受内源性e1a启动子控制。
2.在编码6.7k和gp19k蛋白质的早期3(e3)区域引入了965bp的缺失。这些蛋白质与腺病毒逃避宿主免疫控制机制的能力相关,它们的功能对于腺病毒复制是消耗性的。
3.编码人粒细胞巨噬细胞集落刺激因子(gm-csf)蛋白质的转基因已被插入e3区域,取代6.7k和gp19k。gm-csf基因转录成mrna受内源性e3启动子控制。换句话说,在oncos-102腺病毒中,已从e3区域中缺失了编码病毒基因gp19k和6.7k的965个碱基对,并且已引入了转基因gm-csf来替代它们。
4.血清型5纤维隆突被血清型3纤维替代,从而允许病毒通过血清型3受体而不是血清型5受体car进入细胞。
在oncos-102腺病毒中,存在天然e1a启动子,即其未被另一种启动子替代。
简言之,在oncos-102腺病毒中,gm-csf处于内源性病毒e3控制元件之下,其导致在感染后约8小时开始复制相关的转基因表达。病毒以肿瘤选择性方式复制,从而导致gm-csf的肿瘤局限性产生。通过24-bp缺失实现了肿瘤特异性,这消除了e1a的rb-结合部位,并且如先前报道中所证实的,病毒选择性地在具有p16-rb途径缺陷的细胞(包括大多数(如果不是全部的话)人癌症)中复制。oncos-102腺病毒的溶瘤效力显示比野生型对照病毒更有效。
表达gm-csf的溶瘤腺病毒在通过溶瘤作用直接作用于癌细胞的同时诱导抗癌免疫力。gm-csf是与抗原呈递细胞(apc)(主要是树突状细胞)的募集和成熟以及先天免疫力武装的细胞的募集相关的全身性抗肿瘤免疫力的强效诱导剂。然而,系统性升高的细胞因子水平代表毒性副作用的风险。除了由gm-csf的高血清浓度介导的副作用的直接风险以外,还存在由骨髓来源的抑制性细胞(mdsc)的募集引起的间接风险。虽然mdsc的免疫抑制作用通常对癌症患者有潜在危害,但在癌症免疫疗法的情况下,其可能特别适得其反。因此,将gm-csf表达局限于肿瘤部位是至关重要的。
oncos-102腺病毒已在体外显示出良好的溶瘤潜力和具有功能活性的人gm-csf的产生(koski等人,2010)。在具有免疫能力的仓鼠中显示该病毒有效地阻止侵袭性同基因胰腺肿瘤的生长。通过测量病毒拷贝数显示了病毒在肿瘤中复制的证据。复制的选择性也得到证实,因为在直接注射的肝组织中病毒拷贝数没有增加。证实了gm-csf在肿瘤中的局部复制相关的产生,而gm-csf几乎没有渗漏到血清或肝脏中。还显示了将低剂量环磷酰胺与oncos-102腺病毒组合可以增强抗肿瘤作用,而单独的环磷酰胺治疗不导致肿瘤生长的显著减少。
总体而言,用oncos-102腺病毒治疗晚期癌症患者似乎是安全的,并且已经观察到可能有效的令人期待的迹象。虽然在单次剂量后病毒长期存在于血清中,但多次注射有可能改善肿瘤转导并增强抗肿瘤免疫力。
如本文所用,术语“免疫检查点抑制剂”或“检查点抑制剂”是指完全或部分减少、抑制、干扰或调节一种或多种检查点蛋白质的分子。检查点蛋白质调节t细胞活化或功能。对于免疫检查点过程的关键的是细胞毒性t淋巴细胞相关抗原4(ctla-4)和程序性死亡1(pd-1)免疫检查点途径。认为ctla-4和pd-1途径在免疫反应的不同阶段起作用。ctla-4被认为是免疫检查点抑制剂的“领导者”,因为它在幼稚t细胞活化(通常在淋巴结中)的初始阶段终止潜在自身反应性t细胞。pd-1途径在免疫反应的后期调节先前活化的t细胞,主要在外周组织中。
已经显示,进展中的患者通过肿瘤细胞或肿瘤浸润性免疫细胞缺乏pd-l1上调(romano等人2015)。因此,针对pd-l1/pd-1途径的免疫疗法可能在肿瘤中特别有效,其中这种免疫抑制轴是可操作的,并且向免疫保护环境逆转平衡将重新点燃并加强预先存在的抗肿瘤免疫反应。单克隆抗体可以阻断负调节t细胞免疫反应的细胞相互作用,诸如cd80/ctla-4和pd-1/pd-1l,扩增预先存在的免疫力,且由此引发抗肿瘤免疫反应(sagiv-barfi等人2015)。
因此,pd-1在对感染的炎性反应时限制外周组织中t细胞的活性并限制体外自身免疫性pd-1阻断,增强响应于在混合淋巴细胞反应中特定抗原靶标或同种异体细胞的攻击的t细胞增殖和细胞因子产生。pd-1阻断可以通过各种机制(包括结合pd-1或其配体pd-l1的抗体)实现。
免疫检查点途径的抑制已导致批准几种新药:伊匹单抗(抗ctla-4;
其他免疫检查点抑制剂包括淋巴细胞活化基因-3(lag-3)抑制剂,诸如imp321,一种可溶性ig融合蛋白质。其他免疫检查点抑制剂包括b7抑制剂,诸如b7-h3和b7-h4抑制剂。具体而言,抗b7-h3抗体mga271。还包括tim3(t细胞免疫球蛋白结构域和粘蛋白结构域3)抑制剂。
在某些实施方案中,所述pd-1阻断剂包括抗pd-l1抗体。在某些其他实施方案中,所述pd-1阻断剂包括抗pd-1抗体和类似的结合蛋白质,诸如尼沃单抗(mdx1106、bms936558、ono4538),一种通过其配体pd-l1和pd-l2结合并阻断pd-1的活化的完全人igg4抗体;lambrolizumab(mk-3475或sch900475),一种针对pd-1的人源化单克隆igg4抗体;ct-011,一种结合pd-1的人源化抗体;amp-224是b7-dc的融合蛋白质;抗体fc部分;用于pd-l1(b7-h1)阻断的bms-936559(mdx-1105-01)。可用于某些实施方案中的pd-l1抑制剂的另外的实例是阿特珠单抗(mpdl3280)、avelumab(msb0010718c)和德瓦鲁单抗。
优选地,抗pd-1抗体派姆单抗(keytruda)和尼沃单抗(opdivo)用于本发明中。pd-l1抑制剂诸如德瓦鲁单抗也可与抗pd-1-抗体联合使用。因此,本发明的优选的检查点抑制剂是针对pd-1和pd-l1的那些。
已显示派姆单抗(keytruda)和尼沃单抗(opdivo)有助于治疗几种类型的癌症,包括皮肤的黑色素瘤、非小细胞肺癌、肾癌、头颈癌和霍奇金淋巴瘤。它们也正在研究用于针对许多其他类型的癌症。德瓦鲁单抗和tremelimumab(靶向pd-l1的单克隆抗体)的1b期临床试验已显示在非小细胞肺癌(nsclc)中的一些活性。晚期转移性尿路上皮膀胱的1期数据(研究1108)已导致fda突破性疗法指定。进一步,在肺癌患者中组合德瓦鲁单抗和吉非替尼的i期试验的早期结果已“显示有希望”。靶向pd-l1的药物的进一步实例是阿特珠单抗(tecentriq)。该药物可用于治疗膀胱癌,并且也正在研究用于针对其他类型的癌症。
可以通过本发明的联合利用oncos-102与一种或多种检查点抑制剂的方法治疗的癌症类型是例如黑色素瘤、肾癌、卵巢癌、膀胱癌、前列腺癌、乳腺癌、结肠直肠癌、肺癌(诸如小细胞肺癌、非小细胞肺癌和鳞状非小细胞肺癌)、胃癌、经典霍奇金淋巴瘤、间皮瘤和肝癌。优选地,待用本发明治疗的癌症是晚期黑色素瘤。
黑色素瘤是黑色素细胞(源自神经嵴的细胞)的肿瘤。黑色素瘤主要发生在成人中,并且超过一半的病例出现在皮肤的明显正常区域。尽管大多数黑色素瘤出现在皮肤中,但它们也可以来自粘膜表面或神经嵴细胞迁移的其他部位。如本文所用的“恶性黑色素瘤”或“黑色素瘤”是指从称为黑色素细胞的含有色素的细胞发展的一类癌症。黑色素瘤通常发生在皮肤中,但很少发生在口腔、肠道或眼睛中。当黑色素瘤扩散至身体的其他部位时,它被称为转移性或晚期的。因此,如本文所用的“晚期黑色素瘤”是指转移性黑色素瘤。晚期黑色素瘤是如本文所述的联合疗法的主要靶标。
黑色素瘤患者的预后受临床和组织学因素以及病变的解剖位置的影响。黑色素瘤的厚度和/或侵入水平、肿瘤浸润性淋巴细胞、有丝分裂指数和原发部位的溃疡或出血影响预后。临床分期基于肿瘤是否已扩散至区域淋巴结或远端部位。黑色素瘤可以通过局部延伸(通过淋巴管)和/或通过血液途径扩散至远端部位。转移可能涉及任何器官,但肺和肝脏是常见的部位。
iv期黑色素瘤(即晚期黑色素瘤)经常难以治愈,因为它们已经扩散至远端淋巴结或身体的其他区域。用于成人中不可切除或晚期黑色素瘤的传统非手术疗法包括化学疗法(单独或联合的达卡巴嗪、替莫唑胺或其他药剂)或白介素-2。尽管一些组织产生客观的反应,但它们通常是短暂的。与治疗患者百分比有限的对照治疗相比,较新的疗法诸如braf抑制(威罗菲尼)和免疫刺激剂(伊匹单抗)已显示总体存活率的显著改善,然而,毒性是一个问题。
晚期黑色素瘤的治疗近年来已改变,因为较新形式的免疫疗法和靶向药物已显示比化学疗法更有效。目前用于黑色素瘤的免疫疗法方法分为七大类:检查点抑制剂、溶瘤病毒疗法、癌症疫苗、辅助免疫疗法、过继性细胞疗法、单克隆抗体和细胞因子。癌症免疫疗法中的核心概念在于通常被t细胞识别的肿瘤细胞已经开发出通过利用外周耐受来逃避宿主免疫系统的方式。已显示检查点抑制剂诸如派姆单抗(keytruda)、尼沃单抗(opdivo)和伊匹单抗(yervoy)帮助一些具有晚期黑色素瘤的人活得更长久。
如本文所用的“化学疗法”是指化合物或药物在疾病治疗中的用途,尽管术语化学疗法最通常地与癌症治疗相关。癌症化学治疗性化合物包括近100种单独的药物。
如较早公开的,使用oncos-102腺病毒的癌症治疗以及利用检查点抑制剂的疗法在单独使用时已显示出一定功效。本发明人想要研究腺病毒基因疗法与检查点抑制剂的组合在完全黑色素瘤的治疗方面是否可能比单独任一种更加有效。特别地,本发明人感兴趣的是,对于用检查点抑制剂的先前治疗已经停止响应的晚期黑色素瘤,如果用oncos-102治疗,是否将再次开始响应。
如本文所用的“联合疗法”是指向有此需要的患者施用的oncos-102和一种或多种检查点抑制剂。优选地,oncos-102与抗pd-1抗体、诸如派姆单抗联合使用。还可以将oncos-102和两种抗pd-1抗体的组合、抗pd-1抗体和抗pd-l1抗体或两种抗pd-l1抗体的组合施用于有此需要的患者。
在先前的研究中,已经发生一些患者获得对pd-1抑制剂治疗的抗性。可能地,问题在于没有针对肿瘤的潜在的免疫力,在这种情况下,检查点抑制剂是无效的,因为它们降低免疫抑制,但不产生免疫性。
本发明人较早已经显示,oncos-102在其中在治疗前无法检测到肿瘤特异性t细胞反应的患者中诱导肿瘤特异性t细胞反应(外周血中的cd8+t细胞)(ranki等人2014,ranki等人2016和vassilev等人2015)。进一步,看到治疗后以pd-l1上调形式描绘的癌细胞的动态适应性变化,因此表明oncos-102可能有助于引发肿瘤对检查点抑制剂诸如pd-1/pd-l1抑制剂响应。
在联合疗法中,病毒以及一种或多种检查点抑制剂可以在几天期间以几个剂量施用。治疗方案包括首先用病毒引发,随后施用检查点抑制剂,且然后任选地继续施用病毒和检查点抑制剂两者。也可以使用相反的施用顺序,即首先用一种或多种检查点抑制剂引发,随后施用病毒,且然后任选地继续施用病毒和检查点抑制剂两者。
如本文所用的术语“引发”是指例如首先施用溶瘤病毒以使细胞对检查点抑制剂的作用敏感。在施用病毒之前,检查点抑制剂也可用于使细胞敏感。“引发”也可以是指使用诱导凋亡的预处理。用溶瘤病毒进行的肿瘤引发导致免疫原性癌细胞死亡,其与细胞表面上钙网蛋白的呈递和天然佐剂(特别是高迁移率组蛋白质b1(hmgb1))和atp从死亡细胞内的释放相关,最终导致dc刺激并随后活化适应性免疫反应。这种病毒诱导的肿瘤环境变化在引发有意义的抗肿瘤免疫反应中是必需的。抗原呈递细胞从垂死的肿瘤细胞中捕获肿瘤抗原并加工它们以用于mhci类和ii类呈递,迁移到引流淋巴结并刺激抗原特异性b和t细胞。
如本文所用的“病毒敏化剂”是指可提高溶瘤病毒功效的试剂。适用于此类联合疗法或可用作病毒敏化剂的药剂包括但不限于全反式维甲酸、阿扎胞苷、硫唑嘌呤、博来霉素、卡铂、卡培他滨、顺铂、苯丁酸氮芥、环磷酰胺、阿糖胞苷、柔红霉素、多西他赛、多西氟尿苷、多柔比星、表柔比星、埃博霉素、厄洛替尼、依托泊苷、氟尿嘧啶、吉西他滨、羟基脲、伊达比星、伊马替尼、盐酸氮芥、巯基嘌呤、甲氨蝶呤、米托蒽醌、奥沙利铂、紫杉醇、培美曲塞、替莫唑胺、替尼泊苷、硫鸟嘌呤、戊柔比星、长春碱、长春新碱、长春地辛和长春瑞滨。优选地,待使用的病毒敏化剂是环磷酰胺。
如本文所用,“并行”是指已在如本文所述的联合疗法之前、之后或与之同时施用的药物或疗法。并行疗法的时间可从几分钟到数周不等。通常,与本文所述的联合疗法并行进行的疗法持续数天或数周。
如本文所用,术语“有效量”是指能够实现预期结果的化合物、治疗剂、病毒或药物的量。例如,检查点抑制剂和/或腺病毒的有效量是足以实现有益的或期望的临床结果(包括临床结果)的量。有效量可以在一次或多次施用中施用。如本文中所述,有效量是足以改善、稳定、逆转、减缓和/或延迟恶性黑色素瘤的进展或治愈恶性黑色素瘤的量。在本发明中,检查点抑制剂和oncos-102腺病毒的效果可以例如通过监测肿瘤对所述治疗的反应来进行监测。可用本领域已知的任何合适方法进行肿瘤反应的监测。其可以例如用测量细胞免疫状态的方法诸如ranki等人(2014)列出的那些方法来进行。例如,可通过测量肿瘤中肿瘤浸润性淋巴细胞的存在来进行监测,也可用微阵列监测th1型反应,以及还可在监测中使用ifnγ酶联免疫斑点测定(elispot)。
有效量因此是能够在肿瘤中引起所需的作用或反应或者所需要的量。如本领域所理解的,有效量可以变化,取决于患者病史以及其他因素,诸如所用检查点抑制剂的类型和/或剂量等。
如本文所用,术语“治疗期”是指进行联合治疗时的时间段。治疗期可由oncos-102和检查点抑制剂的数次施用组成,其中可在多个周期中进行施用。治疗期可持续数周或数月。治疗期可持续长达一年。
如本文所用,术语“施用期”是指向患者施用腺病毒、检查点抑制剂或其他药物的时间段。在施用期期间,可施用单次剂量或数次剂量的所述药剂。施用期可以是数分钟、数小时、数天、数周或数月。施用期可由周期组成。例如,可在一种或多种检查点抑制剂的施用中使用三周(21天)的周期。
派姆单抗(keytruda)通常在三周内作为一剂施用,但也可以使用其他周期,诸如每周施用减少的量。尼沃单抗(opdivo)通常每两周作为一剂施用,但也可以使用其他周期,诸如每周施用减少的量。
通常针对具体的施用途径来配制治疗性组合物。在本文所述的联合疗法中,检查点抑制剂(诸如派姆单抗)以其有效浓度使用。例如,当使用21天的周期时,派姆单抗可以例如在每个21天周期的第1天以10分钟静脉内(i.v.)输注进行施用。
本发明的另一个目的是用于治疗人黑色素瘤、特别是晚期人黑色素瘤的oncos-102腺病毒,其中向患者联合施用所述病毒与检查点抑制剂,并且其中所述检查点抑制剂是派姆单抗。
在本发明的一些实施方案中,除了oncos-102与一种或多种检查点抑制剂以外,还可使用环己酰胺、氰钴胺(cyanocobolamine)、叶酸和地塞米松的各种组合。更具体地,从由环己酰胺、氰钴胺、叶酸和地塞米松组成的药剂列表中,可将一种、两种、三种或四种及其任何组合与包含oncos-102和检查点抑制剂的联合疗法同时使用。作为一个实例,可在施用所述联合疗法的药剂之前、期间和之后施用一种或多种减少或消除超敏反应的辅助剂,诸如在施用所述联合疗法的药剂之前、期间和之后施用地塞米松、叶酸和维生素b12来治疗受试者。在某些实施方案中,通过以下方式治疗受试者:在施用所述联合疗法的药剂前一天、当天和一天后口服2-25mg地塞米松;在从施用所述联合疗法的药剂之前7天开始,在至少一个治疗期内,以及在最后一次施用所述联合疗法的药剂后持续21天的时期内,每天口服400-1000μg叶酸;以及在治疗期间首次施用所述联合疗法的药剂之前1周肌内注射1000μg维生素b12。
可使用任何常规方法向有此需要的患者施用oncos-102。施用途径取决于组合物的配方或形式、疾病、肿瘤的位置、患者、并发症和其他因素。在本发明的一个优选实施方案中,通过肿瘤内、肌内、动脉内、胸膜内、膀胱内、腔内或腹膜内注射或口服施用进行施用。优选地,施用以肿瘤内注射或腹膜内注射进行。
可以根据肿瘤的位置和大小为每个患者进行个性化注射。例如,可以以0.5ml至10ml的体积注射(i.t.)病毒。可以对数个,优选多达五个不同的肿瘤部位进行注射。腹膜内剂量的体积可在200ml与800ml之间变化。优选地,施用体积为500ml。
载体的有效剂量至少取决于需要治疗的受试者、肿瘤类型、肿瘤的位置和肿瘤的阶段。剂量可以例如从约108个病毒颗粒(vp)变化至约1014个vp,优选约5x109个vp至约1013个vp,更优选约8x109个vp至约1012个vp。在本发明的一个具体实施方案中,剂量在约5x1010-5x1011个vp的范围内。因此,待施用的oncos-102腺病毒的量可以在5x1010-5x1011个vp的范围内。优选地,oncos102以3x1011个vp施用。另一方面,在以噬斑形成单位表示的情况下,可通过直接注射至所述患者的肿瘤、诸如晚期黑色素瘤肿瘤中或腹膜内而以约108-1012个噬斑形成单位的剂量施用oncos-102。
本发明的一个目的是用于治疗人癌症、诸如晚期黑色素瘤的oncos-102腺病毒,其中向有此需要的患者联合施用所述病毒与检查点抑制剂、诸如派姆单抗,且其中所述病毒的量为5x1010至5x1011个vp。
本发明的另一个目的是用于治疗人癌症、诸如晚期黑色素瘤的oncos-102腺病毒,其中向患者联合施用所述病毒与检查点抑制剂,且其中以3x1011个vp/5ml的量施用所述病毒。
本发明的一个进一步方面是用于治疗人癌症、诸如晚期黑色素瘤的oncos-102腺病毒,其中向患者联合施用所述病毒与检查点抑制剂,且其中所述检查点抑制剂和所述病毒以有效量施用。
本发明的又另一个目的是用于治疗人癌症、诸如晚期黑色素瘤的oncos-102腺病毒,其中向有此需要的患者联合施用所述病毒与检查点抑制剂,且其中所述病毒腹膜内或通过直接注射至肿瘤内来施用,且一种或多种检查点抑制剂静脉内或腹膜内施用。
根据本发明的一个方面,oncos-102腺病毒用于治疗人癌症、诸如晚期黑色素瘤,其中向有此需要的患者联合施用所述病毒与检查点抑制剂,且其中在施用一种或多种检查点抑制剂之前以及在所述一种或多种检查点抑制剂施用期期间施用病毒。
根据一个优选实施方案,可将联合疗法的药剂与第一次引发一起施用,其中在1天至10个月的时期内施用病毒一个剂量或1至10次,然后例如在开始病毒施用后1至4周施用检查点抑制剂。施用可以例如按以下顺序进行:通过在8天(第1、4、8天)的时期中向需要的受试者施用病毒3次来进行利用病毒的引发且派姆单抗(keytruda)然后在21天且向前每周3次施用。在开始施用病毒三周后,因此可以开始施用检查点抑制剂,优选派姆单抗。可以继续施用一种或多种检查点抑制剂,使得例如在约三周的周期中进行总共六次施用。施用次数可从一次到六次不等。
本发明的溶瘤腺病毒载体诱导病毒体介导的肿瘤细胞的溶瘤作用并活化针对肿瘤细胞的人免疫反应。在本发明的一个优选实施方案中,该方法或用途还包括施用能够下调受试者中的调节性t细胞的物质。“能够下调调节性t细胞的物质”是指减少被鉴定为t抑制者或调节性t细胞的细胞量的试剂。这些细胞已被鉴定为由以下免疫表型标记中的一种或多种组成:cd4+、cd25+、foxp3+、cd127-和gitr+。减少t抑制者或调节性t细胞的此类药剂可选自抗cd25抗体或化学治疗剂。
转基因gm-csf的免疫调节功能是武装的溶瘤腺病毒的中心作用机制,此外,腺病毒本身是免疫系统的强活化剂,这显著促成了病毒的整体抗肿瘤功效。
本发明的另一个方面是用于治疗患者中的人癌症、诸如晚期恶性黑色素瘤的方法,其包括以足以杀死癌细胞或防止癌细胞的生长的量和时间向所述患者施用oncos-102腺病毒和检查点抑制剂的步骤。
本发明的一个优选方面是用于治疗患者中的人癌症、诸如晚期恶性黑色素瘤的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中所述治疗包括施用检查点抑制剂派姆单抗。
本发明的另一个优选方面是用于治疗患者中的人癌症、诸如晚期黑色素瘤的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中在开始一种或多种检查点抑制剂的施用期之前首先施用所述病毒,且也可以在所述一种或多种检查点抑制剂的施用期期间施用所述病毒。
本发明的又另一个优选方面是用于治疗患者中的人癌症、诸如晚期黑色素瘤的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中向所述患者施用oncos-102腺病毒1至10次且施用一种或多种检查点抑制剂1至6次。
本发明的又另一个优选方面是用于治疗患者中的人癌症、诸如晚期黑色素瘤的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中待施用的oncos-102腺病毒的量在5x1010-5x1011个vp的范围内。
本发明的又另一个优选方面是用于治疗患者中的人癌症、诸如晚期黑色素瘤的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中所述检查点抑制剂如下施用:每3周2mg/kg派姆单抗(keytruda),每2周2mg/mg尼沃单抗(opdivo),且每4周20mg/kg或每2周10mg/kg德瓦鲁单抗。德瓦鲁单抗可以通过iv输注每四周施用一次,总共12个四周循环。
本发明的一个进一步方面是oncos-102腺病毒在治疗人癌症、诸如晚期恶性黑色素瘤中的用途,其中向患者联合施用所述病毒与一种或多种检查点抑制剂。
本发明的又一个进一步方面是用于治疗人癌症、诸如晚期黑色素瘤的oncos-102腺病毒,其中向有此需要的患者联合施用所述病毒与一种、两种或三种检查点抑制剂。
本发明的又一个进一步方面是用于治疗人癌症、诸如晚期黑色素瘤的oncos-102腺病毒,其中向有此需要的患者施用oncos-102腺病毒1至10次且施用检查点抑制剂1至15次。
可以在联合治疗的时期期间向患者并行施用环磷酰胺(cpo)。环磷酰胺是一种常见的化学治疗剂,其也已用于某些自身免疫性病症。已显示环磷酰胺通过几种机制提高溶瘤病毒的功效。其抑制先天性抗病毒反应,减缓抗溶瘤病毒中和抗体的产生,可靶向t-regs并且可影响肿瘤血管系统,增强溶瘤病毒外渗。数项临床前研究表明,环磷酰胺可以延缓溶瘤病毒的免疫清除,增强病毒感染的持久性并延长治疗效果。在本发明中,环磷酰胺可用作病毒敏化剂以增强病毒复制和gm-csf诱导的对nk和细胞毒性t细胞的刺激(以增强抗肿瘤的免疫反应)的作用。其可以以静脉推注剂量或低剂量口服节律性施用方式进行施用。可用于本发明的实施方案的其他合适的病毒敏化剂包括替莫唑胺和厄洛替尼。
为了减少调节性t细胞,患者将在第一次注射oncos102之前1至4天接受低剂量cpo。cpo将例如以300mg/m2的静脉推注方式施用。推注可在100和600mg/m2之间变化。cpo的施用途径也可以是例如口服施用。也可使用节律性化学疗法。
此外,还可在开始联合疗法之前以及在联合治疗期间向患者施用叶酸。可在施用第一剂联合疗法的化学治疗剂之前至少五天开始叶酸的施用。例如,可以在开始施用联合疗法的药剂之前1-2周开始施用。可以每日施用叶酸(口服施用;po),并且在联合治疗期间也可以继续施用。施用可持续至最后一剂化学疗法的药剂后约三周。叶酸的典型剂量为4mg(po)。本发明的一个优选方面是用于治疗有此需要的患者的黑色素瘤的方法,其包括(a)向所述患者施用oncos-102腺病毒和检查点抑制剂的步骤,以及向所述患者施用叶酸的步骤。
可以在开始联合疗法之前以及在联合疗法期间向患者施用氰钴胺(维生素b12)。通常在开始施用联合疗法的药剂之前1-2周开始氰钴胺的施用。可以例如以9周的间隔以及也可在联合疗法期间通过肌内注射(i.m.)施用氰钴胺。施用可持续至最后一剂化学疗法的药剂后约三周。氰钴胺的典型量是1000mcg(μg)。本发明的一个优选方面是用于治疗有此需要的患者的黑色素瘤的方法,其包括(a)向所述患者施用oncos-102腺病毒和检查点抑制剂的步骤以及向所述患者施用氰钴胺的步骤。
叶酸和氰钴胺通常用于减少与治疗相关的血液学和胃肠道毒性。
还可向经历联合疗法的患者施用地塞米松。通常,在施用联合疗法的药剂的前一天、当天和一天后施用地塞米松。可以以4mgbd(即一天两次)施用地塞米松5天,以及以每三周一次的频率施用多达六个循环。本发明的一个目的是用于治疗有此需要的患者的黑色素瘤的方法,其包括(a)向所述患者施用oncos-102腺病毒和检查点抑制剂和(b)向患者施用地塞米松的步骤。
本文所述的联合疗法还可包括向患者施用环磷酰胺。本发明的一个目的是用于治疗有此需要的患者的黑色素瘤的方法,其包括(a)向所述患者施用oncos-102腺病毒和两种化学治疗剂的步骤,并且还包括在步骤(a)之前向患者施用环磷酰胺。
本发明的另一方面是用于减少患者的肿瘤生长的方法,其中所述方法包括在其中所述患者中的肿瘤生长被减小的条件下向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂。
所述方法可包括在施用联合疗法之前将患者鉴定为患有肿瘤。肿瘤诊断可用任何常规方法进行。可以例如使用诊断成像技术将患者鉴定为患有肿瘤。该方法还可包括在向患者施用联合疗法后测量肿瘤生长的减少。可以通过任何常规方法研究肿瘤的减少。可以例如使用诊断成像技术测量肿瘤生长减少。
本发明的另一方面是使用联合疗法来抑制肿瘤的生长。肿瘤生长的抑制的标志可以例如是肿瘤重量的减少和肿瘤体积的减少。此外,联合疗法可用于抑制肿瘤的扩散。
还应注意,对应于与治疗相关的病变大小增加的肿瘤假性进展可影响旨在揭示当前联合疗法对肿瘤大小的效果的成像追踪的结果。在约30%的患者中,在联合化疗和放射疗法后观察到这种效应。因此,当使用如本文所述的联合疗法时,假性进展可存在于患者的某些部位中。对于那些患者,肿瘤尺寸的减小不是疗法有效性的合适指标。
还公开了减少癌细胞生长的方法,其包括向需要治疗的受试者施用有效量的oncos-102腺病毒和一种或多种检查点抑制剂。
还公开了抑制或杀死人患者中的肿瘤或癌细胞的方法,其包括用oncos-102腺病毒和一种或多种检查点抑制剂治疗患者,其中所述检查点抑制剂是pd-1或pd-l1抑制剂或其任何组合。
此外,公开了杀死肿瘤或癌细胞的方法,其包括使肿瘤或癌细胞与oncos-102腺病毒和一种或多种检查点抑制剂接触,其中所述检查点抑制剂是pd-1或pd-l1抑制剂或其任何组合。
此外,还公开了用于治疗人癌症、诸如晚期黑色素瘤的方法,其包括向有此需要的受试者施用有效量的oncos-102腺病毒和有效量的一种或多种检查点抑制剂,以提供与单独施用oncos腺病毒的效果或不与所述病毒施用所述一种或多种检查点抑制剂的效果相比具有增强的治疗效果的联合疗法。
在本发明的一个实施方案中,oncos-102作为原位癌症疫苗发挥作用。如本文所用,“原位癌症疫苗”是指这样的癌症疫苗,其既杀死肿瘤细胞又增加针对肿瘤细胞的免疫反应。病毒复制是向免疫系统发出强烈的危险信号(=th1型反应所需的),因此可以充当对gm-csf介导的apc成熟和活化以及nk细胞募集的强大共刺激现象。肿瘤细胞裂解还有助于向apc呈递肿瘤片段和表位,此外,通过炎症产生共刺激。因此,在每个肿瘤的背景下产生不依赖于表位(即非hla局限性的)的反应,该反应因此原位发生。当肿瘤细胞裂解后从垂死细胞释放特异性肿瘤抗原时,肿瘤特异性免疫反应在肿瘤环境中被活化。
在本发明的一个优选实施方案中,该方法或用途还包括向受试者施用并行的放射疗法。
在本发明的一个优选实施方案中,该方法或用途还包括向受试者施用自噬诱导剂。自噬是指牵涉通过溶酶体机制降解细胞自身组分的分解代谢过程。“自噬诱导剂”是指能够诱导自噬的药剂,并且可以选自但不限于mtor抑制剂、pi3k抑制剂、锂、他莫昔芬、氯喹、巴弗洛霉素、替西罗莫司、西罗莫司和替莫唑胺。在本发明的一个具体实施方案中,该方法还包括向受试者施用替莫唑胺。替莫唑胺可以是口服或静脉内替莫唑胺。
因此,本发明的一个目的是用于治疗人癌症的oncos-102腺病毒,其中向患者联合施用所述病毒与一种或多种检查点抑制剂。
在如本文所述的联合疗法中,oncos-102腺病毒和一种或多种检查点抑制剂可以以几个剂量和不同时间施用。
本发明的另一个目的是用于治疗人癌症的oncos-102腺病毒,其中所述人癌症选自晚期黑色素瘤、肾癌、卵巢癌、膀胱癌、前列腺癌、乳腺癌、结肠直肠癌、肺癌、胃癌、经典霍奇金淋巴瘤、间皮瘤和肝癌。
本发明的又另一个目的是用于治疗人癌症的oncos-102腺病毒,其中所述人癌症是晚期黑色素瘤。
本发明的一个进一步目的是用于治疗人癌症的oncos-102腺病毒,其中所述检查点抑制剂是抗pd-1抗体或抗pd-l1抗体或其任何组合。
本发明的一个进一步目的是用于治疗人癌症的oncos-102腺病毒,其中所述抗pd-1抗体是派姆单抗或尼沃单抗。
本发明的又另一个目的是用于治疗人癌症的oncos-102腺病毒,其中所述抗pd-l1抗体是德瓦鲁单抗。
本发明的一个进一步目的是用于治疗人癌症的oncos-102腺病毒,其中所述病毒的量为5x1010至5x1011个vp。
用于治疗人癌症的oncos-102腺病毒(其中以3x1011个vp的量施用所述病毒)也是本发明的一个方面。
根据本发明的一个方面,用于治疗人癌症的oncos-102腺病毒,其中所述病毒通过直接注射至肿瘤内来施用,且一种或多种检查点抑制剂静脉内施用。
用于治疗人癌症的oncos-102腺病毒(其中在施用一种或多种检查点抑制剂之前施用所述病毒,且任选地还在所述一种或多种检查点抑制剂施用期期间和/或在施用所述一种或多种检查点抑制剂之后施用所述病毒)也是本发明的一个方面。
本发明的一个目的是治疗患者中的癌症的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤。
一个优选实施方案是治疗患者中的癌症的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中所述癌症是晚期黑色素瘤。
根据一个优选实施方案,在包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤的治疗患者中的癌症的方法中,所述一种或多种检查点抑制剂是抗pd-1抗体或抗pd-l1抗体或其任何组合。
根据另一个优选实施方案,抗pd-1抗体派姆单抗或尼沃单抗用于治疗患者中的癌症的方法中,所述方法包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤。优选地,所述抗pd-l1抗体是德瓦鲁单抗。因此,所述抗pd-1抗体优选为派姆单抗或尼沃单抗,且所述抗pd-l1抗体优选为德瓦鲁单抗。
一个优选实施方案是治疗患者中的癌症的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中在施用一种或多种检查点抑制剂之前施用所述病毒,且任选地还在所述一种或多种检查点抑制剂施用期期间和/或在施用所述一种或多种检查点抑制剂之后施用所述病毒。
另一个优选实施方案是治疗患者中的癌症的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中向所述患者施用oncos-102腺病毒1至10次且施用检查点抑制剂1至15次。
又另一个优选实施方案是治疗患者中的癌症的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其中待施用的oncos-102腺病毒的量在5x1010-5x1011个vp的范围内。
本发明的另一个方面是治疗患者中的癌症的方法,其包括向所述患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤,其进一步包括在向有此需要的患者施用oncos-102腺病毒和一种或多种检查点抑制剂的步骤之前施用环磷酰胺。
oncos-102腺病毒在治疗人癌症中的用途(其中向有此需要的患者联合施用所述病毒与一种或多种检查点抑制剂)也是本发明的一个方面。
本发明的一个目的是开发oncos-102溶瘤腺病毒和一种或多种检查点抑制剂的新型治疗上有效的用途,其与单独使用病毒疗法或仅使用一种或多种检查点抑制剂相比,具有改善的安全性和提高的癌症疗效。
除了使得能够将载体转运到目标部位以外,本发明的腺病毒载体还确保了转基因的表达和持久性。此外,针对载体以及转基因的免疫反应也被最小化。
本发明解决了与常规治疗的治疗抗性相关的问题。此外,本发明还提供了用于选择性治疗的工具和方法,其在健康组织中具有较低的毒性或损害。与其他治疗剂相比,本发明的有利方面还包括不同的和减少的副作用。重要的是,该方法与包括放射疗法在内的许多其他形式的疗法具有协同作用,因此适合用于组合方案。
本发明实现了癌症治疗,其中肿瘤细胞被病毒体引起的溶瘤作用破坏。另外,募集活化人免疫反应的各种不同机制,包括自然杀伤细胞(nk)和树突状细胞(dc)的活化,用于本发明的治疗用途。
因此,本申请描述了策略并提供了有效地招募宿主的免疫系统抵抗恶性细胞并在恶性细胞中同时提供直接溶瘤和检查点蛋白抑制作用,同时保持极好的安全记录的方法和手段。
本发明的方面涉及用于在癌症疗法中实现高效和准确的基因转移以及增加的特异性和足够的肿瘤杀伤能力的新型方法和手段。
总之,所提供的数据为将oncos-102与一种或多种检查点抑制剂联合用于治疗人癌症提供了强有力的理论依据。
实施例
给出以下实施例仅用于举例说明本发明的各种实施方案的目的,它们不意味着限制本发明。本领域技术人员将容易理解,本发明非常适合于实现该目的并获得上述目的和有利方面,以及本文固有的那些目的、目标和有利方面。本领域技术人员将想到其中的变化和包含在由权利要求的范围限定的本发明的精神内的其他用途。
oncos-102的构建
先前(wo2010/072900和koski等人)已经描述了编码人gm-csf(oncos-102)的嵌合溶瘤腺病毒的构建和表征。简言之,使用标准腺病毒制备技术产生和扩增ad5/3-d24-gmcsf。通过在大肠杆菌中同源重组ad5/3luc1病毒基因组与padeasy-1的bstxi消化的8.9kb片段,产生含有嵌合5/3纤维、padeasy5/3的padeasy-1衍生质粒。随后,用pmei将含有e1a中的24bp缺失的穿梭载体(pshuttled24)线性化,并与padeasy5/3重组,得到pad5/3-d24。为了将人gmcsf基因插入e3区,通过将来自ad5基因组的spei至ndei片段插入到pgem5zf+(promega,madison,wi)的多克隆位点,产生了e3克隆性载体pthsn。用suni/muni进一步消化pthsn,在e3区域产生965bp的缺失(6.7k和gp19k被缺失)。编码人gm-csf的432bp互补dna(invitrogen,carlsbad,ca)用该基因侧翼的特异性限制性位点suni/muni的特征性引物扩增,然后将其插入到经suni/muni消化的pthsn中。通过在大肠杆菌中在fspi线性化的pthsn-gmcsf与srfi线性化的pad5/3-d24之间的同源重组,产生pad5/3-d24-gmcsf。通过paci消化释放ad5/3-d24-gmcsf病毒基因组,并将其转染至a549细胞中以用于扩增和拯救。克隆的所有阶段均通过pcr和多重限制性消化进行确认。对穿梭质粒pthsn-gm-csf进行测序。利用pcr确认不存在野生型e1。通过测序和pcr检查最终病毒中的e1区、转基因和纤维。根据oncostherapeutics(helsinki,finland)的cgmp原理,在a549细胞上进行病毒生产,以避免野生型重组的风险。病毒原液缓冲液配方为10mmol/ltrizma碱,75mmol/lnacl,5%(wt/vol)蔗糖,1mmol/lmgcl,10mmol/ll(+)组氨酸,0.5%(vol/vol)etoh,0.02%tween,100μmol/ledta;使用0.9%(wt/vol)nacl溶液(b.braun,melsungen,germany)作为稀释剂。oncos-102由biovian(turku,finland)在glp中生产并于-80℃下储存直至使用。对于使用,在即将施用前解冻oncos-102,并储存在冰上直至使用。解冻后,将oncos-102在层流箱中稀释以获得所需浓度,制备注射器并储存在冰上直至使用。
细胞系
将a-375人黑色素瘤细胞(atcccrl-1619tm)(2x106个细胞/胁)在含有4500mg/ml葡萄糖(sigma-s5671)的dmem中在37℃和5%co2下培养,所述dmem补充有10%热灭活的fbs(南非起源,dutscherp30-1506)和1%青霉素/链霉素(dutscherl0018)。相同的培养方案也适用于sk-mel2(atcchtb-68)人黑色素瘤细胞。
检查点抑制剂(cpi):
对于派姆单抗(keytruda),人剂量为2mg/kg,并且在外推后,使用40μg/小鼠。对于尼沃单抗(opdivo),人剂量为3mg/kg,并且在外推后,使用60μg/小鼠。外推cpi的剂量,记住小鼠重量为20g。对于德瓦鲁单抗,人剂量可以是10-20mg/kg(目前,推荐的德瓦鲁单抗的给药时间表为20mg/kgq4w或10mg/kgq2w。基于来自medimmune的信息,这正在转变为德瓦鲁单抗的固定剂量,其表明基于pk模型选择1500mg德瓦鲁单抗q4w的剂量和时间表),在外推后,可以使用200μg-400μg/小鼠。外推cpi的剂量,记住小鼠重量为20g。
动物选择、随机化、小组分配、圈养、进食和水以及环境适应
将动物随机分成各组。将动物组保持在分开的笼子中,并将研究卡片附在笼子上。这些卡片上标有研究编号、处理组、个体动物id以及它们的来源和到达日期。用耳朵刺穿标记每个笼子中的动物个体以进行识别。一次只处理一个笼子以避免混淆笼子之间的动物。
将动物在湿度和温度受监测的环境中饲养在生物安全水平为2(bsl2)的设施中。将动物圈养在具有过滤盖(greenline,scanbur)的单独通风的塑料笼中。
给动物饲喂随意提供的标准颗粒化饮食。在适应和研究期间随意供应水。
在开始实验部分之前使动物适应7天。在整个适应期间,所有动物都保持良好的健康状态。
肿瘤尺寸进展的分析
在细胞注射后7-11天开始测量并记录肿瘤尺寸。治疗的第一天和肿瘤尺寸测量的第一天标示为第0天。每三天测量一次肿瘤。
记录最长和最短的直径,并使用(宽度x长度x高度)/2的公式计算肿瘤体积。
在整个实验过程中每3天测量一次体重。
肿瘤体积:绝对肿瘤体积是肿瘤体积分析的终点。重复测量的方差分析用作肿瘤体积的分析方法,因为对于每只小鼠测量了两个肿瘤。该模型包含组效应和基线值作为协变量(作为固定效应)。使用tukey法调整组间的成对比较。通过使用ftv(分数肿瘤体积)法进行协同作用计算。
人黑色素瘤异种移植模型
该实验已由法国archamps的tcs用nod/shiscid/il-2rγnull免疫缺陷小鼠品系(nog)进行。在化学清髓性处理后两天,将四周龄的免疫缺陷nog小鼠(taconic)植入脐带血来源的cd34+造血干细胞和祖细胞(法国血液研究所)。植入包括静脉内注射cd34+细胞。细胞注射后14周,通过流式细胞术(attune,lifetechnologies)分析总血白细胞中的人cd45+细胞,监测移植水平。对于该初步研究,仅选择具有高于20%的人源化率(定义为循环hcd45+/总白细胞的比率)的小鼠。我们仅使用雌性小鼠。本研究中描述的所有动物研究均已经由当地伦理委员会(01_transcurebioservices-ab-01)审查和批准。小鼠已经由3-5个个体的组主持。已独特地标识每只小鼠。在以下受控条件下将动物圈养在通风笼(ii型(16x19x35cm,占地面积=500cm2))中:
·室温(22±2℃)
·湿度测定法(55±10%)
·光周期(12:12-小时光暗周期,7am至7pm)
·随意获得水和食物(参考文献2018,harlanfrance)
用异氟烷呋喃(baxter)麻醉小鼠,将x100μl中的a-375细胞注射到两个胁(2e+06/胁)中。在每只小鼠中诱导一个或两个肿瘤。在治疗前让肿瘤生长7-11天。在肿瘤形成后第1、3和5天施用病毒,并且分别在肿瘤形成后第9、13和17天施用检查点抑制剂(keytruda和opdivo)。当研究全身效应时,仅治疗一个肿瘤/小鼠(参见图1c)。用0.9%的盐水处理模拟动物。将oncos-102稀释到0.9%盐水中,并以每个肿瘤5x107vp的剂量进行瘤内注射。注射以扇形图案进行,以确保在整个肿瘤中均匀分布。将检查点抑制剂(keytruda和opdivo)在0.9%的nacl中稀释,并分别以40μg/小鼠(重量20g)的keytruda和60μg/小鼠的opdivo的剂量腹膜内施用。注射体积为50μl的检查点抑制剂。
记录最长和最短直径,并使用(宽度x长度x高度)/2的公式计算肿瘤体积。
实施例1.通过联合使用oncos-102与检查点抑制剂,小鼠中针对黑色素瘤的抗肿瘤活性改善。
在本研究中,小鼠未经治疗或仅用oncos-102、仅用检查点抑制剂或用oncos-102和检查点抑制剂的组合治疗。研究组1-9、小鼠数目和使用的最小周转时间显示于表1中。不久,在研究组1中,用5x106个vp的oncos-102治疗免疫缺陷的小鼠。在第2组中,使用5x107个vp的oncos-102,而第3组中的小鼠完全没有接受任何治疗。通过测量来自这些组的肿瘤体积获得的结果显示于图1a中。结果表明肿瘤体积病毒剂量依赖性地减少。
第4组中的人源化小鼠用5x107个vp的oncos-102治疗,而第5组的小鼠未治疗。第6组和第7组的人源化小鼠分别用keytruda(40μg/小鼠)和opdivo(60μg/小鼠)治疗。第8组中的人源化小鼠首先用oncos-102(5x107个vp)治疗,随后用keytruda(40μg/小鼠)治疗。在第9组中,小鼠具有两个肿瘤(分别为左侧和右侧)。否则如第8组中治疗小鼠,但仅用病毒治疗右侧肿瘤。治疗的右侧肿瘤相比于第9组中未治疗的人源化小鼠的左侧肿瘤和仅用keytruda治疗的人源化小鼠的肿瘤(第6组)的结果显示于图1c中,并表明病毒治疗的全身效应,因为病毒治疗的肿瘤和病毒未治疗的肿瘤两者类似地受影响。在图1b中,显示第3组和第5组的未治疗的免疫缺陷和人源化小鼠之间的比较。结果表明,人免疫系统抑制小鼠中的肿瘤生长。在图1d中,第8组(oncos-102+keytruda)和第4组(仅oncos-102)和第8组和第6组(仅keytruda)的小鼠之间的差异表明联合疗法(其中肿瘤首先用oncos-102引发,然后施用检查点抑制剂)比单独用oncos-102或在没有引发的情况下用keytruda进行治疗更有效。
表1.实验的研究组(第1-9组)。
实施例2.联合疗法的功效的评估。
该实验由法国archamps的tcs用nod/shi-scid/il-2rγnull免疫缺陷小鼠品系(nog)进行。在化学清髓性处理后两天,将四周龄的免疫缺陷nog小鼠(taconic)植入脐带血来源的cd34+造血干细胞和祖细胞(法国血液库)。植入包括静脉内注射cd34+细胞。细胞注射后14周,通过流式细胞术(attune,lifetechnologies)分析总血白细胞中的人cd45+细胞,监测移植水平。人源化率被定义为循环hcd45+/总cd45+(mcd45+hcd45)的比率。将60只人源化nog小鼠用a2058肿瘤细胞移植并随机化成8组。
将8组(每组6至8只)小鼠随机化并如下处理:
·第1组:n=8。媒介物。媒介物(pbs):第15、16和18天(两个肿瘤上的肿瘤内)和第15、16和18天以及整个研究中每3-4天静脉内。
·第2组:n=8。oncos-102。oncos-102(2.5x106个vp/肿瘤=>5x106个vp/小鼠):第15、16和18天(肿瘤内,两个肿瘤)。
·第3组:n=8。keytruda200:keytruda200μg/小鼠:第15、16和18天以及整个研究中每3-4天静脉内。
·第4组:n=8。keytruda400:keytruda400μg/小鼠:第15、16和18天以及整个研究中每3-4天静脉内。
·第5组:n=8。oncos-102+keytruda200:溶瘤病毒(2.5x106个vp/肿瘤=>5x106个vp/小鼠)和keytruda200μg/小鼠:第15、16和18天(肿瘤内,两个肿瘤上)和第15、16和18天以及整个研究中每3-4天静脉内。
·第6组:n=8。oncos-102+keytruda400。溶瘤病毒(2.5x106个vp/肿瘤=>5x106个vp/小鼠)和keytruda400μg/小鼠:第15、16和18天(肿瘤内,两个肿瘤上)和第15、16和18天以及整个研究中每3-4天静脉内。
·第7组:n=6。ov右侧+keytruda200:溶瘤病毒(5x106个vp/肿瘤)和keytruda200μg/小鼠:第15、16和18天(右侧肿瘤上的肿瘤内)和第15、16和18天以及整个研究中每3-4天静脉内。
·第8组:n=6。ov右侧+keytruda400:溶瘤病毒(5x106个vp/肿瘤)和keytruda400μg/小鼠:第15、16和18天(右侧肿瘤上的肿瘤内)和第15、16和18天以及整个研究中每3-4天静脉内。
使用卡尺每周3次监测肿瘤体积。当大到足以测量时,使用下式计算肿瘤体积:(长度x(宽度)2/2)。超过1000mm3的肿瘤体积被认为是终点,并且在这种情况下,将小鼠处死。在第40天安排处死。
使用graphpadprism软件(版本7)分析所有参数。如下进行统计学分析。应用单因素anova与tukey氏事后检验来比较各组。在第40天,应用t-检验以将每个治疗组与媒介物组进行比较。对于存活分析,绘制kaplan-meier曲线并使用对数秩(mantel-cox)检验。
我们观察到(图2),与媒介物处理组相比,oncos-102减小了肿瘤体积。单独的keytruda没有显著效果,但与媒介物组相比,oncos-102与keytruda200μg/小鼠和keytruda400μg/小鼠的组合显著降小了肿瘤体积(分别为p=0.0034和p=0.0023)。oncos-102和keytruda200和400μg/小鼠的组合分别使肿瘤体积减少46%和57%。
在处死时通过流式细胞术分析肿瘤的免疫细胞浸润。对研究结束时,对在第40天收集的肿瘤进行分析。首先研究总人cd45+的量(图3)。在左侧肿瘤中,未观察到组间的差异。在右侧肿瘤(局部处理)中,与媒介物、oncos-102和keytruda200组相比,oncos-102+keytruda200组中的免疫cd45细胞的数目增加,这可能表明oncos-102和keytruda200增加人免疫细胞的募集的协同作用。
在左胁和右胁上,在ov治疗组和用oncos-102+keytruda治疗的组中观察到cd8+t细胞的显著增加。在右胁上,我们还观察到与媒介物组相比,右侧肿瘤中cd8+t细胞的比例的显著增加,但左侧肿瘤中没有。keytruda200和keytruda400对cd8+t细胞的比例没有影响(图4)。
还在黑色素瘤细胞的表面研究pdl1表达(图5)。pdl1在肿瘤中的黑色素瘤细胞的表面表达,并且在各组之间未观察到显著的表达差异。
此外,显示oncos-102和keytruda200μg和400μg/小鼠)的组合显示协同的抗肿瘤作用(表2)。
表2.在hunog小鼠中用oncos-102和keytruda200μg或keytruda400μg联合治疗黑色素瘤。用ftv计算方法评价治疗协同作用。ftv(平均肿瘤体积(%)实验)/(平均肿瘤体积对照(%))。*(keytruda的平均ftv(%))x(oncos-102的平均ftv(%))。**(预期的ftv除以观察到的ftv)。>1的比率(r)表示协同效应,而<1的比率表示小于累加效应。
参考文献
fueyoj.,gomez-manzanoc.,alemanyr.,leep.,mcdonnelltj.,mitliangap.shiy-x.,levinva.,yungwka.andkyritsisap.amutantoncolyticadenovirustargetingtherbpathwayproducesanti-gliomaeffectinvivo.oncogene(2000)19:2-12.
heisec.,hermistont.,johnsonl.,brooksg.,sampson-johannesa.,williamsa.,hawkinsl.&kirnd.anadenoviruse1amutantthatdemonstratespotentandselectivesystemicanti-tumoralefficacy.natmed(2000)6:1134-9.
hanahand,weinbergra.(2000).thehallmarksofcancer.cell(2000)100:57–70.
koskia,kangasniemil,escutenaires,pesonens,cerullov,diaconui,nokisalmip,rakim,rajeckim,gusek,rankit,oksanenm,etal.treatmentofcancerpatientswithaserotype5/3chimericoncolyticadenovirusexpressinggmcsf.molther(2010)18:1874-84.
rankit,joensuut,
rankit,pesonens,hemminkia,partanenk,kairemok,alankot,lundinj,lindern,turkkir,
romanoe,kusio-kobialkam,foukaspg,baumgaertnerp,meyerc,ballabenip,michielino,weideb,romerop,speiserde.ipilimumab-dependentcell-mediatedcytotoxicityofregulatorytcellsexvivobynonclassicalmonocytesinmelanomapatients.procnatlacadsciusa.(2015)112(19):6140-5.doi:10.1073/pnas.1417320112.
sagiv-barfii,kohrthe,czerwinskidk,ngpp,changby,levyr.therapeuticantitumorimmunitybycheckpointblockadeisenhancedbyibrutinib,aninhibitorofbothbtkanditk.procnatlacadsciusa.(2015)112(9):e966-72.doi:10.1073/pnas.1500712112.
siuralam,bramantes,vassilevl,hirvinenm,parviainens,tahtinens,gusek,cerullov,kanervaa,kipara,vaha-koskelam,hemminkia.oncolyticadenovirusanddoxorubicin-basedchemotherapyresultsinsynergisticantitumoractivityagainstsoft-tissuesarcoma.intjcancer(2015)136:945-54.
vassilevl,rankit,joensuut,
- 还没有人留言评论。精彩留言会获得点赞!