制备抑制癌细胞增殖的间充质干细胞的方法与流程
本发明涉及用于培养用于治疗癌症的间充质干细胞的培养基组合物,该间充质干细胞可以在保持其活性的同时抑制癌细胞的增殖。更具体地,本发明涉及用于产生间充质干细胞的包含维生素c和阿司匹林的培养基组合物,该间充质干细胞具有改进的针对癌细胞增殖的抑制活性。
背景技术:
干细胞是指能够自我复制并分化为两种或更多种细胞的细胞。干细胞分为全能干细胞、多能干细胞和专能干细胞。
全能干细胞是指可以发育成一个完整个体的全能细胞,并且在卵用精子受精后胚胎细胞直至八细胞阶段具有这些特性。当这些细胞被分离并移植到子宫中时,它们可以发育成一个完整个体。
多能干细胞是指能够发育成衍生自外胚层、中胚层和内胚层的各种细胞和组织的细胞,并且可以衍生自在受精后4-5天产生的胚泡内部的内细胞团。这种细胞称为“胚胎干细胞”,并且可以分化为各种其他组织细胞,但不能形成新的生物体。
专能干细胞是指如下干细胞,该干细胞仅能够分化为组织和器官特异性细胞(该组织和器官含有这些细胞)。专能干细胞参与胎儿、新生儿和成人阶段的组织和器官的生长和发育,以及成体组织的体内平衡维持和诱导受损组织再生的功能。组织特异性专能细胞统称为“间充质干细胞”。
间充质干细胞(rebeccasywong,等人jbiomedbiotechnol24:2011,2011)已经用于在各种疾病病症(例如心脏病、成骨不全症、和脊髓损伤)中的基于细胞的疗法中,并且结果受到关注。此外,最近对基于细胞的疗法和使用尿源干细胞的再生医学进行了研究(bharadwaj等人,stemcells.31(9):1840-56,2013;zhangd等人,genesdis.1):8-17,2014;guan等人,tissueeng,20(13-14):1794-806,2014)。
然而,若干研究报道了msc治疗的副作用。具体而言,若干研究表明,msc通过肿瘤突变和恶性突变引起肿瘤快速生长和转移,并且对抗癌药具有抗性。此外,各种研究表明间充质干细胞的自发恶性转化。
同时,“癌症”的特征是“不受控制的细胞生长”,并且这种异常的细胞生长导致形成大量称为“肿瘤”的细胞,这些细胞渗透入周围组织,并且在严重的情况下可转移到其他器官,这在学术上也称为“瘤形成”。
治疗癌症的方法包括手术、放射疗法、化学疗法(包括给予抗癌药)等。抗癌药是作用于无限增殖的癌细胞以抑制癌细胞的增殖和生长的药物。目前广泛使用的烷基化抗癌药如顺铂和环磷酰胺与构成dna的核苷酸中的氮共价结合,并因此展现出抗癌活性。5-氟尿嘧啶抑制参与核酸生物合成的酶,或直接插入dna或rna中因此变得有活性。
另外,阿霉素等抗生素强烈地作用于dna以抑制dna的固有功能,因此展现抗癌作用。然而,这些抗癌药不仅作用于肿瘤细胞,而且作用于正常细胞,特别是作用于快速增殖和分化的活细胞如骨髓细胞或肠上皮细胞,因此伴随着各种副作用,例如肾毒性、呕吐和神经毒性。
此外,与其他癌细胞不同,肿瘤中的癌症干细胞仍处于静息期,并且比转移性癌细胞的侵袭力更低。因此,此类细胞存活,被排除在抗癌药的攻击之外,使得仅通过诱导肿瘤中存在的常见癌细胞的死亡(细胞凋亡)不能完全除去肿瘤。
因此,作为使用间充质干细胞开发癌症治疗剂以克服抗癌药等的副作用的大量努力的结果,诸位发明人发现通过在补充有阿司匹林、维生素c等的培养基中培养产生的间充质干细胞在保持细胞活性的同时具有抑制癌细胞增殖的作用,从而完成了本发明。
技术实现要素:
因此,本发明的一个目的是提供一种用于产生间充质干细胞的包含维生素c和阿司匹林的培养基组合物,该间充质干细胞具有改进的针对癌细胞增殖的抑制活性;以及一种通过在培养基中培养间充质干细胞产生具有改进的针对癌细胞增殖的抑制活性的间充质干细胞的方法。
根据本发明,上述和其他目的可以通过提供用于产生间充质干细胞的包含阿司匹林的培养基组合物来实现,该间充质干细胞具有改进的针对癌细胞增殖的抑制活性。
根据本发明的另一个方面,提供了产生具有改进的抑制癌细胞增殖能力的间充质干细胞的方法,其包括在包含阿司匹林的培养基中培养间充质干细胞。
根据本发明的另一个方面,提供了使用用于产生间充质干细胞的包含阿司匹林的培养基组合物产生具有改进的抑制癌细胞增殖能力的间充质干细胞。
附图说明
从以下详细描述结合附图将更清楚地理解本发明的上述和其他目的、特征和其他优点,其中:
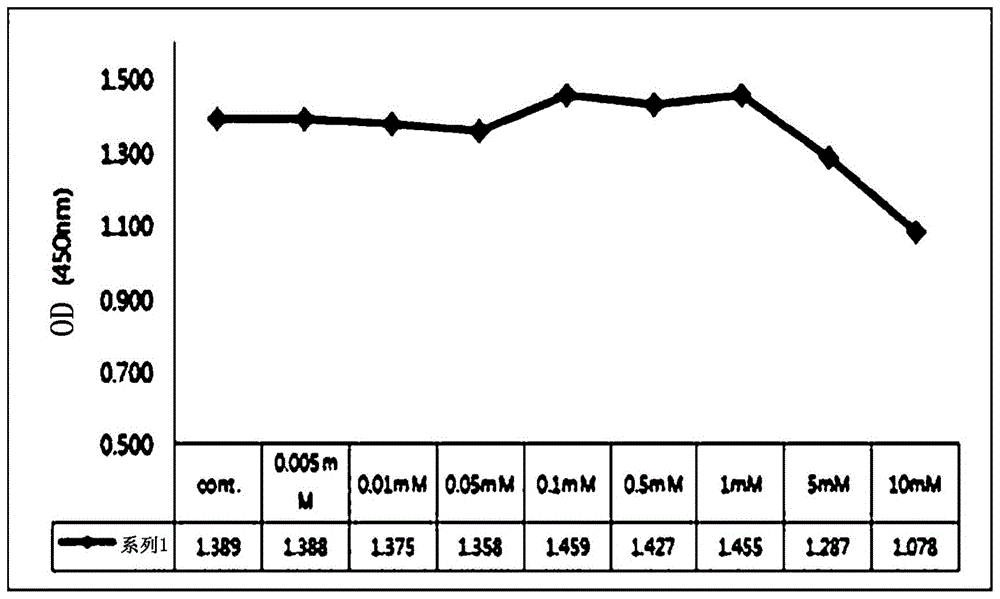
图1示出根据阿司匹林浓度的vit.c-msc的细胞毒性分析结果;
图2示出在包含阿司匹林的培养基中培养的vit.c-msc的形态;
图3示出在包含阿司匹林的培养基中培养的vit.c-msc的增殖率、活力和细胞大小;
图4是示出在包含阿司匹林的培养基中培养的vit.c-msc的集落形成测定(cfa)结果的图像;
图5示出在包含阿司匹林的培养基中培养的vit.c-msc的集落形成测定(cfa)的测量结果;
图6示出用以分析在不含阿司匹林的对照培养基中培养的vit.c-msc的cd标记物表达的facs结果。
图7示出用以分析在包含0.1mm阿司匹林的培养基中培养的vit.c-msc的cd标记物表达的facs结果。
图8示出用以分析在包含0.5mm阿司匹林的培养基中培养的vit.c-msc的cd标记物表达的facs结果。
图9示出用以分析在包含1mm阿司匹林的培养基中培养的vit.c-msc的cd标记物表达的facs结果。
图10示出用以鉴定在包含阿司匹林的培养基中培养的vit.c-msc分化为脂肪细胞的能力的油红o染色结果;
图11示出用以鉴定在包含阿司匹林的培养基中培养的vit.c-msc向脂肪细胞的分化水平的520nm吸光度测量结果;
图12示出用以鉴定在包含阿司匹林的培养基中培养的vit.c-msc分化为骨细胞的能力的茜素红s染色结果;
图13示出用以鉴定在包含阿司匹林的培养基中培养的vit.c-msc向骨细胞的分化水平的560nm吸光度测量结果;
图14示出将在包含阿司匹林的培养基中培养的vit.c-msc与在癌细胞培养基中的mcf-7癌细胞直接共培养后癌细胞数与总细胞数的比率计算结果,随后通过facs测定癌细胞的分布;
图15示出将在包含阿司匹林的培养基中培养的vit.c-msc与在癌细胞培养基中的panc-1癌细胞直接共培养后癌细胞数与总细胞数的比率计算结果,随后通过facs测定癌细胞的分布;
图16示出将在包含0.5mm阿司匹林的培养基中培养的vit.c-msc与在癌细胞培养基中的乳腺癌细胞(mcf-7)或胰腺癌细胞(panc-1)直接共培养后,对针对癌细胞增殖的抑制活性的鉴定结果;
图17示出将在包含阿司匹林的培养基培养的vit.c-msc与在癌细胞培养基中的乳腺癌细胞(mcf-7)直接共培养后的癌细胞数量;
图18示出将在包含阿司匹林的培养基中培养的vit.c-msc与在癌细胞培养基中的panc-1癌细胞直接共培养后的癌细胞数量;
图19示出将在包含0.5mm阿司匹林的培养基中培养的vit.c-msc与在癌细胞培养基中的乳腺癌细胞(mcf-7)或胰腺癌细胞(panc-1)直接共培养后,对针对癌细胞增殖的抑制活性的鉴定结果;
图20是将在包含0.5mm阿司匹林的培养基中培养的vit.c-msc与在癌细胞培养基中的panc-1癌细胞(红色)直接培养后0小时和48小时的荧光显微镜图像;
图21示出用以测定在包含浓度为0.1mm、0.5mm和1mm的阿司匹林的培养基中培养的vit.c-msc中的fasl表达的实时pcr结果;
图22示出用以比较在包含浓度为0.1mm、0.5mm和1mm的阿司匹林的培养基中培养的vit.c-msc中的trail表达的实时pcr结果;
图23示出在包含0.5mm阿司匹林的培养基中培养的vit.c-msc中的fasl、trail和cxcr4表达水平的比较;
图24a示出用以鉴定在包含浓度为0.1、0.5和1mm的阿司匹林的培养基中培养的vit.c-msc中的vegf表达的rt-pcr结果,并且图24b示出rt-pcr后vegf表达的比较(1:vit.cmsc,2:0.1mmasp-vit.cmsc,3:0.5mmasp-vit.cmsc,4:1mmasp-vit.cmsc);
图25示出在包含0.5mm阿司匹林的培养基中培养的vit.c-msc中nrf2、c-myc和p21的表达程度;
图26示出在包含0.5mm阿司匹林的培养基中培养的vit.c-msc中sox2、oct4和nanog的表达程度;
图27示出在癌细胞培养条件下与在包含0.5mm阿司匹林的培养基中培养的vit-c-msc(天使干细胞(angel-stemcell))间接共培养的癌细胞中bcl-2基因的表达的分析结果;
图28示出在癌细胞培养条件下与在包含阿司匹林的培养基中培养的vit-c-msc(天使干细胞)间接共培养的癌细胞中ppar-γ基因的表达的分析结果;
图29示出在癌细胞培养条件下与在包含阿司匹林的培养基中培养的vit-c-msc(天使干细胞)间接共培养的癌细胞中apaf-1基因的表达的分析结果;以及
图30示出在癌细胞培养条件下与在包含阿司匹林的培养基中培养的vit-c-msc(天使干细胞)间接共培养的癌细胞中oct4基因的表达的分析结果。
具体实施方式
除非另外定义,本文所用的全部技术和科学术语具有与本发明所属领域的技术人员所理解的意义相同的意义。通常,本文所用的命名法在本领域中是公知并且通常使用的。
成体干细胞是指已知在胚胎发生以形成胚胎器官的阶段或在成体阶段具有仅分化为组织和器官特异性细胞的专能能力的干细胞。具有组织特异性分化能力的专能干细胞是仅可分化为组织和器官特异性细胞(该组织和器官包含该细胞)的干细胞,参与胎儿阶段、新生儿阶段和成人阶段中的对应组织和器官的生长和发育以及成体组织的体内平衡维持和诱导受损组织再生的功能。
在本发明中,使用成体干细胞,优选人源成体干细胞。
此类成体干细胞可以衍生自组织,例如脂肪、子宫、骨髓、肌肉、胎盘、脐带血液、尿液或皮肤(上皮)。优选地,可以使用从脂肪组织或上皮组织(例如毛囊和羊膜组织)获得的成体干细胞。特别地,优选使用间充质干细胞(msc),最优选使用人脂肪组织衍生的间充质干细胞(at-msc)。
根据本发明的尿源干细胞具有自我更新和专能能力,并表达间充质干细胞标记物。也就是说,尿源干细胞可以分化为中胚层细胞系,例如内皮细胞、骨原细胞、软骨细胞、脂肪细胞和骨骼肌细胞、以及内皮细胞系(例如尿路上皮细胞)。此外,已知尿源干细胞具有高端粒酶活性和长端粒(bharadwaj等人,stemcells.31(9):1840-56,2013;stemcells:currentchallengesandnewdirectionspartoftheseriesstemcellbiologyandregenerativemedicine,19-28:2013)。
如本文所用,术语“干细胞”是指能够自我复制并分化为两种或更多种细胞的细胞,并且术语“成体干细胞”是指在胚胎发生以形成胚胎器官的阶段或在成体阶段的干细胞。
如本文所用,术语“间充质干细胞”是指从人或哺乳动物组织分离的未分化干细胞,其可以衍生自各种组织。具体而言,间充质干细胞可以是脐带衍生的间充质干细胞、脐带血衍生的间充质干细胞、骨髓衍生的间充质干细胞、脂肪衍生的间充质干细胞、肌肉衍生的间充质干细胞、神经衍生的间充质干细胞、皮肤衍生的间充质干细胞、羊膜衍生的间充质干细胞、和胎盘衍生的间充质干细胞,并且从各组织中分离干细胞的方法在本领域中是熟知的。
如本文所用,术语“脂肪衍生的间充质干细胞”是指从脂肪组织分离的未分化干细胞,并且其分离方法可以是例如如下。更具体地,在培养通过抽脂术获得的漂浮在生理盐水中的含脂肪悬浮液后,将粘附到培养容器如烧瓶上的干细胞层用胰蛋白酶处理并且然后收集,或将悬浮在少量生理盐水中的物质是通过刮除直接收集以分离脂肪衍生的间充质干细胞。
这种“脂肪组织衍生的成体干细胞”或“脂肪组织衍生的间充质干细胞”是从脂肪组织分离的未分化的成体干细胞,并且在本文中缩写为“脂肪干细胞”。此类细胞可通过本领域熟知的常规方法获得。
可以使用已知适合于干细胞培养的常规培养基作为用于获得脂肪干细胞产物的培养基。优选地,可以使用dmem(达尔伯克改良伊格尔培养基)或角质形成细胞-sfm(角质形成细胞无血清培养基),并且可以使用imdm(iscove改良的达尔伯克培养基)、a-mem(伊格尔培养基的α改良)、f12(营养素混合物f-12)和dmem/f12(达尔伯克改良伊格尔培养基:营养素混合物f-12)的混合物,但本发明不限于此。
用于培养脂肪干细胞的培养基可以补充有抑制分化同时促进脂肪干细胞的未分化表型的增殖的添加剂。此外,培养基通常可包含中性缓冲液(例如磷酸盐和/或高浓度碳酸氢盐)和蛋白质营养素(例如血清(例如fbs)、血清替代品、白蛋白或必需氨基酸和非必需氨基酸(例如谷氨酰胺))。另外,培养基可包含脂质(脂肪酸、胆固醇、血清hdl或ldl提取物)和此类大多数防腐剂培养基中发现的其他成分(例如胰岛素或转铁蛋白、核苷或核苷酸、丙酮酸盐、任何电离或盐形式的糖源(例如葡萄糖)、硒、糖皮质激素(例如氢化可的松)和/或还原剂(例如β-巯基乙醇))。
此外,优选地,培养基还包含抗结块剂,例如由invitrogen(目录号0010057ae)销售的产品,以防止细胞彼此粘附,粘附到容器壁上,或形成太大的束。
具体而言,用于获得或培养在本发明的一个实施方案中使用的脂肪干细胞的培养基优选包括选自dmem、限定的角质形成细胞-sfm、α-mem、imdm、f12和dmem/f12的基础培养基,以及用于培养间充质干细胞的包含l-抗坏血酸2-磷酸盐(维生素c)、胎牛血清和n-乙酰基-l-半胱氨酸并且进一步补充有阿司匹林的培养基组合物,但本发明不限于此。
在本发明中,培养基可包含0.05mm至1mm抗坏血酸2磷酸盐、2%至20%胎牛血清、0.2mm至20mmn-乙酰基-l-半胱氨酸和0.1mm至1mm阿司匹林,但本发明不限于此。
一方面,本发明涉及用于产生间充质干细胞的培养基组合物,其包含阿司匹林并且具有改进的针对癌细胞增殖的抑制活性。
另一方面,本发明涉及产生具有改进的抑制癌细胞增殖能力的间充质干细胞的方法,其包括在包含阿司匹林的培养基中培养间充质干细胞。
另一方面,本发明涉及使用用于产生间充质干细胞的包含阿司匹林的培养基组合物产生具有改进的抑制癌细胞增殖能力的间充质干细胞。
在本发明中,培养基优选还包含维生素c,但本发明不限于此。
在本发明中,培养基优选为包含5%-10%fbs和nac(n-乙酰半胱氨酸)的dmem或k-sfm,更优选还包含钙、regf、胰岛素和氢化可的松,但本发明不限于此。
在本发明中,将间充质干细胞优选用维生素c预处理,但本发明不限于此。
在本发明中,间充质干细胞优选衍生自选自脂肪、子宫、骨髓、肌肉、胎盘、脐带血液、尿液、毛囊和皮肤的组织,但本发明不限于此。
在本发明中,阿司匹林的浓度优选为0.1mm至1mm,但本发明不限于此。
在本发明中,培养时间优选为24小时,但本发明不限于此。
在本发明中,癌细胞优选是神经胶质瘤、胶质肉瘤、间变性星形细胞瘤、成神经管细胞瘤、肺癌、小细胞肺癌、宫颈癌、结肠癌、直肠癌、脊索瘤、咽喉癌、卡波西肉瘤、淋巴肉瘤、淋巴内皮肉瘤、结直肠癌、子宫内膜癌、卵巢癌、白血病、前列腺癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、睾丸肿瘤、维尔姆斯肿瘤、尤因氏瘤、膀胱癌、血管肉瘤、内皮肉瘤、腺癌、汗腺瘤、皮脂腺癌、乳头状癌、乳头状肉瘤、囊状肉瘤、支气管癌、髓样癌、肥大细胞瘤、间皮瘤、滑膜瘤、黑素瘤、平滑肌瘤、横纹肌瘤、神经母细胞瘤、视网膜母细胞瘤、少突神经胶质瘤、听神经瘤、血管母细胞瘤、脑膜瘤、松果体瘤、室管膜瘤、颅咽管瘤、上皮癌、胚胎癌、鳞状细胞癌、基底细胞癌、纤维肉瘤、粘液瘤、粘膜肉瘤、脂肪肉瘤、软骨肉瘤、成骨性肉瘤或癌症干细胞,更优选地是乳腺癌或胰腺癌细胞,但本发明不限于此。
另一方面,本发明涉及一种治疗癌症的方法,其包括给予具有改进的抑制癌细胞增殖能力的间充质干细胞,该间充质干细胞是通过在包含阿司匹林的培养基中培养间充质干细胞产生的。
另一方面,本发明涉及使用具有改进的针对癌细胞增殖的抑制活性的间充质干细胞治疗癌症,该间充质干细胞是通过在包含阿司匹林的培养基中培养间充质干细胞产生的。
“癌症”的特征是不受控制的细胞生长。这种异常的细胞生长导致形成大量称为“肿瘤”的细胞,这些细胞渗透到周围组织中,并且在严重的情况下转移到其他器官。
术语“抗癌”旨在不仅包括治疗癌症疾病,即抑制癌细胞或癌症干细胞的增殖或消除癌细胞或癌症干细胞,还包括预防癌症疾病,即在癌症发作前改进对癌症的抗性。因此,术语“预防或治疗癌症”或“抑制癌症增殖”和“抗癌”在本文中可互换使用。
在本发明中,术语“癌细胞”包括由于正常细胞的增殖和生长机制中的遗传变异(突变)而经历异常细胞生长并且具有向其他器官的侵袭性移动性(其可称为“转移”)的细胞。此外,已知癌症干细胞存在于肿瘤中,并且被认为是由来自正常干细胞的遗传信息的异常转移引起的。癌症干细胞由于存在用于其存活的称为“生态位”的微环境而保持和增殖,已知生态位的存在和周围正常细胞、免疫相关细胞或分化的癌细胞会影响其特征的维持和增殖。
除非另有说明,如本文所用的术语“治疗性”是指逆转、缓解、抑制或预防该术语所适用的疾病或障碍或者疾病或障碍的一种或多种症状。
如本文所用的术语“治疗”是指当术语“治疗性”是如上定义的情况时的治疗作用。
因此,哺乳动物中对癌症的“治疗”或“疗法”包括以下中的一项或多项:
(1)抑制癌症的生长,即阻抑癌症的发展,
(2)预防癌症扩散,即预防转移,
(3)减轻癌症,即导致癌症消退,
(4)预防癌症复发,和
(5)缓解癌症症状。
癌症是一种难治性慢性疾病,即使通过手术、放射疗法和化学疗法治疗,在许多情况下也无法从根本上治疗,对患者造成严重疼痛并最终导致死亡。在过去的几十年中,手术、化学疗法(用抗癌药治疗)、放射疗法等已经大大进步,但未能提供癌症的最终解决方案。
存在与作为癌症治疗剂的干细胞对抑制或促进癌症的作用相关的报道。从本发明可以看出,这种相反(矛盾)的作用根据培养干细胞的培养基和方法而变化。
在本发明的一个实施方案中,通过在包含阿司匹林的培养基中培养在包含维生素c的培养基中培养的脂肪衍生的间充质干细胞,产生具有改进的针对癌细胞增殖的抑制活性的间充质干细胞。换言之,根据本发明的间充质干细胞可以是具有抗癌功能的干细胞,其通过在包含阿司匹林的培养基中培养通过用维生素c预处理来培养出的脂肪衍生的间充质干细胞而产生;并且可以是具有抗癌功能的干细胞,其通过在包含维生素c和阿司匹林二者的培养基中培养脂肪衍生的间充质干细胞而产生;并且可以是如下干细胞,其通过在包含维生素c和阿司匹林二者的培养基中培养通过用维生素c预处理来培养出的脂肪衍生的间充质干细胞而产生。诸位发明人将所有这些干细胞称为“天使干细胞(angelstemcell)”。
实施例
在下文中,将参考实施例更详细地描述本发明。然而,对于本领域技术人员显而易见的是,提供这些实施例仅用于说明本发明,而不应解释为限制本发明的范围。
[实施例]
实施例1:分离人脂肪组织衍生的间充质干细胞
通过抽脂术分离从腹部脂肪获得的人脂肪组织并用pbs洗涤。将组织切碎,并将其使用补充有1型胶原酶(1mg/ml)的dmem在37℃下消化2小时。将组织用pbs洗涤,然后以1,000rpm离心5分钟。抽吸上清液,并将保持在底部的沉淀用pbs洗涤,然后以1,000rpm离心5分钟。通过过滤通过100μm筛网将碎片除去,用pbs洗涤,然后在包含10%fbs、2mmnac和0.2mm抗坏血酸的dmem培养基中培养。
静置过夜后,将未附着的细胞用pbs洗涤,并进行传代培养,同时每2天替换rkcm-n培养基,即角质形成细胞-sfm培养基(包含5%fbs、2mmnac、0.2mm抗坏血酸、0.09mm钙、5ng/mlregf、5μg/ml胰岛素和74ng/ml氢化可的松),以分离脂肪组织衍生的专能间充质干细胞。
由此获得的脂肪组织衍生的专能间充质干细胞是在包含维生素c的培养基中培养的vit.c-msc,即用维生素c预处理的msc,将其用于以下实施例中。
以下实施例中使用的各种培养基和试剂的来源如下文表1所示。
[表1]
实施例2:评价阿司匹林对vit.c-msc的毒性
将实施例1的在包含维生素c的培养基中培养的vit.c-msc以1x104个细胞/板的浓度接种在96孔细胞培养板上,然后孵育过夜以进行细胞粘附和稳定化。然后,将细胞在新鲜的rkcm-n培养基中培养24小时,该培养基即包含5%fbs、2mmnac、0.2mm抗坏血酸、0.09mm钙、5ng/mlregf、5μg/ml胰岛素和74ng/ml氢化可的松的并补充有各种浓度(0.005mm、0.001mm、0.05mm、0.1mm、0.5mm、1mm、5mm和10mm)阿司匹林的角质形成细胞-sfm。将cck-8(细胞计数试剂盒-8,dojindo)溶液(10μl/100μl)添加至各孔中并反应2小时,并使用酶标仪(lonza)测量450nm处的吸光度。
结果是,从图1中可以看出,阿司匹林浓度为5mm或更低时,对vit.c-msc几乎没有细胞毒性。因此,在以下分析中,以0.1mm至1mm的浓度使用阿司匹林。
实施例3:在包含阿司匹林的培养基中培养的vit.c-msc的特征
将实施例1的在包含维生素c的培养基中培养的vit.c-msc孵育2天以进行粘附和稳定化。然后,将vit.c-msc在补充有浓度为0.1mm、0.5mm、1mm和10mm阿司匹林的新鲜rkcm-n培养基中培养24小时。
用电子显微镜(100x放大倍数,leicadmil)监测经由阿司匹林的vit.c-msc的细胞形态(图2),并使用luna自动细胞计数器(logoy)分析增殖率、活力和细胞大小(图3)。
结果证实,1mm或更低的阿司匹林浓度不影响干细胞的形态、增殖率、活力和细胞大小(图2和图3)。
实施例4:在包含阿司匹林的培养基中培养的vit.c-msc的干细胞性(干细胞能力)的分析
4-1:cfa(集落形成测定)
将在包含维生素c的培养基中培养的vit.c-msc培养2天以进行粘附和稳定化,并且然后在补充有浓度为0.1mm、0.5mm和1mm的阿司匹林的新鲜rkcm-n培养基中培养24小时。然后,针对每种阿司匹林浓度,将300个细胞与rkcm-n培养基混合,并接种在100mm细胞培养皿上。在每2至3天更换培养基的同时,将细胞在37℃和5%co2下培养10天。10天后,将培养基除去,并向其中添加3ml0.1%结晶紫试剂,然后反应10分钟,然后洗涤并干燥。对形成的集落数量进行计数,并通过“集落数/接种的细胞总数x100%”的等式计算集落形成能力(铺板效率,pe)。
结果是,在包含浓度为1mm或更低的阿司匹林的培养基中培养的vit.c-msc示出集落形成能力没有变化,因此干细胞既不会失去干细胞性也不会改变干细胞能力(图4和图5)。
4-2:鉴定表面cd标记物
将在包含维生素c的培养基中培养的vit.c-msc培养2天以进行粘附和稳定化,并在补充有浓度为0.1mm、0.5mm和1mm的阿司匹林的新鲜rkcm-n培养基中培养24小时。
使用facs,在两种类型的msc即vit.c-msc与在阿司匹林中培养的asp-vit.c-msc之间比较下表2中干细胞表面上的cd标记物表达。
[表2]
结果是,如从图6至图9可以看到,在0.1mm、0.5mm和1mm阿司匹林的情况下,干细胞表面上的cd标记物表达没有变化。也就是说,在包含阿司匹林的培养基中培养的vit.c-msc既没有丧失干细胞性(干细胞的特征)也没有改变干细胞能力。
实施例5:鉴定在包含阿司匹林的培养基中培养的vit.c-msc的分化能力
5-1:脂肪细胞分化的诱导
将在包含维生素c的培养基中培养的vit.c-msc培养2天以进行粘附和稳定化,并且然后在补充有浓度为0.1mm、0.5mm和1mm的阿司匹林的新鲜rkcm-n培养基中培养24小时。然后,将细胞以2×104个细胞接种在12孔板上并培养14天,同时用stempro脂肪生成分化试剂盒每2至3天替换培养基。
诱导分化14天后,用油红o对细胞染色,并用显微镜分析。结果是,鉴定分化为脂肪细胞(图10)。将油红o染色的细胞用异丙醇脱色以根据在520nm处的吸光度鉴定分化程度(图11)。
5-2:骨细胞分化的诱导
将在包含维生素c的培养基中培养的vit.c-msc培养2天以进行粘附和稳定化,并且然后在补充有浓度为0.1mm、0.5mm和1mm的阿司匹林的新鲜rkcm-n培养基中培养24小时。然后,将2x104个细胞接种在12孔板上并培养21天,同时用stempro脂肪生成分化试剂盒每2至3天替换培养基。
分化诱导21天后,用茜素红对细胞染色,并用显微镜分析。结果是,鉴定分化为骨细胞(图12)。将茜素红染色的细胞用10%氯化十六烷基吡啶脱色以根据在560nm处的吸光度鉴定分化程度(图13)。
实施例6:通过将在包含阿司匹林的培养基中培养的vit.c-msc与癌细胞直接共培养鉴定抗癌作用
6-1:乳腺癌和胰腺癌细胞
为进行直接共培养,将实施例1的在包含维生素c的培养基中培养的vit.c-msc以10%汇合度(密度)(0.5x106个细胞)接种于在t75烧瓶中的rkcm-n培养基。2天后,当汇合度达到50%至60%时,将rkcm-n培养基,即包含5%fbs、2mmnac、0.2mm抗坏血酸、0.09mm钙、5ng/mlregf、5μg/ml胰岛素和74ng/ml氢化可的松的角质形成细胞-sfm培养基,用浓度为0.5mm、1mm和10mm的阿司匹林处理,并培养24小时,然后收集asp-vit.c-msc(天使干细胞)。
然后,将2x107个乳腺癌细胞(mcf-7)和2x107个胰腺癌细胞(panc-1)用无血清dmem培养基分别洗涤两次。使用pkh26红色荧光细胞接头试剂盒(sigma),将细胞用每1ml稀释剂c溶液4μl红色染色溶液染色10min。将细胞用相同体积的血清(fbs)封闭1分钟,用补充有血清的dmem培养基洗涤两次,并在补充有血清(fbs)的培养基中反应30分钟。用荧光显微镜(100x放大倍数,zeiss,mirax)鉴定染色的癌细胞(图20)。将用红色荧光染料进行荧光标记的mcf-7和panc-1癌细胞以0.5x105个细胞/培养皿的密度接种在100mm细胞培养皿上,并使其附着并稳定过夜。
为通过将asp-vit.c-msc和癌细胞直接共培养来鉴定抗癌作用,将0.5x106个asp-vit.c-msc细胞进一步接种在100-mm细胞培养皿上,mcf-7和panc-1癌细胞分别附着至该细胞培养皿上。将包括癌细胞和干细胞的细胞总数调整为1x106,将细胞在包含10%fbs的dmem培养基中培养48小时,然后收集所有细胞。使用luna自动细胞计数器(logoy)鉴定收集的细胞的细胞数、活力和细胞大小,并关于所收集的细胞用facs鉴定荧光染色的癌细胞的分布。
结果是,与在vit.c-msc中相比,在具有0.5mm阿司匹林浓度的asp-vit.c-msc中,荧光染色的癌细胞(乳腺癌细胞(mcf-7)还是胰腺癌细胞(panc-1)二者)的分布显著更低。也就是说,天使干细胞的抗癌作用非常好(图14至图16)。
图14至图16的对照msc+癌细胞的msc是在包含0.2mm抗坏血酸的培养基中培养的有待用维生素c预处理的vit.c-msc。
6-2:癌症干细胞
产生asp-vit.c-msc,即以与实施例6-1相同的方式用阿司匹林处理的vit.c-msc,然后通过与癌症干细胞直接共培养来鉴定asp-vit.c-msc的抗癌作用。
将癌症干细胞用红色荧光染料标记,以0.5x105个细胞/培养皿接种于接种有0.5x106个asp-vit.c-msc的100-mm细胞培养皿中,然后直接在co2培养箱中在37℃下共培养48小时。
48小时后,收集癌症干细胞,测量总细胞数、活力和大小,用facs鉴定用红色荧光染料标记的癌症干细胞的分布,并且对于angel-msc针对癌症干细胞的抗癌活性进行了比较分析。
实施例7:通过将在包含阿司匹林的培养基中培养的vit.c-msc与癌细胞间接共培养鉴定抗癌作用
7-1:乳腺癌和胰腺癌细胞
为进行间接共培养,使用允许双细胞培养的transwell。将癌细胞附着于孔底部,将vit.c-msc附着于孔中的插入膜上,并将细胞在包含10%fbs的dmem培养基中在5%co2的存在下在37℃共培养48小时。
首先,将实施例1的在包含维生素c的培养基中培养的vit.c-msc以10%汇合度(密度)(0.5x106个细胞)接种于在t75烧瓶中的rkcm-n培养基。2天后,当汇合度(密度)达到50%至60%时,将rkcm-n培养基,即包含5%fbs、2mmnac、0.2mm抗坏血酸、0.09mm钙、5ng/mlregf、5μg/ml胰岛素和74ng/ml氢化可的松的角质形成细胞-sfm培养基,用浓度为0.1mm、0.5mm和1mm的阿司匹林处理,并培养24小时,并且收集asp-vit.c-msc(天使干细胞)。将针对每种阿司匹林浓度收集的asp-vit.c-msc各自以1.4x105个细胞/孔接种到插入式transwell(6孔)中,并置于提供有癌细胞的下孔上。
为通过将asp-vit.c-msc与癌细胞间接共培养来鉴定抗癌作用,将包含具有各阿司匹林浓度的asp-vit.c-msc的插入式transwell(6孔)置于transwell(6孔)的下孔上,mcf-7和panc-1癌细胞各自附着于所述下孔,将细胞在包含10%fbs的dmem培养基中培养48小时,并收集癌细胞。用自动细胞计数器luna(logoy)测定收集的癌细胞的细胞数、活力和细胞大小。
结果是,与vit.c-msc相比,具有0.5mm阿司匹林浓度的asp-vit.c-msc展现出针对癌细胞(乳腺癌细胞(mcf-7)和胰腺癌细胞(panc-1)二者)增殖的优异抑制活性(图17至图19)。换言之,证实天使干细胞asp-vit.c-msc相对于vit.c-msc展现出优异的抗癌作用。
图17至图19的对照msc+癌细胞的msc是在包含0.2mm抗坏血酸的培养基中培养的有待用维生素c预处理的vit.c-msc。
7-2:癌症干细胞
通过使用允许双细胞培养的transwell间接共培养癌症干细胞和vit.c-msc,鉴定asp-vit.c-msc的抗癌作用。
首先,将以大小为200至400μm的球形形式培养的癌症干细胞以1.4x105个细胞接种于transwell(6孔)的下孔中,并将以1.4x105个细胞/孔接种有asp-vit.c-msc的插入式transwell(6孔)置于下孔上。以与实施例7-1相同的方式制备实施例1的在包含维生素c的培养基中培养的vit-c-msc。
在37℃下在co2培养箱中间接共培养48小时后,收集癌症干细胞,并测量总细胞数、活力和细胞大小,以比较性地分析天使msc针对癌症干细胞的抗癌活性。
实施例8:在包含阿司匹林的培养基中培养的vit.c-msc的基因表达分析
将实施例1的在包含维生素c的培养基中培养的vit.c-msc培养2天以进行粘附和稳定化,然后在补充有浓度为0.1mm、0.5mm和1mm的阿司匹林的新鲜培养基中培养24小时。接下来,鉴定了与抗癌机制有关的基因的表达,以及与细胞凋亡和血管生成有关的基因的表达。
将在t75烧瓶中培养的asp-vit.c-msc通过用0.25%胰蛋白酶/1mmedta处理来分离,用pbs洗涤,然后通过在1,500rpm离心5分钟收集。使用
将pcr产物在110v下用2.0%琼脂糖凝胶和1xtae试剂电泳1小时30分钟,然后用fuji分子成像软件成像。β-肌动蛋白用作对照基因。
为测定基因表达,用thunderbirdsybrqpcrmix(toyoboqps-201t)进行实时pcr。实时pcr是如下进行:使用abappliedbiosystems(stepone实时pcr系统,lifetechnologies)在该过程的40个循环重复的条件下进行,该过程包括用10μl的thunderbirdsybrqpcrmix、0.5μl的10μm引物fw(bioneer)、0.5μl的10μm引物rv(bioneer)和1μl的cdna使dna在95℃下变性15秒,并将引物在每个退火温度下加热60秒。
使用pikorealtm实时pcr(thermofisherscientific)仪器和maximasybr主混合物(x2)(thermopikoreal96)(thermo,#k0221)进行实时pcr。通过在95℃变性15秒、然后退火、并在60℃下延伸60秒进行pcr循环。这样的循环总共进行40次。表达水平的比较是通过使用管家基因的ct值(b-act)和靶基因的ct值进行相对比较以比较基因表达水平来进行的。
[表3]
实施例9:在包含阿司匹林的培养基中培养的vit.c-msc中的抗癌、细胞凋亡和血管生成相关基因的分析
9-1:通过fasl、trail和cxcr4基因表达分析鉴定抗癌机制
将实施例1的在包含维生素c的培养基中培养的vit.c-msc培养2天以进行粘附和稳定化,然后在补充有浓度为0.1mm、0.5mm和1mm的阿司匹林的新鲜培养基中培养24小时。
由于干细胞中表达的fasl与癌细胞的fas结合以通过细胞凋亡途径诱导癌细胞的细胞凋亡,因此可以鉴定参与癌细胞的细胞凋亡的fasl基因的表达。此外,包括这种fas的dr4/dr5属于fdaa(具有死亡结构域的fas相关蛋白),是参与细胞凋亡途径的受体,并且trail与称为“dr4/dr5”的受体结合,以诱导细胞凋亡。因此,除fasl之外还鉴定trail基因的表达。以与实施例8中相同的方式进行实时pcr(rt-pcr),并使用表3中列出的引物。
结果是,可以看出fasl和trail(是与参与癌细胞凋亡的抗癌机制相关的基因)的表达在包含浓度为0.5mm的阿司匹林的培养基中培养的vit.c-msc中最高(图21至图23)。也就是说,可以看出天使干细胞asp-vit.c-msc的抗癌作用在0.5mm阿司匹林的情况下是最好的。
另外,鉴定了充当归巢效应子的cxcr4基因的表达(图23)。结果是,发现在包含阿司匹林的培养基中培养的vit.c-msc通过与fasl、trail和cxcr4相关的途径具有抗癌活性。
9-2:通过vegf基因表达分析来鉴定癌细胞的血管生成
将实施例1的在包含维生素c的培养基中培养的vit.c-msc培养2天以进行粘附和稳定化,然后在补充有浓度为0.1mm、0.5mm和1mm的阿司匹林的新鲜培养基中培养24小时。
由于在干细胞中表达的vegf参与癌细胞的血管生成,因此可以鉴定vegf基因的表达。以与实施例8中相同的方式进行rt-pcr,并使用表3中列出的引物。
结果是,可以看出,参与癌细胞血管生成的vegf的表达在包含浓度为0.5mm的阿司匹林的培养基中培养的vit.c-msc中最低(图24)。也就是说,可以看出天使干细胞asp-vit.c-msc的抗癌作用在0.5mm阿司匹林的情况下是最好的。
9-3:致癌转化减少效应
在与实施例7相同的条件下,在msc与包含0.5mm阿司匹林的培养基中培养的vit-c-msc(天使干细胞)之间比较nrf2、c-myc和p21基因的表达水平。以与实施例8中相同的方式进行rt-pcr,并使用表3中列出的引物。
结果是,如图25所示,nrf2、c-myc和p21基因的表达水平均降低,这是表明在包含阿司匹林的培养基中培养的脂肪衍生的干细胞不含致癌转化的证据(juan等人,molecularcancer,13:20,2014)。p21基因的降低可指示干细胞变得更年轻。
此外,分析了sox2、oct4和nanog的表达,并在天使干细胞与msc之间进行比较以分析天使干细胞的干细胞特征。
结果是,天使干细胞以与msc相同的方式表达,并保持干细胞的特征(图26)。
实施例10:与在包含阿司匹林的培养基中培养的vit.c-msc间接共培养的癌细胞的基因表达分析
将在与实施例7相同的条件下在包含阿司匹林的培养基中培养的vit-c-msc(天使干细胞)与癌细胞间接共培养,并分析癌细胞中的基因表达。以与实施例8中相同的方式进行基因表达分析。
用于基因表达分析的各基因的引物显示在表3和表4中。
[表4]
10-1:癌细胞中细胞凋亡基因的表达
为鉴定在包含阿司匹林的培养基中培养的vit-c-msc(天使干细胞)对癌细胞增殖抑制的机制,分析了癌细胞中细胞凋亡相关因子的表达。
结果证实在间接共培养的乳腺癌和胰腺癌细胞中bcl-2表达降低(图27)。此外,证实了在间接共培养的乳腺癌细胞中ppar-γ和apaf-1的表达增加(图28和图29)。这指示与在包含阿司匹林的培养基中培养的vit.c-msc(天使干细胞)共培养可促进癌细胞的细胞凋亡。
10-2:天使干细胞对癌细胞转移的抑制作用
为鉴定在包含阿司匹林的培养基中培养的vit-c-msc(天使干细胞)针对癌细胞转移的抑制作用,分析了癌细胞中oct4基因的表达。用于分析的oct4引物与实施例9-3中的引物(表3)相同。
据报道,oct4用作癌症转移的指示物(liu等人,annsurg.253(6):1165-71,2011;hailin等人,molecularmedicinereports9:1335-1342,2014)。因此,在oct4的表达降低时,转移程度低。
从图30的结果可以看出,在间接共培养的乳腺癌和胰腺癌细胞中oct4表达降低。
实用性
由于根据本发明的用于产生间充质干细胞的包含维生素c和阿司匹林的培养基提供了如下间充质干细胞的生产,该间充质干细胞在保持其活性的同时抑制癌细胞增殖,因此这对于保护干细胞治疗剂免于癌症的安全性以及对于产生抗癌细胞治疗剂是非常有用的。
尽管已经详细描述了本发明的具体配置,但是本领域技术人员应理解,出于说明性目的,将本说明书作为优选实施方案提供,并且不应解释为限制本发明的范围。因此,本发明的实质范围由所附权利要求及其等同物限定。
将认为本领域技术人员容易使用本发明的改变和修改,并且此类改变和修改落入本发明的精神和范围内。
文本文件
参见所附的序列表。
<110>罗廷灿
<120>制备抑制癌细胞增殖的间充质干细胞的方法
<130>pp-b1748
<150>kr10-2016-0097107
<151>2016-07-29
<160>26
<170>kopatentin3.0
<210>1
<211>22
<212>dna
<213>人工序列
<220>
<223>htrail-f
<400>1
atggctatgatggaggtccagg22
<210>2
<211>23
<212>dna
<213>人工序列
<220>
<223>htrail-r
<400>2
tcagctcgttggtaaagtacacg23
<210>3
<211>20
<212>dna
<213>人工序列
<220>
<223>hfasl-f
<400>3
ctggggatgtttcagctctt20
<210>4
<211>21
<212>dna
<213>人工序列
<220>
<223>hfasl-r
<400>4
gtggcctatttgcttctccaa21
<210>5
<211>19
<212>dna
<213>人工序列
<220>
<223>hcxcr4-f
<400>5
gcggaaaaccaagacgctc19
<210>6
<211>20
<212>dna
<213>人工序列
<220>
<223>hcxcr4-r
<400>6
ttcatgtgcgcgtaactgtc20
<210>7
<211>20
<212>dna
<213>人工序列
<220>
<223>hvegf-a-f
<400>7
tgagcttcctacagcacaac20
<210>8
<211>21
<212>dna
<213>人工序列
<220>
<223>hvegf-a-r
<400>8
gaacgctccaggacttatacc21
<210>9
<211>20
<212>dna
<213>人工序列
<220>
<223>hnrf2-f
<400>9
accagtggatctgccaacta20
<210>10
<211>20
<212>dna
<213>人工序列
<220>
<223>hnrf2-r
<400>10
acgtagccgaagaaacctca20
<210>11
<211>20
<212>dna
<213>人工序列
<220>
<223>hc-myc-f
<400>11
aaggcccccaaggtagttat20
<210>12
<211>20
<212>dna
<213>人工序列
<220>
<223>hc-myc-r
<400>12
ttccgcaacaagtcctcttc20
<210>13
<211>20
<212>dna
<213>人工序列
<220>
<223>hp21-f
<400>13
tgtcttgtacccttgtgcct20
<210>14
<211>21
<212>dna
<213>人工序列
<220>
<223>hp21-r
<400>14
gcgtttggagtggtagaaatc21
<210>15
<211>19
<212>dna
<213>人工序列
<220>
<223>hsox2-f
<400>15
gcggaaaaccaagacgctc19
<210>16
<211>20
<212>dna
<213>人工序列
<220>
<223>hsox2-r
<400>16
ttcatgtgcgcgtaactgtc20
<210>17
<211>21
<212>dna
<213>人工序列
<220>
<223>hnanog-f
<400>17
tccaacatccrcaacctcagc21
<210>18
<211>20
<212>dna
<213>人工序列
<220>
<223>hnanog-r
<400>18
ccttctgcgtcacaccattg20
<210>19
<211>20
<212>dna
<213>人工序列
<220>
<223>hoct4-f
<400>19
cactgtactcggtccctttc20
<210>20
<211>21
<212>dna
<213>人工序列
<220>
<223>hoct4-r
<400>20
caggcacctcagtttgaatgc21
<210>21
<211>25
<212>dna
<213>人工序列
<220>
<223>hbcl2-f
<400>21
gggtacgataaccgggagatagtga25
<210>22
<211>20
<212>dna
<213>人工序列
<220>
<223>hbcl2-r
<400>22
ggaggagaagatgcccggtg20
<210>23
<211>20
<212>dna
<213>人工序列
<220>
<223>hppar-r-f
<400>23
ttagatgacagcgacttggc20
<210>24
<211>20
<212>dna
<213>人工序列
<220>
<223>hppar-r-r
<400>24
ggcttgtagcaggttgtctt20
<210>25
<211>22
<212>dna
<213>人工序列
<220>
<223>hapaf1-f
<400>25
cttcttccagtgtaaggacagt22
<210>26
<211>20
<212>dna
<213>人工序列
<220>
<223>hapaf1-r
<400>26
cagcctgccattccatgtat20
- 还没有人留言评论。精彩留言会获得点赞!