一种肽两亲分子及其制备方法与应用与流程
本发明属于生物化学领域,具体涉及一种肽两亲分子及其制备方法与应用。
背景技术:
随着抗生素的滥用,细菌耐药性不断增强,甚至出现多重耐药的“超级细菌”,致使很多抗生素失效,极大地威胁着人类的生命健康。由于传统的抗生素通常靶向于细菌内特定位置而起到杀菌效果,当细菌发生点突变就会造成抗生素失活。作为多细胞生命体天然免疫系统第一道防线的主要成分抗菌肽(Antimicrobial Peptides,AMPs),因其具有正电性和两亲性的特点,可以靶向和分解细菌细胞膜,减缓细菌耐药性的产生。另外,抗菌肽具有广谱抗菌性,对革兰氏阴性菌、革兰氏阳性菌以及真菌均有效。但目前抗菌肽的氨基酸序列较长,分子量较大,合成提纯的成本非常昂贵,且对蛋白酶敏感,限制了其在临床上的应用。因此有必要开发设计新型高效的抗菌剂,来降低细菌耐药性增加带来的危害。
技术实现要素:
本发明的目的是提供一种肽两亲分子及其制备方法与应用,该肽两亲分子可以有效降低成本、提高杀菌效率,并为开发高效的抗菌剂提供指导。
本发明提供的肽两亲分子,其结构式如式Ⅰ所示,
式Ⅰ中,R1为碳原子数为7~17的烷基,R2为碳原子数为8~18的烷基;n为2~8之间的任意整数。
上述的式Ⅰ所示化合物中,R1具体可为碳原子数为9~13的烷基,如碳原子数为11的烷基。
上述的式Ⅰ所示化合物中,R2具体可为碳原子数为10~14的烷基,如碳原子数为12的烷基。
上述的式Ⅰ所示化合物中,n具体可为2~6之间的任意整数,如2、4或6。
上述的式Ⅰ所示化合物具体可为下述式Ⅰ-A至式Ⅰ-C中的任一种:
本发明进一步提供了上述式Ⅰ所示化合物的制备方法,包括如下步骤:
(1)式Ⅱ所示化合物和R2-NH2经缩合反应,得到式Ⅲ所示化合物;R2-NH2中,R2同式Ⅰ;
式Ⅲ中,R2同式Ⅰ;
(2)式Ⅲ所示化合物脱去保护基Fmoc,得到式Ⅳ所示化合物;
式Ⅳ中,R2同式Ⅰ;
(3)式Ⅴ所示树脂在脱去保护基Fmoc后与R1-COOH经缩合反应,得到式Ⅵ所示树脂;R1-COOH中,R1同式Ⅰ;
式Ⅴ和式Ⅵ中,表示聚苯乙烯树脂;n同式Ⅰ;
式Ⅵ中,R1同式Ⅰ;
(4)式Ⅵ所示树脂裂解,得到式Ⅶ所示化合物;
式Ⅶ中,R1同式Ⅰ;n同式Ⅰ;
(5)式Ⅳ所示化合物与式Ⅶ所示化合物经缩合反应,得到式Ⅷ所示化合物;
式Ⅷ中,R1和R2同式Ⅰ;n同式Ⅰ;
(6)将式Ⅷ所示化合物脱去Boc保护基,得到式Ⅰ所示化合物。
上述的制备方法,步骤(1)中,所述式Ⅱ所示化合物与所述R2-NH2的摩尔比可为1:(1~1.3),具体可为1:1.1。
所述缩合反应可以二环己基碳二亚胺(DCC)和1-羟基苯并三唑(HOBT)为缩合剂;所述式Ⅱ所示化合物、所述二环己基碳二亚胺和所述1-羟基苯并三唑的摩尔比可为1:(1.1~1.3):(1.1~1.3),具体可为1:1.2:1.2。
所述缩合反应的温度可为室温20~30℃,具体可为25℃;时间可为24~48小时,具体可为48小时。
所述缩合反应在惰性气氛下进行,如氩气气氛。
所述缩合反应的溶剂可为二氯甲烷、二甲基甲酰胺和四氢呋喃中的任一种,优选二氯甲烷。
步骤(2)中,所述脱去保护基Fmoc在哌啶作用下进行;式Ⅲ所示化合物与所述哌啶的摩尔比可为1:(9.4~15.0)。
所述脱去保护基Fmoc的温度可为室温20~30℃,具体可为25℃;时间可为10~30分钟,具体可为20分钟。
所述脱去保护基Fmoc的溶剂可为二甲基甲酰胺(DMF)和二氯甲烷中的任一种。
步骤(3)中,所述脱去保护基Fmoc在哌啶作用下进行;所述树脂与所述哌啶的摩尔比可为1:(9.4~15.0)。
所述脱去保护基Fmoc的温度可为室温20~30℃,具体可为25℃;时间可为10~30分钟,具体可为30分钟。
所述脱去保护基Fmoc的溶剂可为二甲基甲酰胺(DMF)和二氯甲烷中的任一种。
所述脱去保护基Fmoc的式Ⅴ所示树脂与所述R1-COOH的摩尔比可为1:(2~5),具体可为1:3。
所述缩合反应在缩合剂O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸(TBTU)和N,N-二异丙基乙胺(DIPEA)存在的条件下进行,所述式Ⅴ所示树脂与所述O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸和所述N,N-二异丙基乙胺的摩尔比可为1:(2~5):(8~10),具体可为1:3:9。
步骤(4)中,以体积百分含量计,所述裂解所使用的裂解液可由10%乙酸、10%三氟乙醇和80%二氯甲烷组成;所述裂解的温度可为室温20~30℃,具体可为25℃;时间可为1.5~2小时,具体可为2小时。
步骤(5)中,式Ⅳ所示化合物与式Ⅶ所示化合物的摩尔比为1:(0.8~1.2),具体可为1:1。
所述缩合反应以1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、1-羟基苯并三唑(HOBT)和N,N-二异丙基乙胺(DIPEA)为缩合剂;所述式Ⅳ所示化合物与所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、所述1-羟基苯并三唑和所述N,N-二异丙基乙胺的摩尔比可为1:(1.4~1.8):(1.4~1.8):(2~4),具体可为1:1.6:1.6:3.1。
所述缩合反应的温度可为室温20~30℃,具体可为25℃;时间可为12~24小时,具体可为12小时。
步骤(6)中,所述脱去保护基Boc在三氟乙酸的作用下进行;所述式Ⅷ所示化合物与所述三氟乙酸的摩尔比可为1:(3~5),具体可为1:4。
所述脱去保护基Boc的温度可为室温20~30℃,具体可为25℃;时间可为1.5~2.5小时,具体可为2小时。
本发明还提供了式Ⅰ所示化合物的聚集体,它由上述式Ⅰ所示化合物组装而成。
上述的聚集体中,所述聚集体的尺寸可为微米级或纳米级。
上述的聚集体中,所述聚集体通过如下步骤制备得到:配制所述式Ⅰ所示化合物的溶液,得到所述式Ⅰ所示化合物的聚集体。
所述溶液中,式Ⅰ所示化合物的浓度可为0.68~32μM。
所述溶液中,溶剂可为水和磷酸盐缓冲液中的任一种。
上述的式Ⅰ所示化合物、式Ⅰ所示化合物的聚集体在下述A1)-A3)中至少一种中的应用,也在本发明的保护范围内:
A1)制备抗菌剂;
A2)抗菌;
A3)扦插、分解菌体细胞膜。
上述的应用中,所述菌可为细菌。
进一步地,所述细菌可为革兰氏阳性菌或革兰氏阴性菌。
更进一步地,所述革兰氏阳性菌可为金黄色葡萄球菌;所述革兰氏阴性菌可为大肠杆菌。
本发明也提供了一种抗菌剂,其活性成分为上述的式Ⅰ所示化合物或者式Ⅰ所示化合物的聚集体。
上述的抗菌剂,它可由所述式Ⅰ所示化合物和溶剂组成;
式Ⅰ所示化合物的浓度为0.68~32μM;
所述溶剂为水和磷酸盐缓冲液中的任一种。
上述的抗菌剂中,所述菌可为细菌。
进一步地,所述细菌可为革兰氏阳性菌或革兰氏阴性菌。
更进一步地,所述革兰氏阳性菌可为金黄色葡萄球菌;所述革兰氏阴性菌可为大肠杆菌。
本发明提供的gemini型肽两亲分子能高效抑制革兰氏阴性菌和革兰氏阳性菌且对正常细胞具有低毒性的原因是:革兰氏阴性菌细胞质膜外侧是由外膜和薄的肽聚糖交联网络组成细胞壁,其中外膜中的脂多糖和带负电的磷脂使其表面带负电荷。革兰氏阳性菌细胞质膜外侧的细胞壁是一厚层的肽聚糖形成的多孔网络,同时还有大量的磷壁酸使其表面带负电。因而,革兰氏阴性菌和革兰氏阳性菌相对于正常细胞表面具有更强的电负性,成为阳离子抗菌剂的靶向位点。式I所示的肽两亲分子在很低的浓度下就可以组装形成聚集体,正电荷密度较高的聚集体可以更好地靶向带负电的细菌。式I所示的肽两亲分子具有两条疏水尾链,与细菌细胞膜存在更强的疏水相互作用,更易于扦插、分解细胞膜。因而,式I所示的肽两亲分子可以更加高效地杀伤细菌。此外,通过调节赖氨酸的数目,式I所示的肽两亲分子氢键形成位点增多,头基间静电排斥增强,形成的聚集体尺寸变小,对细菌的杀伤作用增强。
本发明的优点在于提供一种新型的抗菌肽两亲分子,其gemini结构使抗菌肽两亲分子更易形成高正电荷密度的聚集体,同时强的疏水作用可以高效地靶向分解细菌细胞膜,减缓细菌耐药性的产生。式I所示肽两亲分子对革兰氏阴性细菌和革兰氏阳性细菌均具有较高杀伤效果,而对正常细胞的毒性较低,具有较好的选择性。本发明为开发高效低毒的抗菌剂提供了指导。
附图说明
图1为实施例1中式Ⅰ-A所示肽两亲分子的合成路线图;
图2为实施例1中式Ⅰ-B所示肽两亲分子的合成路线图;
图3为实施例1中式Ⅰ-C所示肽两亲分子的合成路线图;
图4是实施例2中的表面张力曲线图;
图5是实施例2中的聚集体粒径分布图;
图6是实施例3中的大肠杆菌杀伤效果与浓度关系图;
图7是实施例4中的肽两亲分子作用前后大肠杆菌表面形貌变化图;
图8是实施例5中的金黄色葡萄球菌杀伤效果与浓度关系图;
图9是实施例6中的细胞毒性与浓度关系图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
Fmoc-Lys(BOC)-OH,品牌Acros,货号为265220010。
Fmoc-Lys(BOC)-OH预载的二氯树脂购自上海吉尔生化,取代度为0.5mmol/g(订制产品)。
PBS为购自Hyclone厂家的货号为SH30256.01的产品。
四甲基偶氮唑盐(MTT)购自北京欣经科生物技术有限公司。
大肠杆菌(E.coli TOP10)购自天根生化科技(北京)有限公司。
金黄色葡萄球菌ATCC 6538购自中国普通微生物菌种保藏管理中心(CGMCC)。
表面张力测量在Dataphysics Instruments GmbH的DCAT11表面张力仪上进行。
电镜成像在扫描电子显微镜(购自Hitachi厂家,型号为S-4800)上进行。
聚集体尺寸和电荷采用Malven Zetasizer Nano-ZS仪器(ZEN 3600,Malven Instruments,Worcestershire,UK)检测。
其余的化学和生物试剂均为商购获得。
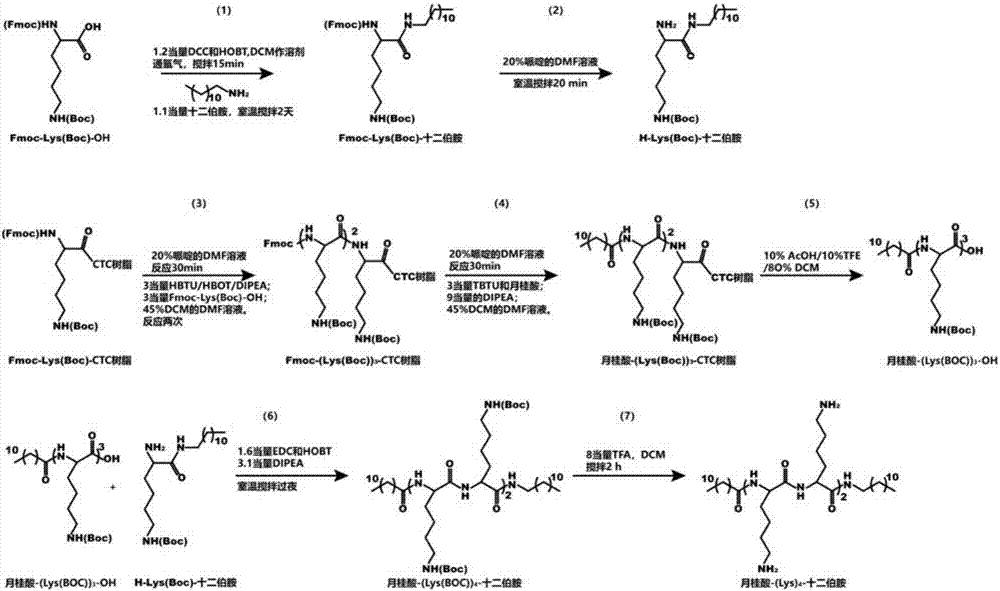
实施例1、合成肽两亲分子
一、合成式Ⅰ-A所示肽两亲分子(简写为12-(Lys)2-12,R1=11,R2=12,n=2)
按照图1所示路线图合成式Ⅰ-A所示肽两亲分子,具体步骤如下:
(1)Fmoc-Lys(BOC)-OH和十二伯胺缩合生成Fmoc-Lys(BOC)-十二伯胺,具体步骤如下:2.63mmol Fmoc-Lys(BOC)-OH与3.16mmol二环己基碳二亚胺(DCC)和3.6mmol 1-羟基苯并三唑(HOBT)溶解于20mL二氯甲烷(DCM)中。氩气氛围下搅拌15分钟后,加入2.89mmol十二伯胺,室温(25℃)条件下搅拌两天。真空抽滤,经硅胶柱纯化,淋洗剂为4:6的醋酸乙酯和环己烷。结构验证数据如下:1H NMR(400MHz):δ0.88(t,3H),1.25-1.32(m,22H),1.42(s,9H),1.53(m,2H),1.77(m,2H),3.18(t,4H),4.45(m,2H),4.70(d,2H),7.28(t,2H),7.55(d,2H),7.90(d,2H)。经验证,结构正确。
(2)在哌啶作用下脱去保护基Fmoc,生成H-Lys(BOC)-十二伯胺,具体步骤如下:将(1)中得到的产物,溶解到8mL含20%哌啶的二甲基甲酰胺(DMF)溶液中,室温(25℃)搅拌20分钟。采用制备薄层色谱法纯化,展开剂为10:6:3:1的甲苯、氯仿、2-丁酮和异丙醇。结构验证数据如下:1H NMR(400MHz):δ0.88(t,3H),1.24-1.32(m,22H),1.42(s,9H),1.53(m,2H),1.77(m,2H),3.18(t,4H),4.44(t,1H)。经验证,结构正确。
(3)采用Fmoc-Lys(BOC)-OH预载的二氯树脂(取代度为0.5mmol/g,即1g树脂上的Fmoc-Lys(BOC)-OH为0.5mmol),固相法合成月桂酸-Lys(BOC)-OH二氯树脂,具体步骤如下:取1mmol Fmoc-Lys(BOC)-OH的二氯树脂,加入10mL DMF,溶涨30分钟后抽滤。加入5mL 20%哌啶/DMF震荡反应30分钟,抽滤除去反应液,再用DMF洗涤树脂。然后依次加入3mmol的O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸(TBTU)、3mmol月桂酸和9mmol二异丙基乙胺(DIPEA)。反应40分钟后,用DMF洗涤树脂,洗净后再用甲醇洗涤树脂,抽滤,真空干燥。
(4)裂解树脂,获得月桂酸-Lys(BOC)-OH,具体步骤如下:加入10%乙酸(AcOH)/10%三氟乙醇(TFE)/80%DCM裂解液,裂解2h,抽滤,收集滤液进行旋蒸。硅胶色谱纯化。结构验证数据如下:1H NMR(400MHz):δ0.83(t,3H),1.25-1.30(m,18H),1.42-1.53(m,13H),1.76(m,2H),2.05(t,2H),3.18(t,2H),4.55(t,1H)。经验证,结构正确。
(5)月桂酸-Lys(BOC)-OH与H-Lys(BOC)-十二伯胺缩合生成月桂酸-(Lys(BOC))2-十二伯胺,具体步骤如下:1mmol H-Lys(BOC)-十二伯胺溶解于40mL无水DMF中,搅拌着加入1mmol月桂酸-Lys(BOC)-OH,1.6mmol的乙基二甲基胺丙基碳化二亚胺(EDC)和1.6mmol的HOBT和3mmol二异丙基乙胺(DIPEA)。搅拌过夜。反应液溶解于500mL乙酸乙酯中,然后依次用饱和NaHCO3、5%柠檬酸和浓盐水洗涤,有机相用硫酸镁干燥,过滤后旋干。
(6)脱Boc保护基,生成月桂酸-(Lys)2-十二伯胺,具体步骤如下:将0.5mmol的月桂酸-(Lys(BOC))2-十二伯胺溶解于60mL DCM,搅拌加入2mmol三氟乙酸(TFA)。反应2小时,旋蒸除去大部分溶剂,然后用乙酸乙酯萃取。乙酸乙酯相用10%碳酸钠和浓盐水冲洗。用无水硫酸钠干燥,最后用HPLC纯化样品(乙腈:水=20:80(0min)→60:40(40min))。结构验证数据如下:ESI-MS:C36H73N5O3的计算值[M+H]+=625.01,检测值[M+H]+=625.21;1H NMR(400MHz):δ0.86(t,6H),1.25-1.30(m,38H),1.36(m,8H),1.99(m,4H),2.11(t,2H),2.74(t,4H),3.02(t,2H),4.16(t,2H)。经验证,结构正确。
二、合成式Ⅰ-B所示肽两亲分子(简写为12-(Lys)4-12,R1=11,R2=12,n=4)
按照图2所示路线图合成式Ⅰ-B所示肽两亲分子,具体步骤如下:
(1)Fmoc-Lys(BOC)-OH和十二伯胺缩合剂生成Fmoc-Lys(BOC)-十二伯胺,具体步骤同一(1);
(2)在哌啶作用下脱去保护基Fmoc,生成H-Lys(BOC)-十二伯胺,具体步骤如下同一(2);
(3)采用Fmoc-Lys(BOC)-OH的二氯树脂,固相法合成Fmoc-(Lys(BOC))3-二氯树脂,具体步骤如下:取1mmol Fmoc-Lys(BOC)-OH的二氯树脂,加入10mL DMF,溶涨30分钟后抽滤。加入5mL 20%哌啶/DMF震荡反应30分钟,使赖氨酸的氨基裸露,抽滤除去反应液,再用DMF洗涤树脂。在反应器中加入3mmol Fmoc-Lys(Boc)-OH与3mmol HBTU/HBOT/DIPEA缩合剂,常温反应30分钟,用DMF洗涤树脂,洗净后再用甲醇洗涤树脂,抽滤。重复此步骤,至连接上第三个赖氨酸。
(4)固相法合成月桂酸-(Lys(BOC))3-二氯树脂,具体步骤同一(3);
(5)裂解树脂,获得月桂酸-(Lys(BOC))3-OH,具体步骤同一(4);结构验证数据如下:1H NMR(400MHz):δ0.85(t,3H),1.25-1.30(m,22H),1.42-1.53(m,33H),1.77(m,6H),2.05(t,2H),3.18(t,6H),4.44-4.55(t,3H)。经验证,结构正确。
(6)月桂酸-(Lys(BOC))3-OH与H-Lys(BOC)-十二伯胺缩合生成月桂酸-(Lys(Boc))4-十二伯胺,具体步骤同一(5);
(7)脱Boc保护基,生成月桂酸-(Lys)4-十二伯胺,具体步骤同一(6);仅将TFA的用量提高2倍。结构验证数据如下:ESI-MS:C48H97N9O5的计算值[M+2H]2+=441.18,检测值[M+2H]2+=441.05;1H NMR(400MHz):δ0.87(t,6H),1.29(m,32H),1.45-1.50(m,12H),1.62(m,2H),1.69-1.74(m,16H),2.31(t,2H),3.01(t,8H),3.20(t,2H),4.19-4.30(m,4H)。经验证,结构正确。
三、合成式Ⅰ-C所示肽两亲分子(简写为12-(Lys)6-12,R1=11,R2=12,n=6)
按照图3所示路线图合成式Ⅰ-C所示肽两亲分子,具体步骤如下:
(1)Fmoc-Lys(BOC)-OH和十二伯胺缩合剂生成Fmoc-Lys(BOC)-十二伯胺,具体步骤同一(1);
(2)在哌啶作用下脱去保护基Fmoc,生成H-Lys(BOC)-十二伯胺,具体步骤如下同一(2);
(3)采用Fmoc-Lys(BOC)-OH的二氯树脂,固相法合成Fmoc-(Lys(BOC))5-二氯树脂,具体步骤同二(3),重复此步骤,至连接上第五个氨基酸;
(4)固相法合成月桂酸-(Lys(BOC))5-二氯树脂,具体步骤同一(3);
(5)裂解树脂,获得月桂酸-(Lys(BOC))5-OH,具体步骤同一(4);结构验证数据如下:1H NMR(400MHz):δ0.88(t,3H),1.25-1.30(m,26H),1.42-1.55(m,55H),1.76(m,10H),2.05(t,2H),3.20(t,10H),4.44-4.55(t,5H)。
(6)月桂酸-(Lys(BOC))5-OH与H-Lys(BOC)-十二伯胺缩合生成月桂酸-(Lys(Boc))6-十二伯胺,具体步骤同一(5);
(7)脱Boc保护基,生成月桂酸-(Lys)6-十二伯胺,具体步骤同一(6),仅将TFA的用量提高3倍。结构验证数据如下:ESI-MS:C60H121N13O7的计算值[M+2H]2+=569.36,检测值[M+2H]2+=569.35;1H NMR(400MHz):δ0.84-0.87(t,6H),1.24(m,48H),1.52(m,14H),1.72(t,12H),1.97-2.00(t,2H),2.75(t,12H),3.02-3.12(t,2H),4.15-4.21(m,6H)。经验证,结构正确。
实施例2、制备肽两亲分子聚集体及其粒径分布测量
(1)临界聚集浓度的检测
两亲分子在空气水表面的吸附会降低水溶液的表面张力,随浓度的增加表面张力会急剧下降,到达一定浓度(临界聚集浓度),在空气水表面吸附达到饱和,在体相就会组装形成聚集体,表面张力不再降低。依据表面张力和浓度对数曲线,可确定两亲分子的临界聚集浓度。
配制不同浓度的式Ⅰ-A所示肽两亲分子的PBS溶液、不同浓度的式Ⅰ-B所示肽两亲分子的PBS溶液、不同浓度的式Ⅰ-C所示肽两亲分子的PBS溶液,采用DCAT11表面张力仪,使用19.90×0.20mm的吊片分别测定其表面张力。测量温度控制在25.00±0.01℃。每条表面张力曲线至少重复两遍。绘制表面张力与浓度间的曲线,如图4所示。
由图4可以确定,12-(Lys)2-12、12-(Lys)4-12和12-(Lys)6-12在PBS中具有超低的临界聚集浓度,分别为2.50、0.68和3.50μM,即在很低的浓度下就能形成聚集体。
(2)聚集体粒径分布
采用Malven Zetasizer Nano-ZS仪器分别测量25μM 12-(Lys)2-12、8μM12-(Lys)4-12、10μM 12-(Lys)6-12PBS溶液中的聚集体粒径分布。实验中以4mW He-Ne激光(λ=632.8nm)作为光源,采集173°背散射光强的变化,利用Contin方法拟合处理,得到的聚集体尺寸分布如图5所示。
由图5可知,随着12-(Lys)n-12中赖氨酸数目的增多(由2增大至6),聚集体的尺寸由几微米减小到几十纳米。尽管赖氨酸数目的增多,会使氢键形成位点增加,但头基间的静电排斥作用也相应增强,形成的聚集体尺寸变小。
实施例3、式I所示化合物对大肠杆菌的杀伤效果
(1)大肠杆菌悬液制备
取具有氨苄抗性的大肠杆菌(pcDNA3.1质粒转化TOP10,Ampr E.Coli)单克隆菌落加入10mL含50μg/mL的氨苄青霉素钠的LB液体培养基中,在37℃,180rpm下摇床振荡培养6-8h。取一定体积菌液,离心除去培养基(7100rpm,2min),用PBS洗涤2次,最后悬于PBS中并调菌液浓度为OD600=1.0,E.Coli的数目大约为108CFU/mL。
(2)给药
将E.Coli悬液(~2×107CFU/mL)与不同浓度的12-(Lys)n-12(n=2,4和6)PBS溶液在37℃下作用30min。
(3)平板法评估抗菌活性
将作用后的菌液用PBS稀释104倍。取100μL稀释菌液均匀涂于含有50μg/mL氨苄青霉素钠的LB固体培养基上(固体培养基平板规格为90mm),每个浓度均进行三次平行实验,然后在37℃下培养14-16h,统计菌斑个数。以下公式计算表面活性剂对E.Coli的杀菌活性:CFU reduction(%)=(A–B)/A×100,其中A为对照组菌落形成单位数(CFU),B为实验组的菌落形成单位数(CFU)。绘制CFU reduction(%)与浓度的关系曲线,如图6所示。
由图6可以确定,12-(Lys)2-12、12-(Lys)4-12和12-(Lys)6-12对大肠杆菌的最小抑菌浓度(MIC,即抑制90%细菌生长所需要的最低抗菌剂浓度)分别为27.0、6.4和7.5μM。这三种肽两亲分子的MIC均较低,且高于自身临界聚集浓度,即聚集体的形成可以有效地增强杀菌效果。
实施例4、式I所示化合物12-(Lys)n-12(n=2,4和6)对大肠杆菌的作用机理
将E.Coli悬液(~2×107CFU/mL)分别与30μM 12-(Lys)2-12、10μM 12-(Lys)4-12和10μM 12-(Lys)6-12的PBS溶液在37℃下作用30min。将作用后的菌液在7100rpm下离心5min,除去上清液,然后将菌体重新悬于灭菌水中。取5μL菌液滴于干净硅片上,在超净台中风干后立即将硅片浸于0.1%戊二醛水溶液中,在4℃冰箱中固定过夜。样品用灭菌水洗涤2次后,依次用50%、70%、90%和100%乙醇梯度脱水,每次6min。待样品自然干燥后,真空干燥1-2h,喷金处理后进行观察。12-(Lys)n-12(n=2,4和6)作用于大肠杆菌后,大肠杆菌形貌变化如图7所示。
由图7可知,加入肽两亲分子之前,大肠杆菌菌体完整,边缘清晰可见。12-(Lys)4-12几百纳米的聚集体和12-(Lys)6-12几十纳米的聚集体加入后,大肠杆菌菌膜塌陷、破裂,内部细胞质泄露导致细菌死亡。而12-(Lys)2-12微米级别的聚集体加入后,主要吸附在大肠杆菌表面,使大肠杆菌团聚,菌膜破裂的较少,杀死细菌需要的浓度较高。也就是说,聚集体尺寸的大小会影响肽两亲分子扦插、分解细胞膜,进而影响杀菌效果。
实施例5、式I所示化合物12-(Lys)2-12对金黄色葡萄球菌的杀伤效果
(1)葡萄球菌悬液制备
取单克隆菌落加入10mL NB液体培养基中,在37℃,180rpm下摇床振荡培养6-8h。取一定体积菌液,离心除去培养基(7100rpm,2min),用PBS洗涤2次,最后悬于PBS中并调菌液浓度为OD600=1.0,S.aureus的数目大约为5×108CFU/mL。
(2)给药
将S.aureus悬液(~108CFU/mL)与不同浓度的12-(Lys)2-12PBS溶液在37℃下作用30min。
(3)平板法评估抗菌活性
将作用后的菌液用PBS稀释104倍。取100μL稀释菌液均匀涂于含有100μg/mL NB固体培养基上(固体培养基平板规格为90mm),每个浓度均进行三次平行实验,然后在37℃下培养14-16h,统计菌斑个数。根据以下公式计算表面活性剂对S.aureus的杀菌活性:CFU reduction(%)=(A–B)/A×100,其中A为对照组菌落形成单位数(CFU),B为实验组的菌落形成单位数(CFU)。绘制CFU reduction(%)与浓度的关系曲线,如图8所示。
由图8可以确定,12-(Lys)2-12对金黄色葡萄球菌的最小抑菌浓度MIC为22.2μM。也就是说,12-(Lys)2-12对革兰氏阳性菌和革兰氏阴性菌均具有较好的杀伤效果。
实施例6、式I所示化合物12-(Lys)n-12(n=2,4和6)的低细胞毒性
将对数生长期的HaCaT细胞通过细胞计数板计数后,以细胞密度为6×103个/孔,种于96孔细胞培养板,然后放入5%CO2、37℃恒温培养箱培养12-24h使其贴壁,分别加入不同浓度(0–64μM)的12-(Lys)n-12(n=2,4和6),每组均做6个平行孔,每孔终体积为100μL,在37℃恒温培养箱作用24h。去除培养基后,每孔加入100μL0.5mg/mL MTT,继续在37℃下培养4h,去除上清液,每孔加入100μL DMSO后,将96孔板放入酶标仪中,先振荡5min充分溶解生成的蓝紫色甲瓒颗粒,测定520nm处的吸光度。根据以下公式计算细胞存活率:Cell viability(%)=A/A0×100,其中A0为对照组(不加脂肽)吸光度值,A为实验组吸光度值。细胞存活率与浓度间的关系,如图9所示。
由图9可知,当12-(Lys)4-12和12-(Lys)6-12浓度达到5倍MIC时,对HaCat细胞仍然没有表现出明显的细胞毒性。这可能是因为细菌表面的负电荷要强于哺乳动物细胞,聚集体与细菌间的静电作用要强于与HaCat细胞的,因而12-(Lys)4-12和12-(Lys)6-12表现出优异的抗菌活性而无明显细胞毒性。而12-(Lys)2-12在MIC浓度下就表现出一定的细胞毒性,形成的聚集体尺寸较大,使其对细胞也具有较强的相互作用,造成其较高的细胞毒性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺