聚醚-b-聚(γ-丁内酯)嵌段共聚物及其制备方法与流程
本发明涉及化工领域。具体地,本发明涉及聚醚-b-聚(γ-丁内酯)嵌段共聚物及其制备方法。
背景技术:
两亲性嵌段共聚物是一类重要的高分子材料,其在水溶液中能够自组装形成胶束、囊泡或水凝胶,在生物医用领域具有重要的用途,包括药物递送、基因转染、组织工程修复等。其中,聚环氧乙烷(peg)常被用作其中的亲水链段。peg已经通过美国食品药品监督管理局(fda)的批准,可以在临床上使用。peg包裹的药物可以显著延长药物在血液中的循环时间,同时降低免疫系统的内吞作用。而脂肪族聚酯具有良好的生物相容性和生物可降解性,低的免疫源性和良好的力学性能,是疏水链段的理想选择。
然而,目前聚环氧乙烷-脂肪族聚酯嵌段共聚物仍有待开发。
技术实现要素:
本发明旨在至少在一定程度上解决现有技术问题至少之一。
需要说明的是,本发明是基于发明人的下列发现而完成的:
聚(γ-丁内酯)是一类重要的脂肪族聚酯,具有以下优点:γ-丁内酯可以从丁二酸制备得到,来源广泛,价格低廉。丁二酸可以从生物质原料,如玉米、小麦等作物得到,是一种可再生原材料。聚(γ-丁内酯)在体内具有合适的降解速率,介于聚乙交酯和聚乳酸之间,但与聚乙交酯和聚乳酸不同,聚(γ-丁内酯)在降解时不会造成酸性物质在组织中的积累,不易引发炎症,因此特别适合用于生物医用领域。目前,聚(γ-丁内酯)已经获得fda的批准,可以作为手术缝合线和疝气补片在临床上使用。
然而,γ-丁内酯具有五元环结构,环张力较小,难以通过开环聚合的方法得到高分子量的聚(γ-丁内酯)。目前商品化使用的聚(γ-丁内酯)主要是通过生物发酵的方法得到,这就导致难以通过化学修饰的方法制备具有复杂结构γ-丁内酯与其他单体的共聚物。
有鉴于此,发明人尝试利用端羟基聚醚作为大分子引发剂,在催化剂或碱金属或碱金属化合物或碱金属烷氧基化合物的催化作用下,通过筛选合适的反应条件,在低温下成功得到了聚醚-b-聚(γ-丁内酯)嵌段共聚物。特别地,低温条件能够有效地减少聚合过程中体系熵效应的影响,是保证聚合成功的重要条件。需要指出的是,本发明首次得到了具有两亲性的聚醚-b-聚(γ-丁内酯)嵌段共聚物,预期在药物递送、组织工程修复等生物医药领域有巨大的应用前景。与现有的聚醚-b-聚酯体系相比,聚醚-b-聚(γ-丁内酯)嵌段共聚物在体内的降解速率更加合适,同时不易造成体内炎症的发生,是一种更加理想的医用生物材料。
为此,在本发明的一个方面,本发明提出了一种化合物。根据本发明的实施例,所述化合物为式(i)所示的化合物或式(i)所示化合物的立体异构体、几何异构体、互变异构体、氮氧化物、水合物或溶剂化物,
其中,
r选自烷基、烯基、炔基、烷氧基、烷氨基、环烷基、杂环基、芳基、杂芳基、稠合双环基、螺双环基、稠合杂双环基、螺杂双环基或式(ⅱ)所示的基团,
r1选自氢或下列之一的基团:
r2选自下列之一的基团:
r3和r4分别独立地选自烷基、烯基、烷氧基、烷氨基、环烷基、杂环基、芳基或杂芳基,
x、y和n分别独立地选自不小于5的自然数。
本发明的化合物是由聚醚和聚(γ-丁内酯)形成的嵌段共聚物。该嵌段共聚物是由端羟基聚醚引发,当端羟基聚醚为单端羟基,得到聚醚-b-聚(γ-丁内酯)两嵌段共聚物;当端羟基聚醚为双端端羟基,则以聚醚为轴,左右对称形成聚(γ-丁内酯)-b-聚醚-b-聚(γ-丁内酯)三嵌段共聚物。本发明首次得到了具有两亲性的聚醚-b-聚(γ-丁内酯)嵌段共聚物,预期在药物递送、组织工程修复等生物医药领域有巨大的应用前景。与现有的聚醚-b-聚酯体系相比,聚醚-b-聚(γ-丁内酯)嵌段共聚物在体内的降解速率更加合适,同时不易造成体内炎症的发生,是一种更加理想的医用生物材料。
根据本发明的实施例,上述化合物还可以具有下列附加技术特征:
根据本发明的实施例,r3和r4分别独立地选自下列之一的基团:
根据本发明的实施例,所述化合物具有下列之一的结构:
其中,各r5分别独立地选自氢、甲基或者乙基。
根据本发明的实施例,所述化合物具有下列之一的结构:
在本发明的另一方面,本发明提出了一种制备前面所述化合物的方法。根据本发明的实施例,所述方法包括:
(1)将催化剂或碱金属或碱金属化合物或碱金属烷氧基化合物与端羟基聚醚溶于有机溶剂中,以便得到混合液;
(2)将γ-丁内酯与所述混合液混合,并进行反应,加入含活性官能团的化合物终止反应,将反应混合物加入甲醇中,收集沉淀,以便获得所述化合物,其中,所述反应是在-70~-20℃下进行的。
发明人尝试利用端羟基聚醚作为大分子引发剂,在催化剂或碱金属或碱金属化合物或碱金属烷氧基化合物的催化作用下,通过筛选合适的反应条件,在低温下(-70~-20℃)成功得到了聚醚-b-聚(γ-丁内酯)两嵌段共聚物。特别地,低温条件能够有效地减少聚合过程中体系熵效应的影响,是保证聚合成功的重要条件。本方法产率较高,且产物纯度较好,操作简便,适于规模化生产。同时,需要指出的是,本发明首次得到了具有两亲性的聚醚-b-聚(γ-丁内酯)嵌段共聚物,预期在药物递送、组织工程修复等生物医药领域有巨大的应用前景。与现有的聚醚-b-聚酯体系相比,聚醚-b-聚(γ-丁内酯)嵌段共聚物在体内的降解速率更加合适,同时不易造成体内炎症的发生,是一种更加理想的医用生物材料。
根据本发明的实施例,所述催化剂选自有机磷腈碱催化剂,优选六[三(二甲基胺)磷氮烯]三聚磷腈、磷腈配体p4-叔丁基或磷腈配体p2-叔丁基。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
根据本发明的实施例,所述碱金属选自钠或钾,所述碱金属化合物选自氢化钠、氢化钾、萘钠、萘钾、联苯钠、二苯甲基钠或二苯甲基钾。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
根据本发明的实施例,所述碱金属烷氧基化合物选自甲醇钾、甲醇钠、乙醇钠或乙醇钾。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
根据本发明的实施例,所述端羟基聚醚选自聚环氧乙烷单甲醚、聚环氧丙烷单甲醚、聚(1,2-环氧丁烷)单甲醚、聚环氧乙烷、聚环氧丙烷、聚(1,2-环氧丁烷)、聚环氧乙烷-b-聚环氧丙烷-b-聚环氧乙烷或聚(环氧乙烷-ran-环氧丙烷)。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
根据本发明的实施例,所述含活性官能团化合物选自酸、酰氯、酸酐、硫代异氰酸酯、异氰酸酯或卤代烃,优选乙酸、苯甲酸、丙烯酰氯、甲基丙烯酰氯、醋酸酐、丁二酸酐、马来酰亚胺基丁酰氯、环氧氯丙烷、3-氯丙烯、3-氯丙炔、4-甲氧基苯基硫代异氰酸酯、4-甲氧苯基异氰酸酯。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
根据本发明的实施例,所述方法包括:(1-1)将端羟基聚醚和催化剂溶于有机溶剂中,置于低温冷浴搅拌;(1-2)将γ-丁内酯加入步骤(1-1)所得到的混合溶液中,进行反应,加入含活性官能团的化合物终止反应,将反应混合物加入甲醇中,收集沉淀,以便获得所述化合物,其中,所述催化剂与端羟基聚醚的摩尔比例为1:3~2:1;所述有机溶剂选自四氢呋喃、二氯甲烷、三氯甲烷、1,1-二氯乙烷、1,2-二氯乙烷、1,1,2,2-四氯乙烷、乙腈和二氧六环的至少之一;所述低温冷浴搅拌是在-70~-10℃下进行10~30min。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
根据本发明的实施例,所述方法包括:(2-1)将端羟基聚醚和碱金属或碱金属化合物溶于有机溶剂中,在氮气保护下进行反应,过滤后得到聚醚碱金属盐溶液;(2-2)将所述聚醚碱金属盐溶液和γ-丁内酯溶于有机溶剂中,进行反应,加入含活性官能团的化合物终止反应,将反应混合物加入甲醇中,收集沉淀,以便获得所述化合物,其中,所述端羟基聚醚与碱金属或碱金属化合物的摩尔比例为1:1~1:10;步骤(2-1)中,所述反应的温度为25~70℃,时间为0.5~72h,所述有机溶剂选自四氢呋喃或二氧六环;步骤(2-2)中,所述有机溶剂选自四氢呋喃、二氯甲烷、三氯甲烷、1,1-二氯乙烷、1,2-二氯乙烷、1,1,2,2-四氯乙烷、乙腈和二氧六环的至少之一;所述聚醚碱金属盐与γ-丁内酯的摩尔比例为1:10~1:200。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
根据本发明的实施例,所述方法包括:(3-1)将端羟基聚醚和碱金属烷氧基化合物溶于有机溶剂中,置于低温冷浴搅拌;(3-2)将γ-丁内酯加入步骤(3-1)所得到的混合溶液中,进行反应,加入含活性官能团的化合物终止反应,将反应混合物加入甲醇中,收集沉淀,以便获得所述化合物,其中,所述碱金属烷氧基化合物与端羟基聚醚的摩尔比例为1:1~2:1;所述有机溶剂选自四氢呋喃、二氯甲烷、三氯甲烷、1,1-二氯乙烷、1,2-二氯乙烷、1,1,2,2-四氯乙烷、乙腈和二氧六环的至少之一;所述低温冷浴搅拌是在-70~-10℃下进行10~30min。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
根据本发明的实施例,所述端羟基聚醚的分子量为200~40000g/mol,所述端羟基聚醚与γ-丁内酯的摩尔比例为1:10~1:200;所述γ-丁内酯在体系中的摩尔浓度为2~10mol/l;所述含活性官能团化合物与端羟基聚醚的摩尔比例为1:1~10:1;所述反应是在-70~-20℃下进行0.5~12h。发明人经过大量实验发现,在此条件下所得到的化合物产率较高,纯度较好。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
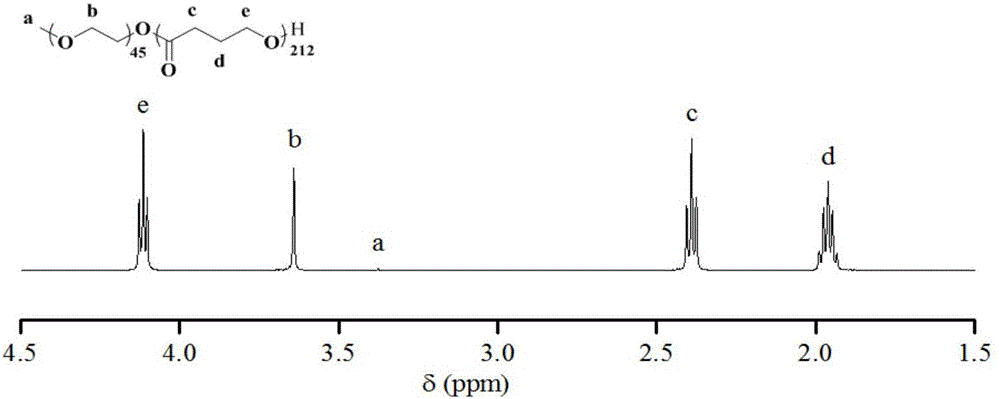
图1为实施例1中制得的聚环氧乙烷-b-聚(γ-丁内酯)的1hnmr谱图;
图2为实施例2中制得的聚环氧乙烷-b-聚(γ-丁内酯)的1hnmr谱图;
图3为实施例3中制得的聚环氧乙烷-b-聚(γ-丁内酯)的1hnmr谱图;
图4为实施例1中制得的聚环氧乙烷-b-聚(γ-丁内酯)的13cnmr谱图;
图5为实施例1中制得的聚环氧乙烷-b-聚(γ-丁内酯)与peg2000的gpc谱图;
图6为实施例2中制得的聚环氧乙烷-b-聚(γ-丁内酯)与peg2000的gpc谱图;
图7为实施例3中制得的聚环氧乙烷-b-聚(γ-丁内酯)与peg5000的gpc谱图;
图8为实施例4中制得的聚环氧乙烷-b-聚(γ-丁内酯)与peg2000的gpc谱图;
图9为实施例5中制得的聚环氧乙烷-b-聚(γ-丁内酯)与peg2000的gpc谱图;
图10为实施例1中制得的聚环氧乙烷-b-聚(γ-丁内酯)的红外谱图;
图11为实施例3中制得的聚环氧乙烷-b-聚(γ-丁内酯)的红外谱图。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
定义和一般术语
在本发明的上下文中,所有在此公开了的数字均为近似值。每一个数字的数值有可能会出现1%、2%、5%、7%、8%或10%等差异。每当公开一个具有n值的数字时,任何具有n+/-1%,n+/-2%,n+/-3%,n+/-5%,n+/-7%,n+/-8%或n+/-10%值以内的数字会被明确地公开,其中“+/-”是指加或减。每当公开一个数值范围中的一个下限,dl,和一个上限,du,时,任何处于该公开了的范围之内的数值会被明确地公开。
本发明所述的所有反应步骤反应到一定程度如原料消耗大约大于70%,大于80%,大于90%,大于95%,或经检测反应原料已经消耗完毕后进行后处理,如冷却、收集、提取、过滤、分离、净化处理或其组合。可以通过常规的方法如薄层层析法(tlc)、高效液相色谱法(hplc)、气相色谱法(gc)等方法检测反应程度。可以采用常规的方法对反应溶液进行后处理,例如,通过减压蒸发或常规蒸馏反应溶剂后收集粗产物,直接投入下一步反应;或直接过滤得到粗产物,直接投入下一步反应;或静置后,倾倒出上层清液得到粗产物,直接投入下一步反应;或选择适当的有机溶剂或其组合进行萃取、蒸馏、结晶、柱层析、润洗、打浆等纯化步骤。
现在详细描述本发明的某些实施方案,其实例由随附的结构式和化学式说明。本发明意图涵盖所有的替代、修改和等同技术方案,它们均包括在如权利要求定义的本发明范围内。本领域技术人员应认识到,许多与本文所述类似或等同的方法和材料能够用于实践本发明。本发明绝不限于本文所述的方法和材料。在所结合的文献、专利和类似材料的一篇或多篇与本申请不同或相矛盾的情况下(包括但不限于所定义的术语、术语应用、所描述的技术,等等),以本申请为准。
应进一步认识到,本发明的某些特征,为清楚可见,在多个独立的实施方案中进行了描述,但也可以在单个实施例中以组合形式提供。反之,本发明的各种特征,为简洁起见,在单个实施方案中进行了描述,但也可以单独或以任意适合的子组合提供。
除非另外说明,本发明所使用的所有科技术语具有与本发明所属领域技术人员的通常理解相同的含义。本发明涉及的所有专利和公开出版物通过引用方式整体并入本发明。
除非另外说明,应当应用本文所使用的下列定义。出于本发明的目的,化学元素与元素周期表cas版,和《化学和物理手册》,第75版,1994一致。此外,有机化学一般原理可参考"organicchemistry",thomassorrell,universitysciencebooks,sausalito:1999,和"march'sadvancedorganicchemistry”bymichaelb.smithandjerrymarch,johnwiley&sons,newyork:2007中的描述,其全部内容通过引用并入本文。
术语“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
“立体异构体”是指具有相同化学构造,但原子或基团在空间上排列方式不同的化合物。立体异构体包括对映异构体、非对映异构体、构象异构体(旋转异构体)、几何异构体(顺20/反)异构体、阻转异构体,等等。
本发明所使用的立体化学定义和规则一般遵循s.p.parker,ed.,mcgraw-hilldictionaryofchemicalterms(1984)mcgraw-hillbookcompany,newyork;andeliel,e.andwilen,s.,“stereochemistryoforganiccompounds”,johnwiley&sons,inc.,newyork,1994。
术语“互变异构体”或“互变异构形式”是指具有不同能量的可通过低能垒(lowenergybarrier)互相转化的结构异构体。若互变异构是可能的(如在溶液中),则可以达到互变异构体的化学平衡。除非另外指出,本发明化合物的所有互变异构体形式都在本发明的范围之内。
本发明的“溶剂化物”是指一个或多个溶剂分子与本发明的化合物所形成的缔合物。形成溶剂化物的溶剂包括,但并不限于,水,异丙醇,乙醇,甲醇,二甲亚砜,乙酸乙酯,25乙酸,氨基乙醇。
本发明的“氮氧化物”是指当化合物含几个胺官能团时,可将1个或大于1个的氮原子氧化形成n-氧化物。n-氧化物的特殊实例是叔胺的n-氧化物或含氮杂环氮原子的n-氧化物。可用氧化剂例如过氧化氢或过酸(例如过氧羧酸)处理相应的胺形成n-氧化物(参见advancedorganicchemistry,wileyinterscience,第4版,jerrymarch,pages)。
本发明的结构式中的符号“ran”是指无规共聚物(randomcopolymer),即单体m1,m2在大分子链上无规排列,两单体在主链上呈随机分布,没有一种单体能在分子链上形成单独的较长链段。
本发明使用的术语“烷基”包括饱和直链或支链的单价烃基,其中烷基可以独立任选地被一个或多个本发明所描述的取代基所取代。其中一些实施例是,烷基基团含有1-10个碳原子;另外一些实施例是,烷基基团含有1-8个碳原子;另外一些实施例是,烷基基团含有1-6个碳原子,另外一些实施例是,烷基基团含有1-4个碳原子;另外一些实施例是,烷基基团含有1-3个碳原子。烷基基团更进一步的实例包括,但并不限于,甲基,乙基,正丙基,异丙基,正丁基,2-甲基丙基或异丁基,1-甲基丙基或仲丁基,叔丁基,正戊基,2-戊基,3-戊基,2-甲基-2-丁基,3-甲基-2-丁基,3-甲基-1-丁基,2-甲基-1-丁基,正己基,2-己基,3-己基,2-甲基-2-戊基,3-甲基-2-戊基,4-甲基-2-戊基,3-甲基-3-戊基,2-甲基-3-戊基,2,3-二甲基-2-丁基,3,3-二甲基-2-丁基,正庚基,正辛基,等等。术语“烷基”和其前缀“烷”在此处使用,都包含直链和支链的饱和碳链。烷基可以被本发明所述的取代基所取代。
本发明中所使用的术语“烷氧基”,涉及到烷基,像本发明所定义的,通过氧原子连接到主要的碳链上。这样的实施例包括,但并不限于,甲氧基,乙氧基,丙氧基等等。烷氧基可以被本发明所述的取代基所取代。
术语“环烷基”或“碳环”是指一价或多价,非芳香族,饱和或部分不饱和环,且不包含杂原子,其中包括3~12个碳原子的单环或3~12个碳原子的二环或三环。合适的环烷基基团包括,但并不限于,环烷基,环烯基和环炔基。环烷基基团的实例进一步包括,但绝不限于,环丙基,环丁基,环戊基,1-环戊基-1-烯基,1-环戊基-2-烯基,1-环戊基-3-烯基,环己基,1-环己基-1-烯基,1-环己基-2-烯基,1-环己基-3-烯基,环己二烯基等等。视结构而定,环烷基可为单价基团或二价基团,即亚环烷基。c4环烷基是指环丁基,c5环烷基是指环戊基,c7环烷基是指环庚基。环烷基可以被本发明所述的取代基所取代。
术语“芳基”可以是单环、双环和三环的碳环体系,其中,至少一个环体系是芳香族的,其中每一个环体系包含6~8个原子,且只有一个附着点与分子的其余部分相连。术语“芳基”可以和术语“芳香环”交换使用,如芳香环可以包括苯基,萘基和蒽。视结构而定,芳基可为单价基团或二价基团,即亚芳基。芳基可以被本发明所述的取代基所取代。
术语“杂芳基”,“杂芳环”在此处可交换使用,都是指单环,双环,三环或者四环体系,其中,双环杂芳环,三环杂芳环或者四环杂芳环体系以稠合的形式成环。其中,杂芳环体系至少一个环体系是芳香族的,环上一个或多个原子独立任选地被杂原子所取代。杂芳体系可以在任何杂原子或者碳原子上连接到主结构上从而形成稳定的化合物。杂芳体系基团可以是3-7个原子组成的单环。
另外一些实施例是,杂芳体系(包含杂芳基,杂芳环)包括以下例子,但并不限于这些例子:呋喃-2-基,呋喃-3-基,n-咪唑基,咪唑-2-基,咪唑-4-基,咪唑-5-基,异噁唑-3-基,噁唑-4-基,噁唑-5-基,4-甲基异噁唑-5-基,n-吡咯基,吡咯-2-基,吡咯-3-基,吡啶-2-基,吡啶-3-基,嗪基,噻唑-2-基,四唑基,三唑基等。杂芳基可以被本发明所述的取代基所取代。
“杂环基”可以是碳基或杂原子基。“杂环基”同样也包括杂环基团与饱和或部分不饱和碳环或杂环并合所形成的基团。杂环的实例包括,但并不限于,吡咯烷基,四氢呋喃基,二氢呋喃基,四氢噻吩基,四氢吡喃基,二氢吡喃基,四氢噻喃基,哌啶基,噻噁烷基,氮杂环丁基,硫杂环丁基,哌啶基,环氧丙基,氮杂环庚基,氧杂环庚基,硫杂环庚基,n-吗啉基,2-吗啉基,3-吗啉基,硫代吗啉基,n-哌嗪基,2-哌嗪基,3-哌嗪基,高哌嗪基,氧氮杂卓基,二氮杂卓基,硫氮杂卓基,吡咯啉-1-基,2-吡咯啉基,3-吡咯啉基,二氢吲哚基,二氢吲哚基,吲哚嗪基,吲哚基,异苯并四氢呋喃基,异苯并四氢噻嗯基。
在一些实施例中,杂环基为1~12个原子组成的杂环基,是指包含1~12个环原子的饱和或部分不饱和的单环,其中至少一个环原子选自氮、硫和氧原子。1~12个原子组成的杂环基的实例包括,但不限于,氮杂环丁基,氧杂环丁基,吡咯烷基,2-吡咯啉基,吡唑啉基,吡唑烷基,咪唑啉基,咪唑烷基,四氢呋喃基,二氢呋喃基,四氢噻吩基,二氢噻吩基,1,3-二氧环戊基,二硫环戊基,四氢吡喃基,二氢吡喃基,四氢噻喃基,哌啶基,等等。
术语“螺环基”,“螺环”,“螺双环基”,“螺双环”表示一个环起源于另一个环上特殊的环状碳。例如,像下面所描述的,一个饱和的桥环体系(环d和b')被称为“稠合双环”,反之环a’和环d在两个饱和的环体系中共享一个碳原子,则被称为“螺环”。螺环里面的每一个环要么是碳环要么是杂脂环族。这样的实例包括,但并不限于,螺[2.4]庚烷-5-基,螺[4.4]壬烷基,等。
术语“螺杂双环基”表示一个环起源于另一个环上特殊的环状碳。例如,像上面所描述的,一个饱和的桥环体系(环d和b')被称为“稠合双环”,反之环a’和环d在两个饱和的环体系中共享一个碳原子,则被称为“螺环”。且至少一个环体系包含一个或多个杂原子,这样的实例包括,但并不限于4-氮杂螺[2.4]庚烷基,4-氧杂螺[2.4]庚烷基,5-氮杂螺[2.4]庚烷基,2-氮杂螺[4.5]癸烷基,2-氮杂螺[3.3]庚烷基,1,7-二氮杂螺[4.4]壬烷基,1,7-二氮杂螺[4.4]壬烷-6-酮-基,2,9-二氮杂螺[5.5]十一烷-1-酮-基,1-氧-3,8-二氮杂螺[4.5]癸烷-2-酮-基,1-氧-3,7-二氮杂螺[4.5]癸烷-2-酮-基,2,6-二氮杂螺[3.3]庚烷基,2-氧-7-氮杂螺[3.5]壬烷基,2-氧-6-氮杂螺[3.4]辛烷基等。视结构而定,螺杂双环基可为单价基团或二价基团,即亚螺杂双环基。螺杂环基可以被本发明所述的取代基所取代。
术语“稠合双环”,“稠环”,“稠合双环基”或“稠环基”表示饱和或不饱和的稠环体系,涉及到非芳香族的双环体系,至少有一个环是非芳香性的。这样的体系可以包含独立的或共轭的不饱和状态,但其核心结构不包含芳香环或芳杂环。稠合双环中的每一个环要么是碳环要么是杂脂环族,这样的实例包括,但并不限于,六氢-呋喃[3,2-b]呋喃基,2,3,3a,4,7,7a-六氢-1h-茚基,7-氮杂双环[2.2.1]庚烷基,稠合双环[3.3.0]辛烷基,稠合双环[3.1.0]己烷基,1,2,3,4,4a,5,8,8a-八氢萘基,这些都包含在稠合双环的体系之内。
术语“稠合杂双环基”表示饱和或不饱和的稠环体系,涉及到非芳香族的双环体系,至少有一个环是非芳香性的。这样的体系可以包含独立的或共轭的不饱和状态,但其核心结构不包含芳香环或芳杂环(但是芳香族可以作为其上的取代基),且至少一个环体系包含一个或多个杂原子。
实施例1
将(0.075mmol,150mg)聚环氧乙烷单甲醚(peg2000,平均分子量mn=2000g/mol)和(0.05mmol,60mg)六[三(二甲基胺)磷氮烯]三聚磷腈加入反应管中,置于-40℃低温冷浴中,加入1.2ml二氯甲烷,搅拌10min使体系混合均匀,置于-50℃低温冷浴中,用注射器将1.15mlγ-丁内酯加入到反应管中。反应在氮气保护下进行4h,加入乙酸(0.15mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚环氧乙烷-b-聚(γ-丁内酯),结构如下所示:
核磁氢谱1hnmr(500mhz,cdcl3)δ(ppm):4.11(425h,t),3.65(180h,s),3.38(3h,s),2.39(426h,t),1.96(438h,m)。核磁碳谱13cnmr(126mhz,cdcl3)δ(ppm):172.6,70.48,63.44,30.56,23.89。gpc测得数均分子量为16.5kg/mol,分子量分布为1.33。所得嵌段共聚物核磁氢谱如图1所示,碳谱如图4所示,gpc曲线如图5所示,红外谱图如图10所示。
实施例2
将(0.075mmol,150mg)聚环氧乙烷单甲醚(peg2000,平均分子量mn=2000g/mol)和(0.05mmol,60mg)六[三(二甲基胺)磷氮烯]三聚磷腈加入反应管中,置于-40℃低温冷浴中,加入0.6ml二氯甲烷,搅拌10min使体系混合均匀,置于-50℃低温冷浴中,用注射器将0.57mlγ-丁内酯加入到反应管中。反应在氮气保护下进行4h,加入醋酸酐(0.3mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚环氧乙烷-b-聚(γ-丁内酯),结构如下所示:
核磁氢谱1hnmr(500mhz,cdcl3)δ(ppm):4.11(160h,t),3.65(180h,s),3.38(3h,s),2.39(163h,t),1.96(180h,m)。gpc测得数均分子量为11.7kg/mol,分子量分布为1.93。所得嵌段共聚物核磁氢谱如图2所示,gpc曲线如图6所示。
实施例3
将(0.075mmol,375mg)聚环氧乙烷单甲醚(peg5000,平均分子量mn=5000g/mol)和(0.05mmol,60mg)六[三(二甲基胺)磷氮烯]三聚磷腈加入反应管中,置于-50℃低温冷浴中,加入0.6ml二氯甲烷,搅拌10min使体系混合均匀,用注射器将0.57mlγ-丁内酯加入到反应管中。反应在氮气保护下进行4h,加入丙烯酰氯(0.15mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚环氧乙烷-b-聚(γ-丁内酯),结构如下所示:
核磁氢谱1hnmr(500mhz,cdcl3)δ(ppm):4.11(312h,t),3.65(450h,s),3.38(3h,s),2.39(309h,t),1.96(314h,m)。gpc测得数均分子量为10.9kg/mol,分子量分布为2.50。所得嵌段共聚物核磁氢谱如图3所示,gpc曲线如图7所示,红外谱图如图11所示。
实施例4
将(0.075mmol,152mg)聚环氧乙烷单甲醚(peg2000,平均分子量mn=2000g/mol)和(0.15mmol,3.6mg)nah加入到反应瓶中,加入5ml四氢呋喃,在氮气保护下回流反应24h,将反应混合物过滤,滤液抽干得到聚环氧乙烷单甲醚钠。在得到的聚环氧乙烷单甲醚钠中加入0.2ml四氢呋喃,搅拌10min,置于-50℃低温冷浴中,加入0.4ml二氯甲烷,搅拌10min使体系混合均匀,用注射器将0.57mlγ-丁内酯加入到反应管中。反应在氮气保护下进行4h,加入环氧氯丙烷(7.5mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚环氧乙烷-b-聚(γ-丁内酯),结构如下所示:
gpc测得数均分子量为12.4kg/mol,分子量分布为1.48。所得嵌段共聚物gpc曲线如图8所示。
实施例5
将(0.075mmol,150mg)聚环氧乙烷单甲醚(peg2000,平均分子量mn=2000g/mol)和(0.15mmol,10.5mg)甲醇钾加入反应管中,加入0.2ml四氢呋喃,置于-50℃低温冷浴中,加入0.4ml二氯甲烷,搅拌10min使体系混合均匀,用注射器将0.57mlγ-丁内酯加入到反应管中。反应在氮气保护下进行4h,加入4-甲氧基苯基异氰酸酯(0.6mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚环氧乙烷-b-聚(γ-丁内酯),结构如下所示:
gpc测得数均分子量为4.5kg/mol,分子量分布为1.66。所得嵌段共聚物gpc曲线如图9所示。
实施例6
将(0.15mmol,150mg)聚环氧乙烷(peg1000,平均分子量mn=1000g/mol)和(0.3mmol,6.9mg)钠加入反应管中,加入0.2ml四氢呋喃,在氮气保护下,25℃搅拌60min,置于-50℃低温冷浴中,加入0.4ml二氯甲烷,搅拌10min使体系混合均匀,将1.15mlγ-丁内酯加入到反应管中。反应在氮气保护下进行2h,加入丁二酸酐(0.45mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚(γ-丁内酯)-b-聚环氧乙烷-b-聚(γ-丁内酯),结构如下所示:
gpc测得数均分子量为6.1kg/mol,分子量分布为1.45。
实施例7
将(0.1mmol,250mg)聚环氧丙烷单甲醚(ppg2500,平均分子量mn=2500g/mol)和(0.1mmol,17.7mg)联苯钠加入反应管中,加入0.3ml四氢呋喃,在氮气保护下,25℃搅拌30min,置于-50℃低温冷浴中,加入0.5ml二氯甲烷,搅拌10min使体系混合均匀,将0.77mlγ-丁内酯加入到反应管中。反应在氮气保护下进行4h,加入3-氯丙烯(0.2mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚环氧丙烷-b-聚(γ-丁内酯),结构如下所示:
gpc测得数均分子量为4.4kg/mol,分子量分布为1.35。
实施例8
将(0.1mmol,200mg)聚环氧乙烷-b-聚环氧丙烷-b-聚环氧乙烷(peg-b-ppg-b-peg,平均分子量mn=2000g/mol)和(0.1mmol,63.4mg)磷腈配体p4-叔丁基(tert-bu-p4)加入反应管中,置于-50℃低温冷浴中,加入1ml二氯甲烷,搅拌10min使体系混合均匀,用注射器将0.77mlγ-丁内酯加入到反应管中。反应在氮气保护下进行4h,加入4-甲氧基苯基硫代异氰酸酯(0.3mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚(γ-丁内酯)-b-聚环氧乙烷-b-聚环氧丙烷-b-聚环氧乙烷-b-聚(γ-丁内酯),结构如下所示:
gpc测得数均分子量为6.5kg/mol,分子量分布为1.56。
实施例9
将(0.075mmol,187.5mg)聚(环氧乙烷-ran-环氧丙烷)(peg-ran-ppg,平均分子量mn=2500g/mol)和(0.15mmol,3.6mg)nah加入到反应瓶中,加入5ml四氢呋喃,在氮气保护下回流反应24h,将反应混合物过滤,滤液抽干得到聚(环氧乙烷-ran-环氧丙烷)钠。在得到的聚(环氧乙烷-ran-环氧丙烷)钠中加入0.2ml四氢呋喃,搅拌10min,置于-50℃低温冷浴中,加入0.4ml二氯甲烷,搅拌10min使体系混合均匀,用注射器将0.57mlγ-丁内酯加入到反应管中。反应在氮气保护下进行4h,加入马来酰亚胺基丁酰氯(0.45mmol),将反应混合物倒入过量甲醇中,离心分离沉淀得到聚(γ-丁内酯)-b-聚(环氧乙烷-ran-环氧丙烷)-b-聚(γ-丁内酯),结构如下所示:
gpc测得数均分子量为10.4kg/mol,分子量分布为1.41。
实施例10
按照实施例1的方法制备化合物,区别在于,将乙酸替换为表1中所示含活性官能团化合物,从而得到相应的聚醚-b-聚(γ-丁内酯)嵌段共聚物。
表1
实施例11
按照实施例6的方法制备化合物,区别在于,将丁二酸酐替换为表2中所示含活性官能团化合物,从而得到相应的聚醚-b-聚(γ-丁内酯)嵌段共聚物。
表2
实施例12
按照实施例7的方法制备化合物,区别在于,将3-氯丙烯替换为表3中所示含活性官能团化合物,从而得到相应的聚醚-b-聚(γ-丁内酯)嵌段共聚物。
表3
实施例13
按照实施例8的方法制备化合物,区别在于,将4-甲氧基苯基硫代异氰酸酯替换为表4中所示含活性官能团化合物,从而得到相应的聚醚-b-聚(γ-丁内酯)嵌段共聚物。
表4
实施例14
按照实施例9的方法制备化合物,区别在于,将马来酰亚胺基丁酰氯替换为表5中所示含活性官能团化合物,从而得到相应的聚醚-b-聚(γ-丁内酯)嵌段共聚物。
表5
实施例15
按照实施例6的方法制备化合物,区别在于,将聚环氧乙烷替换为聚环氧丙烷,将丁二酸酐替换为表6中所示含活性官能团化合物,从而得到相应的聚醚-b-聚(γ-丁内酯)嵌段共聚物。
表6
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!