一种沼气生物资源化利用的方法与流程
本发明涉及一种通过生物法资源化利用沼气的方法,属于生物化工领域。
背景技术:
近年来,沼气排放量的大幅增加导致了环境的改变,为人类和其他物种带来了巨大的危害。研究表明,人口和经济的增长加大了对能源的消耗,预计到本世纪中叶,消耗量将至少是目前的两倍。当前,已有大量研究成果表明化石能源消耗、沼气排放与全球环境变化之间的关系,相关结果同时指出环境变化对社会和经济等各个方面造成的影响不容忽视。
沼气主要包括以碳一气体为主的二氧化碳和甲烷。研究表明,致使全球变暖的沼气中,甲烷的比重达到了20%,而以20年期计算,甲烷的全球变暖潜值是二氧化碳的86倍。甲烷的来源广泛,主要以沼气的形式存在于垃圾填埋厂、污水处理厂、畜牧场等可进行微生物厌氧降解发酵场所。
近年来我国对沼气资源十分重视,随着其生产技术不断完善,沼气已成为一种廉价、充足的碳源。但目前我国大量沼气利用仍以低品位热利用为主,主要通过热电联产燃烧沼气中的甲烷产生热能和电能。然而这种低效利用沼气的方法,不但大大降低了沼气的价值,而且燃烧甲烷产生的二氧化碳造成了二次污染。因此随着沼气产量的不断增加,沼气的高端利用途径急需不断扩展和补充。
好氧性甲烷菌是一种可以将甲烷作为唯一碳源和能量源的微生物,其体内特有的生物酶可将沼气生物转化为包括微生物油脂、长链脂肪酸,糖原、聚-β-羟丁酸,胞外聚合物,四氢嘧啶,环氧衍生物,虾青素,甲醇,菌体蛋白等在内的多种高价值活性物质。因此,目前好氧性甲烷菌在食品,医药,饲料,环保和生物能源等诸多方面具有广泛的应用。
但好氧性甲烷菌对培养条件要求极为苛刻。未被优化的生长条件和培养条件很难实现好氧性甲烷菌高效转化沼气中的甲烷产生高附加值产品的目的。相比较于利用糖类为碳源底物的微生物,好氧性甲烷菌的唯一碳源和能量源为沼气。气体碳源相对于糖类,有着不易被控制且转化效率低的特点。如不进行培养条件的优化无法实现高效利用沼气实现高密度发酵的目的,从而失去了工业化生产的前景。
技术实现要素:
本发明针对目前沼气资源化利用不充分以及生物转化甲烷过程中存在的技术和条件不成熟的问题,通过优化好氧性甲烷菌培养条件和培养基成分,提高沼气的利用效率。
采用连续通气的培养方式进行培养好氧性甲烷菌,在培养过程中连续通入沼气并排除部分菌液,同时补加相应体积的优化培养基进行后续技术培养。
所述好氧性甲烷菌选自:Methylomonas pelagica,Pseudomonas methanica,Methylosinus trichosporium OB3b,Methylosinus sporium,Methylobacter modestohalophilus,Methylocystis parvus,Methylomicrobium specie,Methylomonas methanica,Methylomonas albus,Methylobacter alcaliphilus,Methylococcus capsulatus(Bath),Methylobacter album,Methylobacterium extorquens,Methylobacter capsulatus,Methylobacterium organophilum,Methylomonas specie,Methylomicrobium buryatense,Methylomicrobium alcaliphilum,Methylobacterium radiotolerans,Methylocella silvestris,Methylobacterium populi,Methylacidiphilum infernorum,Methylibium petroleiphilum,Methylocystis GB25,Methylobacterium chloromethanicum,Verrucomicrobia phylum,Methylobacterium nodulans,Methylomicrobium alcaliphilum或者上述菌种的复合混合菌群。
所述好氧性甲烷菌将沼气作为唯一碳源,在连续培养过程中,控制生物反应器的搅拌转速为200-1000转/分钟,将沼气以0.5-3vvm的流量连续通入生物反应器,并保持培养温度为20-35℃,并调节培养基和生物反应器内培养液的pH为5.0-10.0。
所述培养基由氮源、碳酸盐、无机盐、微量元素和水组成
所述连续培养在旋转瓶、机械搅拌式、气升式、鼓泡式或生物膜循环式的生物反应器中进行。
所述生物质和其他终端产品包括烘干菌体、微生物油脂、菌体蛋白、糖原和聚-β-羟丁酸。
所述培养基液的主要成分为:MgSO4·7H2O 0.2~5.0克/升、CaCl2·6H2O0.002~0.2克/升、KNO3 0.1-10.0克/升、NaNO3 0.5-5.0克/升、K2SO4 0.1-1.0克/升、NaCl 1.0-10.0克/升、KH2PO4 0.1~1.0克/升、Na2HPO4 0.1~1.0克/升、NaHCO3 0.5-5.0克/升、Na2CO31.0-5.0克/升、Na-EDTA 0.5~5克/升、FeSO4·7H2O 0.1~4克/升、ZnSO4·7H2O 0.01~1.2克/升、MnSO4·4H2O 0.1-0.5克/升、MnCl2·4H2O 0.003~0.1克/升、H3BO3 0.02~0.12克/升、CoCl2·6H2O0.02~0.4克/升、CuCl2·2H2O 0.02-0.6克/升、CaCl2·2H2O 0.001-0/1克/升、NiCl2·6H2O 0.002~0.1克/升、Na2MoO4·2H2O 0.003~0.1克/升、CuSO4·5H2O0.5~5克/升、KI(碘化钾)0.05-1.0克/升和1mM H2SO4 0.1-2ml,鳌合铁溶液的组成为FeSO4·7H2O 0.5-10.0克/升、FeCl3 1.0-5.0克/升、HCl 1.0-5.0ml和Na2-EDTA 0.5-4.0克/升,实现高密度连续培养所述的好氧性甲烷菌。
所述好氧性甲烷菌经高密度连续培养后得到的生物质干重达到20-40g/L。
本发明通过优化好氧性甲烷菌培养条件和培养基成分,提高沼气中甲烷的利用效率,从而使甲烷生物合成得到的菌体干重浓度20-40g/L、菌体干重产率10-20g/L/天、产物浓度2-10g/L。为沼气的利用提供一种高效生物法资源化利用的方法。
附图说明
图1为实施例1、例2和例3中菌体生长速率曲线图。图1中各个组分含义:#A、#B和#C代表上述三种不同培养基;OD代表菌体吸光度值;Time代表时间小时(h)。
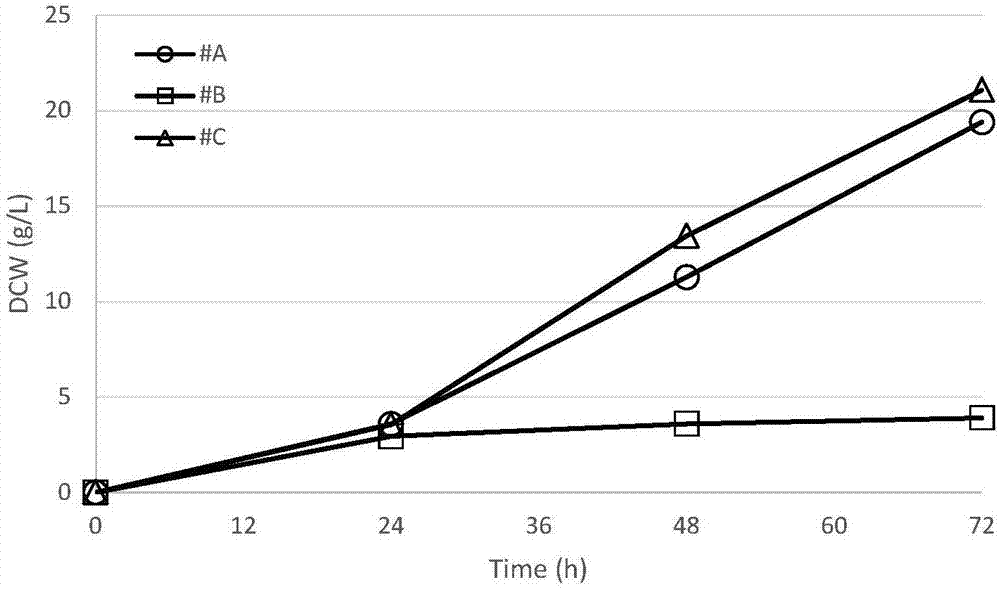
图2为实施例1、例2和例3中细胞干重浓度曲线图。图2中各个组分含义:#A、#B和#C代表上述三种不同培养基;图中DCW代表细胞干重浓度克每升(g/L);Time代表时间小时(h)。
图3为实施例1、例2和例3中生物油脂含量曲线图。图3中各个组分含义:#A、#B和#C代表上述三种不同培养基;Lipid content代表生物油脂(即产物)占细胞干重的比例;Time代表时间小时(h)。
图4为实施例4中菌体生长速率、细胞干重浓度和糖原浓度曲线图。图4中各个组分含义:;OD代表菌体吸光度值;DCW代表细胞干重浓度克每升(g/L);Glycogen代表糖原浓度克每升(g/L);Time代表时间小时(h)。
具体实施方式
下面通过具体实施例对本发明作进一步详细说明,但本发明申请的好氧性甲烷菌包括但不局限于Methylomonas pelagica,Pseudomonas methanica,Methylosinus trichosporium OB3b,Methylosinus sporium,Methylobacter modestohalophilus,Methylocystis parvus,Methylomicrobium specie,Methylomonas methanica,Methylomonas albus,Methylobacter alcaliphilus,Methylococcus capsulatus(Bath),Methylobacter album,Methylobacterium extorquens,Methylobacter capsulatus,Methylobacterium organophilum,Methylomonas specie,Methylomicrobium buryatense,Methylomicrobium alcaliphilum,Methylobacterium radiotolerans,Methylocella silvestris,Methylobacterium populi,Methylacidiphilum infernorum,Methylibium petroleiphilum,Methylocystis GB25,Methylobacterium chloromethanicum,Verrucomicrobia phylum,Methylobacterium nodulans,Methylomicrobium alcaliphilum或者上述菌种的复合混合菌群。
在优选的实施方式中,本发明采用Methylomicrobium buryatense,Methylomicrobium alcaliphilum,Methylosinus trichosporium OB3b混合菌群为例,说明本发明的具体实施方式。在不违背本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
实施例1:
配制培养基液#A和微量元素液#1(其组成见表1和表2),将相应配好的培养基液和微量元素液加入到生物反应器中,补充纯水至工作体积,生物反应器的液体装料系数为0.6。混合菌群的连续培养在旋转瓶、机械搅拌式、气升式或鼓泡式的生物反应器中进行。在优选的实例中,采用机械搅拌式生物反应器。
对已装液的生物反应器进行蒸汽灭菌(121℃维持30分钟)。当温度降至30℃时,按装液体积的8%接入种子液开始连续培养。
在培养过程中,须控制适合的培养条件实现混合菌群的高密度培养。在优选的实例中,控制搅拌转速500转/分钟并以0.8vvm的流量通入沼气,尽量保持溶氧浓度大于10%。控制温度为28℃,采用4mol/L NaOH和4mol/L H2SO4调控pH为9.0。
连续培养开始后,培养基液#A和微量元素液#1可以实现高密度培养。OD最高值达48.5(见图1),细胞干重浓度达19.4g/L(见图2),产物油脂含量为11%(见图3)。
实施例2
以表1和表2中所述,配制培养基液#B和微量元素液#2,其他培养条件和专利要求同例1。
连续培养开始后,培养基液#B和微量元素液#2提供OD最高值达9.6(见图1),细胞干重浓度达3.9g/L(见图2),产物油脂含量为8%(见图3)。
实施例3
以表1和表2中所述,配制培养基液#C和微量元素液#3,其他培养条件和专利要求同例1。
连续培养开始后,培养基液#C和微量元素液#3可以实现高密度培养。OD最高值大52.7(见图1),细胞干重浓度达21.1g/L(见图2),产物油脂含量为15%(见图3)。
实施例4:
配制培养基液#C和微量元素液#2(其组成见表1和表2),将相应配好的培养基液和微量元素液加入到生物反应器中,补充纯水至工作体积,生物反应器的液体装料系数为0.4。混合菌群的连续培养在旋转瓶、机械搅拌式、气升式或鼓泡式的生物反应器中进行。在优选的实例中,采用机械搅拌式生物反应器。
对已装液的生物反应器进行蒸汽灭菌(121℃维持30分钟)。当温度降至30℃时,按装液体积的10%接入种子液开始连续培养。
在培养过程中,须控制适合的培养条件实现混合菌群的高密度培养。在优选的实例中,控制搅拌转速1000转/分钟并以2vvm的流量通入沼气,尽量保持溶氧浓度大于5%。控制温度为30℃,采用2mol/L NaOH和2mol/L H2SO4调控pH为8。
连续培养开始后,培养基液#A和微量元素液#3可以实现高密度培养生物合成糖原。OD最高值达62(见图4),细胞干重浓度达25g/L(见图4),糖原浓度10g/L(见图4)。
表1培养基液组成成分
表2微量元素溶液组成成分
从上述实施例可以看出,通过优化好氧性甲烷菌培养条件和培养基成分,提高沼气中甲烷的利用效率,从而使沼气生物合成得到的菌体干重浓度不低于20g/L、菌体干重产率不低于10g/L/天、产物浓度不低于2g/L。为沼气的利用提供一种高效生物法资源化利用的方法。
- 还没有人留言评论。精彩留言会获得点赞!