噁嗪类化合物及其应用的制作方法
本发明属于抗癌药物设计、合成及应用领域。具体涉及新型噁嗪类光/声敏剂的合成及其对肿瘤的专一性识别及在诊疗中的新应用。
背景技术
光动力作用是指在光敏剂参与下,在光的作用下,使有机体细胞或生物分子发生机能或形态变化,严重时导致细胞损伤和坏死作用,早期这种作用必须有氧的参与,所以又称光敏化-氧化作用,在化学上称这种作用为光敏化作用,在生物学及医学上称之为光动力作用,用光动力作用治病的方法,称为光动力疗法(photodynamictherapy,pdt)。光动力疗法是以光、光敏剂和氧的相互作用为基础的一种新的疾病治疗手段,光敏剂(光动力治疗药物)的研究是影响光动力治疗前景的关键所在。光敏剂是一些特殊的化学物质,其基本作用是传递能量,它能够吸收光子而被激发,又将吸收的光能迅速传递给另一组分的分子,使其被激发而光敏剂本身回到基态。随着第一个光敏剂porfimersodium于1993--1997年在美国、加拿大、欧盟、日本及韩国陆续被批准上市,pdt领域的研究、开发和应用迅速活跃起来。随着新的光动力治疗药物的研发成功及激光设备技术的提高,pdt又迎来了前所未有的发展高峰。国际上,已批准上市或正在临床研究的新的光敏剂近十种。同时,pdt也被用于非肿瘤型疾病,如尖锐湿疣、牛皮癣、鲜红斑痣、类风湿关节炎、眼底黄斑病变、血管成型术后再狭窄等疾病的治疗。国内有代表性的光敏剂主要有:上海复旦张江生物医药股份有限公司研发生产的艾拉(5-ala,外用盐酸氨酮戊酸散)。医学临床和实践中,皮肤科医生方便使用简称艾拉或光动力。
声动力疗法(sonodynamictherapy,sdt)利用超声波对生物组织有较强的穿透能力,尤其是聚焦超声能无创伤地将声能聚焦于深部组织,并激活一些声敏药物(如血卟啉)产生抗肿瘤效应。1990年,yumitai.q等报道了超声联合hp(血卟啉)对小鼠移植肿瘤生长抑制的协同效应,表现为单用hp无抑制作用,单用超声仅有轻微抑制作用.而两者合用则有明显抑制作用.并将之命名为声动力疗法。
目前,应用于临床的光/声敏剂主要以卟啉和酞菁类化合物为主要代表,尽管该类化合物在肿瘤治疗方面取得了较大成功,但是依然存在很多缺陷,例如:治疗体系组成比例不稳定,在肌体内代谢缓慢,最大激发波长较短,易发生光毒副作用等。这些不足严重影响了光动力疗法的实际效果及临床应用。对于光敏剂的制备及应用研究,国际上已经有一定的指导思想能够起到指导作用,但对于声敏剂的制备及应用研究,并未有相关的理论指导,而能够应用于临床的声敏剂更是寥寥无几。因此设计合适的光/声敏剂,对于肿瘤诊疗具有很大推进作用。
技术实现要素:
本发明目的之一在于开发一种具有噁嗪类基础结构,并同时具有光敏及声敏特性的新的化合物。该化合物应当能够利用噁嗪类化合物原本具有的高摩尔消光系数、长吸收发射波长、油/水两亲的特性,在此基础上,该新的化合物还应当具有特别突出的肿瘤细胞靶向识别、标记及杀伤的功能。
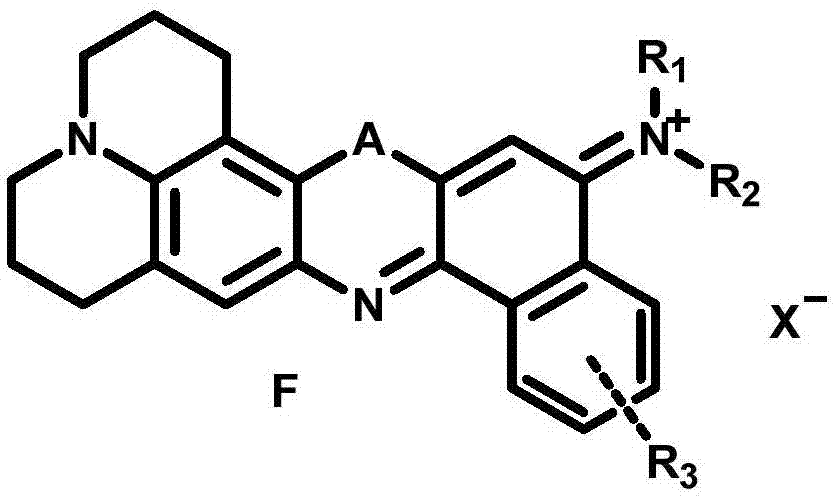
为此,本发明首先提供一类噁嗪类化合物,其具有通式f的结构:
通式f中,
所述的a选自硫(s),硒(se),碲(te)元素;
所述的r1、r2和r3各自独立地选自氢和c1-20的取代或未取代烷基;
所述的取代烷基由下述基团任意取代:卤素、羟基、烷氧基、醛基、羰基、氨基、羧基、酯基、酰胺基、硝基或磺酸基;
所述的x选自磷酸根,硫酸根,硫酸氢根,硝酸根,氯负离子,溴负离子,碘负离子或高氯酸根。
本发明中所述及的噁嗪类化合物是一类具有近红外吸收发射的同时具备光敏及声敏特性的光/声动力活性有机分子。该类化合物最大吸收和发射波长均大于660nm,三线态转化率高,在光照或超声条件下,可较高效率产生活性氧物种,对于癌细胞和癌组织具有较好的杀伤作用,在对肿瘤达到光/声动力治疗的同时几乎不对正常组织增加毒副作用。因此,本发明另一方面公开所述的噁嗪类化合物在制备光/声敏剂中的应用。该所述的光/声敏剂是近红外长波长荧光探针,用于肿瘤细胞的标记。本发明所述的噁嗪类化合物除了可以进行小分子给药操作,亦可自组装成纳米粒子或被其它材料包被成纳米离子进行给药操作,纳米尺度有效范围为1-1000nm。
附图说明
图1是化合物f-1的结构式。
图2是化合物f-1光谱测试实验结果(实施例2)。
图3是化合物f-1光照条件下单线态氧产量测定实验结果(实施例3)。
图4是化合物f-1超声条件下体外细胞抗癌测试实验结果(实施例4)。
图5是化合物f-1光照条件下体外细胞抗癌测试实验结果(实施例5)。
图6是化合物f-2光谱测试实验结果(实施例7)。
图7为化合物f-2光照条件下单线态氧产量测定实验结果(实施例8)。
图8为化合物f-2超声条件下单线态氧产量测定实验结果(实施例9)。
图9为化合物f-2光照条件下体外细胞抗癌测试实验结果(实施例10)。
图10为化合物f-3光谱测试实验结果(实施例12)。
图11为化合物f-3光照条件下单线态氧产量测定实验结果(实施例13)。
图12为化合物f-3超声条件下单线态氧产量测定实验结果(实施例14)。
图13是化合物f-3光照条件下体外细胞抗癌测试结果(实施例15)。
图14是化合物f-1自组装纳米给药体系的扫描电镜成像图(实施例16)。
具体实施方式
本发明提供一类噁嗪类化合物,具有通式f的结构:
通式f中,
所述的a选自硫(s),硒(se),碲(te)元素;
所述的r1、r2和r3各自独立地选自氢和c1-20的取代或未取代烷基;
所述的取代烷基由下述基团任意取代:卤素、羟基、烷氧基、醛基、羰基、氨基、羧基、酯基、酰胺基、硝基或磺酸基;
所述的x选自磷酸根,硫酸根,硫酸氢根,硝酸根,氯负离子,溴负离子,碘负离子或高氯酸根。
具体的技术方案中,所述的通式f中的r1、r2和r3各自独立地选自氢和c1-14的取代或未取代烷基。其中作为优选地,所述的r1、r2和r3各自独立地选自氢和c1-6的取代或未取代烷基。
更为具体的技术方案中,所述通式f中的r1和r2其中之一是氢。该特征可以结合r3是氢的技术特征,构成进一步优选的技术方案。
进一步对各化合物的rna特异性识别能力进行甄别和比较的基础上,本发明提供的最优选的实施方式中,下述9个化合物在制备近红外荧光探针中得以应用,所述的化合物选自f-1、f-2、f-3、f-4、f-5、f-6、f-7、f-8、f-9、f-10和f-11:
除另有说明外,本文中使用的术语具有以下含义。
本文中使用的术语“烷基”包括直链烷基和支链烷基。如提及单个烷基如“丙基”,则只特指直链烷基,如提及单个支链烷基如“异丙基”,则只特指支链烷基。例如,“c1-6烷基”包括c1-4烷基、c1-3烷基、甲基、乙基、正丙基、异丙基和叔丁基。类似的规则也适用于本说明书中使用的其它基团。
本文中使用的术语“卤素”包括氟、氯、溴和碘。
上文中所述及的具有通式f的化合物,其制备方法并未被现有技术所公开,本领域技术人员应当能够结合本说明书中的合成技术信息及有机合成的基本理论和技术来完成本发明所述化合物的获得。本说明书中描述的下述噁嗪类化合物的制备方法提供该类化合物合成的一种具体方案,但不应当理解为对其的限定。
本发明中所述及的噁嗪类化合物通过下述方法合成:使用芳胺或其衍生物形成的偶氮化合物与8-羟基久洛尼定在含酸dmf中缩合,制备得到目标噁嗪染料。该合成方法工艺简洁,转化率高。更为具体的,本发明通式化合物f合成路线为:
上述路线所表示的通式f的化合物的制备方法包括如下步骤:
(1)盐酸酸化体系中,氯化对硝基重氮苯与式i的化合物按照摩尔比1:1在25~35℃条件下反应0.5~2小时,制备式ii化合物;
(2)式ii化合物与8-羟基久洛里定(quinoline)按照摩尔比1:1在酸性dmf中于135~145℃条件下反应2~4小时制备通式f的化合物。
本发明所述的以噁嗪为母体的光/声敏剂具备以下特点:
(1)具备一定的水溶性,同时具有良好的细胞膜通透性;
(2)具有优异的近红外发射特性,应用于生物成像时具有底生物光漂白、光损伤和光毒性,并且产生的荧光信号可以穿透较深的生物组织;
(3)在700nm波长的光照或超声条件下,可以大量产生单线态氧;
(4)在测试条件下暗毒性低,生物相容性好,具备一定水溶性,光稳定性较好,可以作为优良的光敏剂应用于光动力及声动力肿瘤治疗领域;
本发明将氧族重元素引入治疗分子中,使得分子同时具有光动力治疗,声动力治疗以及化学治疗的多方面优点,可以更加高效地对肿瘤进行诊疗。并且,本发明所提供的化合物分子结构简单、稳定、毒副作用小;易于制备和纯化,原料易得,对于产业化生产制备光/声动力治疗肿瘤的药物具有极大优势。
基于上述特点,本发明所述的近红外光/声敏剂可用于肿瘤与非肿瘤细胞和组织标记。除了以本文中所述的形式直接用于肿瘤与非肿瘤细胞和组织的染色标记外,含有本发明的近红外荧光探针化合物的组合物也可以用于肿瘤细胞和组织的染色标记。所述组合物中应当包含有效量的本发明所提供的双光子荧光探针化合物之一。另外,还可以包含生物样品染色所需要的其它组分,例如溶剂、ph调节剂等。这些组分都是本行业内已知的。上述组合物可以以水溶液形式存在,或者可以在使用时用水配制为溶液的其它合适形式存在。
本发明还提供使用上述本发明的近红外光/声敏剂标记肿瘤细胞和组织生物样品的方法,该方法包括使所述化合物与生物样品接触的步骤。本文中使用的术语“接触”可包括在溶液或固相中接触。
下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。
实施例1:制备化合物f-1
(1)中间体1-ii的合成
盐酸酸化体系中,氯化对硝基重氮苯与1-i的化合物按照摩尔比1:1在25~35℃条件下反应0.5~2小时,反应完毕,经过抽滤洗涤操作后得到砖红色固体粉末粗产品得式1-ii的化合物,收率95%。
(2)化合物f-1的合成
将上述反应(1)制备得到的中间体1-ii与硫代久洛里定(quinoline)加入到含有dmf的圆底烧瓶中,滴入1ml高氯酸溶液。滴加完毕,体系搅拌2.5h后停止反应,经硅胶柱色谱分离,二氯甲烷:甲醇(v:v)=8:1洗脱提纯得具金属光泽的深蓝色针状晶体目标化合物f-1(结构式如图1),收率83.2%。
1hnmr(400mhz,dmso)δ9.13(s,1h),8.77(d,j=8.2hz,1h),8.34(d,j=8.1hz,1h),7.84(t,j=7.4hz,1h),7.77(t,j=7.5hz,1h),7.44(s,1h),7.22(s,1h),3.54(d,j=17.3hz,5h),2.96–2.71(m,3h),2.49(s,6h),2.05–1.99(m,2h),1.98–1.92(m,2h),1.35(t,j=7.2hz,3h).
实施例2:化合物f-1光谱测试实验
使用实施例1中合成的化合物f-1,将f-1-dmso溶液加入到二氯甲烷中混合均匀。用紫外可见分光光度计和荧光光谱仪测试其光谱性质。结果如图2所示,f-1分子在二氯甲烷中最大吸收680nm,最大发射700nm。
实施例3:化合物f-1光照条件下单线态氧产量测定实验
使用实施例1中合成的化合物f-1,将f-1-dmso溶液加入到甲醇中混合均匀后加入1,3-二苯基异苯并呋喃(dpbf),调节dpbf浓度使其吸光度值约为1.0后使用660nm波长的氙灯光源(通过光栅滤光调节)照射,等时间间隔测定体系紫外可见吸收曲线。根据dpbf在411nm波长处吸光度变化,绘制吸光度与时间的相关性曲线,采用亚甲基蓝作为参比,计算化合物f-1的单线态氧量子产率,结果如图3。该附图显示了随光照时间延长混合体系紫外可见吸光光谱变化情况,根据相关公式可得,化合物f-1的单线态氧量子产率约为0.018。
实施例4:化合物f-1超声条件下单线态氧产量测定实验
使用实施例1中合成的化合物f-1,将f-1-dmso溶液加入到乙二醇单甲醚中混合均匀后加入1,3-二苯基异苯并呋喃(dpbf),调节dpbf浓度使其吸光度值约为1.0后使用1.5w/cm2,50%循环超声刺激,等时间间隔测定体系紫外可见吸收曲线。根据dpbf在411nm波长处吸光度变化,绘制吸光度与时间的相关性曲线,结果如图4。该附图显示了随超声时间延长混合体系紫外可见吸光光谱变化情况,由图可知,化合物f-1可在超声促进下产生单线态氧。
实施例5:化合物f-1光照条件下体外细胞抗癌测试
将mcf-7(人乳腺癌细胞)以每孔5000个细胞密度种植于96孔培养板中于细胞培养箱中培养24小时(37℃,5%co2),使用实施例1中合成的化合物f-1,将f-1-dmso溶液加入到含10%胎牛血清dmem中配制成不同浓度溶液,将配好的溶液加入96孔板置于细胞培养箱中孵育30分钟后,用660nm波长的红光照射一定时间。照射完毕,96空板放置于细胞培养箱中继续孵育12小时。随后每孔加入含5mg/mlmtt的培养基100μl,并至于细胞培养箱中孵育4小时。除去板孔中的培养液,每孔加入100μldmso充分溶解mtt氧化产物后用酶标仪测定每孔于570nm和630nm处吸光度,计算细胞存活率,结果如图5所示。
从图5可以看出,在没有光照的条件下化合物f-1对细胞的杀伤效应非常小,几乎没有毒性;在有光照的条件下,化合物f-1可以细胞产生明显杀伤效果,并且随光照能量密度增强,化合物f-1光毒性呈现显著性提高。
实施例6:制备化合物f-2
(1)中间体2-ii的合成
盐酸酸化体系中,氯化对硝基重氮苯与2-i的化合物按照摩尔比1:1在25~35℃条件下反应0.5~2小时,反应完毕,经过抽滤洗涤操作后,得到砖红色固体粉末粗产品得式2-ii的化合物,收率95%。
(2)化合物f-2的合成
将上述反应(1)制备得到的中间体2-ii与硒代久洛里定(quinoline)加入到含有dmf的圆底烧瓶中,滴入1ml高氯酸溶液。滴加完毕,体系搅拌2.5h后停止反应,经硅胶柱色谱分离,二氯甲烷:甲醇(v:v)=8:1洗脱提纯得具金属光泽的深蓝色针状晶体目标化合物f-2,收率54.4%。
1hnmr(400mhz,dmso)δ9.26(s,1h),8.91(d,j=7.7hz,1h),8.40(d,j=8.0hz,1h),7.90–7.74(m,2h),7.67(d,j=21.0hz,2h),3.65–3.46(m,6h),3.30(s,3h),2.88(s,2h),2.02(d,j=38.7hz,4h),1.36(t,j=6.8hz,3h).
实施例7:化合物f-2光谱测试实验
使用实施例6中合成的化合物f-2,将f-2-dmso溶液加入到二氯甲烷中混合均匀。用紫外可见分光光度计和荧光光谱仪测试其光谱性质。结果如图6所示,f-2分子在二氯甲烷中最大吸收686nm,最大发射712nm。
实施例8:化合物f-2光照条件下单线态氧产量测定实验
使用实施例6中合成的化合物f-2,将f-2-dmso溶液加入到甲醇中混合均匀后加入1,3-二苯基异苯并呋喃(dpbf),调节dpbf浓度使其吸光度值约为1.0后使用660nm波长的氙灯光源(通过光栅滤光调节)照射,等时间间隔测定体系紫外可见吸收曲线。根据dpbf在411nm波长处吸光度变化,绘制吸光度与时间的相关性曲线,采用亚甲基蓝作为参比,计算化合物f-2的单线态氧量子产率,结果如图7。该附图显示随光照时间延长混合体系紫外可见吸光光谱变化情况,根据相关公式可得,化合物f-2的单线态氧量子产率约为0.47。
实施例9:化合物f-2超声条件下单线态氧产量测定实验
使用实施例6中合成的化合物f-2,将f-2-dmso溶液加入到乙二醇单甲醚中混合均匀后加入1,3-二苯基异苯并呋喃(dpbf),调节dpbf浓度使其吸光度值约为1.0后使用1.5w/cm2,50%循环超声刺激,等时间间隔测定体系紫外可见吸收曲线。根据dpbf在411nm波长处吸光度变化,绘制吸光度与时间的相关性曲线,结果如图8。该附图显示随超声时间延长混合体系紫外可见吸光光谱变化情况,可见,化合物f-2可在超声促进下产生单线态氧。
实施例10:化合物f-2光照条件下体外细胞抗癌测试
将mcf-7(人乳腺癌细胞)以每孔5000个细胞密度种植于96孔培养板中于细胞培养箱中培养24小时(37℃,5%co2),使用实施例6中合成的化合物f-2,将f-2-dmso溶液加入到含10%胎牛血清dmem中配制成不同浓度溶液,将配好的溶液加入96孔板置于细胞培养箱中孵育30分钟后,用660nm波长的红光照射一定时间。照射完毕,96空板放置于细胞培养箱中继续孵育12小时。随后每孔加入含5mg/mlmtt的培养基100μl,并至于细胞培养箱中孵育4小时。除去板孔中的培养液,每孔加入100μldmso充分溶解mtt氧化产物后用酶标仪测定每孔于570nm和630nm处吸光度,计算细胞存活率,如图9所示。
从图9可以看出,在没有光照的条件下化合物f-2对细胞的杀伤效应非常小,几乎没有毒性;在有光照的条件下,化合物f-1在低光照能量密度可以细胞产生明显杀伤效果。
实施例11:制备化合物f-3
(1)中间体3-ii的合成
盐酸酸化体系中,氯化对硝基重氮苯,与3-i的化合物按照摩尔比1:1在25~35℃条件下反应0.5~2小时,反应完毕,经过抽滤洗涤操作后得到砖红色固体粉末粗产品得式3-ii的化合物,收率94%。
(2)化合物f-3的合成
将上述反应(1)制备得到的中间体3-ii与碲代久洛里定(quinoline)加入到含有dmf的圆底烧瓶中,滴入1ml高氯酸溶液。滴加完毕,体系搅拌2.5h后停止反应,经硅胶柱色谱分离,二氯甲烷:甲醇(v:v)=8:1洗脱提纯得具金属光泽的深蓝色针状晶体目标化合物f-3,收率65.9%。
1hnmr(400mhz,dmso)δ9.13(s,1h),8.90(d,j=8.1hz,1h),8.36(d,j=8.1hz,1h),8.07(s,1h),7.80(t,j=7.5hz,1h),7.74(t,j=7.4hz,1h),7.66(s,1h),3.54(dd,j=13.7,6.7hz,2h),3.43(d,j=5.0hz,4h),2.90–2.75(m,2h),2.35(t,j=6.1hz,2h),2.07–2.00(m,2h),1.98–1.86(m,3h),1.36(t,j=7.2hz,3h).
实施例12:化合物f-3光谱测试实验
使用实施例11中合成的化合物f-3,将f-3-dmso溶液加入到二氯甲烷中混合均匀。用紫外可见分光光度计和荧光光谱仪测试其光谱性质。结果如图10所示,f-3分子在二氯甲烷中最大吸收697nm,最大发射740nm。
实施例13:化合物f-3光照条件下单线态氧产量测定实验
使用实施例11中合成的化合物f-3,将f-3-dmso溶液加入到甲醇中混合均匀后加入1,3-二苯基异苯并呋喃(dpbf),调节dpbf浓度使其吸光度值约为1.0后使用660nm波长的氙灯光源(通过光栅滤光调节)照射,等时间间隔测定体系紫外可见吸收曲线。根据dpbf在411nm波长处吸光度变化,绘制吸光度与时间的相关性曲线,采用亚甲基蓝作为参比,计算化合物f-3的单线态氧量子产率,结果如图11。该附图显示随光照时间混合体系紫外可见吸光光谱变化情况,根据相关公式可得,化合物f-3的单线态氧量子产率约为0.73。
实施例14:化合物f-3超声条件下单线态氧产量测定实验
使用实施例11中合成的化合物f-3,将f-3-dmso溶液加入到乙二醇单甲醚中混合均匀后加入1,3-二苯基异苯并呋喃(dpbf),调节dpbf浓度使其吸光度值约为1.0后使用1.5w/cm2,50%循环超声刺激,等时间间隔测定体系紫外可见吸收曲线。根据dpbf在411nm波长处吸光度变化,绘制吸光度与时间的相关性曲线,结果如图12。该附图显示随超声时间延长混合体系紫外可见吸光光谱变化情况,可见,化合物f-3可在超声促进下产生单线态氧。
实施例15:化合物f-3光照条件下体外细胞抗癌测试
将mcf-7(人乳腺癌细胞)以每孔5000个细胞密度种植于96孔培养板中于细胞培养箱中培养24小时(37℃,5%co2),使用实施例11中合成的化合物f-3,将f-3-dmso溶液加入到含10%胎牛血清dmem中配制成不同浓度溶液,将配好的溶液加入96孔板置于细胞培养箱中孵育30分钟后,用660nm波长的红光照射一定时间。照射完毕,96空板放置于细胞培养箱中继续孵育12小时。随后每孔加入含5mg/mlmtt的培养基100μl,并至于细胞培养箱中孵育4小时。除去板孔中的培养液,每孔加入100μldmso充分溶解mtt氧化产物后用酶标仪测定每孔于570nm和630nm处吸光度,计算细胞存活率,如图13所示。
从图13可以看出,由于具有重原子碲的存在,化合物f-3在没有光照的条件下对细胞的具有一定杀伤效果,但其化学疗效较弱;在有光照的条件下,化合物f-3在低光照能量密度可以细胞产生明显杀伤效果。可见化合物f-3具有对于肿瘤细胞具有化学疗法和光/声动力疗法双重功效。
实施例16:自组装纳米给药体系建立测试
使用实施例1中合成的化合物f-1,根据需要将适量f-1-dmso溶液加入到磷酸缓冲液(pbs)或者超纯水中,摇匀后化合物f-1即可在pbs或超纯水中通过自组装过程,形成纳米颗粒体系,体系扫描电镜如图14所示。由图14可以看出,纳米体系中化合物f-1通过自组装形成的纳米颗粒尺寸约为200nm,颗粒形状规整、大小均一,具有优良的分散性质。
- 还没有人留言评论。精彩留言会获得点赞!