人血白蛋白高表达的人肝细胞系及其建立方法和应用与流程
本发明属于基因工程领域,具体地说,是一种人血白蛋白高表达的人肝细胞系及其建立方法和应用。
背景技术
人工肝支持系统借助于机械的、物理的装置通过清除内毒素、胆红素等有毒物质,补充白蛋白、氨基酸、凝血因子等有毒物质,暂时发挥肝脏的支持作用。临床治疗结果显示:人工肝支持系统能够显著提高肝衰竭的临床治愈、好转率。然而,非生物型人工肝支持系统尚不能完全替代肝脏的合成、代谢功能和生物转化等功能。随着肝细胞的分离培养和保存技术、肝细胞大规模培养技术及生物反应器日渐成熟,以肝细胞为生物活性成分的生物型人工肝(bioartificialliver,bal)成为人工肝脏研究的热点。生物型人工肝其依靠接种于生物反应器中的肝细胞,可以提供肝脏的分泌、代谢,生物转化和解毒等功能,在理论上讲,几乎可以代替肝脏的全部功能。
白蛋白(albumin,alb)由肝脏实质细胞合成,占血浆总蛋白的40%-60%,是血清中的主要蛋白质成分。白蛋白在机体中具有重要的生理功能:维持血浆胶体渗透压的恒定;能与体内许多难溶性的小分子有机物和无机离子可逆地结合形成易溶性的复合物,成为这些物质在血液循环中的运输形式;能保证细胞内液、细胞外液与组织液间的交流,起到一种胶体保护的稳定作用;白蛋白是人体内一种重要的营养物质,其体内含量直接关系着肝衰竭病人的预后。
技术实现要素:
本发明的首要目的在于提供一种人血白蛋白高表达的人肝细胞系,命名为hepg2n,其特征在于,所述的人肝细胞系保藏于中国典型培养物保藏中心,其保藏编号为cctccno:c201872,保藏日期为2018年4月10日。
进一步的,所述的人肝细胞系是利用慢病毒载体运载调节蛋白基因组,整合进入原细胞基因组中而得到的细胞系。
进一步的,所述的慢病毒载体一共包括三种慢病毒颗粒,分别运载三种synergisticactivationmediator(sam)蛋白复合体的激活元件的调节蛋白基因组,即dcas9-vp64、ms2-p65-hsf1和靶向特异性sgrna。
进一步的,所述的激活元件的调节蛋白基因组表达sam蛋白复合体激活原件,组合成为sam蛋白复合体。
进一步的,所述的慢病毒载体内包含有筛选基因,也将一同被整合进入原细胞基因组中。
进一步的,所述的筛选基因选自嘌呤霉素puro、杀稻瘟菌素blast和潮霉素hygro。
本发明的第二目的是提供一种人血白蛋白高表达的人肝细胞系的建立方法,包括以下步骤:a)由启动子调控,包含目的基因和筛选基因的质粒;所述启动子选自巨细胞病毒启动子(cmvpromoter),所述目的基因选自:dcas9-vp64蛋白、ms2-p65-hsf1蛋白和靶向特异性sgrna(alb);所述筛选基因选自:嘌呤霉素puro、杀稻瘟菌素blast和潮霉素hygro;
b)将步骤a)得到的质粒分别和pspax2、pmd2.g共转染293t细胞,包装出lentidcas-vp64_blast、lentialb-ms2_puro和lentims2-p65-hsf1_hygro三种慢病毒载体颗粒;
c)将步骤b)得到的慢病毒载体颗粒共感染人肝细胞hepg2;
d)筛选活的,带有puro、blast和hygro抗性基因的人肝细胞;
e)将步骤d)所得人肝细胞传代培养,建立人血白蛋白高表达的人肝细胞系hepg2n。
本发明的第三目的是提供所述人血白蛋白高表达的人肝细胞系在生物型人工肝系统中的应用。
进一步的,所述人肝细胞系作为生物型人工肝系统中的细胞源。
相对于现有技术,本发明的有益效果如下:生物型人工肝其依靠接种于生物反应器中的肝细胞,可以提供肝脏的合成、分泌、代谢、生物转化和解毒等功能,而白蛋白合成是肝细胞合成功能的重要体现之一。白蛋白在机体中能维持血浆胶体渗透压的恒定,能与体内许多难溶性的小分子有机物和无机离子可逆地结合形成易溶性的复合物,成为这些物质在血液循环中的运输形式,还能保证细胞内液、细胞外液与组织液间的交流,起到一种胶体保护的稳定作用。现有生物型人工肝系统中所用的肝细胞系hepg2、c3a和原代肝细胞等细胞系,白蛋白合成功能并不突出。本发明通过慢病毒载体介导的方式,使crispr/dcas9系统蛋白复合物synergisticactivationmediator(sam)基因组插入到细胞系基因组内,使细胞系稳定表达过蛋白复合物sam。该复合物sam能靶向定位白蛋白的基因位点,在此基础上增加转录因子的招募,从而实现针对白蛋白的过表达调控。由相关实验数据表明,本发明中的细胞系hepg2n白蛋白胞外分泌水平约为原细胞的5倍,白蛋白基因表达水平约为原先表达量的2倍,cyp7a1表达水平也有显著提高,westernblot证实胞内白蛋白也较原细胞系增强。因此,本发明中的细胞系hepg2n可作为生物型人工肝的细胞源之一。
附图说明
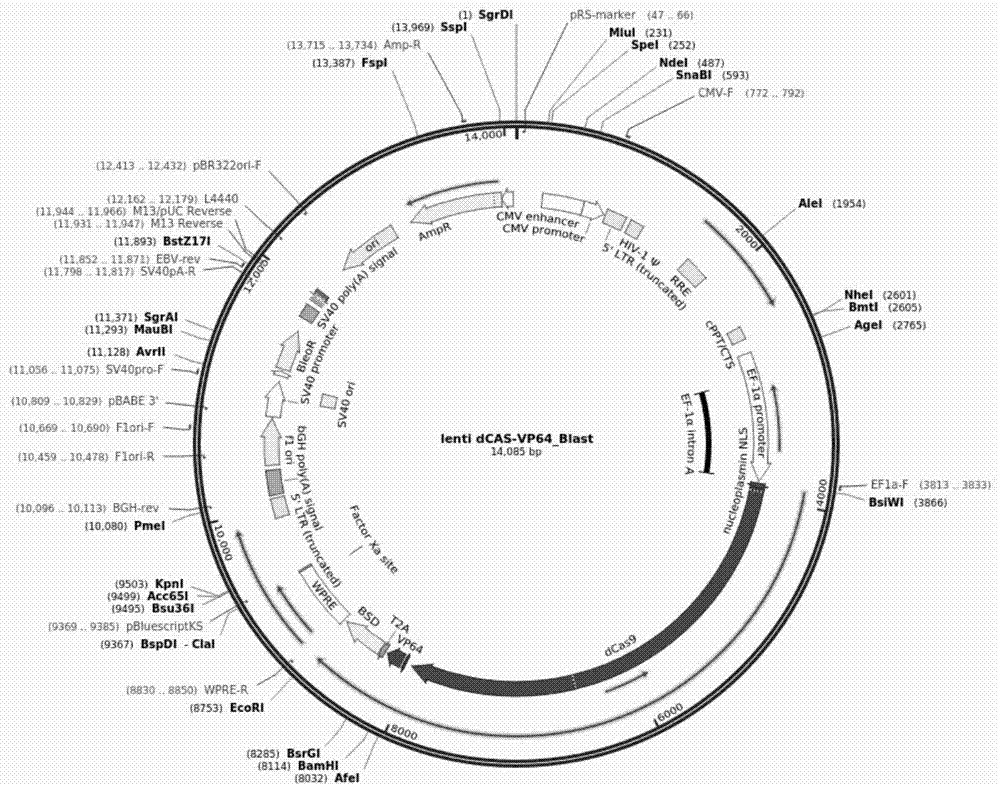
图1a为lentidcas-vp64_blast质粒的结构图;
图1b为lentialb-ms2_puro质粒的结构图;
图1c为lentims2-p65-hsf1_hygro质粒的结构图;
图2a为本发明通过elisa检测两株细胞系培养基上清中alb含量的对比检测结果图;
图2b为elisa试剂盒所测标准曲线图;
图3为本发明通过westernblot检测两株细胞系胞内alb含量的对比检测结果图;
图4为本发明通过rt-qpcr检测两株细胞系alb基因表达的对比检测结果图。
具体实施方式
以下结合具体实施例,对本发明作进一步说明。请理解,以下仅是本发明的优选实施方式,本发明并不限于以下实施例。
下列实施例中的具体实施条件按照常规条件,如《分子克隆实验指南(原书第四版)》(m.r.格林,j.萨姆布鲁克主编,贺福初主译,科学出版社,2017.3)
下列实施例中所需材料如表1所示。
表1.实施例中所需材料
实施例:
1.慢病毒的包装
1.1转染前24h,将293t细胞铺于6孔板上,每孔约10^6个细胞,待细胞长到60%-70%融合。
1.2取1.5ml灭菌ep管,加入0.75μg包装混合质粒(pspax2和pmd2.g)、1μg表达质粒(lentidcas-vp64_blast或lentialb-ms2_puro或lentims2-p65-hsf1_hygro,它们的质粒的结构图如图1a、图1b和图1c所示)、6μl的p3000以及250μl的opti-mem。轻柔混匀,室温孵育5min。
1.3取1.5ml灭菌ep管,取7μllipo3000溶于250μl的opti-mem。轻柔混匀,室温孵育5min。
1.4两管充分混匀,室温孵育20min。
1.5孵育:将混合液逐滴加入细胞中,轻轻混匀后置于含5%co2的37℃温箱孵育。
1.6换液:10h后吸去培养基,加入适量37℃预热的完全培养基(dmem),继续将细胞放置温箱孵育。
1.7收集病毒上清:24h收集含慢病毒的上清。使用0.45um滤器过滤后分装冻存于-80℃。
2.慢病毒感染目的细胞
2.1感染染前24h,将目的细胞铺于12孔板上,每孔约5*10^5个细胞,待细胞长到60%-70%融合。
2.2取三支1.5ml灭菌ep管,分别加入1:1、1:10和1:100的慢病毒液,再依次加入完全培养基(dmem)和polybrene,使总体积为1ml且polybrene的终浓度为8μg/ml。吹打,混匀。
2.3吸去细胞板中原有培养基,分别加入离心管中的混合液,将细胞放置温箱孵育培养24h。
2.4在24h后吸出含慢病毒的培养基,加入1ml完全培养基(dmem),将细胞放置温箱孵育培养至48h。
2.5在48h后吸出培养基,加入含有嘌呤霉素(puromycin)、杀稻瘟菌素(blasticidin)和潮霉素(hygromycin)的完全培养基,筛选稳定转导的细胞株(两到三天进行换液)。
2.6筛选7-10天后,挑取单细胞克隆,消化后放入6孔板中进行扩增,从而得到稳定的人血白蛋白高(alb)表达的人肝细胞系hepg2n。
3.elisa试剂盒检测两株细胞系胞外白蛋白分泌情况
将稳定的细胞系hepg2n和原细胞系hepg2铺于12孔板上,每孔约5*10^5个细胞,分别收取24h细胞上清并行1:50稀释。将上清原液,稀释液和标准品共同行elisa试剂盒检测,根据拟合完成的标准曲线换算细胞上清中的白蛋白浓度并进行细胞系之间的对比。操作流程如下,结果如图2a。
1)将标准品进行倍比浓度稀释。终浓度分别为0ng/ml,3.125ng/ml,6.250ng/ml,12.50ng/ml,25.00ng/ml,50.00ng/ml,100.00ng/ml和200.00ng/ml;
2)每孔中加入标准品和样品各50μl,室温下孵育1小时;
3)每孔中加入1×洗液200μl,每孔各洗5次;
4)每孔中加入1×biotinylatedalb抗体50μl,孵育30分钟;
5)再次清洗,各洗5次;
6)每孔中加入1×sp交联剂50μl,孵育30分钟;
7)再次清洗,各洗5次;
8)每孔中加入显色剂50μl,孵育25分钟;
9)每孔中加入终止液50μl,读板,波长为450nm。
10)将读数进行标准曲线拟合换算,最终浓度结果图2a。图2b为elisa试剂盒所测标准曲线。
4.rt-qpcr检测两株细胞系白蛋白基因表达情况
将稳定的细胞系hepg2n和原细胞系hepg2铺于12孔板上,每孔约5*10^5个细胞,用柱提法分别提取24h细胞总rna,取1μg总rna逆转录成cdna,以1μlcdna为模板进行pcr扩增。逆转录体系和扩增体系如下,分析结果如图。
1)逆转录体系:
反应条件:37℃,15分钟;85℃,5秒钟;4℃,保存。
2)pcr扩增体系:
引物:
cyp7a1-f:gcaatttggtgccaatcctct
cyp7a1-r:gcacaacaccttatggtatgaca
alb-f:gatgcctgctgacttgccttc
alb-r:tcagcagcagcacgacagagta
actin-f:tcaccaccacggccgagcg
actin-r:tctccttctgcatcctgtcg
反应条件:第一步:95℃,30秒钟,循环数1;第二步:95℃,5秒钟,60℃,34秒钟,循环数40。
3)分析结果如图3。
5.westernblot检测两株细胞系胞内白蛋白量
将稳定的细胞系hepg2n和原细胞系hepg2铺于12孔板上,每孔约5*10^5个细胞,用ripabuffer裂解法裂解细胞,分别收取24h细胞总蛋白;lowry法测蛋白浓度,分别取50μg蛋白进行聚丙烯酰胺凝胶电泳(sds-page),电泳参数为80v,10分钟;130v,50分钟。然后将聚丙烯酰胺凝胶上的蛋白转移到pvdf膜上,转膜参数:300ma,60分钟。完成后用anti-alb一抗,封闭过夜。第二天用带hrp标记的二抗来检测各蛋白样品中alb的表达。结果如图4。
由以上检测结果可知,本实施例中的hepg2n相比于原先细胞系各项指标有了显著提高。其中,alb胞外分泌量大约为原先分泌量的5倍;基因表达水平约为原先表达量的2倍,cyp7a1表达水平也有显著提高;westernblot证实胞内alb也较前增强。因此,hepg2n可以在保持其他功能稳定的基础上成功实现alb的过表达,可用于生物型人工肝系统,是一种较合适的理想的细胞源。
- 还没有人留言评论。精彩留言会获得点赞!