利用羊胎盘提取物增强干细胞表面受体CXCR4表达的方法与流程
本发明属于干细胞相关技术领域,具体涉及一种利用全羊胎盘提取物增强干细胞表面受体cxcr4表达的方法。
背景技术:
输注干细胞需要经历归巢、定植、增殖、分化等复杂过程,才能达到修复受损部位的目标。归巢是输注干细胞进入受损部位的首要环节,sdf-1/cxcr4信号通路在此过程中具有重要作用。干细胞“巢”作为一种特殊的微环境,是干细胞生存的基础,干细胞通过表面受体感应干细胞“巢”释放的各种信号分子并定向移植到干细胞“巢”才能进行定植,才能有效激活休眠干细胞并及时修复受损的细胞,干细胞在体内能否正确的归巢已经成为制约干细胞应用的关键因素。
当前培养的干细胞,由于缺乏适宜的诱导方法,培养干细胞的表面受体少,尤其是干细胞表面缺乏cxcr4受体,造成输注干细胞不能有效归“巢”定植,多被肺等器官截留而严重影响干细胞应用。
技术实现要素:
本发明的目的旨在针对现有技术中存在干细胞表面受体表达弱,干细胞归巢能力弱的问题,提供一种利用全羊胎盘提取物增强干细胞表面受体cxcr4表达的方法,使诱导后的干细胞表面受体cxcr4的相对表达量增强。
为达到上述目的,本发明采取以下技术方案:
一种利用羊胎盘提取物增强干细胞表面受体cxcr4表达的方法,包括以下步骤:
s1:取羊胎盘剪切成细小碎块,加入生理盐水在匀浆机中粉碎羊胎盘获取羊胎盘细胞匀浆液,其中羊胎盘与生理盐水按质量体积比(克/毫升)1:2进行匀浆;
s2:将获取的羊胎盘细胞匀浆液通过离心方法收集羊胎盘细胞,弃上清液,为保证细胞完整性,最大相对离心力不能超过1000xg;
s3:将收集到的羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,离心收集羊胎盘细胞,弃上清液;重复洗涤一次后,将羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,分装后冻存于-70℃冰箱中;
s4:从-70℃冰箱取出冻存的羊胎盘细胞置于42℃水浴箱,复融15min,融化后每5min混匀一次,共两次;42℃水浴箱中再重复冻融三次,使羊胎盘细胞充分破碎;然后在相对离心力8000xg以上进行高速离心,收集上清液,得全羊胎盘提取液;
s5:将全羊胎盘提取液用0.22μm的滤膜进行过滤除菌,滤液用于干细胞表面受体诱导或冷冻干燥后保存;
s6:将干细胞进行传代培养后,向干细胞传代培养液中加入全羊胎盘提取液,分别在不同时间进行检测干细胞表面受体cxcr4的表达量,以gapdh为内参基因,用定量pcr方法检测干细胞表面受体cxcr4在不同诱导时间的相对表达量。
进一步地,所述羊胎盘细胞为全羊胎盘提取物,但不局限于羊胎盘。
进一步地,所述干细胞为间充质干细胞,但不局限于间充质干细胞。
本发明的有益效果在于:与现有技术相比,本发明的方法相对更简单、有效,处理前后干细胞表面受体cxcr4的表达量差异很大,添加全羊胎盘提取物的干细胞其表面受体cxcr4的表达量明显增强,可达到未添加全羊胎盘提取物的对照干细胞的18~28倍。
附图说明:
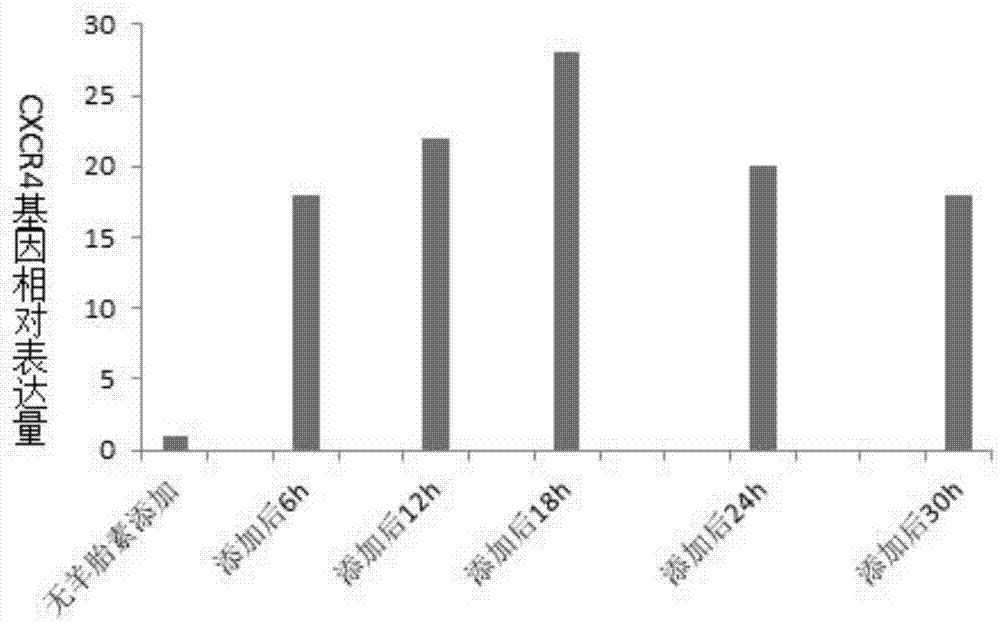
图1是本发明中添加全羊胎素提取物的骨髓间充质干细胞在不同诱导时间的cxcr4基因表达量检测结果。
具体实施方式:
下面结合附图及具体实施例对本发明进行进一步详细的说明,目的是为了使公众更好地理解所述技术内容,而并非对技术方案的限制。
实验材料:p2-p8代的人骨髓间充质干细胞,细胞贴壁生长至细胞融合度达80%以上;培养基:10.0%fbs、2mmol·l-1l-谷氨酰胺、100u·ml-1链霉素、100u·ml-1青霉素的αmem培养基;培养条件为:37℃、5%co2细胞培养箱。(本发明实验所应用的化学试剂以及仪器如未经特别说明,均可从商业渠道购买;全羊胎盘提取物可以自行制备。)
向骨髓间充质干细胞培养液中加入全羊胎盘提取液,培养至第6小时、12小时、18小时、24小时、30小时分别取出干细胞培养液200ul并分离rna,以荧光定量pcr法检测干细胞表面cxcr4表达量,以gapdh为内参基因。其中,定量pcr检测方法如下:用highpurernaisolationkit提取总rna,采用taqmanreversetranscriptionrengents试剂盒将总rna反转录为cdna(20μl体系),取反转录产物cdna模板2.5μl,按照taqmangeneexpressionmastermix说明书进行定量pcr检测,扩增程序为:50℃15min,94℃2min;94℃30s,55℃45s共40个循环,定量pcr仪为roche480ⅱ。
实施例1
(1)将500g羊胎盘剪切成细小碎块,然后加入1000ml生理盐水,在匀浆机中粉碎羊胎盘获取羊胎盘细胞匀浆液,羊胎盘(克)与生理盐水体积(毫升)之比为1:2;通过离心方法800xg收集羊胎盘细胞,弃上清液,为保证细胞完整性,最大相对离心力不能超过1000xg;
(2)将收集到的羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,离心收集羊胎盘细胞,弃上清液;重复洗涤1次;将羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,分装后可冻存于-70℃冰箱;
(3)从-70℃冰箱取出冻存的羊胎盘细胞置于42℃水浴箱,复融15分钟,融化后每5分钟混匀一次,共两次;-70℃/42℃重复冻融三次,使羊胎盘细胞充分破碎;高速离心(相对离心力8000xg)收集上清液,得全羊胎盘提取液;
(4)全羊胎盘提取液用0.22μm的滤膜进行过滤除菌,滤液用于干细胞表面受体诱导或冷冻干燥后保存;
(5)取p2~p8代的人骨髓间充质干细胞,培养基为:10.0%fbs、2mmol·l-1l-谷氨酰胺、100u·ml-1链霉素、100u·ml-1青霉素的αmem培养基,培养条件为:37℃、5%co2细胞培养箱中培养。在骨髓间充质干细胞培养板内加入全羊胎盘提取液,终浓度为0.2μg/ml培养6小时后取出干细胞培养液200ul并分离rna,以荧光定量pcr法检测干细胞表面cxcr4表达量,以gapdh为内参基因。诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高19倍。
实施例2
(1)将500g羊胎盘剪切成细小碎块,然后加入1000ml生理盐水,在匀浆机中粉碎羊胎盘获取羊胎盘细胞匀浆液,羊胎盘(克)与生理盐水体积(毫升)之比为1:2;通过离心方法800xg收集羊胎盘细胞,弃上清液,为保证细胞完整性,最大相对离心力不能超过1000xg;
(2)将收集到的羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,离心收集羊胎盘细胞,弃上清液;重复洗涤1次;将羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,分装后可冻存于-70℃冰箱;
(3)从-70℃冰箱取出冻存的羊胎盘细胞置于42℃水浴箱,复融15分钟,融化后每5分钟混匀一次,共两次;-70℃/42℃重复冻融三次,使羊胎盘细胞充分破碎;高速离心(相对离心力8000xg)收集上清液,得全羊胎盘提取液;
(4)全羊胎盘提取液用0.22μm的滤膜进行过滤除菌,滤液用于干细胞表面受体诱导或冷冻干燥后保存;
(5)取p2~p8代的人骨髓间充质干细胞,培养基为:10.0%fbs、2mmol·l-1l-谷氨酰胺、100u·ml-1链霉素、100u·ml-1青霉素的αmem培养基,培养条件为:37℃、5%co2细胞培养箱中培养。在骨髓间充质干细胞培养板内加入全羊胎盘提取液,终浓度为0.2μg/ml培养12小时后取出干细胞培养液200ul并分离rna,以荧光定量pcr法检测干细胞表面cxcr4表达量,以gapdh为内参基因。诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高23倍。
实施例3
(1)将500g羊胎盘剪切成细小碎块,然后加入1000ml生理盐水,在匀浆机中粉碎羊胎盘获取羊胎盘细胞匀浆液,羊胎盘(克)与生理盐水体积(毫升)之比为1:2;通过离心方法800xg收集羊胎盘细胞,弃上清液,为保证细胞完整性,最大相对离心力不能超过1000xg;
(2)将收集到的羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,离心收集羊胎盘细胞,弃上清液;重复洗涤1次;将羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,分装后可冻存于-70℃冰箱;
(3)从-70℃冰箱取出冻存的羊胎盘细胞置于42℃水浴箱,复融15分钟,融化后每5分钟混匀一次,共两次;-70℃/42℃重复冻融三次,使羊胎盘细胞充分破碎;高速离心(相对离心力8000xg)收集上清液,得全羊胎盘提取液;
(4)全羊胎盘提取液用0.22μm的滤膜进行过滤除菌,滤液用于干细胞表面受体诱导或冷冻干燥后保存;
(5)取p2~p8代的人骨髓间充质干细胞,培养基为:10.0%fbs、2mmol·l-1l-谷氨酰胺、100u·ml-1链霉素、100u·ml-1青霉素的αmem培养基,培养条件为:37℃、5%co2细胞培养箱中培养。在骨髓间充质干细胞培养板内加入全羊胎盘提取液,终浓度为0.2μg/ml培养18小时后取出干细胞培养液200ul并分离rna,以荧光定量pcr法检测干细胞表面cxcr4表达量,以gapdh为内参基因。诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高28倍。
实施例4
(1)将500g羊胎盘剪切成细小碎块,然后加入1000ml生理盐水,在匀浆机中粉碎羊胎盘获取羊胎盘细胞匀浆液,羊胎盘(克)与生理盐水体积(毫升)之比为1:2;通过离心方法900xg收集羊胎盘细胞,弃上清液,为保证细胞完整性,最大相对离心力不能超过1000xg;
(2)将收集到的羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,离心收集羊胎盘细胞,弃上清液;重复洗涤1次;将羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,分装后可冻存于-70℃冰箱;
(3)从-70℃冰箱取出冻存的羊胎盘细胞置于42℃水浴箱,复融15分钟,融化后每5分钟混匀一次,共两次;-70℃/42℃重复冻融三次,使羊胎盘细胞充分破碎;高速离心(相对离心力8000xg)收集上清液,得全羊胎盘提取液;
(4)全羊胎盘提取液用0.22μm的滤膜进行过滤除菌,滤液用于干细胞表面受体诱导;或冷冻干燥后保存;
(5)取p2~p8代的人骨髓间充质干细胞,培养基为:10.0%fbs、2mmol·l-1l-谷氨酰胺、100u·ml-1链霉素、100u·ml-1青霉素的αmem培养基,培养条件为:37℃、5%co2细胞培养箱中培养。在骨髓间充质干细胞培养板内加入全羊胎盘提取液,终浓度为0.2μg/ml培养24小时后取出干细胞培养液200ul并分离rna,以荧光定量pcr法检测干细胞表面cxcr4表达量,以gapdh为内参基因。诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高22倍。
实施例5
(1)将500g羊胎盘剪切成细小碎块,然后加入1000ml生理盐水,在匀浆机中粉碎羊胎盘获取羊胎盘细胞匀浆液,羊胎盘(克)与生理盐水体积(毫升)之比为1:2;通过离心方法500xg收集羊胎盘细胞,弃上清液,为保证细胞完整性,最大相对离心力不能超过1000xg;
(2)将收集到的羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,离心收集羊胎盘细胞,弃上清液;重复洗涤1次;将羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,分装后可冻存于-70℃冰箱;
(3)从-70℃冰箱取出冻存的羊胎盘细胞置于42℃水浴箱,复融15分钟,融化后每5分钟混匀一次,共两次;-70℃/42℃重复冻融三次,使羊胎盘细胞充分破碎;高速离心(相对离心力8000xg)收集上清液,得全羊胎盘提取液;
(4)全羊胎盘提取液用0.22μm的滤膜进行过滤除菌,滤液用于干细胞表面受体诱导或冷冻干燥后保存;
(5)取p2~p8代的人骨髓间充质干细胞,培养基为:10.0%fbs、2mmol·l-1l-谷氨酰胺、100u·ml-1链霉素、100u·ml-1青霉素的αmem培养基,培养条件为:37℃、5%co2细胞培养箱中培养。在骨髓间充质干细胞培养板内加入全羊胎盘提取液,终浓度为0.2μg/ml培养30小时后取出干细胞培养液200ul并分离rna,以荧光定量pcr法检测干细胞表面cxcr4表达量,以gapdh为内参基因。诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高18倍。
实施例6
(1)将100g羊胎盘剪切成细小碎块,然后加入200ml生理盐水,在匀浆机中粉碎羊胎盘获取羊胎盘细胞匀浆液,羊胎盘(克)与生理盐水体积(毫升)之比为1:2;通过离心方法800xg收集羊胎盘细胞,弃上清液,为保证细胞完整性,最大相对离心力不能超过1000xg;
(2)将收集到的羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,离心收集羊胎盘细胞,弃上清液;重复洗涤1次;将羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,分装后可冻存于-70℃冰箱;
(3)从-70℃冰箱取出冻存的羊胎盘细胞置于42℃水浴箱,复融15分钟,融化后每5分钟混匀一次,共两次;-70℃/42℃重复冻融三次,使羊胎盘细胞充分破碎;高速离心(相对离心力12000xg)收集上清液,得全羊胎盘提取液;
(4)全羊胎盘提取液用0.22μm的滤膜进行过滤除菌,滤液用于干细胞表面受体诱导或冷冻干燥后保存;
(5)取p2~p8代的人骨髓间充质干细胞,培养基为:10.0%fbs、2mmol·l-1l-谷氨酰胺、100u·ml-1链霉素、100u·ml-1青霉素的αmem培养基,培养条件为:37℃、5%co2细胞培养箱中培养。在骨髓间充质干细胞培养板内加入全羊胎盘提取液,终浓度为0.1μg/ml培养18小时后取出干细胞培养液200ul并分离rna,以荧光定量pcr法检测干细胞表面cxcr4表达量,以gapdh为内参基因。诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高20倍。
实施例7
(1)将100g羊胎盘剪切成细小碎块,然后加入200ml生理盐水,在匀浆机中粉碎羊胎盘获取羊胎盘细胞匀浆液,羊胎盘(克)与生理盐水体积(毫升)之比为1:2;通过离心方法800xg收集羊胎盘细胞,弃上清液,为保证细胞完整性,最大相对离心力不能超过1000xg;
(2)将收集到的羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,离心收集羊胎盘细胞,弃上清液;重复洗涤1次;将羊胎盘细胞用生理盐水按质量体积比(克/毫升)1:1悬浮,分装后可冻存于-70℃冰箱;
(3)从-70℃冰箱取出冻存的羊胎盘细胞置于42℃水浴箱,复融15分钟,融化后每5分钟混匀一次,共两次;-70℃/42℃重复冻融三次,使羊胎盘细胞充分破碎;高速离心(相对离心力12000xg)收集上清液,得全羊胎盘提取液;
(4)全羊胎盘提取液用0.22μm的滤膜进行过滤除菌,滤液用于干细胞表面受体诱导或冷冻干燥后保存;
(5)取p2~p8代的人骨髓间充质干细胞,培养基为:10.0%fbs、2mmol·l-1l-谷氨酰胺、100u·ml-1链霉素、100u·ml-1青霉素的αmem培养基,培养条件为:37℃、5%co2细胞培养箱中培养。在骨髓间充质干细胞培养板内加入全羊胎盘提取液,终浓度为5μg/ml培养12小时后取出干细胞培养液200ul并分离rna,以荧光定量pcr法检测干细胞表面cxcr4表达量,以gapdh为内参基因。诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高25倍。
参见图1,上述实施例1~实施例5为向骨髓间充质干细胞培养液中加入全羊胎盘提取液,终浓度为0.2μg/ml,培养至第6小时、12小时、18小时、24小时、30小时,诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照分别高19倍、23倍、28倍、22倍、18倍;实施例6为向骨髓间充质干细胞培养液中加入全羊胎盘提取液,终浓度为0.1μg/ml,培养至第18小时,诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高20倍;实施例7为向骨髓间充质干细胞培养液中加入全羊胎盘提取液,终浓度为5μg/ml,培养至第12小时,诱导后干细胞表面cxcr4表达量较无全羊胎盘提取液对照高25倍。
由以上添加全羊胎素提取物的骨髓间充质干细胞在不同诱导时间的cxcr4基因表达量检测结果可知:终浓度为0.2μg/ml时,诱导18小时的干细胞表面受体cxcr4的表达量较非诱导对照增强可达28倍。
- 还没有人留言评论。精彩留言会获得点赞!