甜菊糖苷衍生物莱鲍迪苷A1G的双酶法制备及其应用的制作方法
本发明属于生物技术和食品化工技术领域。具体而言,本发明涉及一种通过生物酶法制备的甜菊糖苷衍生物莱鲍迪苷a1g、其制备方法以及应用。
背景技术
甜菊糖苷是一系列从菊科草本植物甜叶菊(steviarebaudianabertoni)的叶中提取出的糖苷类物质,是天然的甜味剂。在天然植物甜叶菊的叶中占主要含量的为甜菊苷(stevioside,缩写为stv)和莱鲍迪苷a(rebaudiosidea,缩写为ra,也称为甜菊双糖苷a)。莱鲍迪苷a的分子结构如下所示,是一种含20个碳原子的四环二萜类糖苷物质,其由二萜核心在c19位上连接一个葡糖基和c13为上连接3个葡糖基而形成:
研究表明,莱鲍迪苷a的甜度是蔗糖的200-300倍,热量仅为蔗糖的1/300,对酸、碱、热都很稳定,长期储存不易变质,加入食品中经热处理也不会有褐变现象,且不容易造成龋齿。我国在《gb8270-2014食品安全国家标准》和《gb2760-2014食品安全国家标准》的国家标准中对其做作为食品添加剂的使用进行了详细说明。2009年,美国食品药品监督管理局fda也认可莱鲍迪苷a为“gras(generallyrecognizedassafe,总体认为是安全的)”的级别。甜菊糖苷类物质作为蔗糖的天然替代品,不仅可以降低成本,同时也符合食品、饮料逐渐向低糖低热量化发展的要求。其应用前景广阔,是一种非常理想的具有多种用途的绿色甜味剂。
甜菊糖苷虽有着众多优势,但是其主要成分莱鲍迪苷a有严重的苦涩后味,阻碍了它在食品等领域的广泛应用。目前,甜菊糖苷口感的改善可通过生物酶法转化来实现。已有报道,可以葡萄糖基转移酶以udp葡萄糖为葡萄糖基供体对甜菊糖苷的主要成分添加葡萄糖基。但该方法使用的糖基供体udp葡萄糖价格昂贵,成本偏高(biocatalysis:anindustrialperspective,royalsocietyofchemistry,2017,pp199)。还有报道,可利用环糊精糖基转移酶(cgt)改性甜菊糖苷,但是不同生物来源的cgt酶的催化效率和转糖基位点不同,得出的酶催化产物复杂多样(simpleandefficientenzymatictransglycosylationofsteviosidebybeta-cyclodextringlucanotransferasefrombacillusfirmus.biotechnollett.2009sep;31(9):1415-1420)。此外,仅利用cgt的单酶催化产物为不同程度糖基化的衍生物的混合物,这就造成了口感的不均一性,且这些衍生物的分子结构和极性都非常相近,难以分离纯化,很难获得高纯度的单一有效产物。
因此,本领域迫切需要开发出具有改善口感的莱鲍迪苷a衍生物产品及其高效生产的方法。
技术实现要素:
为了解决以上问题,本发明提出一种通过双酶催化法生产新型甜菊糖衍生物的方法及其产物,以改善原料口感,可以较低的成本和较短的生产周期产出优质的生物酶法制备的甜菊糖苷衍生物。
在本发明的第一方面中,提供了如下结构所示的化合物莱鲍迪苷a1g:
在本发明的另一方面中,提供了制备莱鲍迪苷a1g的方法,其中,所述莱鲍迪苷a1g的结构式如上所示,所述方法包括步骤:
(1)提供莱鲍迪苷a和葡萄糖基供体;
(2)通过环糊精糖基转移酶和淀粉酶的催化产生如上结构式的莱鲍迪苷a1g。
在一些实施方式中,所述莱鲍迪苷a为选自下组的一种或多种:存在于天然植物中的莱鲍迪苷a、提取的莱鲍迪苷a、合成的莱鲍迪苷a。
在一些实施方式中,所述葡萄糖基供体为选自下组的一种或多种:淀粉,如可溶淀粉;糊精;麦芽糊精;α-环糊精、β-环糊精、γ-环糊精;麦芽糖。
在一些实施方式中,所述环糊精糖基转移酶选自:α-环糊精糖基转移酶、β-环糊精糖基转移酶、γ-环糊精糖基转移酶。
在一些实施方式中,所述淀粉酶为选自下组中的一种或多种:糖化酶、α-淀粉酶、β-淀粉酶、γ-淀粉酶。
在一些实施方式中,所述糖基转移酶的用量为0.1~30knu/l,例如0.5~20knu/l,1~15knu/l,或5000~50000u/ml,例如10000~40000u/ml,15000~35000u/ml。在一些实施方式中,所述糖基转移酶的用量为5~200knu/kg莱鲍迪苷a,例如10~150knu/kg。
在一些实施方式中,所述淀粉酶的用量为30~300u/ml,例如50~250u/ml,80~220u/ml。在一些实施方式中,所述淀粉酶的用量为300~3000u/g莱鲍迪苷a,例如800~2200u/g莱鲍迪苷a。
在一些实施方式中,所用的一种或多种酶为固定化酶。
在一些实施方式中,莱鲍迪苷a的起始浓度为5~200g/l,例如8~150g/l,10g~120g/l。
在一些实施方式中,葡萄糖基供体的起始浓度为10~800g/l,例如20~700g/l,30~600g/l,30~300g/l。
在一些实施方式中,步骤(2)在水相体系中进行,例如在水(如纯水、蒸馏水、超纯水,ph6)中进行。
在一些实施方式中,步骤(2)的反应温度为35~90℃,如40~90℃,45~85℃,50~70℃,45~85℃。
在一些实施方式中,步骤(2)的反应时间为0.5~72小时,如1~48小时,1.5~36小时,5~20小时。
在一些实施方式中,所述方法还包括选自下组的一个或多个步骤:待酶反应完成后终止酶反应,例如通过煮沸(如100℃煮沸5分钟)使酶变性;分离糖基转移酶的催化反应产物,以用于淀粉酶催化的反应;直接取用糖基转移酶的催化反应后的反应液,以用于淀粉酶催化的反应;补充生产中消耗的莱鲍迪苷a、葡萄糖基供体、糖基转移酶和/或淀粉酶;对步骤(2)所得的莱鲍迪苷a进行分离、纯化、成盐、光学拆分、鉴定和/或包装;和/或,将未用尽的莱鲍迪苷a、葡萄糖基供体、糖基转移酶和/或淀粉酶循环利用到下一轮反应。
在本发明的另一方面中,提供了一种组合物,其包含:(i)本发明的莱鲍迪苷a1g,和/或,通过本发明方法获得的莱鲍迪苷a1g;以及(ii)药学上、食品学上、保健品学上或日用化学品学上可接受的载体、赋形剂和/或辅料;(iii)可选地,其他甜味剂或矫味剂,例如罗汉果苷、安赛蜜、阿斯巴甜、三氯蔗糖、糖精钠、木糖醇、山梨糖醇、赤藓糖醇、蔗糖、果糖、葡萄糖、麦芽糖、柠檬酸、苹果酸、酒石酸、乳酸、甘氨酸、丙氨酸、丝氨酸。
在本发明的另一方面中,提供了本发明莱鲍迪苷a1g,或者,通过本发明方法获得的莱鲍迪苷a1g,或者,本发明的组合物的应用,其用做甜味剂、矫味剂和/或遮味剂,例如用于制备食品、饮料、烟草产品、调味品、日用化工产品、药物组分、营养保健产品、口腔卫生产品和/或化妆品。
在本发明的另一方面中,提供了一种产品,其包含本发明的莱鲍迪苷a1g,和/或,通过本发明方法获得的莱鲍迪苷a1g,和/或,本发明的组合物。
在一些实施方式中,所述产品选自下组:食品,饮料,烟草产品,调味品,日用化工产品,药物组分,营养保健产品,口腔卫生产品和/或化妆品。
在本发明的另一方面中,提供了一种包装品,其包含:本发明的莱鲍迪苷a1g,和/或,通过本发明方法获得的莱鲍迪苷a1g;以及,包装物和/或容器。
在一些实施方式中,所述包装物和/或容器可选自:柔性包装物或容器,例如袋(如纸袋、塑料袋,优选密封袋)和瓶(如塑料瓶);刚性包装物或容器,例如玻璃容器、金属容器、陶瓷容器等。
本领域的技术人员可对上述的技术方案和技术特征进行任意组合而不脱离本发明的发明构思和保护范围。本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
下面结合附图对本发明作进一步说明,这些附图仅为了图示说明本发明的实施方案,而不是为了局限本发明的范围。
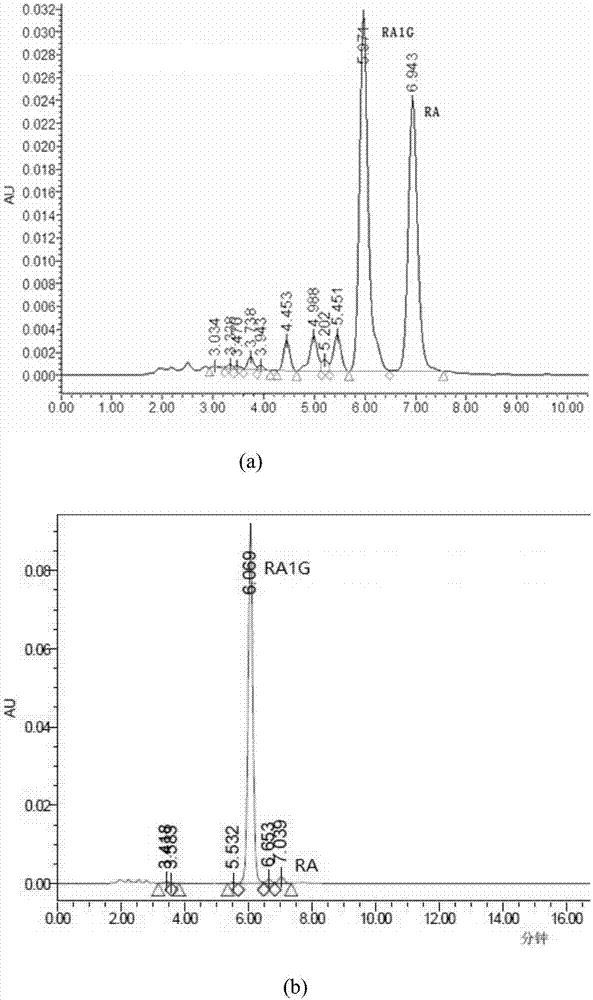
图1:双酶法催化生成莱鲍迪苷a1g产物(a)及纯化后莱鲍迪苷a1g的高效液相色谱图(b)。
图2:双酶法催化生成莱鲍迪苷a1g的示例性流程简图(以采用可溶淀粉作为葡萄糖基供体采用cgt和糖化酶来催化为例)。
图3:莱鲍迪苷a1g的高分辨质谱图。
图4:乙酰化莱鲍迪苷a1g的核磁共振氢谱图。
图5:乙酰化莱鲍迪苷a1g的核磁共振碳谱图。
图6:乙酰化莱鲍迪苷a1g的核磁共振二维cosy谱图。
图7:乙酰化莱鲍迪苷a1g的核磁共振二维hsqc谱图。
图8:乙酰化莱鲍迪苷a1g的核磁共振二维hmbc谱图。
具体实施方式
本发明中提供了一种新型的莱鲍迪苷a衍生物,其在莱鲍迪苷a二萜核心的c19位连接的葡萄糖上通过α-1,4键连接了一个葡萄糖基,故将其命名为莱鲍迪苷a1g(即ra1g)。本发明中还提供了该衍生物的制备方法,所述方法以莱鲍迪苷a为原料,通过两步酶催化进行。与原料莱鲍迪苷a相比,本发明的莱鲍迪苷a1g具有提高的甜度、改善的口感。并且,本发明的莱鲍迪苷a1g还具有生产成本低,生产周期短,生产过程绿色环保等特点。
如本文所用,术语“双酶法”是指以莱鲍迪苷a和葡萄糖基供体为原料,采用两种酶进行催化反应以获得莱鲍迪苷a1g的方法。关于双酶法中所用的反应原料、酶、反应条件、反应产物等的具体描述可参见下文。
如本文所用,“含有”、“具有”或“包括”包括了“包含”、“主要由……构成”、“基本上由……构成”、和“由……构成”;“主要由……构成”、“基本上由……构成”和“由……构成”属于“含有”、“具有”或“包括”的下位概念。
本文中提供的所有数值范围旨在清楚地包括落在范围端点之间的所有数值及它们之间的数值范围。可对本发明提到的特征或实施例提到的特征进行组合。本说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。
反应底物
本发明中可用于双酶法生产莱鲍迪苷a1g的主要反应原料为莱鲍迪苷a和葡萄糖基供体。
用于双酶法生产莱鲍迪苷a1g的莱鲍迪苷a原料可为各种来源的莱鲍迪苷a。可选用的莱鲍迪苷a原料包括但不限于:从天然植物中提取并直接用于本发明方法的莱鲍迪苷a,例如以甜叶菊叶为原料,通过浸提、除杂、脱色、干燥等工艺获得;市售的莱鲍迪苷a;合成的莱鲍迪苷a,例如通过微生物发酵(如重组毕赤酵母、重组酿酒酵母、重组大肠杆菌)合成。可将粉末、晶体、溶液等状态的莱鲍迪苷a用于本发明的反应体系中。
用于双酶法生产莱鲍迪苷a1g的葡萄糖基供体可为能作为糖基转移酶(如环糊精糖基转移酶,cgt)的底物通过酶促反应将其中所含的糖分子转移到受体上的任何多糖和/或低聚糖。可用于本发明的葡萄糖基供体包括但不限于:淀粉(优选可溶淀粉)、β-环糊精、α-环糊精或者γ-环糊精、麦芽糊精、麦芽糖。
酶
在本发明中用于生产莱鲍迪苷a1g的酶有两类,分别为催化转糖基和催化水解反应的酶,优选糖基转移酶(如环糊精糖基转移酶)和淀粉酶。
糖基转移酶是一类催化活化的糖连接到不同的受体分子(如本发明的莱鲍迪苷a)上的酶。环糊精糖基转移酶(cgt酶)是一种能催化不同反应的多功能型酶,其可将葡萄糖基供体上的糖基转移到受体(在本发明中为莱鲍迪苷a)上。关于环糊精糖基转移酶的特性、制备和应用可参见吴敬等,《环糊精葡萄糖基转移酶的制备与应用》(2011年,化学工业出版社)。环糊精糖基转移酶(cgt)可为各种来源的酶,例如市售cgt酶、基因工程化生产的cgt酶等。
淀粉酶是一种水解淀粉和糖原的酶类。可用于本发明方法中的淀粉酶包括但不限于:糖化酶、α-淀粉酶、β-淀粉酶。糖化酶,又称葡萄糖淀粉酶(glucoamylase,ec3.2.1.3),它能把淀粉从非还原性未端水解α-1,4和α-1,6葡萄糖苷键产生葡萄糖,,同时该酶还能水解糊精、糖原的非还原末端释放β-d-葡萄糖。
本发明所用的这两种酶可市售获得,例如购自日本天野酶制品株式会社、诺维信(中国)生物技术有限公司、江西百盈生物技术有限公司等;也可通过微生物发酵等方式获得,只要其具有所需的催化活性。优选采用酶活力高、稳定性高的酶制剂,也可采用固定化形式的酶。
酶促反应
本发明的酶促反应在水相体系中进行,以莱鲍迪苷a为受体底物,以可溶淀粉、β-环糊精或者α-环糊精、麦芽糖等为葡萄糖基供体底物,在环糊精糖基转移酶(cgt)催化作用下进行转糖基反应,生成莱鲍迪苷a衍生物的混合体系,再通过淀粉酶(例如糖化酶)催化混合体系中各成分的水解反应,最终获得均一性更高的新型莱鲍迪苷a衍生物,即莱鲍迪苷a1g。
可将本发明的两种原料溶于水(如纯水、蒸馏水、超纯水等)中,形成水相体系。莱鲍迪苷a原料在反应体系中的初始浓度可为5~200g/l,例如8~150g/l,10g~120g/l。葡萄糖基供体底物原料在反应体系中的初始浓度可为10~800g/l,例如20~700g/l,30~600g/l,30~300g/l。通常所用莱鲍迪苷a原料与葡萄糖基供体原料的比例可为1:2~4重量比。
在水相体系中加入环糊精糖基转移酶(cgt)催化转糖基反应以生成一系列转糖基的莱鲍迪苷a衍生物的混合体系。cgt酶在反应体系中的终浓度可为0.1~30knu/l,例如0.5~20knu/l,1~15knu/l,或5000~50000u/ml,例如10000~40000u/ml,15000~35000u/ml。cgt酶在反应体系中的含量可为5~200knu/kg莱鲍迪苷a,例如10~150knu/kg莱鲍迪苷a。根据反应产物生成情况,可选择将cgt酶的反应温度设置在35~90℃范围内,例如40~90℃,45~85℃,50~70℃,可根据所用的具体酶以及工业成本等对此进行调整。可将cgt酶反应体系的ph设置为该酶最适ph左右,例如ph4~7,ph4.5~6.5,ph5~6,可根据所用的具体酶对此进行调整。cgt酶反应的时间可根据反应进程进行调整,例如反应0.5~72小时,1~48小时,1.5~36小时,5~20小时。
gct酶反应完成后,可通过各种方式终止酶反应(例如较简单的方式是通过煮沸(如100℃煮沸5分钟)使该酶变性以终止反应)。可选地,对所得反应产物进行离心并分离上清液以用于下一步反应。也可将所得反应产物不经分离和纯化直接用于下一步反应。
在gct酶反应产物中加入淀粉酶(如糖化酶)以将莱鲍迪苷a衍生物混合体系中的成分催化分解为在莱鲍迪苷a二萜核心c19位上的葡萄糖通过α-1,4键连接了一个葡萄糖基的莱鲍迪苷a1g。
在一些实施方式中,所述淀粉酶的用量为30~300u/ml,例如50~250u/ml,80~220u/ml。在一些实施方式中,所述淀粉酶的用量为300~3000u/g莱鲍迪苷a,例如800~2200u/g莱鲍迪苷a。
根据反应产物生成情况,可选择将淀粉酶的反应温度设置在35~90℃的范围内,例如40~90℃,45~85℃,50~70℃,可根据所用的具体酶以及工业成本等对此进行调整。可将淀粉酶反应体系的ph设置为该酶最适ph左右,例如ph4~7,ph4.5~7,ph5~7,可根据所用的具体酶对此进行调整。淀粉酶反应的时间可根据反应进程进行调整,例如反应0.5~72小时,1~48小时,1.5~36小时,2~10小时。
淀粉酶反应完成后,可通过各种方式终止酶反应(例如较简单的方式是通过煮沸(如100℃煮沸5分钟)使该酶变性以终止反应)。可对所得反应产物进行进一步分离、干燥、提纯、鉴定等步骤,以获得所需的莱鲍迪苷a1g。
例如,可通过离心分离反应上清液和沉淀物,如12000rpm,离心5分钟等。例如,可通过色谱法分离反应产物,如采用hplc。一种可选的hplc仪器和条件为:agilent1200hplc系统phenomenexluna5μmc18(2)4.6mm×250mm色谱柱,流动相为乙腈-磷酸二氢钠水溶液(ph2.6)。根据本发明,上述的进一步分离的单次上样量为5μl,流速为1.0ml/min,流动相为乙腈:磷酸二氢钠水溶液(ph2.6)体积比68:32,紫外检测波长为210nm。例如,可通过冻干法对所得产物进行干燥。例如,可通过结晶法对所得产物进行进一步的纯化。
本领域普通技术人员也应理解上述反应可采用固定化酶体系进行,可采用固定化的cgt酶和/或固定化的淀粉酶。
可通过高分辨质谱法、核磁共振等方法对用本发明的双酶法获得的产物进行表征,以确定所得产物为莱鲍迪苷a二萜核心的c19位上的葡萄糖通过α-1,4键连接了葡萄糖基,即所得为莱鲍迪苷a1g。
此外,可将反应中未用尽的莱鲍迪苷a、葡萄糖基供体、糖基转移酶和/或淀粉酶循环利用到下一轮反应,以节约成本,提高产率。
示例性制备方法
本发明的一个示例性的方法如下所述,应理解该示例性方法仅用于说明本发明而不用于限制本发明的范围。本领域技术人员可对本发明做出适当的修改、变动,这些修改和变动都在本发明的范围之内。
本发明的一个示例性方法中提供了一种由莱鲍迪苷a通过生物酶法制备甜菊糖衍生物莱鲍迪苷a1g的方法,包括如下步骤:
(1)在水相体系中,以莱鲍迪苷a为受体底物,反应初始浓度为10g~120g/l,以可溶淀粉、β-环糊精或者α-环糊精、麦芽糖为葡萄糖供体底物,反应初始浓度为30~300g/l,在α-环糊精糖基转移酶(cgt)催化作用下进行转糖基反应,生成系列莱鲍迪苷a的衍生物;
(2)将步骤(1)制得的反应体系于45~85℃水浴中反应1~48小时,煮沸终止反应,离心,取上清液;
(3)将步骤(2)获得的上清液,加入糖化酶,以步骤(2)中混合体系中的所有成分为底物,进行水解反应;
(4)将步骤(3)制得的反应体系于45~85℃水浴中反应1~48小时,煮沸终止反应,离心,取上清液;
(5)将步骤(4)制得的上清液,经分离、干燥后,制得一种莱鲍迪苷a的衍生物莱鲍迪苷a1g。
在一个实例中,所述步骤(1)中的水相体系为蒸馏纯水,ph6.0。
在一个实例中,所述步骤(1)中的α-环糊精糖基转移酶可购自江西百盈生物技术有限公司、诺维信(中国)生物技术有限公司和日本天野酶制品株式会社,终浓度为0.05~2g/l。
在一个实例中,所述步骤(1)中的葡萄糖供体底物为可溶淀粉、糊精、麦芽糖
在一个实例中,所述步骤(2)中的反应条件为60℃水浴,反应时间为15小时。
在一个实例中,所述步骤(2)中的煮沸终止反应条件为100℃煮沸5分钟。
在一个实例中,所述步骤(2)中的离心转速为12000rpm,时间为5分钟。
在一个实例中,所述步骤(3)中的糖化酶可购自陕西森弗天然制品有限公司和上海源叶生物技术有限公司,终浓度为0.5~20g/l
在一个实例中,所述步骤(4)中的反应条件为60℃水浴,反应时间为3小时
在一个实例中,所述步骤(4)中的煮沸终止反应条件为100℃煮沸5分钟。
在一个实例中,所述步骤(4)中的离心转速为12000rpm,时间为5分钟。
在一个实例中,所述步骤(5)中的分离采用agilent1200hplc系统phenomenexluna5μmc18(2)4.6mm×250mm色谱柱,流动相为乙腈-磷酸二氢钠水溶液(ph2.6)。
根据本发明进一步在一个实例中,上述的进一步分离的单次上样量为5μl,流速为1.0ml/min,流动相为乙腈:磷酸二氢钠水溶液(ph2.6)体积比68:32,紫外检测波长为210nm。
在一个实例中,所述步骤(5)中的干燥为冷冻干燥。
莱鲍迪苷a1g的应用及相关产品
本发明的莱鲍迪苷a1g具有高甜度、口感佳、绿色健康等多种优点,由此可广泛应用于食品、饮料、药物、保健品、烟草产品、调味品、日用化工产品、口腔卫生产品、化妆品等各种领域中。
可根据需要用各种形式提供莱鲍迪苷a1g,例如干粉、结晶、溶液、组合物等形式。例如,可将本发明的莱鲍迪苷a1g制成便于储存、运输和使用的包装物。例如,可将本发明的莱鲍迪苷a1g与可接受的辅料或赋形剂组合,以形成本发明的组合物。本发明的组合物包含有效量的莱鲍迪苷a1g,并且可任选地包含水、食品添加剂、食品辅料、药物辅料等可接受的辅料或赋形剂。在一个实施方式中,所述食品添加剂可选自但不限于:香精香料、乳化剂、抗氧化剂、食用色素。
可将本发明的莱鲍迪苷a1g与其他甜味剂或矫味剂复配以进一步改善其口味或达到所需味觉要求,例如用于复配的其他甜味剂或矫味剂包括但不限于:罗汉果苷、安赛蜜、阿斯巴甜、三氯蔗糖、糖精钠、木糖醇、山梨糖醇、赤藓糖醇、蔗糖、果糖、葡萄糖、麦芽糖、柠檬酸、苹果酸、酒石酸、乳酸、甘氨酸、丙氨酸、丝氨酸。
如本文所用,术语“可接受的”成分是适用于人和/或动物而没有或无过度不良副反应(如毒性、刺激和变态反应)的,即有合理的效益/风险比的物质。如本文所用,术语“有效量”是指可产生所需甜味、矫味和/或遮味效果的且可被人和/或动物所接受的量。
可将本发明的组合物配制成粉剂、颗粒剂、悬乳剂、水乳剂、乳油剂、微胶囊剂等可用的剂型。本领域普通技术人员可根据具体应用的需要对其剂型和施用形式进行选择。
本发明的莱鲍迪苷a1g或莱鲍迪苷a1g组合物可以应用在各类需要甜味或矫味或遮味的产品中。以产品的重量计,莱鲍迪苷a1g或莱鲍迪苷a1g组合物的加入量可为例如,0~0.064%或0%~0.085%。在一些应用中,所述产品为液态,以所述产品的总体积为基准计,莱鲍迪苷a1g或莱鲍迪苷a1g组合物的浓度可例如远低于蔗糖的使用浓度,例如可为0~0.56g/l或0~0.84g/l。
本领域技术人员也可根据具体需要对莱鲍迪苷a1g或其组合物的加入量、加入时间或加入方式等进行适当的调整,以获得最佳的效果。
有益效果
本发明的方法和产品具有如下一种或多种优异效果:
(1)本发明采用环糊精糖基转移酶-糖化酶的双酶体系,制备了一种新型的甜菊糖苷衍生物莱鲍迪苷a1g(ra1g),该衍生物结构世界范围内未见报道,其具有口感明显优于莱鲍迪苷a的特点,为甜菊糖苷这类多功能的甜味剂的开发和应用提供了极具潜力的产品。
(2)本发明的双酶体系,优选工业/商业用酶制剂,成本低廉,质量稳定。双酶反应结束时其目标产物的含量可达50%以上,两步反应中间可不需要分离纯化步骤,对终反应液分离提纯处理即可获得莱鲍迪苷a的衍生物产品。制备过程简单,转化效率高,且生产成本低、周期短,易工业化。
(3)本发明以天然甜菊糖苷的主要成分莱鲍迪苷a为糖基受体底物,以可食用的淀粉、糊精或麦芽糖为糖基供体底物,利用生物酶法制备莱鲍迪苷a衍生物产品,生产工艺绿色安全,极大的提高产品的竞争力。本发明所得产品,在食品、饮料等行业,具有重要的应用价值。
实施例
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。本领域技术人员可对本发明做出适当的修改、变动,这些修改和变动都在本发明的范围之内。
下列实施例中未注明具体条件的实验方法,可采用本领域中的常规方法或按照供应商所建议的条件。除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1:利用莱鲍迪苷a和可溶淀粉制备甜菊糖苷衍生物
精确称取2g莱鲍迪苷a(购自浩天药业有限公司,ra97)和2g可溶淀粉(购自天津市科密欧化学试剂有限公司,03010803),将其溶解于单次蒸馏的纯水中,加入环糊精糖基转移酶(购自诺维信(中国)生物技术有限公司,toruzyme3.0l,acn00216,3knu/ml)1knu,配置成40ml,ph6.0的反应体系。将该反应体系置于60℃恒温摇床中开始反应,150rpm振荡15h,100℃煮沸终止反应。12000g离心5min,取上清作为样品,使用hplc(agilent1200hplc,流动相为乙腈-磷酸二氢钠水溶液(ph2.6),流速为1.0ml/min)配合phenomenexluna5μmc18(2)4.6mm×250mm柱和紫外检测器检测(210nm)衍生物生成情况。
实施例2:利用糖化酶催化甜菊糖苷衍生物制备高含量的新型莱鲍迪苷a衍生物
取实施例1中反应后的上清20ml,加入精确称量的糖化酶(购自陕西森弗生物技术有限公司,批号01080011,150000u/g)4000u,于60℃恒温摇床中开始反应,150rpm振荡3h,100℃煮沸终止反应。12000g离心5min,取上清作为样品,使用hplc(dac50高压制备色谱,流动相为乙腈:水溶液=29:71,流速为70ml/min)配合10μmc18(500g)50mm×500mm柱和紫外检测器检测(210nm),结果如图1所示,ra1g的保留时间约为6.0min。取双酶催化反应产物,使用以上hplc条件分离,并收集5.85-6.25min时间范围内的成分,冻干,为纯化的ra1g。经hplc检测(条件见上),纯化的ra1g纯度为95%。
实施例3:以莱鲍迪苷a和β-环糊精为原料通过双酶法改性制备莱鲍迪苷a1g
向反应釜(无锡红旗压力容器制造有限公司,500kg乳化锅,设备代码21701098220170001)中加入100l纯化水。称取6kg莱鲍迪苷a(浩天药业有限公司,ra97)和6kgβ-环糊精(曲阜天利药用辅料有限公司,170805),投入反应釜,加热溶解。加入酶改性第一步反应所需的环糊精糖基转移酶(购自诺维信(中国)生物技术有限公司,toruzyme3.0l,acn00216,3knu/ml)600knu。将料液温度维持在60℃,搅拌转速30rpm/min,反应24h。100℃煮沸终止反应。反应液经hplc检测。具体检测条件如下:所用hplc为thermou3000,流动相为乙腈-磷酸二氢钠水溶液(ph2.6),流速为1.0ml/min,配合thermoc184.6mm×250mm(5um)柱和紫外检测器检测(210nm)。
然后,向上述反应液中加入酶改性第二步反应所需的糖化酶(购自陕西森弗生物技术有限公司,批号01080011,150000u/g)15×106u,60℃,搅拌转速20rpm/min,反应2h,100℃煮沸终止反应。反应液经hplc检测衍生物生成情况,检测条件如上所述。
在上述制备过程中产物中各主要组分的含量如下表1中所示。表中,ra2g和ra3g分别代表在莱鲍迪苷a上又连接了2个或3个葡萄糖的莱鲍迪苷a衍生物。
表1.莱鲍迪苷a双酶法改性100l反应体系中产物分析结果
取酶改性第二步产物,使用hplc分离纯化,条件如实施例2。
实施例4:新型莱鲍迪苷a衍生物的结构鉴定
通过质谱和核磁共振技术解析由实施例2和实施例3中获得的纯化的莱鲍迪苷a衍生物ra1g的结构。质谱使用日本岛津高效液相色谱仪耦联离子阱飞行时间质谱(lcms-it-tof),在负离子模式收集数据,流动相为乙腈:水(68:32),流速为1ml/min,分辨率为10000半高全宽。核磁使用brukerdrxavance600mhzspectrometer(switzerland)收集数据,1h谱检测频率为600mhz,13c谱为150mhz,两者检测温度均为25℃。
该衍生物质荷比为1127.4595为莱鲍迪苷a加1个葡萄糖(参见图3)。对该衍生物进行全乙酰化,并根据氢、碳及二维核磁共振谱分析(可参见图4~图8的谱图),确定该衍生物为莱鲍迪苷a二萜核心的c19位的葡萄糖基上通过α-1,4键连接了一个葡萄糖基,故将其命名为莱鲍迪苷a1g。
实施例5:对双酶法第一步转糖基反应底物添加量的研究
按照质量比1:1分别称取10~100mg的莱鲍迪苷a及可溶淀粉(来源同实施例1)或α-环糊精(生工生物工程(上海)股份有限公司,货号10016-20-3)或β-环糊精(曲阜天利药用辅料有限公司,170805),混合溶解于单次蒸馏的纯水中,加入环糊精糖基转移酶(同实施例1)0.025knu,配置成1ml反应体系,进行实验。将各组实验体系置于60℃恒温摇床中开始反应,150rpm振荡10h,100℃煮沸终止反应。12000g离心5min,取上清作为样品,使用hplc配合phenomenexluna5μmc18(2)4.6mm×250mm柱和紫外检测器检测衍生物生成情况。采用如下公式计算莱鲍迪苷a的转化率:
莱鲍迪苷a转化率(%)=(ra初始浓度-反应终止时ra浓度)/ra初始浓度×100%
结果显示所有测试条件下,莱鲍迪苷a的转化率均达到60%以上,其中82.5mgβ-糊精供体和82.5mg莱鲍迪苷a获得了最高转化率(80%)。
实施例6:对酶品种选择及酶量的研究
选取实施例5中转化率较高的底物组合(82.5mgβ-糊精供体+82.5mg莱鲍迪苷a),分别加入购自不同公司的环糊精糖基转移酶配制成酶终浓度不同的反应体系,酶终浓度分别为江西百盈生物技术有限公司(批号15112514,400000u/ml)和日本天野酶制品株式会社(cgtamano,300000u/ml)10000~50000u/ml,诺维信(中国)生物技术有限公司的酶(toruzyme3.0l,acn00216,3knu/ml)1-20knu/l。
各组实验体系于60℃恒温摇床开始反应,150rpm振荡10h,100℃煮沸终止反应。12000g离心5min,取上清作为样品,并使用hplc配合phenomenexluna5μmc18(2)4.6mm×250mm柱和紫外检测器检测衍生物生成情况。如前计算莱鲍迪苷a的转化率,结果显示,在使用诺维信及日本天野酶的所有测试条件下,莱鲍迪苷a的转化率均达到70%以上,其中采用7.5knu/l诺维信toruzyme3.0l环糊精糖基转移酶时获得了较高的转化率为87%。
根据以上莱鲍迪苷a转化率最高的酶(即7.5knu/l诺维信toruzyme3.0l环糊精糖基转移酶,转化率为87%),取上清样品1ml,分别加入购自不同公司的糖化酶:陕西森弗天然制品有限公司(货号01080011,酶活150000u/g),或上海源叶生物技术有限公司(货号9032-08-0,酶活10000u/ml),或上海源叶生物技术有限公司α-淀粉酶(货号9000-90-2,酶活12000u/g)或β-淀粉酶(货号9000-91-3,酶活50000u/g),加酶量为100-200u。
将各组实验体系于60℃恒温摇床开始反应,150rpm振荡5h,100℃煮沸终止反应。12000g离心5min,取上清作为样品,并使用hplc配合phenomenexluna5μmc18(2)4.6mm×250mm柱和紫外检测器检测(210nm)衍生物生成情况。
莱鲍迪苷a1g产率(%)=反应终止时ra1g浓度/ra初始浓度×100%。
结果显示,采用糖化酶、α-淀粉酶或β-淀粉酶均能实现莱鲍迪苷a糖基化衍生物的混合物向单一衍生物莱鲍迪苷a1g的转化,莱鲍迪苷a1g的产率为10~53%,其中使用糖化酶的产率为35%~53%,最高产率53%是使用180u陕西森弗天然公司的糖化酶实现的。
选择莱鲍迪苷a1g产率最高的糖化酶量180u/ml进行后续优化。
实施例7:反应时间和反应温度研究
采用实施例6中第一步转糖基反应体系,于50~80℃在1h~6h的反应时间内进行催化反应。间隔取样,样品煮沸终止后离心并于冰上保存。将上清样品进行hplc分析。结果显示,所有测试条件下,莱鲍迪苷a的转化率均达到60%以上,其中,70℃反应时间为5小时,莱鲍迪苷a的转化率最高(87.5%)。
采用实施例6中第二步糖化酶反应体系,于50~80℃在1h~6h的反应时间内进行催化反应。每小时取样,样品煮沸终止后离心并于冰上保存。将上清样品进行hplc分析。结果显示,所有测试条件下,ra1g的产率均为30%以上,其中60℃反应时间为3小时ra1g产率最高(53%)。
实施例8:莱鲍迪苷a1g的感官评价实验
感官评价实验采用的甜菊糖苷原料,其中ra1g如实施例2hplc法制备,其余测试品均购自浩天药业有限公司,其中ra1g纯度为95%,莱鲍迪苷a(ra)纯度为97%,莱鲍迪苷d(rd)纯度为95%。
将以上甜菊糖苷原料按照不同的配比(表2)溶解在纯净水中,配成360~560ppm样品溶液(为了达到代糖使用目的,本行业使用同甜度下对食品添加剂进行感官评价比较),分别取10ml样品溶液于30ml一次性试饮杯中,由8位经过培训且经验丰富的感官人员进行感官品评(盲评),评定结果取感官人员所打分数的平均值。
测评中,甜度以质量分数为10%蔗糖水溶液(10g/100ml)为标准,按10分计(甜度同10%的蔗糖为10分,同9%的蔗糖为9分,以此类推),完全察觉不出甜味为0分。
苦度以很苦为10分,完全觉察不出苦味为0分的标准进行评分。
综合评价根据总体口感给予0-100分,100分代表9%蔗糖的口感,出现苦味、涩味及其它杂味为扣分项,杂味是指甜、苦、涩味之外的其它不良味道,如醇味、塑料味、金属味、甘草味、化学味等不良味道。品尝时保证各样品的甜度基本一致,比较它们除了甜度之外的其它味道,如苦、杂味等。
由表2可以知,560ppmra1g溶液的甜度与7%蔗糖溶液相似,后苦味及其他不良口感远低于ra,其口感明显优越于原料莱鲍迪苷a。
表2.莱鲍迪苷a1g的感官评价结果
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!