一种可用于展示大量外源蛋白的重组质粒及构建方法和应用与流程
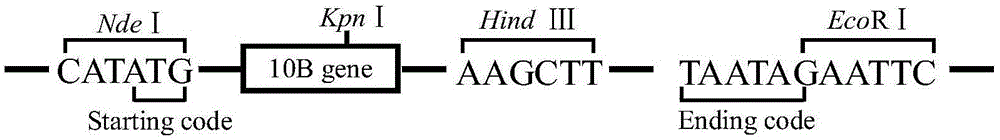
本发明涉及生物技术领域,特别是涉及一种可用于展示大量外源蛋白的重组质粒及构建方法和应用。
背景技术:
众所周知,细胞展示技术是以表达在细胞表面的蛋白为载体,通过基因工程操作将待展示的基因与细胞表面蛋白的表达基因融合,利用细胞自身的编码翻译系统将外缘蛋白展示在细菌或者酵母表面,从而赋予细胞以新的功能。目前,细胞展示技术已经成功应用在疫苗制备、肽库及抗体库的筛选、抗体生产等诸多领域。在抗体库的构建方面,pcantab-5e载体是应用最普遍的载体。但是sfii、noti核酸内切酶的最适温度不同,分步酶切造成的酶切效率低下和步骤繁琐是影响所构建文库库容的重要影响因素之一。
t7噬菌体展示系统能够用于高效展示从长度6-20氨基酸残基的小肽到大至300aa的蛋白;t7为烈性噬菌体,能够在1-2h完全裂解宿主菌,经peg/nacl法沉降能快速方便的收集。以往利用t7噬菌体进行展示,需要先将外源基因连接在t7基因组dna的10b编码基因下游,然后将该基因用t7外壳蛋白包装,才能形成完整的t7噬菌体。鉴于t7基因组dna较长,不易操作,而且t7外壳蛋白价格高昂,自行制备需要超高速离心机而且活性难以保证,所以应用t7噬菌体进行文库构建的难度极大。
基于细胞表面展示技术广泛应用以及t7噬菌体展示系统尚存的不足,构建一种可以展示大量外源蛋白的方法十分必要。
技术实现要素:
为解决上述技术问题,本发明目的在于提供一种可以拓展t7噬菌体展示系统在细胞表面展示技术方面的应用的可用于展示大量外源蛋白的重组质粒。
本发明的目的之二在于提供了所述可用于展示大量外源蛋白的重组质粒的制备方法。
本发明的目的之三在于提供了所述可用于展示大量外源蛋白的重组质粒在噬菌体展示方面的应用。
本发明的一种可用于展示大量外源蛋白的重组质粒,是以pet24a质粒为基础,在其开放阅读框内插入seqidno.1所示氨基酸对应的核苷酸序列,并在在该核苷酸序列后面插入seqidno.2所示的酶切位点与终止密码子的核苷酸序列。
本发明的一种可用于展示大量外源蛋白的重组质粒,所述seqidno.1所示氨基酸对应的核苷酸序列为seqidno.3所示的10b蛋白序列。
本发明的一种可用于展示大量外源蛋白的重组质粒,其构建方法包括以下步骤:
(1)噬菌体外壳蛋白10b基因的获得:以t7select415-1b噬菌体dna为模板,在5’端引物和3’端引物的作用下pcr扩增编码10b蛋白的基因序列;
(2)构建重组质粒:分别以ndei、xhoi酶切10b基因和pet24a载体,在目的基因连入pet24a后,酶切验证正确的载体,并将其命名为pet24a-10b-carrier;
(3)重组质粒的表达验证:分别将gfp基因、6×his-tag和flag-tag基因插入到上述重组质粒的10b基因3’端,并将其分别标记为pet-10b-gfp、pet-10b-his和pet-10b-flag,重组质粒转入大肠杆菌bl21(de3)后,经iptg或乳糖诱导蛋白表达,westernblot鉴定蛋白表达情况;
(4)重组质粒在噬菌体展示领域的应用:将步骤(3)中获得的表达菌,在iptg或乳糖诱导2h后,向菌液中加入新鲜的t7-10-3b噬菌体,继续摇床培养1-1.5h,待菌液变澄清,利用peg/nacl沉降法收集噬菌体,点杂交法确认,噬菌体表面有相应的目标蛋白或者肽段展示,依次为gfp蛋白、his标签和flag标签。
本发明的一种可用于展示大量外源蛋白的重组质粒通过将噬菌体外壳蛋白10b表达基因连接在pet24a的3’端,并在其后添加酶切位点,获得了能够按实验设计展示目标小肽(或者蛋白)的原核表达载体pet24a-10b-carrier,将空质粒转化e.colibl21(de3)感受态细胞,该细胞经诱导剂作用后能表达10b蛋白,重组质粒pet24a-10b-carrier能将肽段或者小分子蛋白展示在t7噬菌体外壳蛋白10b羧基端并展示在噬菌体表面。与现有技术相比本发明具有以下优点和效果:
1、本发明涉及的仅为常用的原核表达质粒pet24a,应用的实验技术只是常规构建质粒时的双酶切、连接等,不涉及t7基因组的酶切、重组等操作,操作简单,易于掌握;
2、本发明是基于大肠杆菌原核表达进行相应目标分子的展示,不涉及t7基因组改造后的噬菌体包装过程,鉴于噬菌体包装过程中包装蛋白的获得需要超速离心、获得成本高、包装过程耗时长等缺点,本发明成功弥补了上述不足,能更方便的用于t7噬菌体展示系统。
附图说明
图1是pet24a-10b-carrier重组质粒开放阅读框架示意图;
图2是获得10b基因的电泳图。m1:核酸分子量标准,dl2000;
图3是重组质粒构建的酶切验证结果;
图4是pet-10b-carrier、pet-10b-gfp转入大肠杆菌bl21(de3)后的蛋白表达结果。10b蛋白344aa,约37.8kda;gfp的编码序列是700多bp,编码一个238个氨基酸的蛋白,蛋白质分子量26.9kda;10b-gfp融合蛋白分子量约为65kda;m1:蛋白质分子量标准,fermentassm04431;
图5是pet-10b-his、pet-10b-flag转入大肠杆菌bl21(de3)后各自表达蛋白的westernblot验证结果;
图6是利用重组质粒展示gfp、his-tag、flag-tag在t7噬菌体表面后,所获噬菌体的点杂交结果,
具体实施方式
下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
本发明所述技术方案,如未特别说明,均为本领域的常规方案。pet24a、pet24a-10b-carrier分别为阴性对照(空质粒)、空白对照(不展示外源肽)。
实施例1:
一种可用于展示大量外源蛋白的重组质粒的构建:
(1)噬菌体外壳蛋白10b基因的获得
以t7select415-1b噬菌体dna为模板,用高保证核酸扩增酶扩增编码10b蛋白的基因序列,5’端引物为10b-f(seqidno.4):cgcatatggctagcatgactg,3’端引物为10b-r(seqidno.5):cggaattctattaaagcttttccactttaaagacc。pcr反应条件为:94℃预变性5min;94℃变性30s、58℃退火30s、72℃延伸1min为一个循环,共进行30个循环;72℃最后延伸10min,随后16℃保温。
核酸电泳验证后,利用琼脂糖凝胶回收试剂盒回收目标基因。该目标基因5’端有ndei酶切位点,3’端有ecori、hindiii、xhoi三个酶切位点以及两个终止密码子taa。
(2)构建重组质粒
分别用ndei、xhoi酶切10b基因和pet24a载体,目的基因连入pet24a后,酶切验证正确的载体,命名为pet24a-10b-carrier,即为本发明的重组质粒。
实施例2:
重组质粒pet24a-10b-carrier转入大肠杆菌后,经化学诱导,获得了噬菌体外壳蛋白10b的可溶性表达。
取100ng重组质粒,转化e.colibl21(de3)感受态细胞,之后涂布于lb固体培养基平板(含50μg/mlkana),37℃培养16h。挑取过夜培养的平板上克隆,接入lbk液体培养基中,在37℃220rpm条件下摇床培养至od600约0.6,随后加入iptg使其终浓度为0.5μmol/l,继续摇床培养4h;收集诱导前后的细菌培养液各1ml,电泳观察10b蛋白的表达情况;收集诱导后的细菌,超声破碎后,分离上清、沉淀,sds-page法观察样品中目的蛋白的含量(图1)。
sds-page结果表明,重组质粒转化后的细菌,能稳定且可溶性表达t7噬菌体外壳蛋白10b,表明该质粒应用前景可期。
实施例3:
利用重组质粒pet24a-10b-carrier将外源蛋白展示在t7噬菌体表面:
(1)绿色荧光蛋白基因的获得
参考pires2-egfp序列信息,设计引物egfpf(seqidno.6):gaagctttctagagtgagcaag与egfpr(seqidno.7):ggaattcttacttgtacagctcgtc,以pires-egfp2质粒为模板,扩增egfp序列,扩增条件为:94℃预变性5min;94℃变性30s、55℃退火30s、72℃延伸1min为一个循环,共进行30个循环;72℃最后延伸10min,随后16℃保温。该核苷酸序列5’端添加了hindiii酶切位点,3’端添加了ecori酶切位点和终止密码子,以便插入carrier载体。
(2)pet-10b-gfp载体的构建及10b-gfp融合蛋白的表达
上述pcr产物与载体质粒pet24a-10b-carrier,经hindiii、ecori双酶切后,回收各自的酶切产物并连接,连接产物转化大肠杆菌dh5α感受态细胞,涂布在lbk固体平板上。从过夜培养的平板上挑单克隆,筛选出插入egfp基因的载体质粒,将其重新转化大肠杆菌bl21(de3)感受态细胞并用iptg诱导目的蛋白的表达。
离心收集的菌体,呈现明显的绿色;sds-page染色结果表明,载体上携带的10b基因与egfp基因串联融合表达并呈可溶性表达(图2)。
(3)pet-10b-gfp协助t7噬菌体完成装配
诱导两瓶细菌(200ml/1000ml锥形瓶),iptg诱导3h后,分别向菌液中加入t7select415-1b(1号)和t7select10-3b噬菌体(2号),继续摇床振荡培养,观察菌液浑浊度的变化及时间。
加入噬菌体前,两瓶的od600分别为0.641和0.603;加入各自噬菌体继续振荡培养1h后,两瓶菌液od600分别为0.124和0.252,1号瓶菌液变澄清,有明显的丝状物存在;继续振荡培养0.5h后,两瓶菌液od600分别为0.098和0.112,2号瓶菌液也变澄清。结果表明,携带egfp基因的重组质粒能够将10b蛋白与gfp融合表达,且融合蛋白的10b亚基能作为重要组装部分协助t7select10-3b噬菌体完成装配过程。
(4)步骤3中展示gfp蛋白噬菌体的验证
将1、2号瓶中噬菌体裂解液4℃10000rpm离心15min;转移离心上清于一洁净的锥形瓶中,加入1/5体积的预冷的peg/nacl,轻轻摇匀后,4℃静置30min;4℃10000rpm离心15min,轻轻颠倒弃去离心上清,倒置2min后,用1mlpbs缓冲液重悬离心沉淀,充分吹打后,4℃3000rpm离心5min,转移上清至一无菌收集管,即得扩增后的噬菌体。
实施例4:
利用重组质粒pet24a-10b-carrier将6×his标签展示在t7噬菌体表面:
(1)构建pet-10b-his重组质粒
利用引物10b-kpn-f(seqidno.8):ctggtacgctcgtgagggcac与10b-his-r(seqidno.9):gaagcttcatcaccatcatcaccatttccactttaaagacc,以pet24a-10b-carrier质粒为模板,pcr获得10b基因3’端,且3’端包含了需要插入的6×his-tag核苷酸序列。pcr反应条件为:94℃预变性5min;94℃变性30s、58℃退火30s、72℃延伸45s为一个循环,共进行30个循环;72℃最后延伸10min,随后16℃保温。引物序列中的下划线部分为酶切位点。
pcr产物与载体质粒pet24a-10b-carrier,经kpni、hindiii双酶切后,回收各自的酶切产物并连接,连接产物转化大肠杆菌dh5α感受态细胞,涂布在lbk固体平板上。从过夜培养的平板上挑单克隆,筛选出插入his标签的重组质粒。
(2)10b-his蛋白的原核表达
将构建成功的质粒转化大肠杆菌bl21(de3)感受态细胞,用0.5mmol/l终浓度的iptg诱导3h,离心收集1ml诱导后菌液的细菌,80μlpbs重悬细菌后,加入5×还原样品处理液处理,煮沸10min,离心;经sds-page分析蛋白表达情况;用his-tag标签抗体进行westernblot鉴定,以确定his标签的表达。以含有pet24a-10b-carrier的bl21(de3)细菌作为对照组。
(3)利用重组载体将his标签展示在t7噬菌体表面
分别培养含有pet-10b-his质粒(his组)和pet24a-10b-carrier(carrier组)的bl21(de3)细菌,每种一瓶(200ml/1000ml锥形瓶),待菌液od600约0.6时,加入终浓度0.5mmol/liptg诱导3h后,然后分别向菌液中加入t7select415-1b噬菌体,继续摇床振荡培养(37℃220rpm)1h左右,至菌液变澄清。
将两瓶中噬菌体裂解液各自转移至250ml离心瓶中,4℃10000rpm离心15min;清转移离心上清于一洁净的锥形瓶中,加入1/5体积的预冷的peg/nacl,轻轻摇匀后,4℃静置30min;4℃10000rpm离心15min,轻轻颠倒弃去离心上清,倒置2min后,用1mlpbs缓冲液重悬离心沉淀,充分吹打后,4℃3000rpm离心5min,转移上清至一无菌收集管,即得扩增后的噬菌体。
分别将his组和carrier组获得的噬菌体和t7select415-1b噬菌体(对照组)进行点杂交实验,以确定his标签在噬菌体表面的展示。取硝酸纤维素膜(nc膜)一块,预先用铅笔在膜上画三个圆圈,分别取10μl相应噬菌体滴在圆圈标记区域,晾干后,再滴加一次;晾干,用5%bsa充分封闭nc膜;封闭结束后,用抗体稀释液稀释hrp标记的小鼠抗his-tag抗体,每个标记区域滴抗体工作液50μl,37℃孵育1.5h;孵育结束后,用pbst洗膜(5min/次共3次),然后向标记区域滴加新鲜配制的dab显色液,室温避光进行显色。his组可见明显的褐色,carrier组和对照组的颜色没有明显变化。由此判断,his标签已经成功展示在利用pet-10b-his质粒制备的噬菌体的表面。
实施例5:
利用重组质粒pet24a-10b-carrier将flag-tag展示在t7噬菌体表面:
(1)构建pet-10b-flag重组质粒
利用引物10b-kpn-f(seqidno.8):ctggtacgctcgtgagggcac与10b-flag-r(seqidno.10):gaagcttgattataaagatgatgacgataaattccactttaaagacc,以pet24a-10b-carrier质粒为模板,pcr获得10b基因3’端,且3’端包含了需要插入的flag-tag核苷酸序列。pcr反应条件为:94℃预变性5min;94℃变性30s、58℃退火30s、72℃延伸45s为一个循环,共进行30个循环;72℃最后延伸10min,随后16℃保温。引物序列中的下划线部分为酶切位点。
pcr产物与载体质粒pet24a-10b-carrier,经kpni、hindiii双酶切后,回收各自的酶切产物并连接,连接产物转化大肠杆菌dh5α感受态细胞,涂布在lbk固体平板上。从过夜培养的平板上挑单克隆,筛选出插入flag标签的重组质粒。
(2)10b-flag蛋白的原核表达
将构建成功的质粒转化大肠杆菌bl21(de3)感受态细胞,用0.5mmol/l终浓度的iptg诱导3h,离心收集1ml诱导后菌液的细菌,80μlpbs重悬细菌后,加入5×还原样品处理液处理,煮沸10min,离心;经sds-page分析蛋白表达情况;用flag-tag标签抗体进行westernblot鉴定,以确定flag标签的表达。以含有pet24a-10b-carrier的bl21(de3)细菌作为对照组。
(3)利用重组载体将flag标签展示在t7噬菌体表面
分别培养含有pet-10b-flag质粒(flag组)和pet24a-10b-carrier(carrier组)的bl21(de3)细菌,每种一瓶(200ml/1000ml锥形瓶),待菌液od600约0.6时,加入终浓度0.5mmol/liptg诱导3h后,然后分别向菌液中加入t7select415-1b噬菌体,继续摇床振荡培养(37℃220rpm)1h左右,至菌液变澄清。
将两瓶中噬菌体裂解液各自转移至250ml离心瓶中,4℃10000rpm离心15min;清转移离心上清于一洁净的锥形瓶中,加入1/5体积的预冷的peg/nacl,轻轻摇匀后,4℃静置30min;4℃10000rpm离心15min,轻轻颠倒弃去离心上清,倒置2min后,用1mlpbs缓冲液重悬离心沉淀,充分吹打后,4℃3000rpm离心5min,转移上清至一无菌收集管,即得扩增后的噬菌体。
分别将flag组和carrier组获得的噬菌体和t7select415-1b噬菌体(对照组)进行点杂交实验,以确定flag标签在噬菌体表面的展示。取硝酸纤维素膜(nc膜)一块,预先用铅笔在膜上画三个圆圈,分别取10μl相应噬菌体滴在圆圈标记区域,晾干后,再滴加一次;晾干,用5%bsa充分封闭nc膜;封闭结束后,用抗体稀释液稀释hrp标记的小鼠抗flag-tag抗体,每个标记区域滴抗体工作液50μl,37℃孵育1.5h;孵育结束后,用pbst洗膜(5min/次共3次),然后向标记区域滴加新鲜配制的dab显色液,室温避光进行显色。flag组可见明显的褐色,carrier组和对照组的颜色没有明显变化。由此判断,flag标签已经成功展示在利用pet-10b-flag质粒制备的噬菌体的表面。
本发明的一种可用于展示大量外源蛋白的重组质粒在噬菌体展示方面的应用,包括可利用该质粒连接目标肽段、目的基因或者随机肽库,构建重组质粒或者文库,表达目标蛋白或随机肽库,与相应的噬菌体结合用于蛋白展示或者文库构建。
本发明涉及的仅为常用的原核表达质粒pet24a,应用的实验技术只是常规构建质粒时的双酶切、连接等,不涉及t7基因组的酶切、重组等操作,操作简单,易于掌握。
本发明是基于大肠杆菌原核表达进行相应目标分子的展示,不涉及t7基因组改造后的噬菌体包装过程,鉴于噬菌体包装过程中包装蛋白的获得需要超速离心、获得成本高、包装过程耗时长等缺点,本发明成功弥补了上述不足,能更方便的用于t7噬菌体展示系统。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!