一种siRNA在制备抗热应激心肌损伤药物中的应用的制作方法
本发明属于生物技术领域,具体涉及一种抑制microrna-126表达的sirna及其应用。
背景资料
近年来,随着地球生态环境的不断恶化,全球变暖已成为难以逆转的气候趋势。极端高热气候不仅在热带和亚热带地区持续加剧,而且在许多温热带地区频发。我国广东地区、东南沿海及南海诸岛等属热带地区,长夏暖冬,夏季炎热多湿。尤其是南海诸岛,四周环海,处于典型的热带海洋气候,空气中的相对湿度高达100%,而且常年气温30℃以上多达8个月。随着我国基础建设和重工业的飞速发展,在钢铁工业、铁路建设、浇铸车间等行业从事高温作业的人群也大幅增加;随着藏南与南海领土争端不断加剧,我军指战员在严酷亚热带、热带季风气候进行大规模户外军事作业的频率也不断增多;2012年5月,随着我国首个自主研发的深水钻井平台在南海方向开钻,大规模的南海方向资源开发也已经逐渐拉开序幕,这意味着大量的工人不得不在热带海域进行户外作业。基于上述分析,我国从事高温环境作业的人员数量急剧增加,越来越多的人员不得不面对热应激的威胁。而与此不相称的是,我国在热环境医学领域的研究近年来却呈现逐渐下降的趋势;近几年国家资助的高温环境和热应激方面的科研项目多集中在畜牧业和养殖业等农业领域,而对高温作业环境下的生理病理反应机制的基础研究却非常少,大量的高温环境作业人员将缺乏有效的健康维护和作业能力维持措施,这将严重削弱我国南疆领土(海)的防卫力度,减缓温热带地区的基础建设进程、妨碍我国工业化进程的步伐、影响南海资源开发的进度。因此,探索高温环境条件下机体作业能力下降生理、病理学基础,发现有效防治环境高热所致健康损害和作业能力下降的医药措施,对于高热环境中作业和生活人群具有重要意义。
高温环境下作业时,炎热的外环境使机体散热困难,甚至被迫接受大量的外加热,可引起一系列的生理、病理性的应激反应,称为热应激。对于高温环境中的作业人员而言,体温调节贯穿着整个热应激的全过程(包括代偿期和失代偿期),而心血管系统在体温调节中扮演了重要的角色。热应激时,心血管系统处于高度的紧张状态,机体为适应散热和供氧的双重需要,体温调节中枢在内、外热刺激的作用下,皮肤血管的交感神经活动减弱,导致皮肤血管高度扩张;而支配心脏的神经末梢释放儿茶酚胺类物质作用于心脏的β-肾上腺素受体,导致心脏的收缩频率和强度迅速增加,使得体内蓄积的热量通过血液迅速向体外发散。心血管系统的这一系列活动在增加散热的同时,由于心脏的收缩强度、频率、每分输出量的迅速增加,其所承受的负荷也迅速升高;此时心肌细胞代谢活跃,需氧量急剧增加,而供氧量却相对不足,导致心肌处于超负荷状态。心脏功能的有效保护已经成为目前高温作业环境医学领域中亟待解决的问题之一。
目前,预防热应激心肌损伤的主要手段是合理补充电解质和水分,防止心律失常发生。补充电解质和水分只能起到防护心率失常的作用,而对渐进性的热应激心肌细胞损伤和凋亡的防护作用则十分有限。对于热应激心肌损伤的治疗目前主要以临床心脏内科的抗心肌缺血或者抗心肌梗死的药物为主,也有一些基于中医理论的对症治疗中药制剂。这些药物和中药制剂由于是非特异性对症治疗药物,导致它们以缓解症状为主,不能从根本上有效阻断热应激心肌细胞损伤的细胞内信号通路,治疗效果十分有限;与此同时,不可避免的会引起一系列的毒副作用。到目前为止,国内外尚缺乏针对热应激所致心肌损伤的特异性防护药物。
以往对microrna-126(mir-126)的研究主要集中在其对肿瘤、血管内皮细胞等功能的调控方面。而对热应激心肌细胞内mir-126的表达规律和功能则未见研究。此外,目前也并没有发现针对mir-126对抗热应激心肌细胞损伤的相关技术的报道。
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种sirna在制备抗热应激心肌损伤药物中的应用。
本发明的第二个目的是提供一种包含sirna的腺病毒载体在制备抗热应激心肌损伤药物中的应用。
本发明的技术方案概述如下:
一种sirna在制备抗热应激心肌损伤药物中的应用,sirna的正义链的核苷酸序列用seqidno.1所示,sirna反义链的核苷酸序列用seqidno.2所示。
一种包含sirna的腺病毒载体在制备抗热应激心肌损伤药物中的应用,sirna的正义链的核苷酸序列用seqidno.1所示,sirna的反义链的核苷酸序列用seqidno.2所示。
正义链:5’to3’ucaaacucguaccgugagu(seqidno.1);
反义链:5’to3’acucacgguacgaguuuga(seqidno.2)。
本发明的优点:
本发明的sirna能明显特异性抑制热应激心肌细胞内microrna-126的表达,给予心肌细胞转染包含上述sirna的腺病毒后,明显抑制热应激所致心肌细胞的线粒体功能紊乱,显著降低热应激心肌细胞的凋亡率,从而起到保护热应激心肌细胞的作用。
附图说明
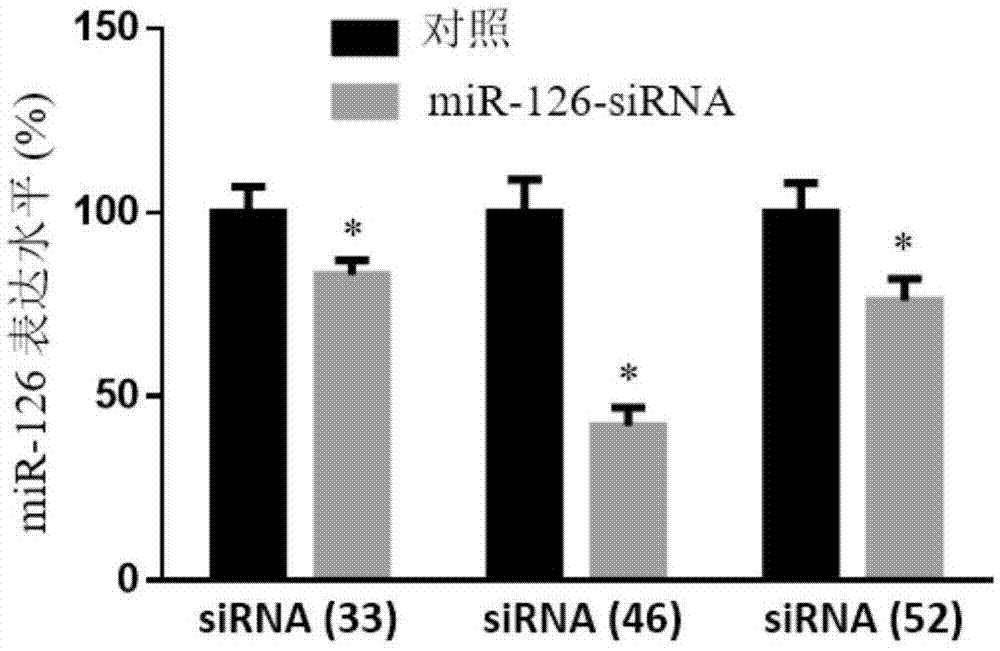
图1为sirna抑制microrna-126的表达的结果。
其中各标号代表:sirna(33):33位点的sirna;sirna(46):46位点的sirna;sirna(52):52位点的sirna。
图2为microrna-126-sirna(46)(靶向microrna-126转录本的第46个碱基位点,抑制microrna-126表达的sirna,简称为microrna-126-sirna(46)。为了提高易读性,如无特殊说明,以下均用简称代替。)对心肌细胞microrna-126表达的影响。
图3为microrna-126-sirna(46)腺病毒对心肌细胞线粒体膜电位的影响(*p<0.05与对照组相比较)。
图4为microrna-126-sirna(46)腺病毒对心肌细胞ros(氧自由基)的影响(*p<0.05与对照组相比较)。
图5为microrna-126-sirna(46)腺病毒对心肌细胞凋亡率的影响(*p<0.05与对照组相比较)。
具体实施方式
细胞培养液1号配方:89%dmem(gibco,cat#8117167),10%胎牛血清(gibco,cat#16000-044),1%青霉素/链霉素溶液(gibco,cat#15140-122)。
细胞培养液2号配方:89%mem(gibco,cat#41500034),10%胎牛血清(gibco,cat#16000-044),1%青霉素/链霉素溶液(gibco,cat#15140-122)。
细胞冻存液1号配方:79%dmem(gibco,cat#8117167),20%胎牛血清(gibco,cat#16000-044),1%青霉素/链霉素溶液(gibco,cat#15140-122)。
以下通过实施例对本发明进一步说明。
以下实施例中的方法中如无特别说明,所用的生化试剂均为市售试剂,所用的生物材料(包括细胞、培养基)均可通过市场购买得到,所用到的质粒均可通过实验室常规方法制备,所有的方法均为常规方法。
实施例1本发明的抑制microrna-126表达的sirna的来源
(1)抑制microrna-126表达的microrna-126-sirna设计
从genebank下载microrna-126的转录本全长序列,用block-ittmrnaidesigner软件搜寻候选的sirna靶位点。
根据以下原则:gc含量在30%-50%左右的sirna要比那些gc含量偏高的更为有效;将潜在的序列和相应的基因组数据库进行比较,排除那些和其他编码序列及est同源的序列。最后将靶点定位为33、46、52三个位点进行化学合成sirna。并合成阴性对照的sirna。
33位点的sirna:正义链:5’to3’gcgcugugacacuucaaac;
(seqidno.3)
反义链:5’to3’guuugaagugucacagcgc;
(seqidno.4)
46位点的sirna:正义链:5’to3’ucaaacucguaccgugagu;
(seqidno.1)
反义链:5’to3’acucacgguacgaguuuga;
(seqidno.2)
52位点的sirna:正义链:5’to3’ucguaccgugaguaauaau;
(seqidno.5)
反义链:5’to3’auuauuacucacgguacga。
(seqidno.6)
上述sirna委托上海吉玛制药技术有限公司直接合成。
(2)microrna-126-sirna的筛选
将上述合成的sirna用lipofectamine2000(invitrogen)转入细胞培养液2号培养的h9c2细胞中,具体操作步骤详见lipofectamine2000(invitrogen)说明书。
将转染的细胞消化收集后提取细胞蛋白,采用real-timepcr检测microrna-126的表达。结果如图1所示,46位点的sirna可以明显抑制microrna-126的表达,该sirna正义链的核苷酸序列用seqidno.1所示,反义链的核苷酸序列用seqidno.2所示。
实施例2将46位点的sirna进行腺病毒包装
一、sirna腺病毒载体的制备
首先采用化学合成法合成含干扰序列的单链dnaoligo。然后于90℃水浴15min退火配对产生双链,再通过其两端所含酶切位点(ageι与ecorι)直接连入酶切后的rnai腺病毒载体上;将连接产物转入制备好的细菌感受态细胞,pcr鉴定阳性重组子后,送测序验证,测序结果经比对确认正确。阳性克隆即为构建成功的目的基因rnai腺病毒载体。
具体操作如下:
1、采用化学合成法合成单链dnaoligo(上海吉凯基因有限公司):
5’to3’
ccggcatcaaactcgtaccgtgagtctcgagactcacggtacgagtttgatttttg(seqidno.7)
2、把上述合成的dna干粉溶解于退火缓冲液中,90℃水浴15min,然后自然冷却至室温,产生双链。
3、连接
通过t4dna连接酶将双酶切(agei与ecori)线性化的rnai腺病毒载体gv119(上海吉凯基因有限公司)和上述dna片段进行连接反应,连接后的产物进行转化实验。连接反应体系如下,于16℃连接过夜,连接产物(连接液)进行转化实验。
4、转化
感受态细胞的制备:
配置下述溶液:
1)0.1mcacl2溶液,以0.45μm过滤除菌;
2)250mmkcl2溶液;
3)2mmgcl2溶液,高压灭菌;
4)sob:1ml250mmkcl2溶液加入100mllb,以5mnaoh调ph值至7.0,高压灭菌,临用前加入0.5ml2mmgcl2溶液。
用氯化钙制备新鲜的dh5α大肠杆菌感受态细胞
1)从于37℃培养16小时的新鲜平板中挑取一个单菌落,转到一个含有100mlsob培养基的1l烧瓶中。于37℃剧烈振摇培养3小时(旋转摇床,300rpm)。
2)在无菌条件下将细菌转移到一个无菌、用冰预冷的50ml聚丙烯管中,在冰上放置10分钟,使培养物冷却至0℃。
3)于4℃,以4000转/分离心10分钟,回收细胞。
4)倒出培养液,将管倒置1分钟,使最后残留的痕量培养液流尽。
5)以10ml用冰预冷的0.1mol/lcacl2重悬每份沉淀,放置于冰浴上。
6)于4℃,以4000转/分离心10分钟,回收细胞。
7)倒出培养液,将管倒置1分钟,使最后残留的痕量培养液流尽。
8)每50ml初始培养物用2ml用冰预冷的0.1mol/lcacl2重悬每份细胞沉淀。
9)将细胞分装成小份,放于-70℃。
转化过程:
配置下述溶液:
1)250mmkcl2溶液
2)2mmgcl2溶液,高压灭菌;
3)sob培养基:1ml250mmkcl2溶液加入100mllb,以5mnaoh调ph值至7.0,高压灭菌,临用前加入0.5ml2mmgcl2溶液;
4)sob琼脂培养基:0.49396gmgso4.7h2o溶于100mlsob培养基,加入1.5g琼脂粉,高压灭菌,冷至温度低于60℃,加入amp至终浓度到100μg/ml,混匀铺板,一般90mm直径平皿需要30-50ml(本实施例选用40ml)培养基;
5)1m葡萄糖溶液,过滤除菌;
6)soc培养基:2ml1m葡萄糖溶液加入100mlsob培养基;
转化步骤:
1)用冷却的无菌吸头从每种感受态细胞悬液中各取200μl转移到无菌的微量离心管中,每管加2μl连接液,轻轻旋转以混匀内容物,在冰中放置30分钟。
2)将管放到预加温到42℃的循环水浴中放好的试管架上,恰恰放置90秒,不要摇动试管,再快速将管转移到冰浴中,使细胞冷却1-2分钟。
3)每管加800μlsoc培养基。用水浴将培养基加温至37℃,然后将管转移到37℃摇床上,温育45分钟使细菌复苏;将150μl已转化的感受态细胞转移到含20mmol/lmgso4和amp抗性(100ug/ml)的lb琼脂培养基上。
4)将平板置于室温直至液体被吸收,再倒置平皿,于37℃培养,16小时;
5)进行阳性克隆pcr。
5、阳性克隆的pcr鉴定
挑取转化子重悬于10μllb溶液,混匀取1μl作为模板;使用gv119通用引物(上海吉凯基因有限公司),进行菌落pcr鉴定实验。
pcr鉴定体系和pcr程序:
pcr程序:
阳性克隆测序:将pcr阳性克隆进行测序,序列如序列表中的seqidno.7所示的核苷酸序列,测序结果正确,与合成的序列一致。
二、sirna腺病毒的包装与滴度检测
1.腺病毒包装
1.1hek293(atcc,crl-1573,购买时间:2017年9月,国家:usa,机构atcc,联系人,网址https://www.atcc.org/products/all/crl-1573.aspx)中)细胞培养
1)活细胞计数
用无血清dmem培养基(gibco,cat#8117167)把细胞悬液稀释到1000个/ml),在0.1ml的细胞悬液中加入0.1ml的0.4%的台盼兰溶液。轻轻混匀,数分钟后,用血球计数板计数细胞。活细胞排斥台盼兰,因而染成蓝色的细胞是死细胞。
2)细胞株的冻存
取培养2天生长旺盛的细胞,用细胞冻存液(细胞冻存液1号)将细胞配成2×106/ml。在1ml细胞冻存管中加入0.5ml细胞悬液,0.4mlfbs和0.1mldmso(或甘油),混匀后密封。置4℃1小时,-20℃2小时,然后直接放入液氮中或置液氮蒸汽上过夜后浸入液氮中。
3)细胞复苏
从液氮罐中取出细胞冻存管,应带有防护眼睛和手套。迅速放入盛有37℃水的水浴中,并不时摇动,尽快解冻。用70%酒精擦拭消毒后,移至净化台上,吸出细胞悬液至培养瓶中,补加3ml细胞培养液1号配方,置温箱培养。次日更换一次培养液后再继续培养。
4)细胞传代
弃去旧培养液,加入5ml灭菌pbs溶液,轻轻晃动,洗涤细胞生长面,然后弃去pbs溶液。加入1ml0.25%胰酶消化液,消化1-2min直到细胞完全消化下来。加入含10%fbs和100u/ml双抗的dmem培养基5ml,用刻度吸管吹打数次,将瓶壁上的细胞冲洗下来。混匀细胞后分按照1:5或1:6传入新的培养瓶中,继续培养。3天左右、待细胞长满时,重新进行传代。
1.2dna溶液的制备
将腺病毒穿梭质粒(上述制备的sirna腺病毒载体)和辅助包装质粒用大肠杆菌菌株dh5α进行扩增,方法如下:
1)用冷却的无菌吸头取200μldh5α转移到无菌的微量离心管中,每管加2μl腺病毒穿梭质粒或辅助包装质粒,轻轻旋转以混匀内容物,在冰中放置30分钟。
2)将管放到预加温到42℃的循环水浴中放好的试管架上,恰恰放置90秒,不要摇动试管,再快速将管转移到冰浴中,使细胞冷却1-2分钟。
3)每管加800μlsoc培养基。用水浴将培养基加温至37℃,然后将管转移到37℃摇床上,温育45分钟使细菌复苏;将150μl已转化的感受态细胞转移到含20mmol/lmgso4和amp抗性(100ug/ml)的lb琼脂培养基上。
4)将平板置于室温直至液体被吸收,再倒置平皿,于37℃培养,16小时;
5)挑取单克隆加入amp抗性(100ug/ml)的lb液体培养基上,于37℃摇床培养,12-16小时。
6)将步骤5中得到的菌液以qiagen公司的质粒抽提试剂盒(cat.12145)提取质粒dna,质粒dna溶于除菌的te中,以紫外光吸收法测定其浓度及纯度,保证所提质粒dna的a260/a280在1.8~2.0之间。
1.3质粒转染过程
1)转染前24h,用0.25%胰蛋白酶消化对数生长期的hek293细胞,以细胞培养液1号配方调整细胞密度为达30%,重新接种于t25瓶,37℃、5%co2培养箱内培养。24h左右待细胞密度达到50%时即可用于转染。细胞状态对于病毒包装至关重要,因此需要保证良好的细胞状态和较少的传代次数。
2)转染前2h将细胞培养基更换为无血清dmem培养基。
3)向一灭菌离心管中加入所制备的dna溶液(穿梭质粒(上述sirna腺病毒载体)5μg和辅助包装质粒(pbhgloxδe1,3cre(microbix.canada))5μg)与dmem混合均匀,调整总体积为50μl,在室温下温育5分钟。
4)将lipofectamine2000试剂轻柔摇匀,取10μllipofectamine2000试剂在另一管中与50μldmem混合,在室温下温育5分钟。
5)把稀释后的dna与稀释后的lipofectamine2000进行混合,轻轻地颠倒混匀,不要振荡。
6)混合后,在室温下温育20分钟,以便形成dna与lipofectamine2000稀释液的转染复合物。
7)将dna与lipofectamine2000混合液转移至hek293细胞的培养液中,混匀,于37℃,5%co2细胞培养箱中培养。
8)培养7h后倒去含有转染混和物的培养基,每瓶细胞加入2ml的pbs液,轻轻左右晃动一下培养瓶以洗涤残余的转染混和物,然后倒去。
9)每瓶细胞中加入含10%血清的细胞培养基5ml,于37℃、5%co2培养箱内继续培养。
10)每天观察转染后细胞生长状况,若细胞培养基明显变黄,酌情补加适量的新鲜全培养液。
1.4重组腺病毒的收获
转染后大约10~15天时,hek293细胞开始飘落,部分细胞出现细胞病变(cytopathiceffect,cpe)。待大部分细胞出现典型的cpe,且有50%的细胞脱壁,低速离心收集细胞并重悬于2mldmem中,-70℃/37℃反复冻融、振荡3次,于4℃,7000g离心5min,收集病毒上清于-70℃保存。
2.腺病毒的扩增
2.1第1轮扩增
将1个t25细胞培养瓶中生长状态良好的hek293细胞4倍稀释后传入另1个t25细胞培养瓶中,以细胞培养液1号配方在37℃,5%co2下培养(以下扩增中均使用此条件培养细胞)。待细胞达到60%汇合时,弃去旧培养液,向培养瓶中加入复制缺陷型腺病毒重组成功后收获的粗提液2ml,将培养瓶置于细胞培养箱中孵育90min,最后再向培养瓶中补加完全培养液3ml并继续培养。待大部分细胞出现典型的cpe,且有50%的细胞脱壁时,低速离心收集细胞并重悬于2mldmem中,-70℃/37℃反复冻融、振荡3次,于4℃,7000g离心5min,收集病毒上清于-70℃保存。
2.2第2轮扩增将1个t25细胞培养瓶中生长状态良好的hek293细胞全部传入1个t75细胞培养瓶中,以完全培养基继续培养。待细胞达到90%汇合时,弃去旧培养液,向培养瓶中加入第1轮扩增所得的病毒液2ml,将培养瓶置于细胞培养箱中孵育90min,最后再向培养瓶中补加完全培养液10ml并继续培养。待大部分细胞出现典型的cpe,且有50%的细胞脱壁时,低速离心收集细胞并重悬于10mldmem中,-70℃/37℃反复冻融、振荡3次,于4℃,7000g离心5min,收集病毒上清于-70℃保存。
3.腺病毒纯化
按adeno-xtmviruspurificationkit(bdbiosciences,clontech)的步骤纯化重组腺病毒,主要步骤如下:
1)取出bdadeno-x纯化装置,将10ml的病毒粗制液用0.45μm孔径的滤膜过滤,滤液保存在收集瓶中;
2)往病毒滤液中加入4μl25u/ul的benzonase.混匀,37℃保温30min;
3)往收集瓶中加入10ml的l×dilutionbuffer,使之与病毒滤液混合均匀;
4)将20ml的注射器中吸入5ml灭菌pbs,把注射器插入滤器,推入pbs使之流经套管,将滤器和套管中的空气排尽;
5)将套管插入收集瓶中的病毒滤液中;
6)将病毒滤液吸入注射器中,以5ml/min的速度推出,使之流经滤器。注意避免空气进入系统中;
7)将套管的入口从收集瓶转移到1×washbuffer中;
8)通过套管将washbuffer吸入注射器中,将全部washbuffer以5ml/min的速度推入流经滤器;
9)取下滤器;
10)用5ml的bdluer-lok注射器洗脱腺病毒:在注射器中吸入3ml的1×eultionbuffer;连接注射器和滤器的凹口,推入lmlelutionbuffer流经滤器到5ml的灭菌离心管中;室温下孵育滤器5min,推入剩下的elutionbuffer流经滤器来收集剩下的腺病毒;
11)将纯化后的腺病毒分装,-70℃保存。
4.腺病毒滴度检测
4.1腺病毒滴度测定-终点稀释法
1)在实验前24小时,向96孔板的每一个孔加入100μlhek293细胞悬液,约含1x103个细胞;
2)准备10个无菌的ep管,在第一个ep管中加入990μl的完全培养液,其余的9个管子中各加入900μl的完全培养液。
3)待测病毒液的稀释:取10μl腺病毒原液加入990μl的ep管中做1:100稀释;然后以此为起点,再取100μl稀释液加入到900μl的ep管中做1:10稀释,直至稀释到10-13。
4)从细胞培养箱中取出96孔板,在显微镜下确定每孔的细胞均生长良好。吸弃旧培养液,然后依次将10-13至10-6稀释的病毒液加入96孔板中,每一稀释度占用一行,每一行的第1-10每孔加入90μl病毒稀释液,而每一行的第11-12每孔均加入90μl不含病毒的完全培养基作为对照。
5)将96孔板置于置37℃,5%co2细胞培养箱中继续培养,
6)10d后观察细胞病变现象,并对cpe孔进行计数,统计每一行的阳性率,计算病毒滴度(spearman-karbermethod):
4.2病毒滴度计算方法
病毒滴度=10(x+0.8)(pfu/ml),x=10-1到10-13依次稀释度下cpe阳性率总和。
最后得到滴度1×1010pfu/ml。
*公式使用条件:
①阴性对照没有cpe和生长抑制现象;
②加入最小稀释浓度病毒液的孔均有cpe。
实施例3
将所构建的包含microrna-126-sirna的腺病毒转染至心肌细胞检测其干扰效率。
1)出生2天的wistar乳鼠麻醉后,立即取出心脏,采用胰酶(sigma)消化法获得原代心肌细胞。
2)将上述腺病毒以100pfus/ml的浓度加入心肌细胞的细胞培养液中(细胞培养液2号)。
3)48小时后显微镜下观察细胞,并收集细胞,检测其细胞内microrna-126表达的变化。
用real-timepcr检测其转染细胞后对microrna-126表达的影响,结果显示:与对照组相比,microrna-126-sirna腺病毒转染心肌细胞后可以明显抑制细胞内microrna-126的表达,如图2所示。
实施例4
抑制microrna-126表达对热应激心肌细胞线粒体功能的影响
将腺病毒以100pfus/cell的浓度加入热应激心肌细胞培养液中,48小时后,流式细胞术检测microrna-126-sirna腺病毒转染对心肌细胞线粒体膜电位和细胞内ros的影响,并检测结果显示,如图所示:microrna-126-sirna腺病毒抑制microrna-126的表达后可以明显抑制ros水平(图3),保护线粒体膜电位(图4),减少细胞凋亡的发生率(图5)。
本发明基于热应激所致心肌细胞损伤的分子机制,开发了一种抑制热应激心肌细胞内microrna-126表达的sirna。包含上述sirna的腺病毒转染至心肌细胞后,能够特异性的保护热应激心肌细胞的线粒体膜电位,明显减少热应激所致心肌细胞ros的生成,有效降低热应激所致心肌细胞的凋亡率。
序列表
<110>军事科学院军事医学研究院环境医学与作业医学研究所
<120>一种sirna在制备抗热应激心肌损伤药物中的应用
<160>7
<170>siposequencelisting1.0
<210>1
<211>19
<212>rna
<213>智人(homosapiens)
<400>1
ucaaacucguaccgugagu19
<210>2
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>2
acucacgguacgaguuuga19
<210>3
<211>19
<212>rna
<213>智人(homosapiens)
<400>3
gcgcugugacacuucaaac19
<210>4
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>4
guuugaagugucacagcgc19
<210>5
<211>19
<212>rna
<213>智人(homosapiens)
<400>5
ucguaccgugaguaauaau19
<210>6
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>6
auuauuacucacgguacga19
<210>7
<211>56
<212>dna
<213>人工序列(artificialsequence)
<400>7
ccggcatcaaactcgtaccgtgagtctcgagactcacggtacgagtttgatttttg56
- 还没有人留言评论。精彩留言会获得点赞!