敲减人IL-15的siRNA、CD19CAR表达载体、CAR-T细胞及构建方法和应用与流程
本发明涉及肿瘤免疫治疗技术领域,具体涉及一种敲减人il-15的sirna、cd19car表达载体、car-t细胞及应用。
背景技术
2017年初,国家癌症中心发布了中国最新癌症数据,每一项数据都用客观的事实告诉我们:中国正在面临一场抗癌战争。每天约1万人诊断癌症,每分钟约7人确诊患癌。癌症新发人数继续上升,从358万增加到368万,增幅3%;世界新发病例约1409万,中国新发癌症病例占世界的1/4。我国癌症的治疗面临着巨大的挑战,目前传统的疗法主要有手术、化疗、放疗和靶向疗法,在一些癌症的治疗方面有一定的作用,但对于很多癌症的治疗效果非常局限。癌症的免疫疗法(cancerimmunotherapy)是继手术、化疗、放疗和靶向疗法之后出现的一种新型治疗方法,它是利用患者自身免疫系统的力量来抵抗癌症,所有癌症的发生从逻辑上都需要突破免疫系统的监视,而免疫疗法主要通过增强机体免疫系统功能,来消灭肿瘤细胞。免疫治疗经历了多年的不断发展,近几年取得了越来越多令人鼓舞的研究成果,包括针对免疫监控点分子或靶向抗原的单抗,双特异性抗体,肿瘤疫苗等,而在众多免疫疗法中,最受瞩目且具前景的当属嵌合抗原受体t细胞免疫疗法,它是免疫疗法与基因疗法相结合的创新疗法。
嵌合抗原受体t细胞免疫疗法(car-t)即car-t技术是通过将识别肿瘤相关抗原(tumor-associatedantigen,taa,是指一些肿瘤细胞表面糖蛋白或糖脂成分,它们在正常细胞上有微量表达,但在肿瘤细胞表达明显增高的scfv(单链抗体可变区片段)、跨膜区片段(cd8、cd28)、胞内信号分子(cd3ξ),共刺激因子(cd28、4-1bb、ox40)在体外进行基因重组,生成重组载体,再在体外通过转染技术转染到患者的t细胞,使患者t细胞表达嵌合抗原受体。转染后经过纯化和大规模扩增后的t细胞,也即car-t细胞,这些嵌合抗原受体修饰后的t细胞具备特异杀伤患者体内肿瘤细胞的能力。t细胞对肿瘤细胞具有很强的杀伤作用,在肿瘤免疫应答中起主要作用,但是肿瘤细胞表面的mhc在免疫编辑的过程中会出现表达下降的情况,这样长期形成的免疫逃逸机制能使肿瘤细胞成功躲避t细胞攻击,肿瘤快速增殖。此外,人体内肿瘤特异性的t细胞数量较少,并且由于大多数肿瘤细胞不断表达自体抗原,使得靶向这些抗原的t细胞通过免疫耐受机制被中和或移除,数量进一步减少。而car的修饰可使t细胞在获得靶向杀伤能力的同时获得更强的增殖及抗凋亡的能力,这种靶向杀伤的特异性来自于识别肿瘤相关抗原的单链抗体与其抗原的特异性结合,而不需要通过传统的抗原呈递免疫激活途径,从而克服肿瘤细胞通过下调mhc分子表达以及降低抗原递呈等免疫逃逸,打破宿主的免疫耐受。所以,它是针对肿瘤治疗的一种优势明显的精准医疗策略。
从全球大量开展的car-t临床实验来看,car-t技术在血液肿瘤、淋巴瘤的治疗上具有令人印象深刻的卓越疗效,而在实体瘤方面,有一些令人鼓舞的突破,但还面临着诸多难点问题需要攻克。美国各大医学研究机构开展的cd19car-t疗法治疗急性淋b淋巴细胞白血病或者淋巴瘤的临床有效率都达到80%左右。在car-t临床实验中,最受瞩目的焦点案例是5岁的急性淋巴细胞白血病儿童emilywhitehead接受了宾夕法尼亚大学的carlh.june研究组的car-t-19细胞的回输,病情已经完全缓解,体内检测不到白血病细胞,而且9岁的emily体内仍然能检测到car-t细胞,这项研究在全球范围引起巨大的轰动,为肿瘤的临床治疗指明了新的方向。当前,美国fda已经批准了诺华公司针对急性淋b淋巴细胞白血病的cd19car-t细胞产品以及凯特公司针对弥漫性b细胞淋巴瘤的cd19car-t细胞产品。虽然在临床试验过程中,cd19car-t细胞产品会带来一些不良反应,包括细胞因子风暴,神经毒性等症状,但是目前对这些症状已有比较好的临床应对措施,而juno公司在同类产品car015疗法的临床研究中,有多名患者在研究过程中不幸去世。经过后续研究,最新分析结果表示导致患者死亡的原因是脑水肿,这些症状与car-t细胞的过快增长有关,一般理想状态下,car-t细胞回输体内在11、12、14天的时候,扩增达到顶峰能够避免脑水肿症状出现,而当患者体内il15水平升高,car-t细胞就会过早、过快的出现扩增,尤其是当car-t细胞被激活增殖后,也会分泌各种细胞因子,包括il15,进一步放大扩增效果。此外,作为car-t疗法主要的不良反应细胞因子风暴甚至细胞因子释放综合征,也是car-t疗法临床应用关注的焦点,是由淋巴细胞释放多种细胞因子如tnf-α、il-1、il-6、il-12、ifn-α、ifn-β、等导致的,其中il15在细胞因子释放综合征中也扮演着重要的角色。
白细胞介素-15(il-15)是与白细胞介素-2(il-2)结构相似的细胞因子。像il-2一样,il-15与il-2/il-15受体β链(cd122)和普通γ链(γ-c,cd132)组成的复合物结合并进行信号传导。在被病毒感染后,单核吞噬细胞(和一些其他细胞)分泌il-15。该细胞因子诱导天然杀伤细胞的细胞增殖,其主要作用是杀死病毒感染细胞的先天免疫系统细胞,此外,il-15调节t淋巴细胞的活化和增殖,在不存在抗原的情况下维持记忆t细胞的生存信号由il-15提供。在啮齿类淋巴细胞中,il-15通过诱导凋亡途径抑制剂bcl2l1/bcl-x(l)来阻止细胞凋亡;在人类免疫系统中,il-15通过诱导bcl-2和/或bcl-xl类似地抑制t-淋巴细胞的凋亡。
因此,为了降低细胞因子综合征和脑水肿的风险,可通过采用温和的化疗方案进行淋巴细胞清除预处理,来降低患者体内的il-15的水平,而car-t细胞自身激活增殖释放的il-15却没有方法进行控制。
技术实现要素:
本发明解决的技术问题在于没有方法控制cd19car-t细胞自身激活增殖释放的il-15。
本发明是采用以下技术方案解决上述技术问题的:
一种敲减人il-15的sirna,所述sirna为:
a.正义链序列如seqidno.1所述的核苷酸序列,反义链序列如seqidno.2所述的核苷酸序列。
本发明还提供所述sirna在cd19car-t细胞中的应用。
本发明还提供一种敲减人il-15的sirna的重组慢病毒表达载体,所述表达载体包含如权利要求1所述的sirna。
优选的,所述表达载体为cd19car的pcdh慢病毒表达载体。
本发明还提供一种敲减人il-15的sirna的重组慢病毒表达载体的构建方法,包括以下步骤:(1)cd19car的pcdh质粒载体的构建;(2)将所述sirna序列克隆进入cd19car的pcdh质粒载体中,获得敲减il-15重组pcdh慢病毒质粒载体;(3)敲减人il-15的重组pcdh慢病毒载体的包装。
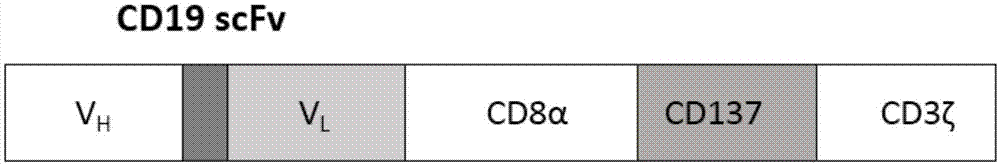
优选的,所述步骤(1)中cd19car采用二代car的组成方式,所述cd19car由识别cd19分子的scfv片段,cd8跨膜区,4-1bb片段,cd3ζ片段组成,所述cd19car序列如seqidno.9所示。
优选的,所述步骤(2)中使用noti与bamh1-f两种限制性内切酶进行酶切,将所述sirna序列克隆进入cd19car的pcdh载体中,随后转染dh5α大肠杆菌,进行载体扩增以及测序鉴定,获得敲减il-15重组pcdh慢病毒质粒载体。
优选的,所述步骤(3)中得到的敲减il-15重组pcdh慢病毒质粒载体分别与质粒gag、rev、vsv共同转染293t细胞,在293t细胞中进行基因转录表达后,包装成功敲减il-15重组pcdh慢病毒载体会释放到细胞培养上清中,收集包含的敲减il-15重组pcdh慢病毒质粒载体的上清液。
本发明还提供一种敲减il-15的cd19car-t细胞,所述的car-t细胞是由所述sirna修饰的t淋巴细胞。
优选的,所述car-t细胞的制备方法包括以下步骤:(1)t细胞的培养;(2)通过所述敲减il-15的sirna的慢病毒载体转染t细胞。
本发明的有益效果在于:
本发明通过设计一种敲减cd19嵌合抗原受体t细胞中il-15的sirna,来实现cd19car-t细胞中il-15的敲减效果,极大程度减少il-15的分泌量,从而降低细胞因子释放综合征和脑水肿的风险。
附图说明
图1为cd19car基因的具体构成;
图2为cd19car的pcdh载体图;
图3为敲减il-15的sirna序列克隆进入cd19car的pcdh载体后的载体图;
图4为cd19car-t细胞与敲减il-15的cd19car-t细胞扩增增殖曲线;
图5为效应细胞分别与靶细胞以10:1的比例共培养条件下,24h后检测对靶细胞的杀伤情况;
图6为效应细胞分别与靶细胞共培养条件10h上清中il-15的含量;
图7为效应细胞分别与靶细胞共培养条件10h上清中il-2的含量;
图8为效应细胞分别与靶细胞共培养条件10h上清中ifnγ的含量。
具体实施方式
为使对本发明的结构特征及所达成的功效有更进一步的了解与认识,用以较佳的实施例对本发明进行详细的说明。
本发明中所使用的试验材料,无特殊说明,均可从商业途径得到;本发明中的实验方法如无特殊说明,均为常规方法。
下述实施例中所用主要材料的来源为:
pcdh载体:购自addgene公司;
xbaⅰ限制性内切酶:购自neb公司,产品货号为r0145;
notⅰ限制性内切酶:购自neb公司,产品货号为r0189;
bamh1-f限制性内切酶:购自neb公司;
t4连接酶:购自neb公司,产品货号为m0202;
pcdh-ef1α-mcs空载体:购自sbi公司,产品货号为cd502a-1;
琼脂糖:购自生工生物工程(上海)股份有限公司,产品货号为a600434;
dh5α大肠杆菌:购自中国食品药品检定研究院;
293t细胞:购于美国菌种保藏中心atcc,产品目录号为crl-11268。
实施例1
敲减人il-15的sirna的序列的设计:
从ncbi官方网站上获取到il-15不同异构体的mrna,进行比对,得到它的共同序列,以这段序列为靶向序列进行sirna的设计。
利用设计网站https://portals.broadinstitute.org/gpp/public/seq/search,获得三对特异性较好的序列,其中选择特异性较好的a序列进行试验:
a.正义链序列如seqidno.1所述的核苷酸序列,反义链序列如seqidno.2所述的核苷酸序列;
b.正义链序列如seqidno.3所述的核苷酸序列,反义链序列如seqidno.4所述的核苷酸序列;
c.正义链序列如seqidno.5所述的核苷酸序列,反义链序列如seqidno.6所述的核苷酸序列。
敲减人il-15的sirna的序列的设计与合成:
转录sirna的基因将使用humanu6启动子来启动,并在sirna的转录序列后端连接polya序列,所述polya序列如seqidno.7所示。
在u6启动子的前端加入bamhi酶切位点末端和保护性碱基,在polya序列末端后加入noti酶切位点末端和保护性碱基,具体序列如seqidno.8所示,直接进行u6启动子+sirna+polya整个sirna转录基因序列的成,所述dna的合成由南京金斯瑞生物科技有限公司进行。
实施例2
敲减人il-15的sirna的重组慢病毒载体的构建
(1)cd19car的pcdh载体的构建:
cd19car基因是采用二代car的组成方式,整个cd19car由识别cd19分子的scfv片段,cd8跨膜区,4-1bb片段,cd3ζ片段组成;
scfv是anti-cd19的抗体分子轻链与重链组成单链分子,具体序列来源于专利号为pctus2011064191的专利文献,所述序列如seqidno.9所示;cd8αhingeregion/transmembrane(cd8αhinge/tm),cd8α铰链区和跨膜区,cd8α铰链区是一段柔性区域,含有大量脯氨酸,cd8α跨膜区主要将胞外区和胞内区锚定在细胞膜上。genebank数据库中查得cd8α铰链区和跨膜区序列nm_001768(1301..1507);
4-1bb属于肿瘤坏死因子受体超家族成员,表达于活化的t细胞上,是t细胞协同刺激因子,配体为4-1bbl,两者结合后可刺激t细胞的活化和增殖;
cd3ζ胞内区是将胞外接收的信号传递至胞内,并将活化信号传递到核内,激活t细胞的增殖。cd3ζ含有3个免疫受体酪氨酸激活基序(immunoreceptortyrosine-basedactivationmotif,itam)具体序列来源于专利号为pctus2011064191的专利文献,所述序列如seqidno.10所示。
cd19car序列由南京金斯瑞生物科技有限公司进行全基因合成,并在cd19car序列两端加入xbaⅰ限制性内切酶和notⅰ限制性内切酶的酶切位点粘性末端以及保护性碱基,cd19car序列具体构成如图1所示,其序列如seqidno.11所示。
①用xbaⅰ限制性内切酶和notⅰ限制性内切酶分别酶切合成的anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ基因片段和pcdh-ef1α-mcs空载体,于37℃酶切30min,1%琼脂糖凝胶电泳鉴定酶切结果,分离纯化anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ基因片段1461bp产物、和pcdh-ef1α-mcs空载体6418bp产物;
②分别使用t4连接酶连接酶切后的pcdh-ef1α-mcs空载体与anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ,16℃过夜连接,取2μl连接产物分别转化dh5a大肠杆菌,第二天,挑取单克隆培养获得质粒送南京金斯瑞生物科技有限公司进行测序,获得pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3z质粒载体,得到的载体图谱如图2所示。
(2)将敲减il-15的sirna序列克隆进入cd19car的pcdh质粒载体中:
采用cd19car载体构建的方法,使用noti与bamh1-f两种限制性内切酶进行酶切,于37℃酶切30min,将敲减il-15的sirna序列克隆进入cd19car的pcdh载体中。随后转染dh5α大肠杆菌,进行载体扩增以及测序鉴定,获得pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3z-il15kd质粒载体。最终敲减il15cd19car载体如图3所示。
(3)pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ和pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ-il15kd慢病毒的包装和收获:
①293t细胞的准备:转染前24小时,铺6孔板,8×105细胞/孔,2ml/孔;待细胞密度达90%时即可用于转染;
②病毒包装:表达质粒和辅助质粒的加入量如下:
③向一灭菌ep管中按照上述表格的量加入所制备的各dna溶液,辅助质粒和表达质粒,与200μl的dmem(不加fbs)混合均匀,在室温下温育5分钟。将293fection试剂轻柔摇匀,取10μl的293fection试剂在另一管中与200μl的dmem(不加fbs)混合,在室温下温育5min。把稀释后的dna与稀释后的293fection进行混合,轻轻地颠倒混匀,不要振荡。必须在5min之内混合。混合后,在室温下温育20min,以便形成dna与293fection稀释液的转染复合物。将dna与293fection混合液转移至293t细胞的培养液中,混匀,于37℃,5%co2细胞培养箱中培养。感染4-6h后,更换新的加血清的dmem培养基;
④感染后72h收集上清,将病毒上清于400g离心10min,除去细胞碎片,以0.45μm滤器过滤上清液于1.5ml离心管中(分装,1ml/管),于-80℃长期保存。
(4)pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ和pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ-t2a-il15kd慢病毒浓缩和滴度检测:
①感染后72h收集上清,将病毒上清于400g离心10min,除去细胞碎片;
②以0.45μm滤器过滤上清液于40ml超速离心管中;
③将带有病毒上清液的超速离心管逐一放入至beckman超速离心机内,25000×g,4℃离心2h;
④离心结束后,除去上清,加入病毒保存液,轻轻反复吹打重悬;
⑤样品滴度的检测,将pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ和pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ-il15kd慢病毒稀释至107tu/ml,-80℃保存。
实施例3
敲减人il-15的cd19car-t细胞:
t细胞的培养和pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ和pcdh-anti-cd19scfv-cd8αhinge/tm-cd137-cd3ζ-il15kd慢病毒转染t细胞
(1)t细胞的复苏:液氮中取出pbmc细胞一支,迅速放入37℃水浴锅中迅速溶解,待细胞冰块只有黄豆大小时,将pbmc细胞转入已预热的rpmi1640培养基中,300g离心5min,去除上清液,kbm581无血清培养基将pbmc细胞重悬,加入至1μg/mlanti-cd3、2μg/mlanti-cd28预包被的培养瓶中,37℃5%co2培养;
(2)第四天,将t细胞转入retronectin预包被的慢病毒中,moi值为10,即慢病毒:t细胞=10:1,37℃5%co2培养。即可获得cd19car-t细胞和敲减il15的cd19car-t细胞。
实施例4
car-t细胞体外增殖及维持能力:
在使用敲减il-15的cd19car慢病毒感染t细胞后,分别在第2、4、6、8、10、12天的时间点进行car-t细胞数目分析,分析采用流式细胞术,以cd3分子作为门控,使用特异性识别anti-cd19scfv的抗体耦联荧光分子进行流式标记来计算car-t细胞数目。cd19car病毒与敲减il-15的cd19car慢病毒制备的car-t细胞扩增增殖曲线如图4所示,图4中il15kdcd19car-t为敲减il-15的cd19car慢病毒制备的car-t细胞,cd19car-t表示cd19car病毒制备的car-t细胞,从图4可以看出,il-15sirna的表达序列对cd19car分子的表达以及car-t细胞的扩增无显著影响。
实施例5
细胞杀伤实验效果评估:
(1)分别培养cd19+k562细胞和pbmc细胞;
(2)实验开始前4天,moi=10的cd19car和敲减il15的cd19car的病毒感染pbmc细胞,培养72-96h后可安排开始实验;
(3)收集靶细胞(cd19+k562)5×105cells和效应细胞(cart细胞)3×106cells,800g,6min离心,弃上清;
(4)用1ml1×pbs溶液分别重悬靶细胞和效应细胞,800g,6min离心,弃上清;
(5)重复步骤(3)一次;
(6)用700μl培养基(1640培养基+10%fbs)重悬效应细胞,用2ml培养基(1640培养基+10%fbs)重悬靶细胞;
(7)设置效靶比为10:1的实验孔,并设置对照组,每组3个复孔;
(8)250×g,5min平板离心;
(9)37℃5%co2培养箱中培养4h;
(10)250×g,5min平板离心;
(11)取每个孔的50μl上清到新96孔板中,并且每孔加入50μl底物溶液(避光操作);
(12)避光孵育25min;
(13)每孔加入50μl终止液;
(14)酶标仪检测490nm吸光度;
(15)将3个复孔取平均值;将所有实验孔、靶细胞孔和效应细胞孔的吸光值减去培养基背景吸光值的均值;将靶细胞最大值的吸光值减去体积校正对照吸光值的均值;
(16)将步骤15中获得的经过校正的值带入下面公式,计算每个效靶比所产生的细
(17)胞毒性百分比,其中杀伤效率=(实验孔-效应细胞孔-靶细胞孔)/(靶细胞最大孔-靶细胞孔)×100%。
结果如图5所示,单个核细胞(pbmc)为对照组,cd19car-t细胞与敲减il-15的cd19car-t细胞(图中表示为il15kdcd19car-t)对靶细胞的杀伤效果相似,说明敲减il-15并没有显著影响效应细胞的杀伤能力。
实施例6
il-15敲减效果评估及评估其他细胞因子释放:
先单独培养cd19+k562细胞、cd19car-t细胞、敲减il-15的cd19car-t细胞(图中表示为il15kdcd19car-t),再分别收集各种细胞进行共培养,具体方法同上述杀伤功能检测。设置效靶比为10:1的实验孔,并设置对照组,在37℃5%co2培养箱中共培养10h,收集200μl共培养上清液,进行elisa检测,检测项目包括il-15,il-2,ifnγ。从图6中可以看出,il-15在敲减il-15效应细胞组以及与靶细胞共培养组都比对照组的il-15水平显著减少,如图7、图8所示,其他的细胞因子,包括il-2、ifnγ都没有显著变化。
以上仅是本发明的优选实施方式,本发明的保护范围并不仅限于上述实施例,与本发明构思无差异的各种工艺方案均在本发明的保护范围内。
sequencelisting
<110>安徽古一生物科技有限公司
<120>敲减人il-15的sirna、cd19car表达载体、car-t细胞及构建方法和应用
<160>11
<170>patentinversion3.3
<210>1
<211>48
<212>dna
<213>人工序列
<400>1
ccaactgggtgaatgtaataactcgagttattacattcacccagttgg48
<210>2
<211>48
<212>dna
<213>人工序列
<400>2
ggttgacccacttacattattgagctcaataatgtaagtgggtcaacc48
<210>3
<211>48
<212>dna
<213>人工序列
<400>3
gcatattgatgctactttatactcgagtataaagtagcatcaatatgc48
<210>4
<211>48
<212>dna
<213>人工序列
<400>4
cgtataactacgatgaaatatgagctcatatttcatcgtagttatacg48
<210>5
<211>48
<212>dna
<213>人工序列
<400>5
tcttggagttacaagttatttctcgagaaataacttgtaactccaaga48
<210>6
<211>48
<212>dna
<213>人工序列
<400>6
agaacctcaatgttcaataaagagctctttattgaacattgaggttct48
<210>7
<211>49
<212>dna
<213>人工合成
<400>7
cacacaaaaaaccaacacacagatgtaatgaaaataaagatattttatt49
<210>8
<211>374
<212>dna
<213>人工合成
<400>8
caccggatccgagggcctatttcccatgattccttcatatttgcatatacgatacaaggc60
tgttagagagataattggaattaatttgactgtaaacacaaagatattagtacaaaatac120
gtgacgtagaaagtaataatttcttgggtagtttgcagttttaaaattatgttttaaaat180
ggactatcatatgcttaccgtaacttgaaagtatttcgatttcttggctttatatatctt240
gtggaaaggacgaaacaccggtccaactgggtgaatgtaataactcgagttattacattc300
acccagttggcacacaaaaaaccaacacacagatgtaatgaaaataaagatattttattg360
aagcggccgcccac374
<210>9
<211>745
<212>dna
<213>人工序列
<400>9
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccagg60
ccggacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtc120
accatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcagaaa180
ccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtccca240
tcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggag300
caagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttcgga360
ggggggaccaagctggagatcacaggtggcggtggctcgggcggtggtgggtcgggtggc420
ggcggatctgaggtgaaactgcaggagtcaggacctggcctggtggcgccctcacagagc480
ctgtccgtcacatgcactgtctcaggggtctcattacccgactatggtgtaagctggatt540
cgccagcctccacgaaagggtctggagtggctgggagtaatatggggtagtgaaaccaca600
tactataattcagctctcaaatccagactgaccatcatcaaggacaactccaagagccaa660
gttttcttaaaaatgaacagtctgcaaactgatgacacagccatttactactgtgccaaa720
cattattactacggtggtagctatg745
<210>10
<211>340
<212>dna
<213>人工序列
<400>10
ctgagagtgaagttcagcaggagcgcagacgcccccgcgtacaagcagggccagaaccag60
ctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgt120
ggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtac180
aatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgag240
cgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggac300
acctacgacgcccttcacatgcaggccctgccccctcgct340
<210>11
<211>1459
<212>dna
<213>人工序列
<400>11
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccagg60
ccggacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtc120
accatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcagaaa180
ccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtccca240
tcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggag300
caagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttcgga360
ggggggaccaagctggagatcacaggtggcggtggctcgggcggtggtgggtcgggtggc420
ggcggatctgaggtgaaactgcaggagtcaggacctggcctggtggcgccctcacagagc480
ctgtccgtcacatgcactgtctcaggggtctcattacccgactatggtgtaagctggatt540
cgccagcctccacgaaagggtctggagtggctgggagtaatatggggtagtgaaaccaca600
tactataattcagctctcaaatccagactgaccatcatcaaggacaactccaagagccaa660
gttttcttaaaaatgaacagtctgcaaactgatgacacagccatttactactgtgccaaa720
cattattactacggtggtagctatgctatggactactggggccaaggaacctcagtcacc780
gtctcctcaaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcg840
cagcccctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacg900
agggggctggacttcgcctgtgatatctacatctgggcgcccttggccgggacttgtggg960
gtccttctcctgtcactggttatcaccctttactgcaaacggggcagaaagaaactcctg1020
tatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgt1080
agctgccgatttccagaagaagaagaaggaggatgtgaactgagagtgaagttcagcagg1140
agcgcagacgcccccgcgtacaagcagggccagaaccagctctataacgagctcaatcta1200
ggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatgggg1260
ggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataag1320
atggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcac1380
gatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatg1440
caggccctgccccctcgct1459
- 还没有人留言评论。精彩留言会获得点赞!