一种非种子特异性的启动子及其应用的制作方法
本发明涉及植物基因工程领域,特别涉及一种非种子特异性表达的pbntc06启动子及其应用。
背景技术
启动子是基因中重要的顺式作用元件,一般位于基因转录起始位点上游。启动子根据转录模式不同可以分为三种:组成型启动子、组织特异性启动子和诱导性启动子。组织特异性启动子的活性受到特定的组织细胞结构和化学、物理信号诱导调节的,即这类启动子的表达具有特定的时空性。在这类启动子的驱动下,基因的表达往往只限于某些特定的器官部位或特定的发育时期。组织特异性启动子不仅能使目的基因的表达产物在一定的器官或组织部位积累,提高区域表达量,同时也可以避免目标基因在其他组织中表达造成的消耗或不利影响。
技术实现要素:
发明人研究发现上游启动子pbntc06具有在种子发育中后期不表达或低表达的特性。
基于上述发现,本发明提供了一种非种子特异性启动子。
本发明非种子特异性启动子的序列为:
(1)seqidno.2所示核苷酸序列;或
(2)与(1)限定的核苷酸序列中至少有90%同源性的核苷酸序列。
本发明还提供了用于植物遗传转化的重组载体,所述载体含有本发明的seqidno.2所示启动子。本发明可选用本领域已知的各种载体,只要适合本发明启动子的表达即可,例如可以为市售的植物表达载体及质粒。
本发明同时提供了seqidno.2所示非种子特异启动子用于目的基因在植物的种子发育中后期不表达或低表达的应用。
本发明的在植物的种子发育中后期不表达或低表达包括在植物的种子发育中后期不表达或低表达、在种子发育前期表达或低表达和在非种子组织中表达或高表达。
本发明进一步提供了一种目的基因在植物的非种子组织中表达的方法,方法包括:将包含目的基因和本发明所述启动子的表达载体转化到植物中进行表达。
有些实施方案中,本发明的目的基因在植物的非种子组织中表达的方法还包括将第二目的基因在植物的种子组织中表达,所述将第二目的基因在植物的种子组织中表达包括:将包含第二目的基因和seqidno.1所示核苷酸序列启动子的表达载体转化到植物中进行表达,所述第二目的基因与所述目的基因不同。具体的,本发明将分别含有种子特异启动子:seqidno.1所示启动子和本发明所述启动子的用于植物遗传转化的真核表达载体,可以使外源目的基因在植物中表达。
具体的,本发明启动子启动gus基因表达的方法,包括:
(1)将seqidno.1所示和本发明启动子分别替换pbi121载体中位于gus基因上游的35s启动子,构成重组质粒;
(2)将所得重组质粒通过农杆菌介导的方法导入模式植物。本发明具有以下积极有益的技术效果:
1.本发明首次分离了油菜微管蛋白非种子特异性表达的pbntc06启动子,该启动子在种子以外的其他组织中启动目的基因高表达。该启动子与之前报道的只在某种组织中特异表达的启动子不同,它可以同时在除种子中后期之外的其他组织或时期高表达目的基因。如果与反义rna或rnai技术结合,也可以用于在除种子之外的其他组织中表达反义rna基因片段或颈环rna,实现沉默相关基因的目的。这种特异的启动子,可以满足基因工程中要在非种子组织中表达的特殊需要,用于植物抗病、发育和代谢调控等领域。
2.本发明首次分离了油菜油体蛋白种子发育中后期特异性表达的pbnoa03启动子,该启动子在种子发育中后期启动目的基因高表达。与一般的种子特异启动子不同,该启动子并不是在种子发育的整个过程中表达,只是在种子发育中后期表达,这个时期也是种子中贮藏物质积累的重要阶段。更有意义的是,该启动子与本发明中pbntc06启动子在组织和时空表达上能够互补表达。pbnoa03启动子除可以单独用于种子改良等基因工程或研究外,也可以与pbntc06启动子配合使用,很好的实现两个不同目的基因互补表达的应用,如本发明中遇到的提高种子中多不饱和脂肪酸的问题。
3.本发明有助于促进人们对改良植物种子特性和改良植物非种子组织的研究,在基因工程领域具有广阔的空间和市场前景。将为基因工程的研究提供方便而有利的工具。
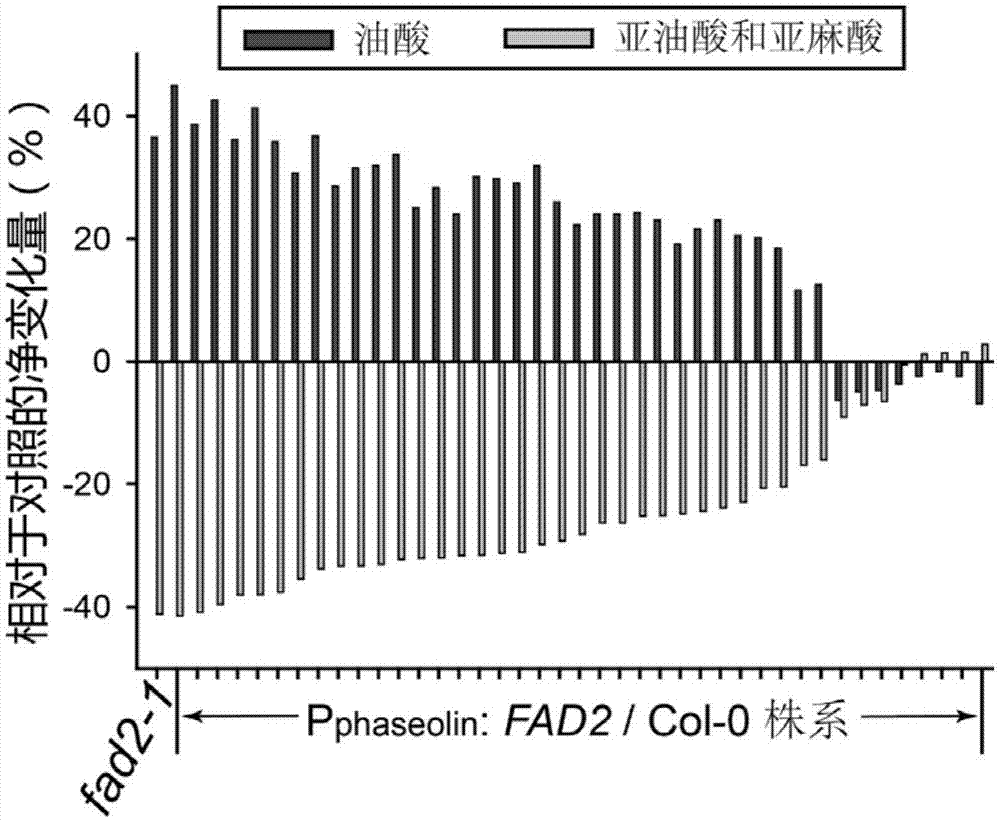
4、本发明的启动子可用于解决研究背景中fad2在rdr6突变体中抗病性降低的问题:在过表达fad2基因提高植物种子中多不饱和脂肪酸的研究中,发明人发现在绝大多数fad2转基因株系,不但不能提高其产物多不饱和脂肪酸的含量,而且引起了其底物油酸的大量积累(附图1)。进一步分析发现,在这些造成fad2底物积累而产物降低的株系中(图2a),fad2转基因引起内源和总的fad2基因表达的降低(图2b)。也就是说,fad2转基因引起了rna沉默,这也被称为共抑制(co-suppression)。为了鉴定这种强烈的共抑制是否受rna沉默相关遗传因子的控制,发明人将fad2基因转入rdr6突变体,结果发现,fad2可以明显提高多不饱和脂肪酸含量(图3a),进一步检测基因表达发现,在rdr6背景下的fad2转基因株系中,总fad2的表达水平可以大幅度提高(图3b)。也就是说,rdr6参与了fad2转基因沉默的发生。在rdr6的突变体中,可以有效提高fad2的产物多不饱和脂肪酸的含量。但由于rdr6也参与植物的抗病毒过程(mourrain等,2000),如果利用rdr6突变体来提高多不饱和脂肪酸的含量,有可能会带来了植物抗病性降低的潜在问题。考虑到fad2发生作用的关键时期为种子发育的中后期,为了解决这个新问题,需要在rdr6突变体中部分恢复其功能,也就是让rdr6在除种子中后期之外的其它组织中表达,而在种子中后期不表达。
附图说明
图1为fad2在拟南芥野生型种子中过表达t2代株系的脂肪酸变化。图例中的脂肪酸种类:红色柱子为油酸(18:1),代表fad2的底物;绿色柱子为亚油酸(18:2)和亚麻酸(18:3)的和,代表fad2的产物。横坐标pphaseolin:fad2/col-0表示fad2在种子特异性phaseolin启动子驱动下转化拟南芥col-0野生型所获得的独立转基因系,fad2-1是fad2的一个突变体。纵坐标相对于对照的净变化量是指,转基因系中所示脂肪酸与拟南芥野生型col相应脂肪酸含量的差值,横坐标之上为净增加,横坐之下为净减少。过表达atfad2在大部分转基因株系中表现出其产物亚油酸的降低。fad2转基因系中,油酸的积累和多不饱和脂肪酸的减少接近甚至超过了fad2突变体的表型。
图2为拟南芥fad2转基因株系脂肪酸组分和fad2表达水平分析。横坐标为野生型及fad2转基因t2株系。a图纵坐标表示fad2产物亚油酸与亚麻酸之和与底物油酸的比值。b图纵坐标为fad2的表达水平,用与野生型的表达量的比值表示。表达水平采用q-pcr技术定量,利用5’utr引物检测内源fad2,采用编码区引物检测总fad2。图中横坐标代表野生型col-0以及atfad2在col-0中的转基因株系。在种子中过表达atfad2株系中,fad2基因表达水平与多不饱和脂肪酸水平一致。亚油酸降低的株系中,内源和外源fad2表达水平降低,个别亚油酸提高的株系中,总fad2大量积累。
图3为fad2/rdr6转基因系脂肪酸表型与fad2表达水平分析。横坐标为rdr6和在其背景下过表达fad2的转基因系。a图纵坐标表示fad2产物亚油酸与亚麻酸之和与底物油酸的比值。b图纵坐标为fad2的表达水平,用与野生型的表达量的比值表示。表达水平采用q-pcr技术定量,利用5’utr引物检测内源fad2,采用编码区引物检测总fad2。fad2在rdr6突变体中过表达可以在全部株系中提高多不饱和脂肪酸,过表达fad2转基因沉默在rdr6突变体中完全被解除,fad2总表达水平可以提高超过10倍以上。
图4植物表达载体pbnoa03::gus。植物表达载体的骨架位pbi121,以gus基因为目的基因,将pbnoa03构建于目的基因的上游。
图5植物表达载体pbntc06::gus。植物表达载体的骨架位pbi121,以gus基因为目的基因,将pbntc06构建于目的基因的上游。
图6pbnoa03::gus转基因植株中gus基因表达模式分析。其中a:萌发5天幼苗;b:茎;c:茎生叶;d:花;e:莲座叶;f:开花后4天角果;g:开花后7天角果;h:开花后7天种子;i:开花后11天种子;j:开花后15天种子;k:开花后18天种子;l:开花后21天种子。培养基上生长了5天的幼苗各个部位都没有发现gus的明显表达;茎、茎生叶、莲座叶、花中没有发现gus基因的明显表达,其中花器的雌蕊柱头部分、花瓣和雄蕊的花药、花丝也没有发现gus染色。开花后4天的种荚和株柄没有gus染色;开花后7天的种荚及种子中没有发现gus信号;开花后11天的角果中,种荚和株柄没有染色,种子中发现有gus的浅着色;开花后15天的角果中,种荚和株柄都没有染色,在种子中可以检测到有gus染色;开花后18天的角果中,种荚和株柄均没有染色,种子中发现较深的gus染色;开花后21的角果中,种荚、株柄和种子中都没有检测到gus染色。pbnoa03::gus转基因植株中的gus染色,可以与pbntc06::gus转基因植株中的gus染色互相作为阳性和阴性对照。
图7pbntc06::gus转基因植株中gus基因表达模式分析。其中a:萌发5天幼苗;b:茎;c:茎生叶;d:花;e:莲座叶;f:开花后4天角果;g:开花后7天角果;h:开花后7天种子;i:开花后11天种子;j:开花后15天种子;k:开花后18天种子;l:开花后21天种子。培养基上生长了5天的幼苗有明显的gus基因表达;茎、茎生叶、莲座叶、花中也有gus基因的明显表达,其中花器的雌蕊柱头、花瓣和雄蕊的花药、花丝也发现gus染色。开花后4天的种荚和株柄有较深gus染色,开花后7天种荚及种子中发现有较深gus染色;开花后11天的角果中,种荚和株柄有染色,但染色较浅,而种子染色也着色浅;开花后15天的角果中,种荚和株柄有较浅染色,种子中能略微检测到gus信号;开花后18天的角果中,种荚、株柄和种子都没有染色;开花后21的角果中,种荚、株柄和种子都没有检测到gus染色。pbnoa03::gus转基因植株中的gus染色,可以与pbntc06::gus转基因植株中的gus染色互相作为阳性和阴性对照。
具体实施方式
本发明的目的基因包括但不限于植物代谢、生长、发育、抗病或抗逆等方面的基因或基因片段。
不同植物种子发育中后期的时间不同。种子发育初期一般指种子的形态建成阶段,如形成了子叶和胚轴,中期指种子形态建成后营养物质贮藏阶段,后期指种子的逐渐干燥和成熟阶段。
本发明的植物非种子组织包括叶片、茎、根和花器等种子之外的组织。
以下实施例用于说明本发明,但不用来限制本发明的范围。下述实施例中的实验方法或检测方法,如无特殊说明,均为常规方法。下述实施例中所用到的试验试剂或材料,如无特殊说明,均为常规生化试剂公司购买得到。
实施例1:油菜油体蛋白基因bnoa03和油菜微管蛋白基因bntc06分离,包括以下步骤:
(1)油菜基因组dna的制备
取种植于温室的烟草嫩叶,采用ctab法提取基因组dna,经琼脂糖凝胶电泳检测后保存于-20℃。
(2)bnoa03基因启动子和bntc06基因启动子的克隆
利用上游引物bnoa03-f:
5’-ccaagcttattctgcgtatttccaaactgag-3’;
下游引物bnoa03-r:
5’-ctctagataatcctccaagctaaatctttg-3’。
从甘蓝型油菜基因组中pcr扩增获得长度为537bp的pbnoa03启动子,测序获得的核苷酸序列如seqidno.1,该序列与油菜基因组数据库中序列同源性为95%。为便于克隆,在pcr产物两端分别带有hindⅲ、xbaⅰ的酶切位点及保护碱基。
利用上游引物bntco6-f:
5’-ccaagcttcgataattctattttggtacagttc-3’;
下游引物bntco6-r:
5’-cgggatccggcttgaccgatgtggat-3’。
从甘蓝型油菜基因组中pcr扩增获得长度为457bp的pbntc06启动子,测序获得的核苷酸序列如seqidno.2,该序列与油菜基因组数据库中序列同源性为99%。为便于克隆,pcr产物两端分别带有hindⅲ和bamhⅰ的酶切位点及保护碱基。
上述pcr扩增体系均为:(20μl体系)
pcr程序:94℃5min;94℃30s,55℃30s,72℃1min30s,共34个循环;72℃5min。
(3)bnoa03基因启动子和bntc06基因启动子的序列分析
利用plantcare对启动子序列中的顺式元件进行预测分析。发现两个启动子区域中均含有水稻胚乳特异性表达顺式调控元件skn-1基序,abre应答元件,对转录起始其重要作用的tata-box和对基因的转录起到很强的激活作用的caat-box等基础元件,特别地,油体蛋白基因启动子具有种子特异表达有关的ry-motif,微管蛋白基因启动子具有与根特异性表达有关的i-box元件,与花粉特异性表达有关的pollen-box元件。这将在基因工程的研究中具有广泛的应用价值。
实施例2:植物表达载体的构建,包括以下步骤:
根据实施例1中pcr克隆得到pbnoa03启动子和pbntco6启动子,切胶回收产物分别用hindⅲ、xbaⅰ和hindⅲ、bamhⅰ双酶切,将中间载体pmd18-t分别用hindⅲ、xbaⅰ和hindⅲ、bamhⅰ进行双酶切,用t4连接酶连接后转化至大肠杆菌dh5α中扩繁,提取质粒后经测序鉴定,表明油菜油体蛋白基因启动子pbnoa03和油菜微管蛋白基因启动子pbntc06成功克隆到pmd18-t上。分别用限制性内切酶hindⅲ、xbaⅰ和hindⅲ、bamhⅰ酶切带有油菜油体蛋白基因启动子pbnoa03和带有油菜微管蛋白基因启动子pbntco6的pmd18-t中间载体和植物表达载体pbi121,回收酶切目标片段并进行连接。分别获得双元表达载体pbnoa03::gus(图4)和pbntc06::gus(图5)。
将植物表达载体pbnoa03::gus和pbntc06::gus转化至大肠杆菌dh5α中扩繁。
大肠杆菌感受态细胞转化,方法包括(1)从-80度冰箱中取出大肠杆菌感受态,置于冰上;(2)加入5μl连接体系于感受态细胞中,轻轻混匀,冰浴30min;(3)42℃的水浴锅中热激1min后,立即置于冰上2min;(4)加入500μl的lb液体培养基(不含抗生素),37℃,200rpm条件下培养15-30min;(5)随后取100μl,涂布于含有抗生素的lb固体平板上。放于37℃恒温培养箱过夜培养。(6)稀释引物,取5个小离心管标记,取转化板,给5个1.5ml离心管各加入10μl水并标记,挑单菌落5个,用枪头轻轻挑取单一且菌落较大的单菌落,在离心管中吸打,加入1μl于小离心管;(7)离心后,放入pcr仪。检测筛选到的阳性克隆扩繁提取质粒后转化农杆菌eha105。
实施例3:种子特异性pbnoa03启动子和非种子特异性pbntco6启动子活性的鉴定,包括以下步骤:
通过根癌农杆菌介导转化方法,分别将pbnoa03::gus和pbntc06::gus转入拟南芥,分别获得转化pbnoa03::gus和pbntc06::gus的转基因t1和t2株系。
(1)根癌农杆菌介导的拟南芥转化
本实施例所用拟南芥为野生型col-0。拟南芥种子在4℃的环境下放置2-4天进行同步化处理后,在人工控制培养室的培养,生长条件为:温度条件为22℃,光周期是16小时光照/8小时黑暗,光强是100-130μem-2s-1。
通过花序浸沾法对拟南芥进行遗传转化(cloughandbent,1998)。在拟南芥盛花期,利用花序浸染法对拟南芥及其他突变体进行遗传转化,将pbnoa03::gus和pbntco6::gus载体转化到col-0植株中。收集转化得到拟南芥种子于1.5ml离心管,在含有kan抗性的1/2ms培养基中筛选收获的转基因种子。观察培养5天左右幼苗,挑选出能够正常生长的绿色幼苗,移栽到营养土中。待植株生长至多片莲座叶时,剪取少量叶片,用ctab法提取dna,进行pcr鉴定。依据此可以筛选出t1代转基因种子。将t1代种子萌发,为t1代转基因植株,将其移至以蛭石、珍珠岩、泥炭为基质的盆钵中,让其在培养室中继续生长至收获,为t2代种子。选择不同遗传转化中获得的t2代多个独立转化系的种子,分别编号命名。
(2)转基因植株非种子组织gus染色
对转基因t1植株的嫩叶和不同发育时期的角果进行gus染色预试验,挑选表达符合预期的株系,收获种子,筛选得到t2代植株,对t2代植株的不同时期的幼苗,根系,莲座叶,茎叶,茎,花和开花后4、7、11、15、18、21天的角果进行gus染色。具体步骤如下:将样品(冰上取样)放入1.5ml的离心管中,加入冰浴后的90%丙酮1ml,固定15min;吸出丙酮,加入不含x-gluc的gus洗脱液1ml,静置2min,重复两次;加入含有x-gluc的gus染液,没过组织,放入37℃的恒温烘箱染色12h,随时观察不同组织的染色情况;吸掉染色液,加入75%酒精,室温放置1h,吸掉75%酒精,加入95%酒精使其脱色;用立体显微镜观察拟南芥不同组织的gus染色情况。
(3)转基因植株种子不同发育时期gus活性表达分析
gus活性分析表明,pbnoa03启动子是一个在种子发育中后期,即种子储藏物质和油脂积累时期启动gus基因高表达的启动子,如图6所示,因而pbnoa03启动子在植物种子中具有特异性,适合在各种植物的种子发育中后期表达目标基因并提高目的基因的表达量(如在本发明研究背景中表达fad2)。gus活性分析结果表明pbntc06启动子是一个除在种子以外的其他组织中启动gus基因高表达的启动子,如图7所示,因而pbntc06启动子在非种子组织中具有特异性,可以用于研究只需要在其他组织表达而不需要在种子中表达的相关基因这将为基因工程的研究提供方便而有利的工具。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明的基础上,可以对之作一些修改或改进,这对于本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
核苷酸序列表电子文件
<110>西北农林科技大学
<120>一种非种子特异性的启动子及其应用
<141>
<160>
<210>1
<211>537
<212>dna
<213>种子特异启动子
<220>
<223>
<400>1
1aagcttgaaatcaaggatttgtagcaaagtaatcacattctcatgtttaagtgatcagag
61agttataagaatgtggagattcaattcaagcacaagacagatctcgttctgcatggatct
121tgaagtcagttacaggatatgtactaagtttggtaaaaccaggttcttggtcagtctcct
181gcagagtctgttcgatatcactttgggattttattttgaactgattagcagaaggatccc
241ctttaattgatgcggtacgcattcttaattgtccgtctcagcccgtccattggtatcatc
301ggattcgcaatcttcctctctttccaaagtttcaaaagaggaaatgaaacttgttactca
361tgcaaggttctcaggtgccacgtctctcctttacgtgtcacgttctcgcagcatgtcgcc
421catctatattacaacaaacccaattccattacttaaaccttaaaaaggcagaagcaacta
481atccgcaacatcttgcttttagtttcttgcgtaacaaagatttagcttggaggatta
<210>2
<211>458
<212>dna
<213>非种子特异启动子
<220>
<223>
<400>2
1tcacacaggaaacagctatgaccatgattacgccaagcttcgataattctattttggtac
61agttctttatcgcttcggtttactatagatattggtctgatccggttttaatcccggttt
121gcgctcttccttttccgtaattcaagggatttttgaatttcaaaaaaacaagagagagag
181agagaaacggcccaacagaaccgaagcggcaaattttaaaattagaaaatatgcagctca
241cgagagtaaccctatcaataaccatggttagcacttacccaataatatcatcacacgtgt
301catatacagcccgttacctaaagatggaggatggttccgctatataaaccagctaacatc
361tgtgtaaaccttgaaatcgaaaaaccagatctagagagcgtcttcatacacgccctccca
421tttcttcttctctgcgaatctcagtcctccgcgaagcg
<210>3
<211>31
<212>dna
<213>上游引物bnoa03-f
<220>
<223>
<400>3
5’-ccaagcttattctgcgtatttccaaactgag-3’
<210>4
<211>30
<212>dna
<213>下游引物bnoa03-r
<220>
<223>
<400>4
5’-ctctagataatcctccaagctaaatctttg-3’
<210>5
<211>33
<212>dna
<213>上游引物bntco6-f
<220>
<223>
<400>5
5’-ccaagcttcgataattctattttggtacagttc-3’
<210>6
<211>26
<212>dna
<213>下游引物bntco6-r
<220>
<223>
<400>6
5’-cgggatccggcttgaccgatgtggat-3’
- 还没有人留言评论。精彩留言会获得点赞!