一种来源于凡纳滨对虾血蓝蛋白的抗WSSV肽LvHcS52及其应用的制作方法
本发明涉及生物技术领域,尤其涉及一种来源于凡纳滨对虾血蓝蛋白的抑制白斑综合症病毒(wssv)的短肽lvhcs52及其编码基因与应用。
背景技术
对虾白斑综合症病毒(whitespotsyndromevirus,wssv)是对虾养殖业中危害最大的一种病毒,该病毒传染力强、致死率高,对虾感染wssv后,7-10天死亡率可达100%,在过去二十多年来给全球范围内对虾养殖业造成了巨大的经济损失。至今仍未得到完全控制,成为对虾养殖业发展的主要障碍之一。
目前,对虾生产上均采用养殖抗病能力强的种类及切断wssv传播途径等方法防止wssv病害的传播。同时,多年来国内外许多学者试图通过增强对虾体质,提高抗病能力等对对虾wssv进行防治。有研究表明,一些富含多糖、生物碱、有机酸等多种成分的天然免疫物质给虾口服或注射后,既有抗菌作用,又有免疫刺激作用,它们能增强虾类机体的细胞免疫和体液免疫的功能,提高对虾的抗病力。
因此,通过寻找具有抑制wssv增殖的活性物质,添加到饲料中增强对虾体质,提高抗病能力等,不失为一种可行的方法。
技术实现要素:
本发明的目的在于提供一种来源于凡纳滨对虾血蓝蛋白的抗wssv肽lvhcs52,以解决现有技术存在的问题。
从凡纳滨对虾的血淋巴中,通过大量的实验,最终获得了一种能够抑制wssv增殖的多肽lvhcs52,由55个氨基酸组成,其氨基酸序列如seqidno:1所示。
本发明还提供一种上述来源于凡纳滨对虾血蓝蛋白的抗wssv肽lvhcs52的编码基因,如seqidno:2所示。
本发明还提供一种含上述编码基因的表达盒。
本发明还提供一种含上述编码基因的重组菌。
本发明还提供一种含上述编码基因的重组载体。
本发明还提供含上述来源于凡纳滨对虾血蓝蛋白的抗wssv肽lvhcs52、上述编码基因或上述重组载体制备抑制wssv的制剂中的用途。
本发明还提供一种用于抗wssv的制剂,包含上述来源于凡纳滨对虾血蓝蛋白的抗wssv肽lvhcs52、上述编码基因、上述重组载体中的一种或者多种混合。
一种含有上述来源于凡纳滨对虾血蓝蛋白的抗wssv肽lvhcs52的饲料添加剂。
一种含有上述来源于凡纳滨对虾血蓝蛋白的抗wssv肽lvhcs52的饲料。
本发明的抗wssv短肽lvhcs52可以采用本领域技术人员已知的方法合成,例如固相合成,并采用本领域技术人员已知的方法进行原核表达和纯化。
与现有技术相比,本发明对自然界生物内的多种天然多肽进行特异性选择,通过大量的实验,获得了一种能够抑制wssv增殖的约5.8kda,来源于凡纳滨对虾血蓝蛋白的肽段lvhcs52,并可用化学法合成。根据lvhcs52的氨基酸序列相对应的核苷酸,设计引物,克隆得到lvhcs52的核苷酸组成,并构建到原核表达载体中,转化到大肠杆菌中,通过诱导表达并纯化得到重组的lvhcs52。并在体内和体外原代培养的血细胞中验证lvhcs52的活性,结果表明该肽段不管在动物水平还是在体外细胞水平,均能显著抑制wssv极早期基因wsv069和晚期基因wsv421的转录,同时在体内还能显著抑制wssv的增殖。通过进一步的实验研究,发现lvhcs52能激活对虾血细胞内的stat信号通路,引发该信号通路下游抗菌肽的转录从而发挥抗wssv的功能。本发明的抗wssv短肽可以作为添加剂添加到饲料中,以期提高对虾的抗wssv能力。
附图说明
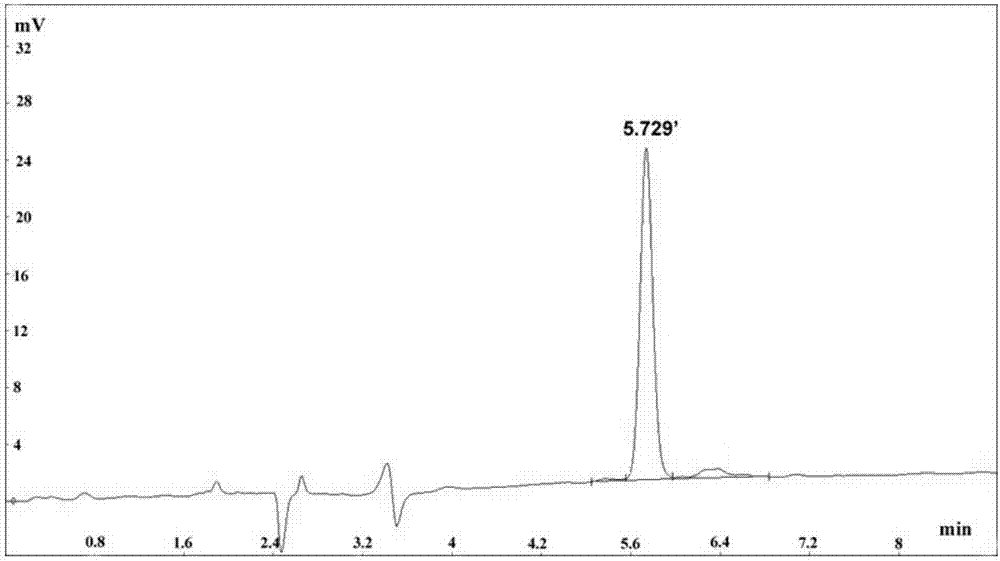
图1为本发明抑制wssv的短肽lvhcs52的高效液相色谱图;
图2为本发明抑制wssv的短肽lvhcs52的质谱图;
图3为本发明抑制wssv的lvhcs52短肽和对照gst的sds-page图;
图4为本发明抑制wssv的短肽lvhcs52在动物体内水平的wssv极早期基因wsv069基因的转录变化情况;
图5为本发明抑制wssv的短肽lvhcs52在动物体内水平的wssv晚期基因wsv421基因的转录变化情况;
图6为本发明抑制wssv的短肽lvhcs52在动物体内水平的wssvcopy数的变化情况;
图7为本发明抑制wssv的短肽lvhcs52在体外细胞水平的wssv极早期基因wsv069基因的转录变化情况;
图8为本发明抑制wssv的短肽lvhcs52在体外细胞水平的wsv421基因的转录变化情况;
图9为本发明抑制wssv的短肽lvhcs52在体外细胞水平验证stat信号通路stat基因的转录变化情况;
图10为本发明抑制wssv的短肽lvhcs52在体外细胞水平验证stat信号通路alf1基因的转录变化情况;
图11为本发明抑制wssv的短肽lvhcs52在体外细胞水平验证stat信号通路alf3基因的转录变化情况。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。但本领域技术人员了解,下述实施例不是对本发明保护范围的限制,任何在本发明基础上做出的改变和变化,都在本发明的保护范围之内。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法
实施例1:抑制wssv的短肽lvhcs52的固相合成、切割、纯化及鉴定
先从凡纳滨对虾的血淋巴中,通过大量的实验,最终获得了一种能够抑制wssv增殖的多肽lvhcs52,再利用多肽合成仪采用固相合成法合成所述抑制wssv的短肽,具体固相合成方法如下:
(1)以dmf为溶剂,各种α-氨基被fmoc保护的氨基酸溶液的浓度为0.25m,hbtu溶液、hobt溶液的浓度为0.33m,哌啶溶液的浓度为200ml/l,diea溶液的浓度为174.2ml/l。
(2)称取0.05mmolfmoc-ala-wang树脂(官能团含量0.33mmol/g)置于固相反应器中,加8mldcm溶胀过夜,减压抽去溶剂。加入浓度为200ml/l的哌啶溶液8ml,室温下反应5min,抽干;再加入浓度为200ml/l的哌啶溶液8ml,室温下反应20min,抽干;依次用8ml的dmf洗涤3次,每次1min。准确量取0.2mmol的α-氨基被fmoc保护的氨基酸溶液、0.2mmol的hbtu溶液、0.195mmol的hobt溶液加入固相反应器中,反应5min后加入0.4mmol的diea,室温下氮气气泡振荡反应2h。依次用8ml的dmf洗涤3次,每次1min。加入浓度为200ml/l的哌啶溶液8ml,室温下反应5min,抽干;再加入浓度为200ml/l的哌啶溶液8ml,室温下反应20min,抽干;依次以8ml的dmf洗涤3次,每次1min。按照如上步骤从肽链的碳端到氮端逐一连续合成了本发明的抑制wssv的短肽lvhcs52,lys-gly-gly-lys-thr-ser-ile-glu-arg-lys-ser-thr-glu-ser-ser-val-thr-val-pro-asp-val-pro-ser-ile-his-asp-leu-phe-ala-glu-ala-glu-ala-gly-gly-ala-gly-leu-ala-lys-phe-glu-ser-ala-thr-gly-leu-pro-asn-arg-phe-leu-leu-pro-lys。
(3)待合成完毕后,分别用dmf和dcm先后清洗连有多肽链的树脂,后将树脂至于真空干燥箱内干燥备用。
(4)抑制wssv的短肽的切割:
(a)待树脂干燥后,用刮刀将树脂尽量打散,转移至鸡心瓶中,加入磁子,在冰水浴下缓慢加入用于脱除树脂的切割液10ml(切割液中tfa:纯水:苯甲硫醚:苯酚:乙二硫醇比例为82.5:5:5:5:2.5),冰水浴下反应2h。
(b)待反应完成,将反应液连同树脂一同转移至过滤器中,用水泵抽滤,将得到的滤液置于圆底烧瓶中,并在氮气流下吹干。
(c)待圆底烧瓶中的样品吹至粘稠,撤下氮气管,在圆底烧瓶中倒入约20ml的4℃冰乙醚,混合后充分打散,然后于冷冻离心机内,4℃下8000r/min离心15min,弃上清,再于20ml的4℃冰乙醚中打散,离心;如此重复操作3次,将沉淀再次真空干燥,即得抑制wssv的短肽的粗品。
(5)抑制wssv短肽的纯化及鉴定:
用反向高效液相色谱法对抗wssv肽进行纯化鉴定。采用c18半制备柱,流动相:a相(水相):去离子水(含0.1%tfa(m/v));b相(有机相):80%乙腈水溶液(含0.1%tfa(m/v));流速:6ml/min;洗脱梯度:a相以每分钟1%的变化从55%降到10%,b相以每分钟1%的变化从45%升到90%。
根据高效液相色谱图,见图1采集5.6-6min的洗脱液,采用旋转蒸发仪除去洗脱液中的有机相乙腈,之后将剩余的抗wssv肽水溶液放入冰箱冷冻成冰块,最后用冷冻干燥机除去水分,得到蓬松固体粉末,为抑制wssv的短肽纯品。图2为抑制wssv的短肽lvhcs52的质谱图。
实施例2:基因克隆与原核表达该与抑制wssv有关的对虾血蓝蛋白降解肽段
(1)根据多肽的n端和c端序列,定位至血蓝蛋白氨基酸序列中,结合核苷酸序列:aagggtggaaaaacttcaattgaacgcaagtccacggaatcttcagtaactgtaccggacgtgccaagcatacatgacctgtttgcagaagccgaggcaggcggcgctggccttgccaaattcgagagtgcaacaggcctaccaaacaggttccttctccccaag,设计pcr引物,用肝胰腺的cdna为模板进行pcr扩增。目的条带使用琼脂糖凝胶dna回收试剂盒(上海生工)回收纯化,方法参见试剂盒说明手册,并测浓度,用于下一步实验。
(2)纯化后的pcr产物和pgex-6p-1用限制性内切酶进行酶切,胶回收后测浓度,并用t4连接酶于16℃过夜酶连。连接产物转化大肠杆菌菌株rosetta中,并在含有100μg/ml氨苄青霉素(amp)的lb固体培养基上,于37℃倒置培养。
(3)挑取单菌落,于含100μg/mlamp的lb液体培养基37℃中培养。并进行菌液pcr验证,根据验证结果,部分送至华大科技测序验证序列的正确性。并依据测序结果,保留序列正确的菌种。在菌液中加入终浓度为15%的甘油,-20℃保存备用。
(4)将测序正确的菌株用于诱导表达。测序正确的菌株按1:100的比例加入液体lb培养基中(含amp100μg/ml);37℃,200rpm摇床培养至od600到0.6左右时加入iptg,终浓度为0.5mm,同时取出1ml菌液作为未诱导对照;诱导4h后的菌液转移至离心管中,4℃,5000g离心20min,收集菌体;加入适量超声破碎缓冲液(含50mmtris,5mmedta,100mmnacl,ph8.0,现加1mmpmsf)重悬浮菌体;置于冰上超声破碎菌体;4℃,20000g离心30min,分别收集上清和沉淀;进行sds-page分析,验证是否有诱导表达。
(5)尽可能将目的片段表达于上清,利于下一步的纯化。
(6)采用gst柱材(geheathercare,us)纯化gst标签的血蓝蛋白降解肽段。
(7)采用prescissionprotease(gehealthcare,us)将gst标签去除,获得抗wssv的血蓝蛋白降解肽段lvhcs52。
(8)按照上述步骤将转化了pgex-6p-1质粒的大肠杆菌bl21菌株进行诱导表达,用gst柱材纯化gst标签蛋白,采用10mm的还原性谷胱甘肽将gst从柱材上特异性洗脱下来,用于下一步实验。
图3的sds-page结果表明,得到重组表达的gst(rgst)和lvhcs52(rlvhcs52)。
实施例3:抑制wssv短肽的动物体内水平活性验证
(1)将重组表达的短肽用灭菌的0.01mpbs(ph7.4)稀释至10μm(阴性对照为重组表达的gst),加入102copy/μl的wssv,阳性对照为0.01mpbs(ph7.4)稀释的102copy/μlwssv,均于室温中孵育2h。
(2)用无菌的1ml注射器取100μl混合溶液从对虾第3腹节进行肌肉注射。
(3)于0、2、6、12和24hpi取对虾全血细胞,分别用海洋动物组织基因组dna提取试剂盒(tiangen生化)和总rna抽提试剂盒(上海飞捷生物有限公司)提取对虾基因组dna和总rna。
(4)用反转录试剂盒(全式金生物科技有限公司)将mrna反转录成cdna,并根据模板浓度稀释5-10倍;用无菌水将基因组dna浓度调成一致。
(5)wssvcopy数的计算。以基因组dna为模板,wsv421的qpcr引物检测对虾血细胞基因组dna中的wssvcopy数。
(6)wssv极早期基因wsv069和晚期基因wsv421转录水平的qpcr检测。用wsv069、wsv421和内参基因ef-1α进行qpcr分析,检测其转录情况。
图4-图6为lvhcs52在动物体内水平的抗wssv活性验证,图4为wsv069基因的转录变化情况;图5为wsv421基因的转录变化情况;图6为wssvcopy数的变化情况。可以得出,与对照相比lvhcs52在wssv感染后2h显著提高wsv069的转录,在12h显著抑制wsv069的转录,同时在6h和12h显著抑制wsv421的转录,同时可以显著的抑制wssv的增殖。
实施例4:抑制wssv短肽的体外细胞水平活性验证
(1)用抗凝剂(ph6.0)收集对虾全血细胞,并用昆虫培养基insertxpress稀释,细胞计数后,细胞培养板中的每个孔接种106个全血细胞,待细胞贴壁后更换含3%双抗的培养基,于27℃细胞培养箱中培养24h。
(2)将化学固相合成的短肽用昆虫培养基稀释至10μμ[阴性对照为化学固相合成的绿色荧光蛋白(gfp)片段],加入106copy的wssv,阳性对照为昆虫培养基稀释的106copywssv,均于27℃细胞培养箱中孵育2h。
(3)将细胞培养板取出,小心吸出培养基,用0.01mpbs(ph7.4)洗细胞三次,每孔加入含有10μμ短肽和106copywssv的培养基混合液处理细胞。
(4)于处理后的0、2、6和12h用总rna抽提试剂盒(上海飞捷生物有限公司)提取细胞的总rna,再用反转录试剂盒(全式金生物科技有限公司)将mrna反转录成cdna,并根据模板浓度稀释5-10倍。
(5)wssv极早期基因wsv069和晚期基因wsv421转录水平的qpcr检测。
图7-8为lvhcs52在体外细胞水平的抗wssv活性验证,图7为wsv069基因的转录变化情况;图8为wsv421基因的转录变化情况。结果表明,与对照相比lvhcs52在wssv感染体外原代培养的血细胞2h后可显著提高wsv069的转录,在12h显著抑制wsv069的转录,同时在6h和12h显著抑制wsv421的转录,与体内动物水平的结果相似。
实施例5:抑制wssv短肽激活stat信号通路,引发下游抗菌肽基因的表达
(1)按实施例4进行对虾血细胞的原代培养,处理细胞时只用含10μμ短肽的培养基,对照为合成的gfp肽段和溶解多肽的h2o。
(2)按上述实施例,于0、2、6和12h提取细胞总rna并进行cdna的反转录,将浓度调成一致。
(3)利用qpcr技术检测stat信号通路相关重要基因以及下游抗菌肽基因的转录变化情况。
图9-11为lvhcs52在体外细胞水平验证stat信号通路相关基因的转录变化情况,图9为stat基因的转录情况;图10为alf1基因的转录变化情况;图11为alf3基因的转录变化情况。结果表明,与对照相比lvhcs52能显著提高stat基因的转录;同时在多肽处理细胞2和6h后,其可以显著抑制下游抗菌肽基因alf1和alf3的转录,而在12h显著提高这两个抗菌肽基因的转录。
sequencelisting
<110>汕头大学
<120>一种来源于凡纳滨对虾血蓝蛋白的抗wssv肽lvhcs52及其应用
<130>2018
<160>2
<170>patentinversion3.3
<210>1
<211>55
<212>prt
<213>人工序列
<400>1
lysglyglylysthrserilegluarglysserthrgluserserval
151015
thrvalproaspvalproserilehisaspleuphealaglualaglu
202530
alaglyglyalaglyleualalysphegluseralathrglyleupro
354045
asnargpheleuleuprolys
5055
<210>2
<211>165
<212>dna
<213>人工序列
<400>2
aagggtggaaaaacttcaattgaacgcaagtccacggaatcttcagtaactgtaccggac60
gtgccaagcatacatgacctgtttgcagaagccgaggcaggcggcgctggccttgccaaa120
ttcgagagtgcaacaggcctaccaaacaggttccttctccccaag165
- 还没有人留言评论。精彩留言会获得点赞!