一种乳酸乳球菌抗菌肽、其制备方法及应用与流程
本发明涉及基因工程
技术领域:
,尤其涉及一种乳酸乳球菌抗菌肽、其制备方法及应用。
背景技术:
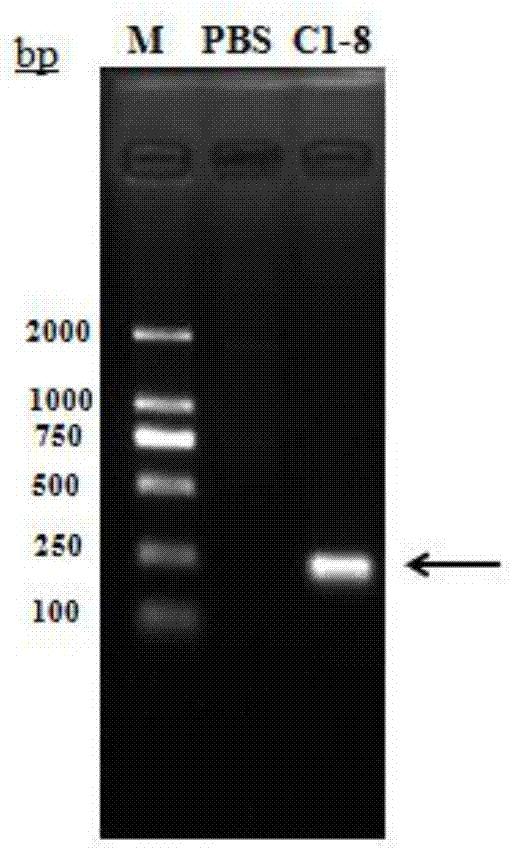
抗菌肽是生物先天免疫的重要效应分子,广泛存在于动物、植物、微生物中,属于对抗外源病原体的多肽类物质。迄今为止,已有数千种抗菌肽被分离鉴定出来,且陆续有新的天然抗菌肽被发现,大致可以分为四类:杀菌肽类、防御素类、蛙皮素和植物抗菌肽。不同抗菌肽的分子量、抑菌谱、遗传起源与生化特性、作用方式等都不相同,且不同抗菌肽产生菌都表现出了其独特的免疫机制。大多数抗菌肽由真核生物产生,在杀灭病原微生物的同时,不可避免地亦会杀灭益生菌,从而打破微生态平衡。乳酸菌作为一类广泛存在于环境、人类和动物肠道中的菌群,绝大多数对维持生命健康具有重要的生理作用,其产生的乳酸、抗菌肽等抑菌类物质对抑制肠道有害菌的生长和定植起着极其关键的作用,从而维持肠道正常的微生态平衡,且不会危害到益生菌的生长。抗生素的使用引发了一系列问题,如由于抗生素难降解,使环境遭到严重破坏与污染,且已诱发多种抗性基因的产生,人类的身体健康受到严重的威胁。抗菌肽作为一种安全环保的抗生素替代品,在医药行业、饲料和食品添加剂等领域都具有广泛的应用前景。目前已报道的抗菌肽中,有几种来源于乳酸乳球菌的抗菌肽类物质已被证实具有高效的抑菌活性和良好的开发潜力,其中部分乳酸乳球菌天然存在于动物的消化道中。最早被发现的乳酸菌肽是一种由乳酸乳球菌亚种产生的肽,命名为nisin,于1969年被fao/who认证许可用于食品的防腐中,是目前世界上唯一在多数国家得到授权并允许应用于食品领域的抗菌肽。nisin可有效抑制多数革兰氏阳性致病菌的生长,具有较强的热稳定性和ph稳定性,在酸性及中性条件下表现出良好的抑菌活性,但在碱性条件下基本失去活性,无法保持理想的抑菌作用,因而获得一种可耐酸耐碱的抗菌肽,可拓宽其应用范围及保持良好的应用效果。鉴于乳酸乳球菌普遍会产生nisin,且少数可产生其他广谱或耐酸碱抗菌肽,为进一步开发利用源于乳酸菌的抗菌肽,找到更多的抗菌肽进行研究,从而为后期的实际应用奠定基础。技术实现要素:鉴于此,有必要针对上述问题提供一种新型乳酸菌抗菌肽、其制备方法及应用,所述抗菌肽具有较强的抑制耐药性金黄色葡萄球菌、蜡样芽孢杆菌的活性,且具有较强的热稳定性及耐酸碱特性。本发明是通过以下技术方案实现的:第一方面,本发明提供一种抗菌肽,所述抗菌肽命名为lactocinc1-8;所述抗菌肽氨基酸序列如下seqidno.1所示。优选地,所述抗菌肽核苷酸序列如下seqidno.2所示。优选地,所述抗菌肽氨基酸序列的分子量为3475da。所述抗菌肽具有较强的热稳定性,于121℃条件下处理15min后仍保持原有活性的90%以上。所述抗菌肽具有耐酸耐碱活性,于ph2.0或ph10.0条件下孵育2h后,仍保持原有活性的80%以上。优选地,所述抗菌肽来自于斑仔鱼肠道菌群。第二方面,本发明提供一种表达载体,所表述载体含有至少一个拷贝的如第一方面所述的核苷酸序列。第三方面,本发明提供一种重组的宿主细胞,所述重组的细胞含有如第二方面所述的表达载体。优选地,所述宿主细胞为大肠杆菌、枯草芽孢杆菌、毕赤酵母或乳酸乳球菌中的任意一种,优选为乳酸乳球菌。本发明中,所述宿主细胞为大肠杆菌、枯草芽孢杆菌或毕赤酵母时,除抗菌肽自身序列外,应连同其携带的信号肽序列(seqidno.3)一起转入宿主中进行表达;而宿主选用乳酸乳球菌时,其特有的usp45信号肽可替代原前导肽。第四方面,本发明提供一种如第一方面所述的抗菌肽的制备方法,包括如下步骤:(1)提取菌群宏基因组;(2)根据抗菌肽nisin基因设计引物,以提取的菌群宏基因组为模板进行pcr扩增;(3)将pcr产物纯化,并将该目的产物和载体分别进行ncoi和hindiii双酶切,验证酶切成功后进行纯化;(4)将酶切产物进行连接,构建分泌表达抗菌肽的重组质粒,导入宿主细胞,得到表达抗菌肽的表达工程菌。优选地,步骤(2)所述引物为如下seqidno.4-5所示的序列;上游引物(nisf)seqidno.4:5’-ccggaattcataaggaggcactcaaaatg-3’下游引物(nisr)seqidno.5:5’-cccaagctttactatcctttgatttggtt-3’优选地,步骤(4)所述构建分泌表达抗菌肽重组质粒为将抗菌肽lactocinc1-8的基因序列连接到pnz8148质粒的ncoi和hindiii克隆位点。第五方面,本发明提供一种如第一方面所述的抗菌肽、如第二方面所述的表达载体或如第三方面所述的宿主细胞在制备动物饲料中的应用。第六方面,本发明提供一种如第一方面所述的抗菌肽、如第二方面所述的表达载体或如第三方面所述的重组宿主细胞在制备治疗药物中的应用。第七方面,本发明提供一种如第一发明所述的抗菌肽、如第二方面所述的表达载体或如第三方面所述的宿主细胞在食品加工及保藏中的应用。本发明中,所述的药物可以用于治疗包括但不限于由金黄色葡萄球菌、蜡样芽孢杆菌引起的感染或者生产治疗包括但不限于由金黄色葡萄球菌、蜡样芽孢杆菌引起的感染的药物。本发明有益效果:(1)本发明制备的抗菌肽lactocinc1-8,具有高效广谱抑菌作用,具有较强的抑制耐药菌的能力,尤其针对金黄色葡萄球菌、蜡样芽孢杆菌具有明显的抑制作用;(2)本发明制备的抗菌肽lactocinc1-8,热稳定性高,耐酸耐碱,毒性低,可作为抗生素替代品使用;(3)本发明制备的抗菌肽lactocinc1-8为进一步开发利用抗菌肽奠定了基础。附图说明图1是本发明抗菌肽基因的pcr产物;图2是本发明重组质粒构建示意图;图3是本发明nz9000重组子的平板单菌落图;图4是本发明工程菌发酵液对金黄色葡萄球菌的抑制效果图;图5是本发明工程菌发酵液对蜡样芽孢杆菌的抑制效果图;图6是本发明工程菌发酵液经不同温度处理后的抑菌变化情况;图7是本发明工程菌发酵液经不同ph条件处理后的抑菌变化情况。具体实施方式为了更好地说明本发明所解决的问题、所采用的技术方案和所达到的效果,现结合具体实施例和相关资料进一步阐述。需要说明的是,本
发明内容包含但不限于以下实施例及其组合实施方式。本发明实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购等途径获得的常规产品。斑仔鱼购自广州南沙菜市场:乳酸乳球菌乳脂亚种(lactococcuslacticssubsp.cremoris)nz9000、配套质粒pnz8148(氯霉素抗性)购于上海北诺生物科技有限公司;大肠杆菌mg1655从novagen公司购买;引物由苏州金唯智生物科技有限公司合成;主要试剂购自上海生工生物工程有限公司;质粒提取和dna凝胶回收试剂盒购自天根公司;相关的酶购自takara公司。主要试剂的配制:(1)乳酸乳球菌gm17培养液/基大豆胨5.0g,蛋白胨5.0g,酵母浸粉2.5g,牛肉浸粉5.0g,抗坏血酸钠0.5g,β-甘油磷酸钠19.0g,硫酸镁0.25g,加ddh2o至900ml,121℃高压蒸汽灭菌15min。待灭菌冷却后分别加入50ml用0.22μm滤膜过滤后的5%葡萄糖、5%乳糖溶液。配制固体培养基时加入2%的琼脂粉。(2)lb培养液/基胰蛋白胨(tryptone)10g,酵母提取物(yeastextract)5g,nacl10g,以950ml去离子水溶解,用5mol/lnaoh调ph至7.0,用去离子水定容至1l,在121℃高压蒸汽灭菌20min。配制固体培养基时加入2%的琼脂粉。(3)乳酸乳球菌感受态细胞培养用g-sgm17培养液/基大豆胨5.0g,蛋白胨5.0g,酵母浸粉2.5g,牛肉浸粉5.0g,抗坏血酸钠0.5g,β-甘油磷酸钠19.0g,硫酸镁0.25g,蔗糖171.1g,甘氨酸25g,加去离子水至900ml,在121℃高压蒸汽灭菌20min。待灭菌冷却后分别加入50ml用0.22μm滤膜过滤后的5%葡萄糖、5%乳糖溶液。(4)mrs培养基蛋白胨10.0g,牛肉浸粉10.0g,酵母提取液5.0g,葡萄糖20.0g,乙酸钠5.0g,柠檬酸二胺2.0g,吐温-801.0ml,磷酸氢二钾0.4g,硫酸镁0.58g,硫酸锰0.29g,碳酸钙20.0g,琼脂15.0g,去离子水溶解并定容至1000ml,调ph至6.2-6.6,搅拌均匀后于121℃高压蒸汽灭菌20min。(5)氯霉素溶液称取氯霉素溶解于无水乙醇中,0.22μm滤膜过滤除菌,1.5ml离心管分装,-20℃储存备用。储存浓度为35mg/ml,工作浓度为10μg/ml。(6)大肠杆菌电转孵化液用soc培养基2%(w/v)胰蛋白胨,0.5%(w/v)酵母提取物,0.05%(w/v)氯化钠,2.5mm氯化钾,10mm氯化镁,20mm葡萄糖溶液(0.22μm滤膜过滤除菌,培养基灭菌后加入)。121℃高压蒸汽灭菌20min,冷却后-20℃储存备用。(7)50×tae(tris-乙酸)电泳缓冲液tris碱242g,edta18.622g,加入800ml去离子水,充分搅拌溶解后加入57.1ml醋酸,充分混匀,再加入去离子水定容至1l,室温保存。使用前稀释为1×tae电泳缓冲液。实施例1提取斑仔鱼肠道菌群基因组提取斑仔鱼肠道基因组,包括如下步骤:(1)将剪刀、镊子用75%酒精消毒;(2)取斑仔鱼回肠,剪碎,加入5mlpbs,转移至15ml无菌离心管中,于振荡器漩涡混匀;(3)4000×g室温离心10min;(4)将上清转移至2ml无菌ep管中,1,2000rpm离心5min,弃上清,加入200μl溶菌酶溶液(20mg/ml),37℃水浴1h。(5)将经溶菌酶处理过的样品用ezup柱式土壤dna抽提试剂盒(生工sangonbiotech)提取基因组。实施例2制备抗菌肽重组表达载体(1)根据抗菌肽nisin基因序列设计引物:上游引物:5’-ccggaattcataaggaggcactcaaaatg-3’(seqidno:4)下游引物:5’-cccaagctttactatcctttgatttggtt-3’(seqidno:5)(2)pcr扩增:以实施例1提取的斑仔鱼肠道菌群基因组为模板进行pcr扩增,反应体系如下:反应体系配制:reagent组分rnx(μl)ddh2o34.7510×extaqbuffer(mg2+plus)5上游引物2下游引物2extaqenzyme(5u/μl)0.25模板22.5mmdntps4total50设置一组以水为样本的阴性对照。pcr扩增程序如下:pcr反应程序:对所获得pcr产物进行验证,结果如图1所示,可见条带正确。验证后用天根公司的胶回收试剂盒进行切胶回收。(3)全合成:对pcr产物进行测序,得序列seqidno.6,其前导肽序列为seqidno.7。对序列seqidno.6进行重新设计,即将前导肽序列seqidno.7用乳酸乳球菌特有的分泌表达信号肽usp45替代,并在序列5’端加上ncoi酶切位点,在3’端加上hindiii酶切位点,命名为lactocinc1-8,由上海生工生物工程有限公司合成:(4)构建重组质粒:酶切连接,构建重组质粒,反应体系如下:pcr产物及质粒pnz8148酶切反应体系配制:试剂组分rnx(μl)质粒pnz8148/抗菌肽基因lactocinc1-85quickcutncoi1quickcuthindiii110×quickcutbuffer2ddh2o11total2037℃恒温水浴锅中反应3h,酶切产物经胶纯化回收,将酶切后的载体与基因进行连接,反应体系如下:连接反应体系的配制:轻轻混匀组分,置于16℃水浴锅反应2h,得到重组载体pnz8148-lactocinc1-8。实施例3构建抗菌肽宿主细胞(1)将实施例2制备的重组载体转化mg1655感受态细胞,涂氯霉素抗性lb平板,挑选阳性克隆进行测序验证。大肠杆菌mg1655感受态的制备①挑单菌落于5mllb培养液中,37℃,200-250rpm培养12h;②取1ml菌液接种至100mllb培养液中,37℃,200-250rpm培养,直至od600达到0.4-0.6;③菌液在冰上预冷30min后,4200rpm,4℃离心10min;④弃上清,离心管中加入少量灭菌并且预冷的ddh2o,使沉淀悬浮后,再将水注满离心管,离心,4200rpm,4℃,10min;⑤弃上清,加少量预冷灭菌水,重悬菌体,再将水注满离心管,4200rpm,4℃离心10min;⑥弃上清,往离心管中加入少量10%甘油(灭菌,预冷),重悬菌体,再加满10%甘油,4200rpm,4℃离心10min;⑦弃上清,每个离心管中加入10%的甘油2-3ml,使沉淀悬浮后,将菌液以100μl/管分装于1.5ml的离心管中,立即使用或者-80℃冰箱中保存,待用于转化。(2)将重组质粒转化nz9000感受态细胞,挑选阳性克隆;乳酸乳球菌乳脂亚种nz9000感受态细胞的制备:solutioni的配制:蔗糖171.1g,甘油100ml,加ddh2o至1000ml,121℃高压蒸汽灭菌20min。solutionii的配制:蔗糖171.1g,甘油100ml,edta18.612g,加ddh2o至1000ml,121℃高压蒸汽灭菌20min。solutioniii的配制:g-sgm17培养液100ml+1mlmgcl2(20mm)+400μlcacl2(0.5mm)。①挑nz9000单菌落接种到1.5mlg-sgm17培养液中,30℃静置,14h培养;②1ml菌液接种至15mlg-sgm17培养液中(用封口膜封住锥形瓶瓶口),30℃静置,培养14h;③10ml菌液接种至100mlg-sgm17培养液中(用封口膜封住锥形瓶瓶口),30℃静置培养,直至od600达到0.3-0.5(约3-4h);④6000×g,4℃离心20min,弃上清;⑤用100mlsolutioni(预冷)重悬并洗涤细胞,6000×g,4℃离心20min,弃上清;⑥用100mlsolutionii(预冷)重悬细胞,冰浴15min,6000×g,4℃离心20min,弃上清;⑦用100mlsolutioniii(预冷)洗涤细胞,6000×g,4℃离心20min,弃上清;⑧用3mlsolutioni(预冷)重悬细胞;⑨分装,每40μl一管分装至1.5ml离心管中,-80℃保存,使用前在冰上解冻。(3)抗菌肽的表达①将构建好的重组质粒pnz8148-lactocinc1-8转化乳酸乳球菌乳脂亚种nz9000感受态细胞,在gm17平板上培养;②挑取转化子到5mlgm17液体培养基(含氯霉素10μg/ml)中,30℃培养14h;③取0.8ml菌液到10ml新鲜gm17培养液(含氯霉素10μg/ml)中,至od600达0.4左右;④加入终浓度为10ng/ml的nisin诱导,12h后检测抗菌肽活性。实施例4构建抗菌肽宿主细胞(1)所述重组质粒也可以通过电转化到大肠杆菌mg1655感受态细胞,其制备方法如下:①从-80℃冰箱取出mg1655感受态细胞100μl,放在冰上解冻;待感受态细胞解冻后,与10μl连接产物混合加入已预冷的电转杯中,冰浴5min;②在电击仪上设置电转条件:2kv,将电转杯放入电转槽,按下电击仪pulse按钮进行电转化;③电转化后立即加入1mlsoc培养基(预冷),冰浴5min;④将电转杯中菌液转入1.5ml离心管,37℃、250rpm复苏40min;⑤将复苏液于12,000rpm离心2min,弃上清,加入200μl含氯霉素抗性的lb培养液,混匀,吸取200μl菌液加至lb筛选平板(含氯霉素10μg/ml),用玻璃涂布棒把菌液均匀涂布于整个平板表面,37℃倒置,过夜培养(12-16h)。(2)所述重组质粒也可以通过电转化到乳酸乳球菌乳脂亚种nz9000感受态细胞,其制备方法如下:solutioni的配制:蔗糖171.1g,甘油100ml,加ddh2o至1000ml,121℃高压蒸汽灭菌20min。solutionii的配制:蔗糖171.1g,甘油100ml,edta18.612g,加ddh2o至1000ml,121℃高压蒸汽灭菌20min。solutioniii的配制:g-sgm17培养液100ml+1mlmgcl2(20mm)+400μlcacl2(0.5mm)。①从-80℃冰箱取出nz9000感受态细胞40μl,放在冰上解冻;待感受态细胞解冻后,与10μl连接产物混合加入已预冷的电转杯中,冰浴5min(阴性对照组:40μl感受态细胞+4μl空载pnz8148);②在电击仪上设置电转条件:2kv,将电转杯放入电转槽,按下电击仪pulse按钮进行电转化;③电转化后立即加入1mlsolutioniii(预冷),冰浴5min;④将电转杯中菌液转入1.5ml离心管,在30℃孵育1.5h;⑤将菌液于12,000rpm离心2min,弃上清,加入100μl含氯霉素抗性的gm17培养液,混匀,吸取100μl菌液加至gm17筛选平板(含氯霉素10μg/ml),用玻璃涂布棒把菌液均匀涂布于整个平板表面,用封口膜将平板密封,30℃倒置,过夜培养(12-16h)。培养结果如图3所示,30℃培养后出现的单菌落图,从中筛选出阳性克隆。(3)抗菌肽的表达①将构建好的重组质粒pnz8148-lactocinc1-8转化乳酸乳球菌乳脂亚种nz9000感受态细胞,在gm17平板上培养;②挑取转化子到5mlgm17液体培养基(含氯霉素10μg/ml)中,30℃过夜培养;③取0.8ml菌液到10ml新鲜gm17培养液(含氯霉素10μg/ml)中,至od600达到0.4左右;④加入终浓度为10ng/ml的nisin诱导,12h后检测抗菌肽活性。实施例5抗菌肽活性的检测(1)将两种菌发酵液于9000rpm,4℃离心15min,将获得的上清液进行0.22μm过滤获得诱导后的无菌上清液;(2)以金黄色葡萄球菌和蜡样芽孢杆菌为指示菌(~106cfu/ml),用牛津杯琼脂扩散法做抑菌实验,每个样品加入100μl,做三个重复;(3)于37℃培养12h后,导入lactocinc1-8基因的重组乳酸乳球菌乳脂亚种nz9000(实验组)上清液样品可见明显的抑菌圈,结果如图4、5所示。实施例6热处理对抗菌肽活性的影响①取实验组上清液样品分成a、b、c、d、e共五组,各1ml;②将a-d组分别放置于37℃(对照)、60℃、80℃、100℃水浴中孵育60min,d组置于121℃高压蒸汽中放置15min,到达各处理时间后立即于冰水中冷却,每组做三个重复;③以金黄色葡萄球菌为指示菌(~106cfu/ml),用牛津杯琼脂扩散法做抑菌实验,每个样品加入100μl;④于37℃培养12h后,可见与a组(对照)相比,b、c、d组的抑菌活性基本无变化,e组活性仅有9%的降低,结果如图6所示。实施例7抗菌肽酸碱活性范围检测①取实验组上清液样品分成a、b、c、d、e、f、g、h、i共九组,各1ml;②以2mnaoh/hcl将a-i组样品ph分别调至2.0、3.0、4.0、5.0、6.0(对照)、7.0、8.0、9.0、10.0,于37℃水浴孵育2h,每组做三个重复;③取10μg/ml标准nisin样品,做与实验组同样处理,以此为对照组。以金黄色葡萄球菌为指示菌(~106cfu/ml),用牛津杯琼脂扩散法做抑菌实验,每个样品加入100μl;④于37℃培养12h后,可见与nisin对照相比,于ph2.0-ph7.0处理条件下,nisin活性比lactocinc1-8样品抑菌活性强,可能的原因是nisin的浓度比上清液样品中lactocinc1-8的有效浓度高;于ph7.0-ph10.0处理条件下,实验组仍能保持原有活性的80%以上,但nisin的抑菌效果明显变弱,结果如图7所示。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。序列表<110>深圳先进技术研究院广州中国科学院先进技术研究所<120>一种乳酸乳球菌抗菌肽、其制备方法及应用<130>cnp201810119<141>2018-07-26<160>7<170>siposequencelisting1.0<210>1<211>34<212>prt<213>人工序列(artificialsequence)<400>1ilethrserileserleucysthrproglycysleuthrglyalaleu151015metglycysalametleuthralathrcysalacysserilehisval202530serleu<210>2<211>105<212>dna<213>人工序列(artificialsequence)<400>2attacaagtatatcgctatgtacacccggttgtaagacaggagctctgatgggttgtaac60atgaaaacagctacttgtaattgtagtattcacgtaagcaaataa105<210>3<211>23<212>prt<213>人工序列(artificialsequence)<400>3metserthrleualaproalaleualaleuvalservalserleugly151015alaalaglyalaserproala20<210>4<211>29<212>dna<213>人工序列(artificialsequence)<400>4ccggaattcataaggaggcactcaaaatg29<210>5<211>29<212>dna<213>人工序列(artificialsequence)<400>5cccaagctttactatcctttgatttggtt29<210>6<211>174<212>dna<213>人工序列(artificialsequence)<400>6atgagtacaaaaaattttaacttggatttggtatctgtttcgaaggaagattcaggtgca60tcaccacgcattacaagtatatcgctatgtacacccggttgtaagacaggagctctgatg120ggttgtaacatgaaaacagctacttgtaattgtagtattcacgtaagcaaataa174<210>7<211>69<212>dna<213>人工序列(artificialsequence)<400>7atgagtacaaaaaattttaacttggatttggtatctgtttcgaaggaagattcaggtgca60tcaccacgc69当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1