鼠抗人ROS1蛋白单克隆抗体制备及其免疫组化用途的制作方法
本发明涉及免疫学领域,特别涉及一种鼠抗人ros1蛋白的单克隆抗体,以及该抗体的免疫组化用途。
背景技术
原癌基因蛋白酪氨酸激酶(c-rosoncogene1,ros1)属于胰岛素受体超家族,最初是在鸟肉瘤病毒(ur2)中发现,可与gag基因(编码病毒的核心蛋白)融合,融合后具有一定的致瘤性。野生型ros1基因定位于6号染色体q12区,编码2347个氨基酸,编码蛋白为跨膜型酪氨酸激酶受体蛋白,由酪氨酸激酶区、跨膜区及含糖基化位点的细胞外区三部分组成。较早的研究发现ros1基因异常存在于胶质母细胞瘤和脑膜瘤中,后来在胆管癌、卵巢癌、非小细胞肺癌、血管肉瘤及炎性肌纤维母细胞瘤中也相继被报道。ros1基因异常主要是由于ros1基因突变、重排、过表达等,异常的ros1蛋白激酶会激活下游多条致癌信号途径。ros1重排代表一类新的独特的非小细胞肺癌(nsclc)分子亚型,是继egfr和alk之后的又一癌症驱动基因及药物作用新靶点。ros1受体酪氨酸激酶参与激活多条信号转导通路,包括pi3k/akt/mtor、ras-mapk/erk、jak/stat3及plcγ/ip3和shp2/vav3等途径。这些通路参与或介导了肿瘤细胞的增殖、存活,细胞形态转化及肿瘤细胞的转移和迁移。ros1基因重排发生的几率很低,是一个少见驱动基因,同样在肺腺癌的治疗中发挥重要的疗效预测作用。因此,研究ros1在非小细胞肺癌、肺腺癌等恶性肿瘤中的表达对于恶性肿瘤的致病机理、治疗方案选择和预后具有重要的科学意义和临床价值。
目前,针对ros1基因的临床检测缺少简便、高效的检测手段。而免疫组化(ihc)方法操作简单,收费较低,绝大部分病理实验室均可以开展,ihc方法可作为临床工作中ros1异常表达的首选检测方法,并且对指导临床用药、预测ros1抑制剂疗效具有重要意义。鉴于国内外研发的可用于临床诊断(ivd)用的ros1抗体稀少,特异性和亲和力方面均有待提高,因此亟待研发新的性能优异的抗ros1单克隆抗体,填补国内本行业的空白,降低治疗费用,减轻病人负担。本发明研制出一种特异性高、表现稳定且效价高的抗ros1蛋白的特异性单克隆抗体,可用于恶性肿瘤中ros1蛋白的异常表达水平研究及与疾病发生、进展、耐药性、预后相关的病理生理研究,具有一定的医学基础研究价值。本发明采用免疫组化(ihc)方法,建立基于所述ros1单克隆抗体的免疫组织化学技术,用于恶性肿瘤的辅助诊断、治疗方案选择和预后,恶性肿瘤主要包括非小细胞肺癌、肺腺癌、胃癌、胆管癌、卵巢癌、胶质细胞瘤、肝癌、肾癌、结肠癌等。
技术实现要素:
基于以上所述的现有技术现状,本发明的目的为提供一种特异性好、表现稳定且效价高的抗ros1蛋白的单克隆抗体,并建立基于所述ros1单克隆抗体的免疫组织化学技术。
为实现上述目的,本发明采用如下技术方案:
本发明所述ros1单克隆抗体的制备方法如下:
(1)重组表达载体的构建:根据人ros1基因的ore全序列(uniprot-p08922),订购基因合成获得ros1基因羧基末端免疫源目标序列(ros1核苷酸序列和氨基酸序列分别见序列表),基因两侧分别引入限制性内切酶位点nhei和xhoi,插入表达载体pdb-his-gst和pdb-his-mbp(加拿大应用生物材料有限公司,appliedbiologicalmaterialsinc.),构建ros1重组表达质粒(ros1-pdb-gst和ros1-pdb-mbp)。前者ros1-pdb-gst用以免疫实验动物,后者ros1-pdb-mbp用以elisa筛选阳性克隆。
(2)ros1重组蛋白的表达与纯化:将ros1-pdb-gst重组表达质粒转化bl21de3star感受态细胞,裂解细胞后离心取上清,nickel柱纯化,获得纯化的ros1重组蛋白。
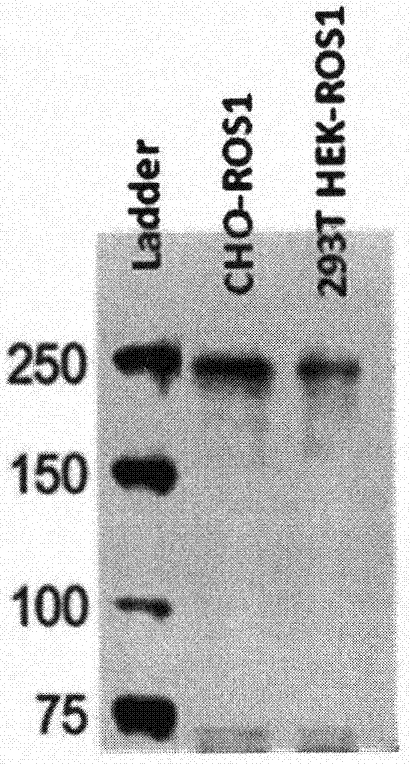
(3)单抗的筛选与制备:采用上述纯化的ros1-pdb-gst重组蛋白免疫balb/c小鼠,取小鼠脾脏细胞与sp2/0细胞进行融合,有限稀释法获得单克隆,使用ros1-pdb-mbp预铺的96孔板采用elisa法筛选阳性杂交瘤细胞,获得能分泌抗ros1特异性抗体的杂交瘤细胞株;制备小鼠腹水,通过proteina柱层析纯化ros1单抗。分别通过westernblot(结果见图1)和免疫组化实验(结果见图2)验证该单抗的特异性和灵敏度。
同时,本发明提供一种上述单克隆抗体在制备用于检测ros1蛋白的免疫组化工具中的应用。
所述免疫检测工具为试剂、试剂盒、芯片或试纸条。
本发明还提供了上述单克隆抗体在制备用于检测恶性肿瘤的免疫组化用途。ros1作为非小细胞肺癌、肺腺癌等恶性肿瘤治疗的靶点基因,检测ros1在肿瘤细胞的表达,对于机体恶性肿瘤的辅助诊断、治疗方案选择和预后具有重要的指导作用。
以使用leica的免疫组化自动染色机bondmax为例,应用该ros1单克隆抗体进行免疫组化染色的条件为:
(1)使用机器自带的ihcprotocolf,将过氧化物酶封闭步骤由使用一抗前移至dab显色前;
(2)抗体使用终浓度为0.5μg/ml,室温孵育30min;
(3)抗原修复使用ph9.0的抗原修复液(er2),100℃加热孵育30min。
使用其他ihc自动染色机或进行手工染色时,请参照上述条件进行。
本发明所述的特异性单抗,可与ros1蛋白特异结合,同时建立了基于该单克隆抗体的免疫组织化学技术,可用于恶性肿瘤的辅助诊断、治疗方案选择和预后,恶性肿瘤主要包括非小细胞肺癌、肺腺癌、胃癌、胆管癌、卵巢癌、胶质细胞瘤、肝癌、肾癌、结肠癌等。
附图说明
图1为本发明单克隆抗体的westernblot结果:ladder泳道为marker,cho-ros1泳道为ros1基因转染的cho-k1细胞裂解液,293thek-ros1泳道为ros1基因转染的293thek细胞裂解液。
图2为以本发明单克隆抗体为一抗,免疫组化法检测肺癌组织中ros1蛋白的表达染色图。
具体实施方式
本发明公开一种特异性好、表现稳定且效价高的抗ros1蛋白的单克隆抗体,以及检测肿瘤细胞ros1蛋白的免疫组化用途。本领域技术人员可参考本文内容进行适当改进以实现和应用本发明的技术,但是类似的替换和改动应视为包括在本发明。
为了使本领域的技术人员更好地理解本发明的技术方案,下面结合具体实施例对本发明作进一步的详细说明。
实施例1抗ros1单克隆抗体的制备
一、ros1重组表达质粒的构建
根据uniprot报道的ros1基因(uniprot-p08922),订购基因合成获得ros1基因羧基末端免疫源目标序列,并在序列两端分别引入酶切位点nhei和xhoi,进而分别克隆入表达载体pdb-his-gst和pdb-his-mbp质粒,建立ros1-pdb-gst和ros1-pdb-mbp重组表达质粒,分别用于免疫实验动物和elisa筛选阳性克隆。
二、ros1重组蛋白的表达与纯化
1、转化bl21de3star感受态细胞
使用上述构建的ros1-pdb-gst和ros1-pdb-mbp质粒分别转化到bl21de3star感受态细胞,预培养获得250ml细菌液,进一步将预培养液加入6l含卡那霉素(kanamycin)的lb培养液中,37℃培养至od值达0.8,使用0.5mm的iptg诱导表达,培养4h。
2、裂解细胞
离心获得细胞沉淀后,以溶液a(20mm磷酸钠,ph8.0,500mm氯化钠溶液)重悬细胞,超声破碎1minx6次。3000g/min离心15min沉淀细胞碎片,收集上清用于下一步纯化。
3、nickel柱层析纯化
以孔径为0.45μm,直径为33mm的pvdf膜滤器过滤离心后的裂解液上清并转入15ml管。加入10ml溶液a与样本混合准备过柱纯化。nickel树脂反复颠倒混匀后,取3ml加入柱中,用溶液a清洗并平衡3次,静置使树脂自然沉积。加入样品,收集首次流出液。用溶液a清洗柱子5次,加入5倍体积预先配置的洗脱液(溶液a中加入250mm咪唑)。静置1min后收集洗脱液。
4.透析
由步骤3洗脱的样本采用1×pbs溶液透析,分两次完成透析,共用4l透析液。
三、单抗的筛选与制备
1、动物免疫:上述经过纯化的ros1-pdb-gst重组蛋白以完全弗氏佐剂乳化,采用皮下或腹腔注射方法免疫6-8周龄balb/c小鼠,免疫剂量为50μg/只,间隔两周后进行第二次免疫,以不完全弗氏佐剂乳化,免疫剂量为50μg/只。免疫两次后取尾血以elisa法梯度稀释测定血清效价;根据结果确定是否加强免疫,选取抗体效价最高的小鼠进行细胞融合。
2、细胞融合:骨髓瘤细胞采用balb/c来源的sp2/0,融合时处于对数生长期;取上述免疫的小鼠脾脏,制成淋巴细胞单细胞悬液;免疫小鼠脾淋巴细胞与骨髓瘤细胞以1∶5-1∶10混合,滴加37℃的50%peg(ph8.0)1ml,加入不完全培养基及其余终止液,离心弃上清后加入hat培养基悬浮混匀,mc定容到50ml,分装到3.5cm培养皿中,放于湿盒中,置于37℃、5%co2恒温培养箱中进行培养。
3、筛选和克隆:融合7-10天内挑选细胞克隆,使用上述纯化的ros1-pdb-mbp重组蛋白进行elisa测试,标记细胞株号。对阳性孔细胞进行有限稀释,每次有限稀释后5-6天测定elisa值,挑取od280阳性值较高的单克隆孔进行有限稀释,直至elisa测定96孔板全板结果为阳性。
4、腹水单抗的制备与纯化:10-12周龄的雄性balb/c小鼠腹腔注射0.5ml降植烷,一周后每只小鼠用1ml注射器腹腔注射经pbs洗涤重悬的单克隆细胞悬液,细胞用量为5×106/只,每株抗体打2只小鼠。待小鼠腹水积聚后收集腹水,离心取上清,proteina柱层析法进行腹水纯化,纯化后的单抗浓度测定、分装、冻存在-20℃。
以本发明单克隆抗体为一抗,对经过ros1基因转染的cho-k1细胞和293thek细胞系的蛋白裂解液进行westernblot检测,杂交、显色,其结果如图1所示,由图可见:该抗体成功检测ros1基因,并呈现单一条带。
实施例2以本发明单克隆抗体为一抗的免疫组化实验
1、分别取24种不同类型的癌组织取样制作组织芯片,使用leicarm2235型组织切片机进行切片,切片厚度为4μm;
2、使用leicabondmax免疫组化自动染色机对本发明抗体进行免疫组化染色测试,使用机器自带的脱蜡与水化条件,具体步骤为:60℃孵育30min,应用脱蜡溶液(leica)洗3遍。抗原修复采用抗原修复液2(er2,leica),100℃孵育30min。一抗使用本发明抗体,采用抗体稀释液(leica)稀释到终浓度为0.5μg/ml,150μl。抗体室温孵育30min。使用配套的二抗(leica)150μl,室温孵育8min。使用多聚物检测液(leica)150μl,室温孵育8min。使用内源性过氧化物酶封闭液150μl室温孵育5min。使用dab显色液(leica)150μl,室温孵育10min。苏木素复染,室温孵育5min;
3、脱水和透明:去离子水清洗1min,95%乙醇1min,100%乙醇2minx2次,二甲苯2minx3次,中性树胶封片;
4、镜检,结果:部分肿瘤组织显示细胞浆或细胞膜阳性染色,包括肺癌、宫颈癌、胶质细胞瘤、胃癌、肝癌等,部分样本显示阴性无ros1染色。其中肺癌染色如图2所示,可见明显细胞浆染色。染色模式正确,信号较强,未见明显非特异染色。
实施例3本发明单克隆抗体的特异性检测
应用本发明抗体采用elisa检测无关抗原预铺的96孔板(her-2),结果为阴性。
以上所述仅是本发明的优选实施方式,应理解,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些等价形式也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!